2. 贵州师范大学喀斯特洞穴研究中心, 贵阳 550025
2. Center of Karst Caves, Guizhou Normal University, Guiyang 550025, China
喀斯特洞穴是喀斯特地貌区的一种多功能的天然资源,长期栖息在洞内的洞穴动物(如洞螈、红点齿蟾幼体、真洞穴鱼等)外部形态和内部结构与栖息于地表的动物不同[1],这引起了学者们的关注,另外,洞穴还具有一定的美学价值[2-3]。与地表生态系统相比,洞穴是一个较封闭和脆弱的特殊地下生态系统,如果受到破坏,不可逆转,难以恢复。在洞穴生态系统中,洞穴动物是重要的生物类群,在维持洞穴生态系统平衡中扮演着至关重要的角色,对洞穴动物及群落结构的研究是洞穴生态学研究的重要内容。对洞穴动物的研究主要包括:洞穴动物分类与区系组成[4-5],洞穴动物生理学[6],洞穴动物的起源与演化[7],洞穴动物的遗传与繁殖[8-9],洞穴动物的重金属污染评价[10]等。国外学者对影响洞穴鱼类、蝙蝠、桡足类等动物群落的环境因素进行了诸多研究[11-13]。国内对洞穴动物群落结构与环境因子关系报道主要集中在贵州的喀斯特洞穴,涉及到的环境因子主要有洞穴内空气温度和湿度、滴水pH、CO2和O2的含量、土壤有机质和钙含量等[14-17]。
荔波位于贵州省的南部,境内有著名的茂兰国家级自然保护区。区内岩溶洞穴发育良好,岩溶洞穴数量多,洞穴动物丰富,具有重要的科研价值。对荔波洞穴动物的研究主要集中在其形态分类和物种多样性调查[18-19],关于荔波洞穴动物群落结构与环境因子关系也有一些研究,黎道洪[14-16]采用Pearson相关系数法分析了5个未受人类干扰的洞穴(水拔洞、董背洞、水江洞、波多洞和甲良洞)内动物群落结构与部分环境因子的关系。本研究选择未受人类干扰的干细洞和已受人类干扰的拉梭洞为研究对象,在环境因子选取上增加了洞穴土壤湿度和酸碱度,采用主成分分析(PCA)法分析两个洞穴动物群落与环境的关系,以期了解不同类型洞穴内动物群落结构的主导影响因子,从而为当地洞穴动物多样性保护、生态资源可持续发展提供科学依据,也为进一步研究洞穴生态提供基础数据。
1 洞穴概况与研究方法 1.1 干细洞与拉梭洞概况干细洞位于贵州省荔波县甲良镇甲岸村益觉组,地处107°40′59.10″E,25°29′52.08″N,海拔835 m,洞口朝向北偏东35°,周围植被较丰富。有光带长150 m,滴水较多,洞底土层厚约10 cm。弱光带长70 m,滴水较多,洞底土层薄,含少量砂石,洞壁较有光带粗糙,洞顶有少量小的石钟乳。黑暗带调查洞段长200 m,滴水较弱光带少,土壤含大量砂石,洞壁和洞顶较光滑,部分地方洞顶有石钟乳。
拉梭洞位于贵州省荔波县永康乡白岩村二组,地处107°56′36.9″E,25°22′12.7″N,海拔720 m,洞口朝向正西。该洞受人类干扰大,有光带有人为从黑暗带引水修筑的水池,供生活用水。有光带长100 m,滴水较少,洞顶有少量小石钟乳。弱光带长80 m,滴水较多,土壤含少量砂石,在该光带有两个岔口,左边较浅约10 m左右,右边通往黑暗带深处,洞壁较有光带粗糙,洞顶有少量小的石钟乳。黑暗带210 m,洞厅较矮,深处有大面积水源,滴水较弱光带少,土壤含细小砂石较多,洞壁和洞顶较光滑。
1.2 样品采集及环境调查2017年8月赴干细洞和拉梭洞进行实地调查,GPS测定地理位置和海拔高度,JD-3型数字式光照度计测定光照度。
按光带布设样方进行洞穴动物采样。根据光照度,将每个洞穴分别划分为有光带、弱光带和黑暗带[17]。每个洞穴各光带的洞底按梅花型布设5个样方,每个样方面积大小设置为5 m2。
动物样品采集:采集洞底样方内以及距离样方较近的洞壁、洞顶处肉眼能看到的动物个体,部分螺类未见活体,采集其螺壳。采集的动物标本用75%的乙醇浸泡保存后带回实验室分类鉴定。为了不破坏洞穴生态系统的稳定性,同种动物采集3~5号即可,其余均计数统计。
土样和气样采集:在每个样方内分别采集洞底表层土壤1 kg和气样1 L,带回实验室检测。
环境因子测定:WS2080AJ型温湿度计测定洞穴空气中的温度、湿度,精密pH试纸测定滴水pH值,PJ-TPH型手持土壤分析仪测定土壤的湿度和酸碱度。
1.3 室内样品处理及检测土壤有机质的检测:土样经风干、研磨后过100目筛。称取土样0.2 g于装有简易空气冷凝管和AgSO4的三角瓶中,加入75 mL 0.25 mol·L-1的K2CrO4和5 mL浓H2SO4,加热消煮1 h,消煮完毕冷却后加入少量去离子水,加入3~5滴邻菲啰啉指示剂,用FeSO4标准溶液滴定后计算土壤中有机质含量。
土壤K、Na、Ca的检测:称取土样0.5 g于100 mL三角烧瓶中,加入20 mL浓HNO3和3 mL浓H2SO4,加热至样品变白后冷却,以0.5%的HNO3定容至50 mL,用AA800原子吸收光谱仪测定土壤中K、Na、Ca含量。其中,测定Ca含量需要加入5 mL硝酸锶。
洞穴中CO2含量用气相色谱仪(GC-16A)检测。
1.4 数据分析与处理采用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)、Margalef丰富度指数(D)、Simpson优势度指数(C)分析洞穴动物群落多样性[17],采用Jaccard相似性指数(q)分析洞穴动物群落相似性[20],其测度公式如下:
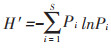
|
(1) |
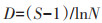
|
(2) |
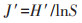
|
(3) |

|
(4) |
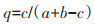
|
(5) |
式中:Pi为第i种的个体比;S为群落内物种数;N为群落内所有物种个体数之和;ni为群落内第i种的个体数量;c为两群落的共有物种数;a和b分别为群落A和群落B的物种数。
主成分分析(PCA)采用SPSS 25.0统计分析软件进行。
2 结果与讨论 2.1 洞穴动物种类组成和分布两洞共获洞穴动物899号(含统计数),计70种(或类群),隶属4门7纲19目38科56属(表 1)。其中,干细洞536号,计56种,拉梭洞363号,计23种。
|
|
表 1 干细洞和拉梭洞内动物的种类(类群)组成及相对数量 Table 1 Animal species(groups)composition and relative individual quantity in Ganxi cave and Lasuo cave |
从整个洞穴的动物种类和数量分布看,干细洞的优势种有小婴石螺Chalepotaxis infantilis和丝钻螺Opeas filare,分别占该洞总获数的17.91%和13.06%,拉梭洞的优势种有闪夜蛾Sypna sp.、裸灶螽Diestrammena sp.、长踦盲蛛Phalangiidae sp.和三带喙库蚊Culex tritaeniorhynchus,分别占该洞总获数的26.17%、18.18%、13.77%和11.02%。从各洞段分布的动物物种数看,干细洞和拉梭洞均为有光带>弱光带>黑暗带,这与水江洞、波多洞、甲良洞、织金洞结果一致[15-17]。从各洞段分布的动物数量看,干细洞为有光带(380)>黑暗带(67),而拉梭洞则为黑暗带(140)>有光带(85)。其原因可能是:①拉梭洞的有光带有人工修建的生活饮水水池,动物的栖息环境遭到破坏,严重影响了该光带动物的分布数量;②拉梭洞黑暗带的动物数量多,主要为适应黑暗环境的闪夜蛾,占该洞总获数的22.87%。总体看,受人类干扰的拉梭洞的物种数和总个体数小于未受干扰的干细洞以及已被研究的水拔洞等5个洞穴[14-16]。
2.2 洞穴动物群落组成根据不同洞穴和不同光带中动物种类和数量的组成以及环境因子的不同[16-17],将干细洞和拉梭洞的动物划分为6个动物群落。
群落A:小婴石螺+丝钻螺群落。分布在干细洞的有光带,两者均为优势种,分别占该光带总获数的25.26%和18.42%。
群落B:裸灶螽+麦氏拟管螺群落。分布在干细洞的弱光带,两者均为优势种,均占该光带总获数的16.85%。
群落C:裸灶螽+长踦盲蛛群落。分布在干细洞的黑暗带,两者均为优势种,分别占该光带总获数的29.85%和34.33%。
群落D:长踦盲蛛+灰巴蜗牛群落。分布在拉梭洞的有光带,两者均为优势种,分别占该光带总获数的35.29%和20.00%。
群落E:三带喙库蚊+裸灶螽群落。分布在拉梭洞的弱光带,两者均为优势种,分别占该光带总获数的28.99%和21.74%。
群落F:闪夜蛾+裸灶螽群落。分布在拉梭洞的黑暗带,两者均为优势种,分别占该光带总获数的59.29%和17.86%。
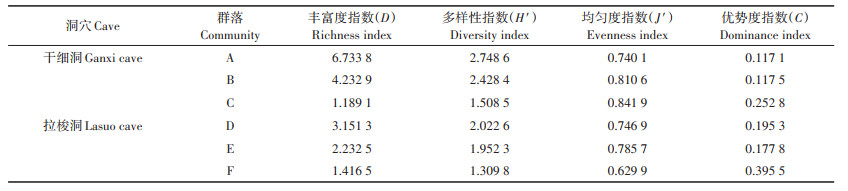
2.3 洞穴动物群落结构特征从表 2可知,干细洞丰富度指数和多样性指数排列顺序均为群落A>群落B>群落C,均匀度指数和优势度指数均为群落C>群落B>群落A。拉梭洞丰富度指数和多样性指数排列顺序均为群落D>群落E>群落F,均匀度指数为群落E>群落D>群落F,优势度指数为群落F>群落D>群落E。由此得出两个洞穴的丰富度指数和多样性指数均沿有光带、弱光带、黑暗带呈逐渐递减趋势,这与很多研究结果[14, 16-17]一致。原因在于:①为洞穴动物直接或间接提供食物来源的生产者(植物)主要分布在有光带,黑暗带几乎无植物分布[21];②有光带的植物为洞穴动物的生存提供了良好的栖息环境;③有光带离洞口近,平时生活在洞口周围或离洞口较近的某些地表动物,会因为地表环境的变化而迁入有光带暂居或长期定居下来[14]。
|
|
表 2 干细洞和拉梭洞洞穴动物群落的多样性特征 Table 2 Richness, diversity, evenness and dominance index of six animal communites in Ganxi cave and Lasuo cave |
地表动物群落结构的研究显示群落优势度与均匀度和多样性大致呈负相关变化[22-23],本研究的拉梭洞与之基本符合,但干细洞的优势度与均匀度未呈负相关变化。其因可能是干细洞内群落之间物种组成差异较大(如有光带41种,而黑暗带仅6种),另外虽然有光带的物种数和个体数占该洞的比例较大,但个体数在类群间分布极不均匀,仅丝钻螺的数量就占有光带总数量的18.4%。
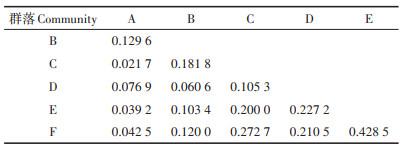
由表 3可知,相似性指数较高的有群落E-F(0.428 5)、群落C-F(0.272 7)、群落D-E(0.227 2)。相似性指数较低的有群落A-C(0.021 7)、群落A-E(0.039 2)、群落A-F(0.042 5)。表明处于同一洞穴相邻光带或不同洞穴同一光带的群落间相似性较高,而处于同一洞穴相隔较远光带或不同洞穴相隔较远光带的群落间相似性较低,这与前人的研究结论[15-17]一致。但群落间相似性指数总体偏低,除了群落E-F、群落C-F处于中等不相似水平以外,其余群落之间均处于极不相似水平,说明两个洞穴内群落间异质性大,这可能由于拉梭洞人类干扰严重,黑暗带有大面积水环境,有光带又有人工修建的水池,使两洞各洞段之间的环境和动物组成存有较大差异,导致群落之间的相似性低。
|
|
表 3 干细洞和拉梭洞不同洞穴动物群落的相似性指数 Table 3 Similarity index of six animal communities in Ganxi cave and Lasuo cave |
对可能影响干细洞和拉梭洞动物群落结构的环境因子(表 4)进行KMO和Bartlett检验,KMO值分别为0.727、0.673,说明数据可以进行PCA分析。根据特征根大于1,干细洞和拉梭洞分别提取了2个主成分和3个主成分(表 5),累积贡献率分别为88.74%和89.56 %。
|
|
表 4 干细洞和拉梭洞不同光带中环境因子的平均值 Table 4 Average value of environmental factors of three light zones in Ganxi cave and Lasuo cave |
|
|
表 5 干细洞和拉梭洞环境因子主成分的载荷量与贡献率 Table 5 Load quantity and contribution rate of principal component of environment factors in Ganxi cave and Lasuo cave |
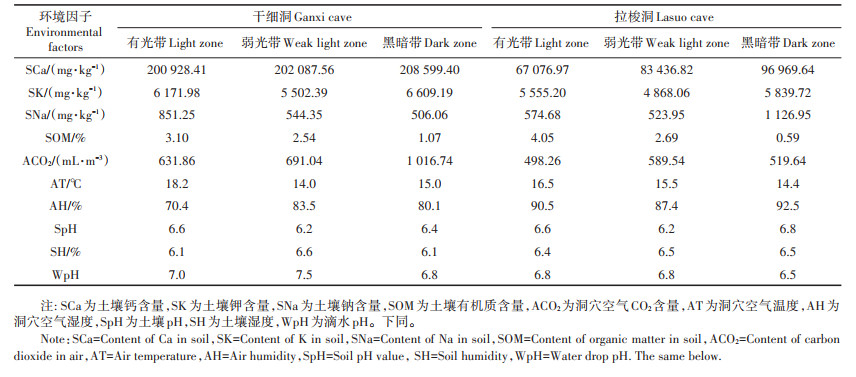
从表 5可知,干细洞第1主成分的贡献率为48.65%,土壤Na(0.991)、气温(0.895)、空气湿度(-0.868)、土壤有机质(0.834)的绝对值偏高,其中土壤Na、气温、土壤有机质的载荷量为正值,空气湿度为负值。第2主成分的贡献率为40.09%,土壤K(0.982)和土壤湿度(-0.872)的绝对值偏高,载荷量分别为正值和负值。说明土壤营养元素(Na、K)、土壤有机质、气温、空气湿度和土壤湿度是影响干细洞动物群落结构的主导因子。拉梭洞第1主成分的贡献率为50.00%,土壤Na(0.979)、空气湿度(0.885)、土壤K(0.842)、土壤有机质(-0.804)的绝对值偏高,其中土壤Na、空气湿度、土壤K的载荷量为正值,土壤有机质为负值。第2主成分的贡献率为28.98%,CO2含量(-0.850)的绝对值偏高,载荷量为负值。第3主成分的贡献率为10.58%,滴水pH(0.819)的绝对值偏高,载荷量为正值。说明土壤营养元素(Na、K)、土壤有机质、空气湿度、CO2含量和滴水pH是影响拉梭洞动物群落结构的主导因子。
土壤有机质是土壤的重要组成物质,受土地利用类型、地形、成土母质、人为随机因素的影响[24]。土壤有机质是全球陆地生态系统中最大的碳库,很多研究表明土壤有机质含量对洞外动物群落结构具有重要影响,Hasegawa[25]研究发现土壤有机质含量影响节肢动物的群落结构,韩慧莹等[26]研究显示土壤动物的密度、类群数与土壤有机质含量呈极显著正相关,唐政等[27]研究表明土壤大型动物类群数和多样性与土壤有机质呈显著正相关。织金洞[17]、荔波水拔洞等5个洞穴[14-16]的研究结果均表明,土壤有机质含量对洞穴动物群落结构具有正向影响,这与本研究干细洞结果一致。而在拉梭洞,土壤有机质虽是影响其动物群落结构的主导因子,但它在第1主成分中的载荷量为负值,这可能由于人类干扰对拉梭洞动物群落结构影响更大,虽然有机质含量在有光带中最高,但有光带人为修建的水池限制了洞穴动物在该光带的空间分布,从而使得有机质含量最高的光带动物个体数量分布最少。除了土壤有机质以外,土壤营养元素(K、Na)对干细洞和拉梭洞动物群落结构具有正向影响,这与洞外生态系统的相关研究结果一致,如小兴安岭森林生态系统中土壤K和Na与土壤动物类群数的灰色关联度较大[28],铁烈华等[29]研究也表明土壤动物个体密度、类群数与土壤K呈极显著正相关。
气温和湿度(降水量)的变化可直接或间接地影响洞外动物生存环境的变化,从而对动物群落结构产生影响[30-31]。相关研究表明土壤动物类群数、个体密度、多样性指数与气温和湿度呈显著正相关[20, 31]。就干细洞而言,气温和湿度在第1主成分中贡献均较大,温度载荷量为正,与前述的地表动物研究结果一致,但湿度载荷量为负值,可能是因为洞穴空气湿度相对洞外更高[21],一定程度上限制了非喜湿性动物的分布。拉梭洞内空气湿度在第1主成分贡献也较大,但载荷量为正,这是由于黑暗带有大面积的水源使其湿度很大,喜黑暗环境的闪夜蛾又在黑暗带分布较多,尽管通常情况下有光带分布的动物种类和数量比黑暗带多,但拉梭洞有光带受到了人类干扰,限制了洞穴动物的数量分布,从而使该洞的动物群落结构特征(如动物相对数量)表现为湿度较高的黑暗带高于湿度较低的有光带和弱光带。另外,拉梭洞内气温不是影响动物群落结构的主导因子,可能是由于该洞受人类干扰大,导致温度对群落结构的影响不显著。
在洞外生态系统,Eisenhauer等[32]研究显示大气CO2浓度升高增加了纤毛虫、微型节肢动物腐食者和革螨的密度,但线虫丰富度降低。伍一宁等[33]研究发现CO2浓度升高使弹尾目丰富度减少,由此看出大气CO2对洞外动物有正面影响也有负面影响。就干细洞和拉梭洞而言,大气CO2浓度对洞穴动物群落结构具有负面影响,该结果与水拔洞等洞穴的研究结果[14, 16-17]一致。这可能是因为洞穴内空气CO2浓度比洞外高,而当空气中CO2含量过高时,脊椎动物的呼吸会加快,一些昆虫会进入休眠[16],并且CO2浓度升高对动物的影响还受气候以及土壤因子等多因素的协同作用[33]。另外,干细洞中土壤湿度在第2主成分上贡献最大,载荷量为负值。本研究的土壤湿度(6.1%~6.6%)低于南泥湾湿地土壤含水量(19.44%~ 30.11%)[34]和广西环江喀斯特生态恢复生境土壤湿度(8.9%~16.4%)[27],其中,南泥湾湿地中小型土壤动物个体总数、类群数与土壤含水量呈显著负相关,而广西环江喀斯特生态恢复生境中土壤大型动物个体总数、类群数、丰富度、多样性指数与湿度呈显著正相关。此外,韩慧莹等[26]的研究表明长白山地低山区大型土壤动物类群数、密度对土壤湿度具有正响应,中小型土壤动物类群数、密度对土壤湿度具有显著正响应。可见,不同类型的动物在不同的研究区域对土壤湿度的响应程度不同,而且动物群落结构变化不是单一因子影响的结果,而是受气候、土壤理化性质、地形等多因素的综合作用。因此洞穴动物群落结构与环境因子间更细致的作用机理还有待今后进一步研究。
3 结论喀斯特洞穴是一个较封闭和脆弱的地下生态系统,一旦遭到人类破坏,很难恢复,对栖息于洞穴内的动物种类和数量分布以及动物群落结构会产生极大的影响。对荔波干细洞(未受人类干扰)和拉梭洞(已受人类干扰)的动物群落结构及其环境关系的研究结论如下:
(1)拉梭洞由于受人类干扰大,其群落动物物种数和总个体数均比干细洞少。两个洞穴的物种数均沿有光带、弱光带、黑暗带呈递减趋势。
(2)干细洞和拉梭洞共划分为6个群落,群落丰富度指数和多样性指数均沿有光带、弱光带、黑暗带呈逐渐递减趋势。群落间相似性指数偏低,除了群落E-F(0.428 5)、群落C-F(0.272 7)处于中等不相似水平,其余群落之间均处于极不相似水平。群落间相似性规律表现为分布在同一洞穴相邻光带或不同洞穴同一光带的群落间相似性较高,分布在同一洞穴相隔较远光带或不同洞穴相隔较远光带的群落间相似性较低。
(3)主成分分析(PCA)结果表明,影响干细洞动物群落结构的主导因子为土壤营养元素(Na、K)、土壤有机质、气温、空气湿度和土壤湿度。影响拉梭洞动物群落结构的主导因子为土壤营养元素(Na、K)、土壤有机质、空气湿度、CO2含量和滴水pH。
| [1] |
Romero A. Cave biology life in darkness[M]. London: Cambridge University Press, 2009.
|
| [2] |
吴清林, 李坡, 熊康宁. 织金洞的美学价值分析[J]. 贵州科学, 2010, 28(1): 93-96. WU Qing-lin, LI Po, XIONG Kang-ning. Analysis of aesthetic value of Zhijin cave[J]. Guizhou Science, 2010, 28(1): 93-96. DOI:10.3969/j.issn.1003-6563.2010.01.019 |
| [3] |
Cigna A A, Forti P. Caves:The most important geotouristic feature in the world[J]. Tourism and Karst Areas, 2013, 6(1): 9-22. |
| [4] |
Ortega J, Maldonado J E, Wilkinson G S, et al. Male dominance, paternity, and relatedness in the Jamaican fruit-eating bat(Artibeus jamaicensis)[J]. Molecular Ecology, 2003, 12(9): 2409-2415. DOI:10.1046/j.1365-294X.2003.01924.x |
| [5] |
王福星, 曹建华. 桂林洞穴无脊椎动物的区系分布[J]. 中国岩溶, 1998, 17(2): 161-167. WANG Fu-xin, CAO Jian-hua. Fauna distribution of cave invertebrates in Guilin[J]. Carsologica Sinica, 1998, 17(2): 161-167. |
| [6] |
Šustr V, Elhottová D, Krištûfek V, et al. Ecophysiology of the cave isopod Mesoniscus graniger(Frivaldszky, 1865)(Crustacea:Isopoda)[J]. European Journal of Soil Biology, 2005, 41: 69-75. DOI:10.1016/j.ejsobi.2005.09.008 |
| [7] |
Riesch R, Plath M, Schlupp I. Matrotrophy in the cave molly:An unexpected provisioning strategy in an extreme environment[J]. Evolutionary Ecology, 2010, 24(4): 789-801. DOI:10.1007/s10682-009-9335-z |
| [8] |
姚雁鸿.湘西盲高原鳅遗传多样性与生理学研究[D].武汉: 华中农业大学, 2012. YAO Yan-hong. Genetic diversity and physiology of the cavefish(Triplophysa Xiangxiensis)[D].Wuhan: Huazhong Agriculture University, 2012. |
| [9] |
Stern D B, Crandall K A. Phototransduction gene expression and evolution in cave and surface crayfishes[J]. Integrative and Comparative Biology, 2018, 58(3): 398-410. DOI:10.1093/icb/icy029 |
| [10] |
晏翰林, 徐承香, 巴家文, 等. 贵州荔波喀斯特洞穴鱼体重金属含量及食用健康风险评价[J]. 淡水渔业, 2019, 49(6): 107-112. YAN Han-lin, XU Cheng-xiang, BA Jia-wen, et al. Health risk assessment and content of heavy metal of Karst cavefish in Libo, Guizhou[J]. Freshwater Fisheries, 2019, 49(6): 107-112. |
| [11] |
Tobler M, Schlupp I, Heubel K U, et al. Life on the edge:Hydrogen sulfide and the fish communities of a Mexican cave and surrounding waters[J]. Extremophiles, 2006, 10(6): 577-585. DOI:10.1007/s00792-006-0531-2 |
| [12] |
Nagy Z L, Postawa T. Seasonal and geographical distribution of cavedwelling bats in Romania:Implications for conservation[J]. Animal Conservation, 2011, 14(1): 74-86. DOI:10.1111/j.1469-1795.2010.00392.x |
| [13] |
Pipan T, Christman M C, Culverd C. Dynamics of epikarst communities:Microgeographic pattern and environmental determinants of epikarst copepods in Organ cave, west Virginia[J]. The American Midland Naturalist, 2006, 156(1): 75-87. DOI:10.1674/0003-0031(2006)156[75:DOECMP]2.0.CO;2 |
| [14] |
黎道洪. 贵州水拔洞内动物群落结构与部分环境因子的相关性研究[J]. 中国岩溶, 2006, 25(3): 256-262. LI Dao-hong. Study on correlation between fauna structure and some environmental factors in Shuiba cave, Guizhou[J]. Carsologica Sinica, 2006, 25(3): 256-262. DOI:10.3969/j.issn.1001-4810.2006.03.013 |
| [15] |
黎道洪. 贵州董背洞和水江洞内动物群落结构与部分环境因子的相关性(英文)[J]. 动物学研究, 2006, 27(5): 481-488. LI Daohong. Correlation between the animal community structure and environmental factors in Dongbei cave and Shuijiang cave of Guizhou Province[J]. Zoological Research, 2006, 27(5): 481-488. DOI:10.3321/j.issn:0254-5853.2006.05.005 |
| [16] |
黎道洪. 贵州波多洞和甲良洞内部分环境因子与动物群落结构的相关性[J]. 生态学报, 2007, 27(6): 2167-2176. LI Dao-hong. The correlation between the environmental factors and animal community structure in Boduo cave and Jialiang cave of Guizhou Province[J]. Acta Ecologica Sinica, 2007, 27(6): 2167-2176. DOI:10.3321/j.issn:1000-0933.2007.06.003 |
| [17] |
徐承香, 李子忠, 黎道洪. 贵州织金洞洞穴动物群落多样性与光照强度及土壤重金属含量的关系[J]. 生物多样性, 2013, 21(1): 62-70. XU Cheng-xiang, LI Zi-zhong, LI Dao-hong. Relationships between the diversity of animal communities and the lighting environment and content of heavy metals in soils in Guizhou Zhijin cave[J]. Biodiversity Science, 2013, 21(1): 62-70. |
| [18] |
冉景丞. 荔波洞穴鱼类初步研究[J]. 中国岩溶, 2000, 19(4): 327-332. RAN Jing-cheng. A preliminary research on cave fish in Libo County[J]. Carsologica Sinica, 2000, 19(4): 327-332. DOI:10.3969/j.issn.1001-4810.2000.04.006 |
| [19] |
杨天友, 侯秀发, 王应祥, 等. 中国南方喀斯特荔波世界自然遗产地翼手目物种多样性与保护现状[J]. 生物多样性, 2014, 22(3): 385-391. YANG Tian-you, HOU Xiu-fa, WANG Ying-xiang, et al. Bat species diversity and conservation in Libo World Natural Heritage site of south China Karst[J]. Biodiversity Science, 2014, 22(3): 385-391. |
| [20] |
刘瑞龙, 杨万琴, 吴福忠, 等. 川西亚高山/高山森林凋落物分解过程中土壤动物群落结构及其多样性动态[J]. 应用与环境生物学报, 2014, 20(3): 499-507. LIU Rui-long, YANG Wan-qin, WU Fu-zhong, et al. Soil fauna community structure and diversity during foliar litter decomposition in the subalpine/alpine forests of western Sichuan[J]. Chinese Journal of Applied & Environmental Biology, 2014, 20(3): 499-507. |
| [21] |
徐承香, 李子忠, 黎道洪. 喀斯特洞穴动物与部分生态环境因子的关系[J]. 湖北农业科学, 2012, 51(6): 1081-1084. XU Chengxiang, LI Zi-zhong, LI Dao-hong. The correlation of cave animals and some eco-environmental factors in Karst areas[J]. Hubei Agricultural Sciences, 2012, 51(6): 1081-1084. DOI:10.3969/j.issn.0439-8114.2012.06.001 |
| [22] |
张雪萍, 张武, 曹会聪. 大兴安岭不同冻土带土壤动物生态地理研究[J]. 土壤学报, 2006, 43(6): 996-1003. ZHANG Xue-ping, ZHANG Wu, CAO Hui-cong. Geo-ecology of soil fauna in different tundras in Daxing'anling Mountains[J]. Acta Pedologica Sinica, 2006, 43(6): 996-1003. DOI:10.3321/j.issn:0564-3929.2006.06.017 |
| [23] |
肖玖金, 赵波, 周开伦, 等. 野青茅根系和叶分解过程中土壤动物群落特征[J]. 应用与环境生物学报, 2018, 24(5): 1179-1184. XIAO Jiu-jin, ZHAO Bo, ZHOU Kai-lun, et al. Community characteristics of the soil fauna associated with decomposing roots and litter of Deyeuxia arundinacea[J]. Chinese Journal of Applied & Environmental Biology, 2018, 24(5): 1179-1184. |
| [24] |
解文艳, 周怀平, 杨振兴, 等. 黄土高原东部潇河流域农田土壤有机质时空变异及影响因素[J]. 农业资源与环境学报, 2019, 36(1): 96-104. XIE Wen-yan, ZHOU Huai-ping, YANG Zhen-xing, et al. The spatial-temporal variation of soil organic matter and its influencing factors in Xiaohe River basin in eastern Loess Plateau, China[J]. Journal of Agricultural Resources and Environment, 2019, 36(1): 96-104. |
| [25] |
Hasegawa M. The relationship between the organic matter composition of a forest floor and the structure of a soil arthropod community[J]. European Journal of Soil Biology, 2001, 37(4): 281-284. DOI:10.1016/S1164-5563(01)01099-8 |
| [26] |
韩慧莹, 殷秀琴, 寇新昌. 长白山地低山区土壤动物群落特征及其对环境因子变化的响应[J]. 生态学报, 2017, 37(7): 2197-2205. HAN Hui-ying, YIN Xiu-qin, KOU Xin-chang. Community characteristics of soil fauna in the low-mountain of the Changbai Mountains and its respond to the change of environmental factors[J]. Acta Ecologica Sinica, 2017, 37(7): 2197-2205. |
| [27] |
唐政, 李忠芳, 胡宁, 等. 喀斯特生态恢复下土壤大型动物群落结构与基本肥力的协同恢复[J]. 南方农业学报, 2018, 49(4): 669-675. TANG Zheng, LI Zhong-fang, HU Ning, et al. Co-recovery of soil macrofauna and basic fertility under ecological restoration in Karst areas[J]. Journal of Southern Agriculture, 2018, 49(4): 669-675. DOI:10.3969/j.issn.2095-1191.2018.04.08 |
| [28] |
殷秀琴, 刘继亮, 高明. 小兴安岭森林生态系统中营养元素关系及土壤动物的作用[J]. 地理科学, 2007, 27(6): 814-819. YIN Xiuqin, LIU Ji-liang, GAO Ming. Relationships of nutrient elements in forest ecosysterm of Xiao Hinggan Mountains and role of soil fauna[J]. Scientia Geographica Sinica, 2007, 27(6): 814-819. DOI:10.3969/j.issn.1000-0690.2007.06.014 |
| [29] |
铁烈华, 白文玉, 冯茂松, 等. 柏木低效林5种改造措施对土壤动物和土壤理化性质的影响[J]. 应用与环境生物学报, 2019, 25(5): 1053-1060. TIE Lie-hua, BAI Wen-yu, FENG Mao-song, et al. Effects of five low-benefit Cupressus funebris recovery measures on soil fauna and physical and chemical properties[J]. Chinese Journal of Applied & Environmental Biology, 2019, 25(5): 1053-1060. |
| [30] |
Ayal Y. Trophic structure and the role of predation in shaping hot desert communities[J]. Journal of Arid Environments, 2007, 68(2): 171-187. DOI:10.1016/j.jaridenv.2006.05.013 |
| [31] |
刘任涛, 朱凡. 半干旱区草地生境中大型土壤动物群落季节动态[J]. 生态环境学报, 2013, 22(1): 72-77. LIU Ren-tao, ZHU Fan. Seasonal dynamics of soil macro-faunal community in semi -arid grassland[J]. Ecology and Environmental Sciences, 2013, 22(1): 72-77. DOI:10.3969/j.issn.1674-5906.2013.01.014 |
| [32] |
Eisenhauer N, Cesarz S, Koller R, et al. Global change belowground:Impacts of elevated CO2, nitrogen, and summer drought on soil food webs and biodiversity[J]. Global Change Biology, 2012, 18(2): 435-447. DOI:10.1111/j.1365-2486.2011.02555.x |
| [33] |
伍一宁, 王贺, 钟海秀, 等. 三江平原土壤动物群落多样性对CO2浓度升高的响应[J]. 生物多样性, 2018, 26(10): 1127-1132. WU Yi-ning, WANG He, ZHONG Hai-xiu, et al. The response of diverse soil fauna communities to elevated CO2 concentrations in Sanjiang Plain[J]. Biodiversity Science, 2018, 26(10): 1127-1132. DOI:10.17520/biods.2018081 |
| [34] |
罗梦娇, 李松松, 强大宏, 等. 南泥湾湿地土壤动物群落组成与土壤理化性质的关系[J]. 生态环境学报, 2018, 27(8): 1432-1439. LUO Meng-jiao, LI Song-song, QIANG Da-hong, et al. Relationship between soil animal community composition and soil physical and chemical properties in Nanniwan wetland[J]. Ecology and Environmental Sciences, 2018, 27(8): 1432-1439. |
 2021, Vol. 38
2021, Vol. 38