2. 山东师范大学地理与环境学院, 济南 250358;
3. 中国环境科学研究院, 国家环境保护洞庭湖科学观测研究站, 环境基准与风险评估国家重点实验室, 湖泊水污染治理与生态修复技术国家工程实验室, 北京 100012;
4. 中国环境监测总站, 北京 100012
2. College of Geography and Environment, Shandong Normal University, Jinan 250358, China;
3. State Environmental Protection Scientific Observation and Research Station for Lake Dongting, State Key Labratory of Environment Criteria and Risk Assessment, National Engineering Laboratory for Lake Pollution Control and Ecological Restoration, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;
4. China National Environmental Monitoring Centre, Beijing 100012, China
喹诺酮类药物是人工合成的通过妨碍DNA回旋酶进而损害细菌DNA的抗生素药物[1]。诺氟沙星(NOR)作为喹诺酮类抗生素中应用最多的一种,它能有效抑制革兰氏阳性菌和革兰氏阴性菌的DNA促旋酶的合成和复制[2],被广泛用于治疗敏感菌感染的肠道、泌尿、呼吸系统疾病[3]。磺胺类化合物性质持久,结构复杂,可阻碍细菌生长或杀死细菌,其品种较多[4],成本相对较低,是动物食品生产中最受欢迎的活性抗菌剂之一[5],磺胺甲恶唑(SMX)是一种广谱抗菌药,对葡萄球菌及大肠杆菌作用极强,广泛应用于水产养殖业、畜牧业、种植业及医疗卫生行业[6]。但SMX和NOR被人或动物服用后仅有部分被吸收[7-8],大部分SMX和NOR会以母体或代谢产物的形式通过不同方式排放到周围土壤和水体[9]。在畜牧养殖业废水、粪便和周边土壤中检出浓度最高的抗生素为四环素、喹诺酮类、磺胺类兽药抗生素,浓度可达μg·L-1或mg·L-1级别[10]。调查表明地表水中超过100种高浓度溶解相抗生素[11]对藻类、鱼类和水蚤等水生生物具有急性毒性(EC50 < 1 mg·L-1),抗生素在环境中的积累可能导致细菌耐药性,造成微生物生态系统失衡,可能给疾病治疗带来困难[12],威胁人类健康。
传统废水处理方法(混凝沉淀、离子交换或活性污泥法等)去除抗生素效果不佳,甚至会出现出水浓度高于进水浓度的现象,例如活性污泥法中污泥细菌具有耐药性不佳等缺点,其残留物仍具生物活性,对水环境有巨大潜在危害[13]。目前,吸附法因安全高效、能耗低且吸附剂可回收再生重复利用[14],在吸附污染物时不会产生高毒性中间代谢物[5]而被广泛应用。去除抗生素类药物的吸附剂有沸石[15]、碳纳米管[16]、气凝胶[17]、微塑料[18]及活性炭等,但大多吸附剂开发受限,例如:碳纳米管制备要求较高,对污染物的吸附也会影响其在环境中的行为;微塑料吸附效率低;活性炭经济费用较高,而生物质炭是在无氧或缺氧环境下生物质残体高温热解产生的富碳材料[19],比表面积大,孔隙结构丰富,表面富含功能团和矿物质,具良好吸附特性[20-21],在环境污染物吸附去除中有较大应用潜力[22]。而溶液初始pH可影响吸附剂表面化学官能团的解离程度,当pH值达到某个值时,羟基、羧基等官能团会发生水解,影响吸附材料表面电性。同时,对于离子型抗生素,溶液体系pH值的变化也会影响其在溶液中的溶解度和存在形态,从而影响吸附过程。王开峰等[23]研究表明,600 ℃热解制得的水稻秸秆炭对磺胺甲恶唑在pH为3时的吸附率可超过60%;Zheng等[24]研究发现,不同热解温度下制得的生物质炭对磺胺甲恶唑的吸附均表现出溶液pH 1~4吸附量逐渐升高、pH 4~12吸附量逐渐降低的趋势。目前人工湿地中大部分无经济价值或经济价值较低的植物(芦苇、芦竹等)尚未得到较好处理处置,芦苇若不能及时收割,则会重新释放体内的污染物至环境中形成二次污染[25]。将湿地植物热解制成生物质炭既可有效解决湿地部分植物处理问题,又可作为吸附剂去除水体中污染物[26]。
本研究选用芦苇秸秆热解制得生物质炭,通过探讨三种pH值下等温吸附、动力学和热力学过程,对比分析不同pH值下生物质炭对NOR和SMX的吸附效果,以期为生物质炭的合理应用和湿地植物资源化利用提供科学依据和数据支持。
1 材料与方法 1.1 生物质炭制备芦苇取自微山湖人工湿地,将芦苇秸秆洗净,干燥,剪至2~3 cm的小段。芦苇生物质炭采用中高温热解方式制备。升温程序:2 h升至40 ℃,再30 min升至500 ℃[22],保持1.5 h;氮气速率:300 mL·min-1。冷却至室温后用去离子水洗至pH为中性,于恒温干燥箱烘干24 h后过100目筛,得到芦苇生物质炭,备用。
1.2 试验试剂试验所选用的诺氟沙星(Norfloxacin,NOR,≥99.0%)和磺胺甲恶唑(Sulfamethoxazole,SMX,≥99.0%)抗生素均购于德国Dr. Ehrenstorfer GmbH公司。诺氟沙星分子式为C16H18FN3O3,分子量为319.33;磺胺甲恶唑分子式为C10H11N3O3S,分子量为253.28。
1.3 生物质炭表征用Zeta电位分析仪(90Plus Zeta型,美国)测定芦苇秸秆生物质炭的表面电荷。称取一定量的生物质炭,按照0.8 g·L-1的固液比(与吸附实验保持一致)添加到超纯水中,并用0.1 mol·L-1的HCl和NaOH调节溶液pH值为2~11,平衡后测定溶液Zeta电位,每个点测定3次取平均值。生物质炭的等电点(pHPZC)即为Zeta电位为零时的pH值。采用傅立叶红外光谱(FTIR)仪(Perkin Elmer 1725 X,美国)测定表面官能团,利用KBr压片法对吸附前后的生物质炭进行红外光谱测试,将一定质量的生物质炭置于玛瑙研钵中,然后加入一定量的高纯度KBr(纯度>99%),充分研磨后压成薄片,波数区间为400~4000 cm-1。
1.4 吸附试验(1)pH值的影响。准确配制10 mg·L-1的NOR和SMX溶液,使用HCl和NaOH分别调节溶液pH为1、3、5、6、7、9、11,称取0.02 g生物质炭于30 mL玻璃离心管中,加入25 mL调好pH的抗生素溶液(10 mg·L-1),在25 ℃下于气浴振荡器(THZ-82A,常州博远实验分析仪器厂)振荡24 h(220 r·min-1)达到吸附平衡后,用0.22 μm滤膜过滤,用高效液相色谱(HPLC,Agilent 1200,安捷伦科技有限公司)测定溶液中剩余的抗生素浓度。
(2)吸附动力学。称取0.02 g生物质炭于30 mL玻璃离心管中,加入25 mL质量浓度10 mg·L-1的抗生素溶液,NOR溶液pH分别为4、7、9,SMX溶液pH分别为1、5、9。在25 ℃下于气浴振荡器振荡24 h(220 r·min-1)达到吸附平衡后,分别在1、3、5、10、20、40、60、90、120、180、360、540、720、1 080、1 440 min取样,经0.22 μm滤膜过滤,用高效液相色谱法测定溶液中剩余的抗生素浓度。
(3)吸附等温线。称取0.02 g生物质炭于30 mL玻璃离心管中,加入25 mL质量浓度分别为1、3、5、10、20、30、50 mg·L-1的NOR和SMX溶液,NOR溶液pH分别调整为4、7、9,SMX溶液pH分别为1、5、9。分别在25、35 ℃下于气浴振荡器振荡24 h(220 r·min-1)达到吸附平衡后,用0.22 μm滤膜过滤,用高效液相色谱法测定溶液中剩余的抗生素浓度。
1.5 数据处理采用拟二级动力学模型和颗粒内扩散模型对生物质炭吸附NOR和SMX的动力学过程进行拟合,方程分别如下:
拟二级动力学方程

|
(1) |

|
(2) |
颗粒内扩散方程

|
(3) |
式中:t为吸附反应时间,h;qt为t时刻的吸附量,mg·g-1;qe为吸附达到平衡时的单位质量生物质炭吸附抗生素的质量,即平衡吸附量,mg·g-1;K2为拟二级动力学吸附速率常数;t1/2为反应到达平衡吸附量一半时反应所需时间,表征吸附反应速率;kd为颗粒内扩散速率常数,mg·g-1·min-0.5,其与颗粒内扩散系数D的关系为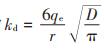
分别用Langmuir等温方程和Freundlich等温方程两种模型对NOR和SMX在生物质炭上的等温吸附过程进行拟合,方程分别如下:
Langmuir方程:

|
(4) |
Freundlich方程:

|
(5) |
式中:KL为Langmuir等温方程式系数,是表征吸附表面强度的常数;Ce为溶液中NOR和SMX平衡浓度,mg·L-1;Qm为NOR和SMX单分子层吸附时的最大吸附量,mg·g-1;KF和1/n为Freundlich等温方程系数,是与温度有关的常数,其大小表示吸附剂吸附的难易程度。
计算芦苇生物质炭在298.15 K和308.15 K时吸附NOR和SMX过程中的吉布斯自由能(ΔG)、吸附焓(ΔH)、吸附熵(ΔS)等热力学参数,研究温度对芦苇生物质炭吸附NOR和SMX的影响,公式如下:

|
(6) |

|
(7) |
式中:lnKT为温度为T时的吸附热力学平衡常数,ΔG为标准吉布斯自由能,kJ·mol-1;ΔS为熵,J·K-1·mol-1;ΔH为焓,kJ·mol-1;R为气体常数,8.314 J·mol-1·K-1;T为温度,K。
2 结果与讨论 2.1 pH的影响吸附体系的pH会影响生物质炭和抗生素在水中的存在形态,进而影响水中抗生素的去除[28]。NOR在溶液中有pKa1=6.34、pKa2=8.75两个酸解离常数,pKa1为羧基(-COOH)的去质子化,pKa2为哌嗪基上氨基(-N2C4H9)的质子化。当pH≤6.34时,NOR主要以阳离子形态NOR+存在;当6.34≤pH≤8.75,NOR主要以中性NOR0分子形态或两性NOR±形态存在;当pH≥8.75时,NOR主要以阴离子NOR-形态存在[29]。SMX在溶液中有pKa1=1.85、pKa2=5.60两个酸解离常数,pKa1表示氨基(-NH2)的质子化,pKa2表示磺酰胺(-SO2NH-)的去质子化。当pH≤1.85时,SMX主要以阳离子形态SMX+存在;当1.85≤pH≤5.60,SMX主要以中性SMX0或两性SMX±形态存在;当pH≥5.60时,SMX主要以阴离子SMX-形态存在[30]。
pH值对生物质炭吸附NOR和SMX的影响见图 1,由图 1可见:生物质炭对NOR的吸附呈现先增后减趋势;对SMX的吸附呈先减后增再减趋势。

|
图 1 pH对生物质炭吸附NOR和SMX的影响 Figure 1 Effect of pH on adsorption of NOR and SMX by biochar |
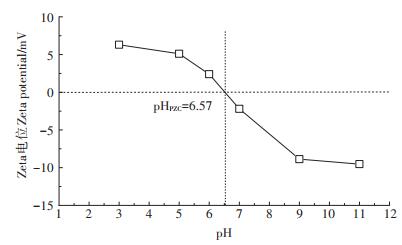
为进一步探讨pH对芦苇秸秆生物质炭结构形态的影响及其与NOR、SMX间的相互作用机制,对生物质炭进行Zeta电位分析,其在不同pH下的Zeta电位曲线见图 2,图中两虚线的交点即为生物质炭的等电点。pHPZC的大小可一定程度上反映生物质炭表面官能团情况。
|
图 2 芦苇秸秆生物质炭的Zeta电位 Figure 2 Zeta potential of reed straw biochar |
由图 2可得生物质炭的等电点为pHPZC=6.57,且随着平衡pH的增加生物质炭电负性增强。溶液pH可使生物质炭表面电荷改变,溶液pH < 6.57,表明生物质炭表面带正电荷,利于吸附阴离子;而当溶液pH>6.57时,生物质炭表面带负电荷,对阳离子吸附有利。
由以上结果可得,pH对NOR和SMX在生物质炭上的吸附有明显影响[8]。根据NOR在不同pH下具有不同形态的特点,可以判断生物质炭对NOR的吸附主要以静电力为主,这与Luo等[9]用KOH改性生物质炭对NOR的吸附效果规律一致。分析认为:溶液为强酸环境时,过多的H+占据了生物质炭表面的吸附点位,与NOR+产生竞争吸附,降低了生物质炭与NOR+的结合力[25],同时,在酸性条件下,生物质炭表面发生质子化作用使其带正电荷,与NOR+之间存在静电斥力,吸附量较低。由芦苇秸秆生物质炭的Zeta电位(图 2)可知,随着溶液pH在1~5范围内逐渐升高,生物质炭表面电量逐渐降低,生物质炭所带正电荷减少,与NOR+之间静电排斥力降低。同时,由中性条件下生物质炭的FTIR表征结果可得,生物质炭吸附NOR之后羟基减少,表明生物质炭与NOR之间可能发生氢键作用,吸附量增大[10],在pH=5左右时吸附量达最大(7.80 mg·g-1)。当pH>7时,NOR以中性分子或两性NOR±存在,碱性条件下基本全部为NOR-,生物质炭表面所带负电荷与NOR-之间静电斥力逐渐增大,同时,由于pH高时会影响生物质炭表面官能团的羟基化,从而影响氢键的形成[15],故此时吸附过程中生物质炭表面氢键作用逐渐减弱,吸附量降低[20]。
SMX易溶于甲醇等有机溶剂,亲脂性较强,在中性条件下有一定的疏水相互作用。而在pKa1值左右时,生物质炭对SMX的吸附量较大的原因可能为SMX+相较于H+数量处于优势,带正电荷生物质炭与阳离子SMX+发生阳离子交换,生物质炭大量吸附SMX+,因此吸附容量较大;弱酸性条件下SMX在溶液中主要以中性离子态存在,具有较强π电子接受能力,生物质炭上过量的π电子与SMX0间的π-π电子供体受体相互作用[27],促进了生物质炭对SMX的吸附。在pH>5时,生物质炭对SMX的吸附量逐渐降低,在碱性条件下SMX-与生物质炭之间存在静电斥力,生物质炭对SMX的吸附效果下降,吸附量减少。通过以上分析发现,生物质炭对NOR和SMX的吸附未有明显差异,其吸附过程主要与静电力、阳离子交换、π-π电子供体受体作用及疏水相互作用有关。
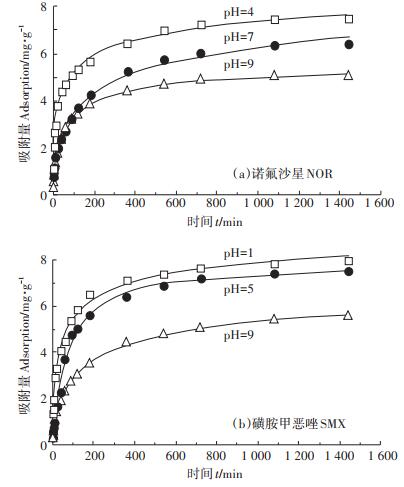
2.2 吸附动力学不同pH时生物质炭对NOR和SMX的吸附动力学特征见图 3,生物质炭对NOR和SMX的吸附量随时间推移呈现相同变化趋势:吸附初始阶段,溶液中抗生素浓度降低较快,在200 min左右吸附量超过平衡吸附量的80%。在吸附前期,抗生素在溶液中的分散度较高,并快速扩散至生物质炭外表面,随后传质阻力逐渐增大[9],溶液中NOR和SMX的扩散速度减缓,在24 h左右达到吸附平衡。
|
图 3 生物质炭对NOR和SMX的吸附动力学曲线 Figure 3 Adsorption kinetics curves of NOR and SMX on biochar |
拟一级动力学方程更适合描述单个影响因素的吸附过程,即物理吸附的初期动力学,应用过程存在一定局限性。拟二级方程可描述两种主要因素影响的吸附过程,同时包含了膜扩散、颗粒内部扩散和表面吸附等吸附过程,可更好描述吸附过程[7, 10]。本研究用拟二级动力学模型对生物质炭吸附NOR和SMX的动力学过程进行拟合,相关参数见表 1。由表 1可知,由拟二级动力学模型算得的生物质炭对NOR的平衡吸附量在三个pH下分别6.46、5.41、5.20 mg·g-1,与实际吸附容量值7.49、6.42、5.07 mg·g-1较为接近且R2均大于0.98;生物质炭对SMX拟二级动力学模型的吸附容量较接近实际吸附容量值(7.08、6.68、4.50 mg·g-1),说明拟二级动力学模型较为准确地描述生物质炭对两种抗生素的吸附行为,其吸附过程受两种以上因素共同影响[25]。
|
|
表 1 生物质炭吸附NOR和SMX动力学拟合参数 Table 1 Parameters of adsorption kinetics of NOR and SMX |
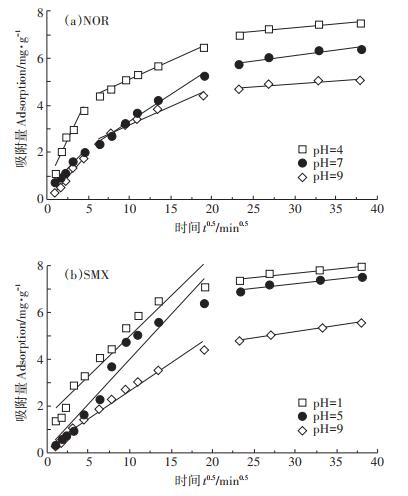
为更好了解生物质炭对两种抗生素在吸附中的扩散机制和实际控制步骤,采用颗粒内扩散方程拟合动力学数据。用吸附量对t0.5作图为直线,若直线通过原点,那么颗粒内扩散为速率控制的唯一步骤;如不通过原点,则表示颗粒内扩散不是唯一的控制步骤[27]。拟合结果见图 4和表 2。
|
图 4 生物质炭对NOR和SMX的吸附颗粒内扩散模型拟合曲线 Figure 4 Fitting curve of intraparticle diffusion model for NOR and SMX adsorbed on biochar |
|
|
表 2 颗粒内扩散模型拟合参数 Table 2 Parameters of the intraparticle diffusion model for adsorption NOR and SMX on biochar |
由图 4和表 2可知,生物质炭对NOR吸附过程可分为三个阶段:0~200 min为快速吸附阶段,表示NOR通过膜扩散穿过边界层快速转移到生物质炭表面,且kd1较大,说明表面扩散较快,吸附速率大[24],NOR向生物质炭表层的快速转移主要发生在反应初期[31-32];第二阶段为NOR逐渐进入生物质炭材料内部进行颗粒内扩散过程,kd2减小,可能是边界层效应增大,传质阻力增大,使颗粒内扩散速率放缓[27];第三阶段为生物质炭对NOR的吸附容量趋于平衡的吸附平衡阶段,kd3进一步降低,当生物质炭表面的吸附位点被NOR分子或离子占据后,其余的NOR分子或离子缓慢地扩散到生物质炭内部[29],固液相分配逐渐平衡,吸附过程逐渐达到平衡[33]。生物质炭吸附NOR的拟合直线前两个阶段R2均较大,第三个阶段R2较小,且颗粒内扩散模型拟合直线均没有通过坐标原点,C值均不等于零,说明在吸附过程中颗粒内扩散不是唯一的控制步骤,还有其他过程(如表面吸附等)共同控制吸附反应速率[29]。而生物质炭对SMX的吸附过程可分为两个阶段:0~400 min为SMX从溶液中快速扩散到生物质炭表面的过程,且线性拟合斜率较大,说明表面扩散过程较快;第二阶段为SMX扩散到生物质炭材料内部的过程,kd2远低于kd1,吸附速率明显降低,主要是由于溶液中SMX浓度随着吸附时间的增加而降低[32],表明生物质炭对SMX吸附速率主要受控于颗粒内扩散。
2.3 吸附等温线试验温度为25 ℃时,三种pH下生物质炭对NOR和SMX的吸附等温线见图 5,两者均呈现在吸附初期吸附量随着平衡浓度增大迅速增加的趋势,当平衡浓度在10 mg·L-1时,吸附量升高趋势变缓而后趋于稳定。通过吸附等温线对比可得,在酸性条件下生物质炭对NOR和SMX的吸附量远高于在碱性条件下的吸附量。

|
图 5 生物质炭对NOR和SMX的吸附等温线 Figure 5 Adsorption isotherm of NOR and SMX under different pH by biochar at 25 ℃ |
将NOR和SMX在生物质炭上的等温吸附过程分别用Langmuir等温方程和Freundlich等温方程拟合,结果见图 6和表 3。与Freundlich吸附等温方程(R2>0.809 0)相比,Langmuir方程能更好描述不同pH时生物质炭对NOR和SMX的等温吸附行为(R2>0.974 5),说明生物质炭在水溶液中吸附NOR和SMX时易发生单分子层吸附。生物质炭对NOR在三种pH下的最大理论吸附量依次为15.17(pH=4)、10.05(pH=7)、5.22 mg·g-1(pH=9),SMX在三种pH下的最大理论吸附量依次为26.88(pH=1)、12.41(pH=5)、6.25 mg·g-1(pH=9),这与pH对吸附效果的影响结果一致。在Freundlich等温吸附模型中,一般认为2 < n < 10吸附容易进行,即优惠吸附,n < 0.5时吸附难进行[33]。本试验中生物质炭对NOR的吸附1/n均小于0.5,即n>2,表明此吸附过程易发生,属于优惠吸附。

|
图 6 生物质炭对NOR和SMX的吸附拟合曲线 Figure 6 Fitting curve of NOR and SMX by biochar |
|
|
表 3 NOR和SMX的吸附等温线拟合参数 Table 3 Parameters of adsorption isotherm of NOR and SMX |
通过计算吸附过程中的吉布斯自由能(ΔG)、吸附焓(ΔH)、吸附熵(ΔS)等热力学参数来确定吸附反应热力学效应,研究温度对芦苇生物质炭吸附NOR和SMX的影响。其中,ΔH和ΔS通过lnKT对1/T作图后的斜率和截距得出[33],相关参数见表 4。由表 4可知,吉布斯自由能ΔG在试验温度下均为负值,说明在298~308 K范围内生物质炭对NOR和SMX的吸附反应是自发的。ΔH为正,则该吸附过程是吸热,反之为放热。生物质炭对NOR的吸附中ΔH为正,表明生物质炭对NOR的吸附过程是吸热,升温利于生物质炭对NOR的吸附。生物质炭对SMX的吸附中ΔH为负,表明生物质炭对SMX的吸附是放热,升温会抑制吸附。ΔS为正,表明在吸附中系统能量升高,离子混乱度增加[10]。
|
|
表 4 不同温度下生物质炭对NOR和SMX的吸附热力学参数 Table 4 Thermodynamic parameters for NOR and SMX adsorption at different temperatures |
随着温度增加,生物质炭吸附NOR的| ΔG |增大,自发程度增大,且ΔG变幅不大,说明温度不是影响生物质炭吸附NOR的主要因素;pH=1时,生物质炭吸附SMX的| ΔG |随温度升高而减小,自发程度减小,原因可能为升温降低了生物质炭与SMX之间的作用力。随pH的增加,生物质炭吸附NOR和SMX的| ΔG |减小,自发程度减小,说明吸附反应易在酸性条件进行,这与pH影响生物质炭吸附NOR和SMX的结果一致。
2.4 吸附机理对吸附前后(未调pH)的生物质炭表面官能团进行傅立叶红外光谱(FTIR)表征,结果见图 7。生物质炭对NOR和SMX的吸附在吸附前后的官能团基本一致,但对应的吸收峰强度有明显不同。3 425 cm-1左右的吸收峰是羟基官能团(-OH)的特征振动吸收峰,在吸附NOR和SMX后吸收峰蓝移至3 418 cm-1和3 417 cm-1,说明NOR和SMX与生物质炭表面官能团羟基化形成氢键从而被吸附[28];2 925 cm-1处的吸收峰是C-H官能团的特征振动吸收峰,吸附抗生素后吸收峰强度减弱,表明在吸附过程中生物质炭与NOR和SMX会存在阳离子交换作用;1 617 cm-1为C=O或-C=C-在芳香核上的拉伸振动吸收峰,吸附后吸收峰强度减弱,说明NOR、SMX与生物质炭的芳香结构之间形成π-π共轭结构;1 384 cm-1是-OH的伸缩振动吸收峰;1 106 cm-1处可能对应脂肪族醚的强吸收峰[29]。由图 7可知,芦苇秸秆生物质炭存在羟基、羧基等含氧官能团。
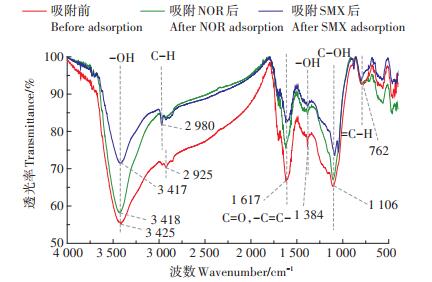
|
图 7 生物质炭的FTIR表征 Figure 7 FTIR characterization of biochar |
NOR和SMX在生物质炭上可能存在的吸附机制如图 8所示,根据吸附前后光谱图的对比分析可知,生物质炭吸附NOR和SMX后,-OH(3 425 cm-1)、C-H(2 980 cm-1)、C-OH(1 106 cm-1)和-C=C-(1 617 cm-1)处的吸收峰存在蓝移或红移现象,且吸附后羟基减少,表明生物质炭吸附NOR和SMX存在氢键作用。生物质炭对SMX的吸附还存在π-π电子供体受体作用,同时SMX中的异恶唑基与生物质炭上的C=O官能团之间可能会存在疏水相互作用。

|
图 8 生物质炭对NOR和SMX吸附机制示意图 Figure 8 Possible mechanisms for NOR and SMX on biochar |
(1)pH对芦苇秸秆生物质炭吸附NOR和SMX的影响较为显著。在酸性条件下更有利于生物质炭对NOR和SMX的吸附,这主要由于生物质炭对NOR的吸附以静电力和氢键为主,对SMX的吸附主要为π-π电子供体受体、阳离子交换作用及疏水相互作用。
(2)Langmuir方程能更好地描述芦苇秸秆生物质炭对NOR和SMX的等温吸附行为,符合单层吸附,对NOR和SMX的最大吸附量分别为13.85 mg ·g-1和12.79 mg·g-1。热力学吸附试验表明,生物质炭对NOR的吸附反应为吸热反应,对SMX的吸附反应为放热反应。吸附过程自发,升高温度有利于生物质炭对NOR的吸附,降低温度有利于其对SMX的吸附。
(3)拟二级动力学模型能更为准确地描述生物质炭对两种抗生素的吸附行为,200 min时吸附量可超过平衡吸附量的80%。生物质炭对NOR的吸附过程受到膜扩散、表面吸附和颗粒内扩散作用的共同影响,对SMX的吸附速率主要受限于颗粒内扩散机制。
| [1] |
Fu H, Li X B, Wang J, et al. Activated carbon adsorption of quinolone antibiotics in water:Performance, mechanism, and modeling[J]. Journal of Environmental Sciences, 2017, 56: 145-152. DOI:10.1016/j.jes.2016.09.010 |
| [2] |
Cao D Q, Yang W Y, Wang Z, et al. Role of extracellular polymeric substance in adsorption of quinolone antibiotics by microbial cells in excess sludge[J]. Chemical Engineering Journal, 2019, 370: 684-694. DOI:10.1016/j.cej.2019.03.230 |
| [3] |
Zhang J H, Lu M Y, Wan J, et al. Effects of pH, dissolved humic acid and Cu2+ on the adsorption of norfloxacin on montmorillonite-biochar composite derived from wheat straw[J]. Biochemical Engineering Journal, 2018, 130: 104-112. DOI:10.1016/j.bej.2017.11.018 |
| [4] |
Peng J, Wu E H, Wang N N, et al. Removal of sulfonamide antibiotics from water by adsorption and persulfate oxidation process[J]. Journal of Molecular Liquids, 2019, 274: 632-638. DOI:10.1016/j.molliq.2018.11.034 |
| [5] |
Li Y, Wang Z W, Xie X Y, et al. Removal of norfloxacin from aqueous solution by clay-biochar composite prepared from potato stem and natural attapulgite[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017, 514: 126-136. DOI:10.1016/j.colsurfa.2016.11.064 |
| [6] |
Reguyal F, Sarmah A K. Adsorption of sulfamethoxazole by magnetic biochar:Effects of pH, ionic strength, natural organic matter and 17 α-ethinylestradiol[J]. Science of the Total Environment, 2018, 628: 722-730. |
| [7] |
Yao Y, Gao B, Chen H, et al. Adsorption of sulfamethoxazole on biochar and its impact on reclaimed water irrigation[J]. Journal of Hazardous Materials, 2012, 209/210: 408-413. DOI:10.1016/j.jhazmat.2012.01.046 |
| [8] |
Yang X, Zhang X L, Wang Z W, et al. Mechanistic insights into removal of norfloxacin from water using different natural iron ore-biochar composites:More rich free radicals derived from natural pyrite-biochar composites than hematite-biochar composites[J]. Applied Catalysis B:Environmental, 2019, 255: e117752. DOI:10.1016/j.apcatb.2019.117752 |
| [9] |
Luo J W, Li X, Ge C Y, et al. Sorption of norfloxacin, sulfamerazine and oxytetracycline by KOH-modified biochar under single and ternary systems[J]. Bioresource Technology, 2018, 263: 385-392. DOI:10.1016/j.biortech.2018.05.022 |
| [10] |
王强锋, 朱彭玲, 夏中梅, 等. 三种农用抗生素降解真菌的筛选及其降解性能[J]. 农业资源与环境学报, 2018, 35(6): 533-539. WANG Qiang-feng, ZHU Peng-ling, XIA Zhong-mei, et al. Screening and degradation properties of three kinds of agricultural antibiotics degrading fungi[J]. Journal of Agricultural Resources and Environment, 2018, 35(6): 533-539. |
| [11] |
Baran W, Adamek E, Ziemiańska J, et al. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 2011, 196: 1-15. DOI:10.1016/j.jhazmat.2011.08.082 |
| [12] |
Liu X, Steele J C, Meng X Z. Usage, residue, and human health risk of antibiotics in Chinese aquaculture:A review[J]. Environmental Pollution, 2017, 223: 161-169. DOI:10.1016/j.envpol.2017.01.003 |
| [13] |
Manaia C M. Assessing the risk of antibiotic resistance transmission from the environment to humans:Non-direct proportionality between abundance and risk[J]. Trends in Microbiology, 2017, 25(3): 173-181. DOI:10.1016/j.tim.2016.11.014 |
| [14] |
兰涛.活性炭吸附技术去除水中氯贝酸和磺胺甲恶唑的研究[D].上海: 华东理工大学, 2011. LAN Tao. Activated carbon adsorption technique for clofibric acid and sulfamethoxazole removal from aqueous solution[D]. Shanghai: East China University of Science and Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10251-1011050404.htm |
| [15] |
Fukahori S, Fujiwara T, Ito R, et al. pH-dependent adsorption of sulfa drugs on high silica zeolite:Modeling and kinetic study[J]. Desalination, 2011, 275(1/2/3): 237-242. |
| [16] |
Li X Y, Pignatello J J, Wang Y Q, et al. New insight into adsorption mechanism of ionizable compounds on carbon nanotubes[J]. Environmental Science & Technology, 2013, 47(15): 8334-8341. |
| [17] |
Tian X M, Liu J X, Wang Y Q, et al. Adsorption of antibiotics from aqueous solution by different aerogels[J]. Journal of Non-Crystalline Solids, 2019, 505: 72-78. DOI:10.1016/j.jnoncrysol.2018.10.033 |
| [18] |
Li J, Zhang K N, Zhang H. Adsorption of antibiotics on microplastics[J]. Environmental Pollution, 2018, 237: 460-467. DOI:10.1016/j.envpol.2018.02.050 |
| [19] |
Oni B A, Oziegbe O, Olawole O, et al. Significance of biochar application to the environment and economy[J]. Annals of Agricultural Sciences, 2019, 64(2): 222-236. DOI:10.1016/j.aoas.2019.12.006 |
| [20] |
Kasozi G N, Zimmerman A R, Nkedi-Kizza P, et al. Catechol and humic acid sorption onto a range of laboratory-produced black carbons (biochars)[J]. Environmental Science & Technology, 2010, 44(16): 6189-6195. |
| [21] |
Yao Y, Gao B, Inyang M, et al. Removal of phosphate from aqueous solution by biochar derived from anaerobically digested sugar beet tailings[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 501-507. DOI:10.1016/j.jhazmat.2011.03.083 |
| [22] |
Inyang M, Gao B, Ding W, et al. Enhanced lead sorption by biochar derived from anaerobically digested sugarcane bagasse[J]. Separation Science and Technology, 2011, 46(12): 1950-1956. DOI:10.1080/01496395.2011.584604 |
| [23] |
王开峰, 彭娜, 吴礼滨, 等. 水稻秸秆生物炭对磺胺类抗生素的吸附研究[J]. 环境科学与技术, 2017, 40(9): 61-67. WANG Kai-feng, PENG Na, WU Li-bin, et al. Sorption characteristics of sulfonamide antibiotics by rice straw biochar[J]. Environmental Science and Technology, 2017, 40(9): 61-67. |
| [24] |
Zheng H, Wang Z Y, Zhao J, et al. Sorption of antibiotic sulfamethoxazole varies with biochars produced at different temperatures[J]. Environmental Pollution, 2013, 181: 60-67. DOI:10.1016/j.envpol.2013.05.056 |
| [25] |
张涵瑜, 王兆炜, 高俊红, 等. 芦苇基和污泥基生物炭对水体中诺氟沙星的吸附性能[J]. 环境科学, 2016, 37(2): 689-696. ZHANG Han-yu, WANG Zhao-wei, GAO Jun-hong, et al. Adsorption characteristics of norfloxacin by biochars derived from reed straw and municipal sludge[J]. Environmental Science, 2016, 37(2): 689-696. |
| [26] |
何琦, 曹凤梅, 卢少勇, 等. 挺水植物生物炭对硫丹的吸附及催化水解作用[J]. 中国环境科学, 2018, 38(3): 1126-1132. HE Qi, CAO Feng-mei, LU Shao-yong, et al. Adsorption and catalytic hydrolysis of endosulfan on biochars derived from emergent plants[J]. China Environmental Science, 2018, 38(3): 1126-1132. DOI:10.3969/j.issn.1000-6923.2018.03.040 |
| [27] |
刘莹.改性活性炭对水中典型磺胺类抗生素的吸附性能研究[D].济南: 山东师范大学, 2018. LIU Ying. Study on adsorption characteristics of typical sulfonamides in aquatic solutions by modified activated carbon[D]. Jinan: Shandong Normal University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10445-1018221109.htm |
| [28] |
Ahmed M B, Zhou J L, Ngo H H, et al. Single and competitive sorption properties and mechanism of functionalized biochar for removing sulfonamide antibiotics from water[J]. Chemical Engineering Journal, 2017, 311: 348-358. DOI:10.1016/j.cej.2016.11.106 |
| [29] |
Chen Z M, Xiao X, Xing B S, et al. pH-dependent sorption of sulfonamide antibiotics onto biochars:Sorption mechanisms and modeling[J]. Environmental Pollution, 2019, 248: 48-56. DOI:10.1016/j.envpol.2019.01.087 |
| [30] |
Liu X H, Lu S Y, Liu Y, et al. Adsorption of sulfamethoxazole(SMX) and ciprofloxacin(CIP) by humic acid(HA):Characteristics and mechanism[J]. RSC Advances, 2017, 7(80): 50449-50458. DOI:10.1039/C7RA06231A |
| [31] |
Yang W B, Lu Y P, Zheng F F, et al. Adsorption behavior and mechanisms of norfloxacin onto porous resins and carbon nanotube[J]. Chemical Engineering Journal, 2012, 179: 112-118. DOI:10.1016/j.cej.2011.10.068 |
| [32] |
Gao J, Pedersen J A. Adsorption of sulfonamide antimicrobial agents to clay minerals[J]. Environmental Science & Technology, 2005, 39(24): 9509-9516. |
| [33] |
王栋纬, 宋燕西, 冶晓凡, 等. 氧化石墨烯对磺胺甲恶唑和磺胺甲基嘧啶的吸附性能研究[J]. 分析化学, 2018, 46(2): 211-216. WANG Dong-wei, SONG Yan-xi, YE Xiao-fan, et al. Adsorption properties of graphene oxide on sulfamethoxazole and sulfamethoxazole[J]. Analytical Chemistry, 2018, 46(2): 211-216. |
 2020, Vol. 37
2020, Vol. 37






