2. 养分资源高效开发与综合利用国家重点实验室, 金正大生态工程集团股份有限公司, 山东 临沭 276700;
3. 山东蓬勃生物科技有限公司, 山东 泰安 271018
2. State Key Laboratory of Nutrition Resources Integrated Utilization, Kingenta Ecological Engineering Group Co., Linshu 276700, China;
3. Pengbo Biology Technology Ltd. Co., Tai'an 271018, China
水稻是我国最主要的粮食作物,超过60%的人口以大米为主食[1],水稻的高产稳产对于维护国家粮食安全具有重要作用[2]。水稻对盐中毒敏感[3],盐渍会延缓水稻的发育,影响器官的生长,抑制组织的分化[4],最终降低水稻产量,是造成水稻减产的主要非生物胁迫因子之一[5]。据统计,我国耕地中盐渍化的面积已达9.209 × 106 hm2,占全国耕地总面积的6.62%[6]。盐渍土集中分布于滨海地区、西北内陆、黄淮海平原、松嫩平原以及内蒙古、甘肃、宁夏等省份,其中相当一部分区域是我国重要的粮食生产基地,解决土壤盐渍化问题须受到高度重视[7]。但常规土壤盐渍改良方法仍有许多不足:泡田、客土等物理手段成本高、工程量大、作用时间短、常受水源限制[8-9];施用改良剂或矿质化肥等化学手段易造成二次污染,且施用后仍需大量的水冲洗,成本昂贵,不能完全解决盐渍化问题[10-11]。因此,提高水稻自身耐盐性是保障盐渍区水稻稳产、减轻盐渍危害的新思路。
生物刺激素能够增强作物对养分的吸收和利用,提高植物对非生物/生物胁迫的耐受性[12],是可持续农业中缓解盐渍毒害的重要手段[13]。生物刺激素来源广泛,海藻提取物、甲壳素和腐殖质都属于这类物质[14-16]。2013—2018年,全球生物刺激素市场以每年12.5%的速度快速增长[17]。随着生物刺激素在农业中应用的日益增多,发展新型高效的生物刺激素已成为提高作物抗逆能力、实现农业可持续发展的重要举措。沙棘具有耐盐、耐旱、抗风沙的特性,不仅根系发达,抗逆性强,还能通过渗透调节抵御盐胁迫[18],被广泛用于荒漠治理和水土保持[19]。因此推测其内生菌提取物施用后也具有较好的抗逆效果,继而开展了本试验。供试生物刺激素来源于野生沙棘根系内生菌宛氏拟青霉的发酵物,通过液培试验研究生物刺激素及其纯化物对盐胁迫下水稻生长指标、光合参数、保护酶活性及离子交换作用的影响,以期为该生物刺激素应用于农业生产及盐渍改良提供参考依据。
1 材料与方法 1.1 试验材料试验于2018年7月在山东省泰安市山东农业大学土肥资源高效利用国家工程实验室进行。
供试生物刺激素及其纯化物的制备方法[20]:将消毒洗净后的野生沙棘根切割成0.5 cm长的小段,接种于孟加拉红平板培养基,28 ℃下培养5 d后根系边缘长出菌丝,经反复分离纯化后的菌丝即为宛氏拟青霉菌株(Paecilomyces variotii)。
将宛氏拟青霉菌株(保藏号CGMCC NO.10114)接种到平板PDA培养基上,25 ℃下培养6 d,随后转接于装有50 mL种子培养液的250 mL三角烧瓶内,于28 ℃、120 r·min-1的全自动摇床上培养3 d。培养结束以10%量接种至装有150 mL发酵培养基的500 mL三角瓶中,继续在同条件下培养5 d后终止发酵,放置于4 ℃冰箱中保存。将培养得到的菌丝体洗涤后在60 ℃下烘干称质量,粉碎后同体积乙醇浸提3次,每次24 h,磁力搅拌器混匀后超声波振荡1 h,真空抽滤所得滤液即为宛氏拟青霉菌株的提取物PVE。PVE为淡黄色澄清液体,pH为6.14。PVE的主要成分为分子量181~10 000之间的小分子低聚糖、氨基酸、嘧啶核苷、糖蛋白和多肽等物质。经液相分子排阻法对PVE中的活性物质进行富集后的产物即为PVE纯化物。
供试水培装置由硬质PVC管组装而成,底部完全封闭,高12.5 cm,直径9.5 cm,顶部为直径10.5 cm的圆形盖子,盖子上钻出4个直径1.5 cm的圆孔。水稻幼苗经海绵缠绕后固定于圆孔中。
供试水稻品种为“圣稻13”,生育期为156 d,属于中晚熟常规粳稻。
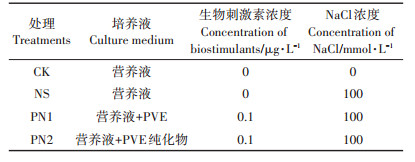
1.2 试验设计与方法试验采用营养液培养的方式,通过预试验确定了PVE及其纯化物的最适用量为0.1 μg·L-1,试验共设4个处理(表 1),重复3次。选取大小均匀、生命力强的水稻种子,5%的NaClO溶液消毒10 min,随后无菌水清洗5遍,吸干水分,均匀撒播于装有细沙的长方形塑料盒中,每日定时补充水分。待水稻生长至两叶一心期时,转移至装有1/20国际水稻标准营养液的装置中,在25 ℃的恒温培养箱中继续培养3 d使幼苗适应水生环境。随后CK处理继续培养于无盐营养液中,NS、PN1和PN2处理培养于含100 mmol·L-1 NaCl(约为0.6%含盐量土壤)营养液中,并分别根据试验设计加入PVE和PVE纯化物。营养液每两日更换一次,并随着水稻幼苗的生长逐步提高营养液浓度,直至样品采集。
|
|
表 1 试验设计 Table 1 Experimental design |
盐胁迫处理后,水稻叶片在第10 d出现了明显缺水失绿现象,此时对水稻样品进行采集。各处理随机选取3株水稻(每个培养装置取1株,下同),进行叶长和根长的测量,随后擦干表面水分称量叶片与根系的鲜质量。再将叶片和根系置于105 ℃烘箱中杀青30 min,75 ℃烘干至恒质量并计算含水量,之后磨碎过2 mm筛用于测定各元素含量。各处理另随机取3株水稻,分别取0.5 g水稻叶片和根系于研钵中,加入液氮磨碎,提取后用于抗氧化酶活性的测定。再随机选择3株水稻将根和叶分离,叶片用于叶绿素含量的测定。
根系形态:用万深LA-S植物根系分析仪测定根系总长度、投影面积、面积、表面积、根体积和根平均直径;叶片光合速率(Pn):收获当日的上午9:00—11:00使用LI-6400XT便携式光合仪测定;叶绿素含量:95%乙醇浸提,紫外分光光度计测定665、649 nm和470 nm处的光吸收值[21];微量元素含量:微波消解-原子吸收法测定[22];超氧化物歧化酶(SOD)活性:氮蓝四唑法测定[23];过氧化物酶(POD)活性:愈创木酚法测定[23];过氧化氢酶(CAT)活性:紫外吸收法测定[23];丙二醛(MDA)含量:硫代巴比妥酸法测定[24]。Na+、K+含量:火焰光度计测定。
1.4 数据分析采用万深LA-S根系分析系统和Excel 2016、SAS 8.0软件进行数据处理分析,使用Duncan多重检验法(Duncan′ s multiple range test)分析各处理α=0.05水平的差异显著性。
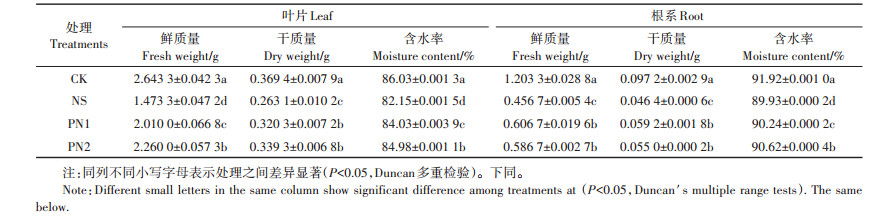
2 结果与分析 2.1 不同处理水稻幼苗叶片和根系质量及含水率由表 2可知,盐胁迫抑制了水稻叶片和根系的生长,NS处理叶片及根系质量均显著低于CK处理。与NS处理相比,PN1、PN2处理叶片干质量显著增加了21.74%和28.96%,根系干质量显著增加了27.59%和18.53%;PN2叶片鲜质量还较PN1显著提高了12.44%,但二者叶片干质量、根系鲜质量和根系干质量均无显著差异。水稻遭遇盐胁迫时细胞内外渗透压差会导致植物失水,含水率是反映作物遭受盐害程度的重要指标。PN1叶片和根系含水率较NS处理分别显著提高了2.29%和0.34%。PN2处理较PN1处理进一步降低了盐胁迫下的水分损失,叶片和根系含水率较PN1处理分别显著提高了1.13%和0.42%。总体来说,施用PVE和PVE纯化物都能够有效地促进幼苗生长,减少组织失水。
|
|
表 2 不同处理水稻叶片和根系质量及含水率 Table 2 The biomass and water content of rice leaves and roots under different treatments |
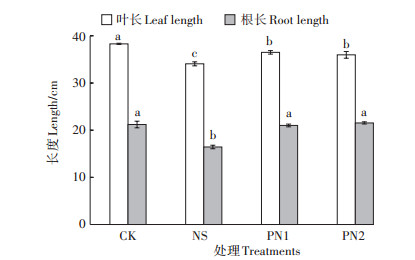
由图 1可知,盐胁迫下,NS处理的叶长和根长较CK处理显著降低了11.04%和22.5%。施用生物刺激素后,PN1、PN2处理的水稻叶长较NS处理分别显著提高了7.14%和5.58%,根长显著增加了27.79%和31.03%,均缓解了NaCl对水稻幼苗的胁迫。虽然PN1、PN2处理水稻叶长仍显著低于CK处理,但PN1、PN2处理根长相较于CK处理却无显著差异,因此,PVE及其纯化物对盐胁迫下水稻根系生长具有一定促进作用。
|
不同小写字母表示处理间差异显著(P < 0.05) The different lowercase letters indicate significant differences among treatments (P < 0.05) 图 1 不同处理水稻叶片和根系长度 Figure 1 Leaf and root length of rice under different treatments |
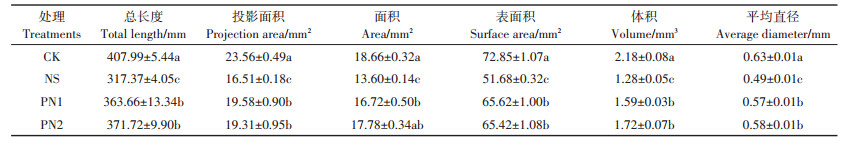
根系扫描结果(表 3)表明施用生物刺激素能够显著缓解盐胁迫对水稻根系生长的抑制。PN1处理根系总长度、根投影面积、面积、根表面积、根体积和根系平均直径较NS处理分别显著提高了14.59%、18.59%、22.94%、26.97%、24.22%和16.33%;PN2处理根系各项指标较NS处理分别显著提高了17.13%、16.96%、30.74%、26.58%、34.38%和18.37%。综合来看,与NS处理相比,水稻根系在施用生物刺激素后更为发达,从而能够更好地进行水分及养分的吸收。但PN1处理与PN2处理的根系形态并没有显著差异。
|
|
表 3 不同处理水稻根系扫描特征 Table 3 Root scanning characteristics of rice under different treatments |
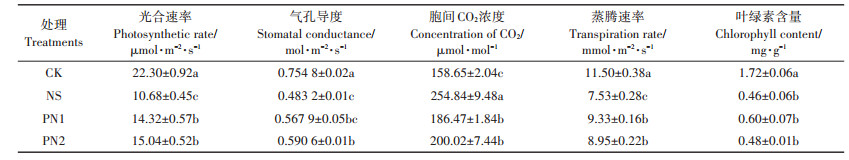
叶片是植物进行光合作用的主要场所,光合作用是水稻进行产量累积的基础,盐胁迫严重抑制了水稻叶片的光合进程(表 4)。NS处理较CK处理气孔导度降低了35.98%,胞间CO2浓度升高了60.63%,蒸腾速率降低了34.52%,光合速率也降低了52.11%,证明盐胁迫会导致气孔关闭,从而引起净光合速率下降。施用生物刺激素能够提高光合速率,PN1、PN2处理光合速率分别较NS处理显著提高了34.08%和40.82%,且PN2处理与NS处理相比,水稻叶片气孔导度增加了22.22%,促进了叶片的气体交换。蒸腾作用是水稻水分吸收和运输的主要动力,PN1、PN2处理叶片蒸腾速率分别较NS处理显著提高了23.90%和18.86%。胞间CO2浓度随着光合效率的增加而降低,PN1和PN2处理叶片胞间CO2浓度分别较NS处理显著降低了26.83%和21.51%。叶绿素是植物进行光合作用的主要色素,在光合作用的光吸收过程中具有核心作用,NS处理较CK处理叶绿素含量降低了近四分之三,证明盐胁迫严重抑制了叶绿素合成,但NS与PN1、PN2处理的叶绿素含量没有显著差异。
|
|
表 4 不同处理水稻叶片的光合参数和叶绿素含量 Table 4 Photosynthetic parameter and chlorophyll content of rice leaves under different treatments |
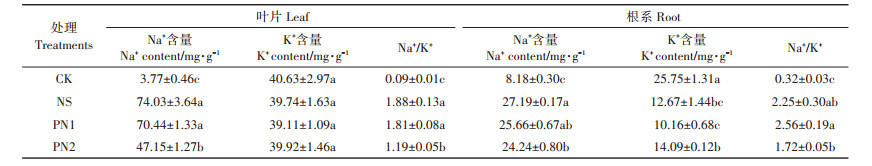
水稻在NaCl胁迫条件下,不仅会因营养液中的Na+、Cl-浓度升高导致水分吸收困难而出现渗透胁迫,还会因Na+的流入和K+的流出使细胞原生质中的Na+、Cl-过量累积而产生离子毒害。因此Na+/K+越低,植物在NaCl胁迫下的生长状况越好。通过测定水稻叶片及根系中Na+和K+的含量(表 5),发现在NaCl胁迫条件下,植株体内的Na+含量急剧增加,尤其集中在叶片位置,NS处理叶片中的Na+含量较CK处理提高了18.64倍,根系的Na+含量较CK处理提高了2.32倍。所有处理叶片中的K+含量均无显著差异,K+的流出主要集中在与营养液直接接触的根系部位,NS处理根系K+含量较CK处理显著降低了50.80%。与NS处理相比,PN1处理对水稻体内钠钾离子的运移无显著影响,但PN2处理显著降低了叶片中近1/3 Na+的流入,从而降低了Na+/K+,最终缓解了盐胁迫造成的离子毒害与渗透胁迫。
|
|
表 5 不同处理水稻叶片和根系Na+、K+含量及钠钾比 Table 5 Na+、K+ contents and Na+/K+ ratio in leaves and roots of rice under different treatments |
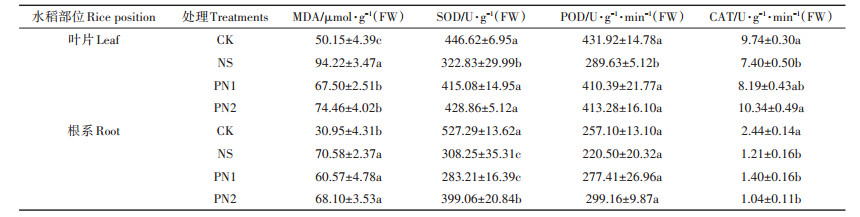
超氧化物歧化酶(SOD)和过氧化氢酶(CAT)是植物体内清除活性氧的关键酶,二者与过氧化物酶(POD)协调作用,可清除植物体内的超氧阴离子和自由基,使植物细胞免受氧化损伤。而丙二醛(MDA)含量能够反映膜脂过氧化和膜系统受损伤程度。盐胁迫对水稻抗逆酶活性的影响主要集中在叶片部位(表 6),NS处理叶片SOD、POD、CAT活性分别较CK处理显著降低了27.72%、32.94%和24.02%,MDA含量显著增加了87.88%,叶片细胞遭受到不同程度的氧化损伤。与NS处理相比,PN1和PN2处理叶片中SOD活性分别显著提高了28.58%和32.84%,POD活性分别显著提高41.69%和42.69%,MDA含量显著降低了28.36%和20.97%,从而减少了细胞的氧化损伤,提高了水稻的耐盐能力。但PN1处理和PN2处理相比,三种抗氧化酶活性和MDA含量没有显著差异。
|
|
表 6 不同处理水稻叶片和根系抗氧化酶活性 Table 6 Activities of stress resistance enzymes in leaves and roots of rice under different treatments |
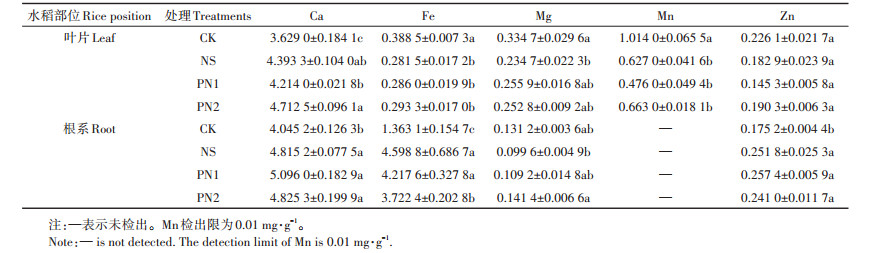
Ca是影响植物逆境感应、信息传递及相关基因表达的重要元素;Fe是合成叶绿素必需的物质,与光合作用密切相关。同样,Mg、Mn、Zn也都是植物体内多项生命反应的重要参与者。为探寻PVE及其纯化物对水稻体内微量元素含量的影响,对水稻叶片和根系Ca、Fe、Mg、Mn、Zn 5种元素进行了测定(表 7)。CK处理叶片和根系的Ca含量均低于其他处理。CK处理叶片中的Fe含量显著高于其他处理32.46%~ 38.01%,证明盐胁迫降低了叶片中的Fe含量,抑制了叶绿素的合成,从而降低了水稻的光合作用。PN2处理根系的Fe含量显著低于NS处理,Mg含量显著高于NS处理,但PN1处理水稻体内微量元素含量与NS处理无显著差异。
|
|
表 7 不同处理水稻叶片和根系微量元素含量(mg·g-1) Table 7 Contents of trace elements in leaves and roots of rice under different treatments(mg·g-1) |
生物刺激素经常因其中的多种生物活性成分共同作用而难以阐明作用机理[25],但植物对不同生物刺激素存在如增强养分吸收、提高胁迫耐受性等共性的响应。特别是根系生长方面,经生物刺激素处理的植物中经常观察到根毛长度和密度显著增加,这表明生物刺激素诱导根系发生“养分获取反应”,通过增加吸收表面积,促进植物的养分吸收[26]。本试验施用PVE后也发现了类似结论:水稻根系总长度、面积和根系平均直径分别较NS处理显著提高了14.59%、22.94%和16.33%,水稻根系更为发达,从而提高了根系对水分和养分吸收的能力和面积。同时研究者还发现生物刺激素可以调控植物中激素和/或生长调节剂的产生,以及初级和次级代谢中功能酶的基因表达与活性[27]。施用PVE和PVE纯化物后叶片中SOD、POD活性均明显提升,MDA含量显著下降,证明PVE添加影响了水稻体内抗氧化酶的活性,并可能通过影响内源激素水平的形式达到稳定蛋白质并保护膜系统的作用。除此之外,生物刺激素还被发现能够通过独立于脱落酸的信号转导机制,调控叶片中的碳代谢关键酶活性和影响二磷酸核酮糖羧化酶(Rubisco)含量等途径影响了植物的光合作用进程以及组织中营养物质含量[28]。施用PVE后,叶片中光合速率和蒸腾速率均有明显提升,从而增加了幼苗对养分吸收的动力,使水稻的生物量累积均显著高于NS处理。
试验所用NaCl为100 mmol·L-1,Na+和Cl-是营养液中最主要的盐分离子,换算后约为0.6%的土壤含盐量,属于重度盐化土。苗期是水稻对盐分高度敏感的时期,盐胁迫下水稻会自叶尖渐向叶片底部、由下方叶片渐向叶心,先发生卷叶,然后渐渐枯黄,细胞质膜透性增大,脯氨酸大量积累,水稻根系逐渐发育不良,根尖变为黑褐色,最终秧苗全株枯焦[29]。供试PVE及其纯化物在0.1 μg·L-1极低的施用量下能够使水稻幼苗产生较好的耐盐效果。而腐植酸、海藻酸、壳寡糖等常见生物刺激素虽然来源和组分不同,但施用范围大致在50~1000 mg·L-1之间。本试验中,PVE用量仅为常规生物刺激素的1/500 000,甚至更低,因此能够认为PVE是一种高效且具有高活性的生物刺激素。
生物刺激素能够提高作物的抗逆性,降低成本,减少水土流失及二次污染的风险,为解决盐碱地粮食种植提供了有效途径。但以PVE为例,生物刺激素在推广应用过程中也存在一定的局限性。首先,生物刺激素促进作物耐盐的效果存在阈值,在超重度盐碱地甚至光板地上单独施用生物刺激素,作物可能仍然无法生长,还需配合物理化学方法进行综合治理。其次,尽管生物刺激素在农业中的使用日益增多,但目前生物刺激素最大的市场仍在欧洲和北美[17],我国对于生物刺激素的研究起步较晚,且缺乏科学的同行评议,导致市场上的商品良莠不齐。此外,不同类型的生物刺激素或浸种处理,或叶面喷施,或随肥料/灌溉水一同施入,即最佳施用方式不同。生物刺激素施用量过大还往往伴随着巨大的抑制作用[30],PVE因其较高的生理活性和极低的施用量,更易出现施用不均、施用量过大等问题。因此针对不同作物,PVE的用量、施用方式和作用机理仍需进一步探讨。
4 结论(1) 沙棘内生菌宛氏拟青霉的提取物PVE及PVE纯化物作为生物刺激素,在施用量仅为常规生物刺激素1/500 000甚至更低的浓度下显著降低了盐害对水稻幼苗的胁迫,表现出较高的生理活性。
(2) 营养液中添加PVE或PVE纯化物,促进了根系的生长发育,提高了叶片的光合特性,增强了抗氧化酶活性,并通过提高水分和养分的吸收面积和动力、降低细胞氧化损伤、维持细胞内部环境稳定等途径缓解了盐胁迫对水稻幼苗的胁迫。
(3) PVE和PVE纯化物用于提高水稻耐盐性是生物刺激素低成本、高效化缓解盐胁迫的成功应用案例,为生物刺激素在农业生产中的推广提供了参考和借鉴。
| [1] |
徐正进, 陈温福, 马殿荣, 等. 辽宁水稻食味值及其与品质性状的关系[J]. 作物学报, 2005, 31(8): 1092-1094. XU Zheng-jin, CHEN Wen-fu, MA Dian-rong, et al. Relationship between eating quality and other characters of rice in Liaoning[J]. Acta Agronomica Sinica, 2005, 31(8): 1092-1094. DOI:10.3321/j.issn:0496-3490.2005.08.022 |
| [2] |
李诗豪, 刘天奇, 马玉华, 等. 耕作方式与氮肥类型对稻田氨挥发、氮肥利用率与水稻产量的影响研究[J]. 农业资源与环境学报, 2018, 35(5): 447-454. LI Shi-hao, LIU Tian-qi, MA Yu-hua, et al. Effects of tillage practices and nitrogen sources on NH3 volatilization, nitrogen use efficiency and yield in paddy fields in central China[J]. Journal of Agricultural Resources and Environment, 2018, 35(5): 447-454. |
| [3] |
鄂志国, 张丽靖. 水稻盐胁迫应答的分子机制[J]. 杂交水稻, 2010, 25(2): 1-5. E Zhi-guo, ZHANG Li-jing. Molecular mechanism of rice responses to salt stress[J]. Hybrid Rice, 2010, 25(2): 1-5. DOI:10.3969/j.issn.1005-3956.2010.02.001 |
| [4] |
田蕾, 陈亚萍, 刘俊, 等. 粳稻种质资源芽期耐盐性综合评价与筛选[J]. 中国水稻科学, 2017, 31(6): 631-642. TIAN Lei, CHEN Ya-ping, LIU Jun, et al. Comprehensive evaluation and selection of rice(Oryza sativa japonica)germplasm for saline tolerance at germination stage[J]. Chinese Journal of Rice Science, 2017, 31(6): 631-642. |
| [5] |
胡婷婷, 刘超, 王健康, 等. 水稻耐盐基因遗传及耐盐育种研究[J]. 分子植物育种, 2009, 7(1): 110-116. HU Ting-ting, LIU Chao, WANG Jian-kang, et al. Progress of genetic and breeding on salt tolerance in rice[J]. Molecular Plant Breeding, 2009, 7(1): 110-116. |
| [6] |
杨劲松. 中国盐渍土研究的发展历程与展望[J]. 土壤学报, 2008, 45(5): 837-845. YANG Jin-song. Development and prospect of the research on salt-affected soils in China[J]. Acta Pedologica Sinica, 2008, 45(5): 837-845. DOI:10.3321/j.issn:0564-3929.2008.05.010 |
| [7] |
张添佑, 王玲, 王辉, 等. 玛纳斯河流域盐渍化灌区生态环境遥感监测研究[J]. 生态学报, 2017, 37(9): 3009-3018. ZHANG Tian-you, WANG Ling, WANG Hui, et al. Assessment of soil salinization ecological environment change in the Manas River basin using remote sensing technology[J]. Acta Ecologica Sinica, 2017, 37(9): 3009-3018. |
| [8] |
张梅, 王宇, 赵兰坡, 等. 苏打盐碱土种稻改良的水资源高效利用田间试验研究[J]. 灌溉排水学报, 2014, 33(1): 132-134. ZHANG Mei, WANG Yu, ZHAO Lan-po, et al. Experiment research of water resources utilization on soda saline-alkali soil improvement by planting rice in the field[J]. Journa1 of Irrigation and Drainage, 2014, 33(1): 132-134. |
| [9] |
岳增璧, 张学培, 朱金兆, 等. 滨海盐碱地基盘法造林试验初报[J]. 水土保持研究, 2009, 16(4): 234-243. YUE Zeng-bi, ZHANG Xue-pei, ZHU Jin-zhao, et al. Approach of seed-base for afforesting in seashore saline land[J]. Research of Soil and Water Conservation, 2009, 16(4): 234-243. |
| [10] |
张凌云, 赵庚星, 徐嗣英, 等. 滨海盐渍土适宜土壤盐碱改良剂的筛选研究[J]. 水土保持学报, 2005, 19(3): 21-23. ZHANG Ling-yun, ZHAO Geng-xing, XU Si-ying, et al. Filtration of suitable saline-alkali soil amendments on coastal saline soil[J]. Journal of Soil and Water Conservation, 2005, 19(3): 21-23. DOI:10.3321/j.issn:1009-2242.2005.03.006 |
| [11] |
张密密, 陈诚, 刘广明, 等. 适宜肥料与改良剂改善盐碱土壤理化特性并提高作物产量[J]. 农业工程学报, 2014, 30(10): 91-98. ZHANG Mi-mi, CHEN Cheng, LIU Guang-ming, et al. Suitable utilization of fertilizer and soil modifier to ameliorate physicochemical characteristics of saline-alkali soil and increase crop yields[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(10): 91-98. DOI:10.3969/j.issn.1002-6819.2014.10.011 |
| [12] |
Vasconcelos A C F D, Zhang X Z, Ervin E H, et al. Enzymatic antioxidant responses to biostimulants in maize and soybean subjected to drought[J]. Scientia Agricola, 2009, 66(3): 395-402. DOI:10.1590/S0103-90162009000300015 |
| [13] |
张强, 常瑞雪, 胡兆平, 等. 生物刺激素及其在功能水溶性肥料中应用前景分析[J]. 农业资源与环境学报, 2018, 35(2): 111-118. ZHANG Qiang, CHANG Rui-xue, HU Zhao-ping, et al. Biostimulants and its potential utilization in functional water-soluble fertilizers[J]. Journal of Agricultural Resources and Environment, 2018, 35(2): 111-118. |
| [14] |
Khan W R U P, Subramanian S, Jithesh M N, et al. Seaweed extracts as biostimulantss of plant growth and development[J]. Journal of Plant Growth Regulation, 2009, 28(4): 386-399. DOI:10.1007/s00344-009-9103-x |
| [15] |
Pichyangkura R, Chadchawan S. Biostimulants activity of chitosan in horticulture[J]. Scientia Horticulturae, 2015, 196(1): 49-65. |
| [16] |
Canellas L P, Olivares F L, Aguiar N O, et al. Humic and fulvic acids as biostimulants in horticulture[J]. Scientia Horticulturae, 2015, 196(1): 15-27. |
| [17] |
Calvo P, Nelson L, Kloepper J W. Agricultural uses of plant biostimulants[J]. Plant and Soil, 2014, 383(1/2): 3-41. |
| [18] |
阮成江, 谢庆良. 盐胁迫下沙棘的渗透调节效应[J]. 植物资源与环境学报, 2022, 11(2): 45-47. RUAN Cheng-jiang, XIE Qing-liang. Osmotic adjustment effect of Hippophae rhamnoides L. under salt-stress[J]. Journal of Plant Resources and Environment, 2022, 11(2): 45-47. |
| [19] |
王浩, 杨方社, 李怀恩, 等. 沙棘柔性坝对砒砂岩沟道泥沙粒径分布及有机质影响[J]. 水土保持学报, 2017, 31(5): 158-163. WANG Hao, YANG Fang-she, LI Huai-en, et al. Effects of seabuckthorn flexible dam on sediment particle size distribution and organic matter in the soft sandstone gully[J]. Journal of Soil and Water Conservation, 2017, 31(5): 158-163. |
| [20] |
山东蓬勃生物科技有限公司.一种宛氏拟青霉菌株SJ1及其应用: 201510059660.1[P]. 2015-02-05. Shandong Pengbo Biology Technology Ltd. Co.. Application for Paecilomyces Variotii of SJ1: 201510059660.1[P]. 2015-02-05. |
| [21] |
武爱莲, 郭珺, 丁玉川, 等. Bacillus amyloliquefaciens Pb-4对穴盘育苗番茄生长及生理特性的影响[J]. 植物营养与肥料学报, 24(3): 841-848. WU Ai-lian, GUO Jun, DING Yu-chuan, et al. Effects of Bacillus amyloliquefaciens Pb-4 on growth and physiological characteristics of tomato under the condition of plug seeding[J]. Journal of Plant Nutrition and Fertilizer, 24(3): 841-848. |
| [22] |
Carrasco-Gil S, Rios J J, álvarez-Fernández A, et al. Effects of individual and combined metal foliar fertilisers on iron- and manganesedeficient Solanum lycopersicum plants[J]. Plant and Soil, 2016, 402(1/2): 27-45. |
| [23] |
张淑英, 褚贵新, 梁永超. 不同铵硝配比对低温胁迫棉花幼苗生长及抗氧化酶活性的影响[J]. 植物营养与肥料学报, 2017, 23(3): 721-729. ZHANG Shu-ying, CHU Gui-xin, LIANG Yong-chao. Impacts of different ammonium/nitrate ratios on the growth and antioxidant defense enzyme activities in cotton seedlings exposed to low-temperature stress[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(3): 721-729. |
| [24] |
周美利, 沈广爽, 赵瑞瑞, 等. 铅胁迫对紫穗槐光合作用及生理生化特征的影响[J]. 农业资源与环境学报, 2017, 34(3): 286-292. ZHOU Mei-li, SHEN Guang-shuang, ZHAO Rui-rui, et al. Effects of lead stress on photosynthesis and physiological and biochemical characteristics of Amorpha fruticosa[J]. Journal of Agricultural Resources and Environment, 2017, 34(3): 286-292. |
| [25] |
Ertani A, Francioso O, Tugnoli V, et al. Effect of commercial lignosulfonate-humate on Zea mays L. metabolism[J]. Journal of Agriculture and Food Chemistry, 2011, 59(22): 11940-11948. DOI:10.1021/jf202473e |
| [26] |
Nardi S, Pizzeghello D, Schiavon M, et al. Plant biostimulants:Physiological responses induced by protein hydrolyzed-based products and humic substances in plant metabolism[J]. Scientia Agricola, 2016, 73(1): 18-23. DOI:10.1590/0103-9016-2015-0006 |
| [27] |
Jardin P D. Plant biostimulant:Definition, concept, main categories and regulation[J]. Scientia Horticulturae, 2015, 196(6): 3-14. |
| [28] |
García A C, Santos L A, Izquierdo F G, et al. Vermicompost humic acids as an ecological pathway to protect rice plant against oxidative stress[J]. Ecological Engineering, 2012, 47(5): 203-208. |
| [29] |
潘兴, 王宇, 蒋滢, 等. 施加外源物质对盐胁迫下水稻生长发育的影响[J]. 生物技术通报, 2012(5): 15-19. PAN Xing, WANG Yu, JIANG Ying, et al. Effects of exogenous substances on rice growth and development under salt stress[J]. Biotechnology Bulletin, 2012(5): 15-19. |
| [30] |
Zhang Y L, Goritschnig S, Dong X N, et al. A gain-of-function mutation in a plant disease resistance gene leads to constitutive activation of downstream signal transduction pathways in suppressor of npr1-1, constitutive 1[J]. Plant Cell, 2003, 15(11): 2636-2646. DOI:10.1105/tpc.015842 |
 2020, Vol. 37
2020, Vol. 37