2. 云南省烟草公司玉溪市公司, 云南 玉溪 653100;
3. 烟草行业病虫害生物防治工程研究中心, 云南 玉溪 653100
2. Yuxi Company of Yunnan Provincial Tobacco Company, Yuxi 653100, China;
3. Application Technology of Biological Control for Tobacco Diseases and Insect Pests Engineering Research Center of China Tobacco, Yuxi 653100, China
植物寄生线虫造成全球经济损失年均可达1600亿元[1]。其中根结线虫(Meloidogyne spp.)为最主要植物病原线虫,其寄主广泛,常见寄主多达2000余种[2],危害植物生长。根结线虫病是世界性的烟草主要病害[3],更是限制我国烟草生产的主要因素之一,仅云南省每年发病面积就超2万hm2,致使烟叶减产,造成重大经济损失[4]。烟草根结线虫病不仅直接危害烤烟的产量与质量[5],而且还会使烤烟的抗性降低,导致烟草黑胫病、根黑腐病等一系列病害的发生[6]。长期以来,对该病的防治主要以化学药剂为主,但由于其抗药性、环境污染及农药残留等问题而使大量的农药被禁用。通常情况下,烟农一般采用烟草和其他作物轮作进行种植。根结线虫不仅对烟草造成损失,也会对下茬作物造成危害。不同种类的根结线虫对作物的危害不同,因此对根结线虫种类的鉴定、分布研究对推动相应地区的农业持续发展具有重要意义。SCAR(Sequence characterized amplified region)- PCR是一种可靠的鉴定根结线虫的方法[7-8],本研究采用该方法对云南玉溪地区根结线虫种类进行鉴定。
生物防治具有可持续治理及保护生物多样性的优势,是近年来发展速度较快的防治方法,是国内外研究和应用的热点,取得了多方面的研究进展。其中,昆虫病原线虫(Entomopathogenic nematode,EPN)是一类具有巨大潜力的生物防治因子。昆虫病原线虫作为一种理想的生物杀虫剂,具有以下优点:寄主范围广[9];对寄主昆虫具有主动搜寻能力;自我增殖快、易于遗传改良;能够以人工培养基低成本大量培养;对人畜无害,在欧美一些国家可以豁免注册生产和释放;田间施用时可与多种化学农药混合使用,并能以传统喷药设备施用。
近年来,许多国内外研究学者已经发现了昆虫病原线虫具有抑制植物线虫的作用,特别是利用昆虫病原线虫防治根结线虫的研究逐渐展开。宋洁等[10]研究发现,昆虫病原线虫体内携带的共生细菌对大豆胞囊线虫和根结线虫的卵孵化均表现出明显的抑制作用。Molina等[11]的研究表明,活的或死的夜蛾斯氏线虫(Steinernema feltiae)和异小杆线虫(Heterorhabditis baujardi)均能够显著抑制番茄上M. mayaguensis的卵孵化和二龄幼虫的侵染。Valle等[12-13]利用感染了EPN的大蜡螟(Galleria mellonella)虫尸研究其对胡椒和西葫芦南方根结线虫病的抑制作用,结果显示,虫尸能减少植株根上根结数和卵囊中的卵块数。王宇坤等[14]也发现EPN能够显著降低经济作物烟草根结线虫的卵粒数。但这些研究基本是室内试验,而相关的田间应用试验鲜有报道[15]。本研究首先对云南省玉溪市根结线虫进行鉴定与分布调查,然后在澄江县和易门县布置田间试验,探究昆虫病原线虫对根结线虫的防治效应,旨在为绿色防控该地区的根结线虫危害提供相应的理论依据。
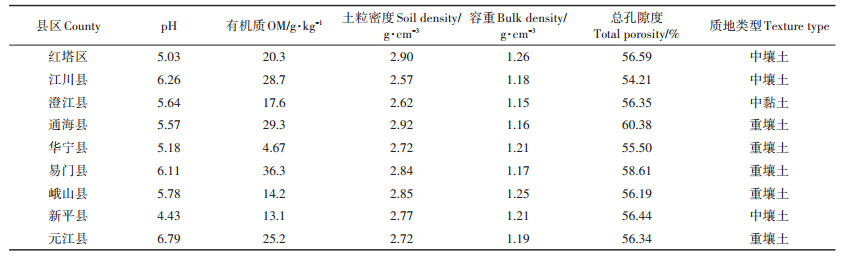
1 材料与方法 1.1 样品采集对云南省玉溪市八县一区的试验样地土壤进行理化性质分析,包括pH值、有机质含量、土粒密度、容重、总孔隙度、质地类型等,由云南同川农业分析测试技术有限公司检测。
根据往年发病情况,结合各县区当年烤烟种植区域、品种,对烤烟根结线虫发生危害情况进行调查,得出各县区烤烟根结线虫发生区域、面积等。
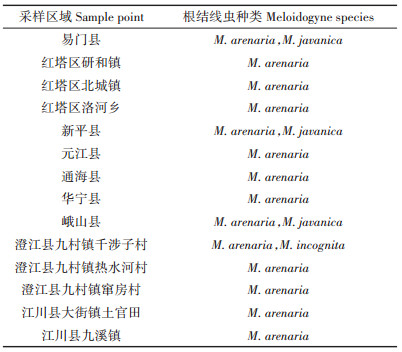
在调查的基础上,在每个县区选择2个根结线虫发病严重的地块,每个地块选择1株发病最严重的烟株,连根带土挖起,去掉茎叶。保留根结密集部位约500 g左右的根结样品,放入采样袋中,并尽快运回实验室进行根结线虫的种类鉴定。采样时记录GPS信息。
1.2 SCAR-PCR法根结线虫种类鉴定参考文献[8]中SCAR-PCR方法对根结线虫进行分子鉴定。
DNA提取:根系可直接用来挑取线虫,在根结明显部位挑取雌虫,用非常细的毛笔或解剖针挑取至少5条线虫至含提取液(8 μL ddH2O和1 μL 10×Ex Taq缓冲液,不含Mg2+)的200 μL PCR管中,液氮冷冻1 min后,置于65~95 ℃水浴或PCR仪中2 min,重复4次;然后向PCR管中加入1 μL 1 mg·mL-1蛋白酶K,65 ℃温1 h后,置于95 ℃下10 min。
PCR引物:采用的SCAR标记引物见表 1。对四种主要根结线虫进行种类鉴定:南方根结线虫(Meloidogyne incognita),花生根结线虫(M. arenaria),爪哇根结线虫(M. javanica)和北方根结线虫(M. hapla)。
|
|
表 1 根结线虫特异性PCR引物 Table 1 Specific primers of Meloidogyne species |
PCR扩增:PCR反应体系(25 μL)为DNA模板2 μL,上、下游引物(2.5 μmol·L-1)分别为2 μL(共4 μL),dNTPs(2.5 mmol·L-1)2.5 μL,MgCl2(2.5 mmol·L-1)2 μL,10×Ex taq缓冲液(不含Mg2+)2.5 μL,Ex taq DNA聚合酶0.5 μL,加ddH2O至25 μL。覆盖一层矿物油。扩增条件为94 ℃预变性30 s,60~62 ℃退火30 s,72 ℃延伸1 min,40个循环;72 ℃延伸10 min。
电泳:PCR扩增产物使用1.5%琼脂糖凝胶电泳分离,用DL2000 DNA Marker作为对照,经溴化乙锭染色后,在凝胶成像仪上进行观察和拍照记录。
1.3 昆虫病原线虫田间防治试验 1.3.1 试验设计试验于2015年5—9月在玉溪澄江县和易门县进行,分别选取往年根结线虫发生较重区域布置田间对比试验。供试材料为经根结线虫侵染的烤烟;供试昆虫病原线虫为异小杆科线虫(Heterorhabditis bacteriophora),由南开大学提供。试验共设置3个处理,分别为昆虫病原线虫、化学农药(25%阿维·丁硫水乳剂,北京市东旺农药厂生产)、空白对照,每个处理3次重复,共9个小区,每个小区不少于100株烟,总面积约400 m2。
昆虫病原线虫处理:在烤烟移栽时放一条昆虫病原线虫虫尸于烤烟根部,不使用任何其他杀线虫的药剂,后期按照烟膜下小苗移栽技术要求进行管理。
虫尸剂(感染线虫的昆虫尸体)制作:在24孔板的每孔放入与孔径直径接近的滤纸圆片,再放置一头体重相近(约0.35 g)的大蜡螟,用H. bacteriophora的侵染期线虫感染大蜡螟,线虫的浓度约为每头大蜡螟60条线虫,于室温(21~25 ℃)下培养一周后即可使用。
化学农药处理:参照使用说明,在烤烟移栽时,将25%阿维·丁硫水乳剂稀释1000倍,每小区浇施80 g稀释液。
空白对照处理:不使用昆虫病原线虫及任何防治根结线虫的药剂。
1.3.2 调查项目从移栽后20 d开始调查,之后每隔15 d调查一次,直至烤烟采收结束。采用五点取样法,每点选5株烟,拔根(挖根)调查记录根结线虫发病级数,计算病情指数。
根结线虫病拔根检查分级标准如下,0级:根部正常,无可见根结;1级:1/4以下根上有少量根结;3级:1/4~1/3根上有少量根结;5级:1/3~1/2根上有根结;7级:1/2以上根上有根结,少量次生根上产生根结;9级:所有根上(包括次生根)长满根结。

|
采用SPSS 19.0和Excel软件进行统计,Duncan新复极差法进行多重比较。
2 结果与分析 2.1 土壤理化性状分析云南省玉溪地区各县区土壤理化性状如表 2所示,烟田土壤皆偏弱酸性,pH值在4.43~6.79之间。土壤有机质含量差异较大,在华宁县仅为4.67 g·kg-1,而在易门县达到36.3 g·kg-1。各县区土壤土粒密度、容重和总孔隙度差异较小,分别为2.62~2.92、1.15~1.26 g·cm-3和54.21%~60.38%。各县区土壤质地类型主要为壤土,其中红塔区、江川区和新平县为中壤土,通海县、华宁县、易门县、峨山县和元江县为重壤土,仅澄江县土壤为中黏土。
|
|
表 2 云南省玉溪市各县区土壤理化性状 Table 2 Physio-chemical properties of soil samples in Yuxi, Yunnan Province |
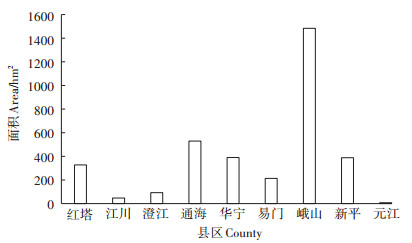
玉溪市2014年根结线虫病发生情况如图 1所示。除元江外,其余各县区均有大面积不同程度的根结线虫病发生,其中以峨山县的根结线虫病危害最为严重,发生面积达到了1483 hm2。
|
图 1 云南省玉溪烟田根结线虫病发生面积 Figure 1 The area of root knot nematode occurrence in tobacco field of Yuxi, Yunnan Province |
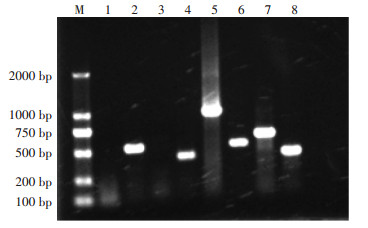
通过对分离的根结线虫进行PCR扩增及电泳观察(图 2),确定了根结线虫的种类。玉溪地区根结线虫的鉴定结果及分布如表 3所示。花生根结线虫(M. arenaria)在所有区县都被检出,因此玉溪地区主要的优势种群为花生根结线虫;同时在三个区县发现爪哇根结线虫(M. javanica),该种为次要种群;在一个地方发现南方根结线虫(M. incognita),该种群属于零星分布;未检出北方根结线虫。另外通过观察发现,爪哇根结线虫和南方根结线虫均与花生根结线虫并存,属于复合种群。
|
M为DNA Marker DL 2000;泳道1~4为测试样品;泳道5~8分别为南方根结线虫、爪哇根结线虫、北方根结线虫、花生根结线虫的阳性对照 M: DNA Marker DL 2000; Lanes1~4: samples; Lanes 5~8: positive control of Meloidogyne incognita, M. javanica, M.hapla, and M.arenaria 图 2 云南省玉溪根结线虫代表性样本的PCR扩增产物 Figure 2 Amplification products of Meloidogyne spp. isolates collected from Yuxi, Yunnan Province using species-specific SCAR primers |
|
|
表 3 云南省玉溪地区根结线虫鉴定与分布 Table 3 Identification and distribution of root-knot nematodes in Yuxi, Yunnan Province |
施加昆虫病原线虫和化学药剂对云南省玉溪市澄江和易门两县烟草根结线虫病的田间试验结果如图 3所示。易门田间小区试验中,移栽35、65、95 d后,各植株病情指数不存在显著差异,移栽125 d后开始出现显著差异,表明虫尸剂及化学药剂均对根结线虫具有抑制作用,且虫尸剂效果更佳。澄江田间小区试验中,移栽35、65、95 d后,各植株病情指数不存在显著差异,移栽110 d后开始出现差异,表明虫尸剂及化学药剂均对根结线虫具有抑制作用。
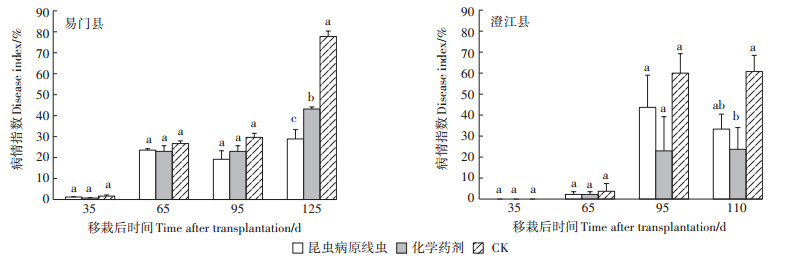
|
相同时间下不同字母表示处理间差异显著(P<0.05) The different lowercase letters at the same time indicate significant differences among treatments(P<0.05) 图 3 昆虫病原线虫处理对根结线虫病情指数的影响 Figure 3 The disease index of root knot nematode under entomopathogenic nematode treatment |
随着根结线虫鉴定方法的不断改进,分子鉴定也逐渐成熟,它能够快速、精确地鉴定出依据形态特征难以区分的线虫种类。因此,可直接利用分子生物学方法进行根结线虫的种类鉴定[18-20]。本研究则通过SCAR-PCR的方法,从分子水平对云南玉溪地区根结线虫的种类进行了准确的检测和鉴定。
研究表明,1990—1996年,花生根结线虫在云南地区呈持续增加的趋势,1990年检出率为14.29%,而1996年的检出率已达91.58%;相反,南方根结线虫检出率逐渐下降,从1990年的检出率57.14%下降到1996年的0。调查显示爪哇根结线虫种群有变动但没有明显的趋势[21]。本研究与上述研究结果相符,说明花生根结线虫更适合在云南烟草种植区生长。张喆[22]在玉溪地区采集的10个根结线虫种群中,检测出5个花生根结线虫种群和1个爪哇根结线虫种群,但没有检测到南方根结线虫。杨艳梅等[19]也对玉溪部分地区(四县一区)的20份根结线虫样本进行了分子鉴定,在5个区域都发现有花生根结线虫分布。在本研究中,对玉溪市全地区(八县一区)的样品鉴定结果表明,每个行政区域都有花生根结线虫分布,其中还发现了花生根结线虫与南方根结线虫混合侵染种群。这表明花生根结线虫为玉溪地区主要的优势种群,其次为爪哇根结线虫,南方根结线虫有零星分布。因此,在该地区进行抗病品种选育时,要以花生根结线虫为主要病原生物开展有针对性的抗性评价。同时,其他防治措施的室内评价也需要以花生根结线虫为主要研究对象来展开。
田间研究发现,施用昆虫病原线虫后,易门和澄江烟苗根结线虫的病情指数下降了48.89和27.47个百分点,根结线虫的危害显著降低,防治效果与化学农药相当。Kepenekci等[23]的盆栽研究发现,Heterorhabditis bacteriophora的侵染期幼虫不仅能够抑制南方根结线虫的繁殖率,也可降低花生根结线虫的繁殖率。Sun等[24]研究也发现,加入H. bacteriophora后能够显著降低根结线虫的侵染率。这表明昆虫病原线虫H. bacteriophora能够有效控制根结线虫。值得一提的是,本研究是在大田布置昆虫病原线虫防治根结线虫实验,发现H. bacteriophora能够有效防治农业病原生物根结线虫的危害。
昆虫病原线虫可能通过以下几种途径有效控制根结线虫。第一,昆虫病原线虫共生细菌的代谢产物能够直接抑制根结线虫的发育。Bi等[25]从Steinernema bicornutum分离到共生细菌Xenorhabdus budapestensis,并发现这种共生细菌产生的多肽能够有效杀死根结线虫的二龄幼虫。第二,昆虫病原线虫及共生细菌诱导植物产生抗性,从而抵御根结线虫的侵染。有研究发现土壤中加入昆虫病原线虫Steinernema coupocapsae感染的虫尸剂,能够诱导植物的广谱系统性抗性[26]。第三,昆虫病原线虫移动可干扰根结线虫移动,从而降低根结线虫侵染植物根系的机会。研究发现,Ascarosides是一种信号物质,能够影响线虫的交配、聚集和趋避等行为[27-28]。该物质可引起昆虫病原线虫的扩散,而且昆虫病原线虫感染的昆虫尸体已经发现有信号物质Ascarosides[29]。
昆虫病原线虫田间应用的关键是增加防效且降低成本。昆虫病原线虫可以采用线虫悬液和虫尸剂两种施用方式。线虫悬液施用时采用增加秸秆覆盖[30]或土壤穴施后土壤覆盖[31]等措施能有效降低干旱和紫外线对昆虫病原线虫的致死效应[32],提高线虫存活率。施用虫尸剂具有线虫活力高、持续释放时间长等优点,但虫尸剂规模化生产方法、储藏运输和田间机械化应用等问题尚处于研究阶段,需要进一步开展技术攻关。另外,最新研究[33]表明,某些昆虫病原线虫的共生细菌菌液对根结线虫具有明显的防治效果,共生细菌作为微生物,其工厂化生产技术成熟,在大规模应用上将具有明显的优势。因此,如何筛选到高致病力的昆虫病原线虫并建立对根结线虫具有明显防治效果的共生细菌资源库,对根结线虫这一重要农业病害的高效率低成本防治具有非常重要的现实意义。
4 结论(1)我国云南省玉溪地区根结线虫病危害十分严重,经鉴定,该区域的优势种为花生根结线虫Meloidogyne arenaria。
(2)施加昆虫病原线虫对烟草根结线虫病具有显著的抑制作用,昆虫病原线虫的防治效果与昆虫病原品系、施用量及田间施用技术都有一定的关系。
| [1] |
Abad P, Gouzy J, Aury J M, et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita[J]. Nature Biotechnology, 2008, 26(8): 909-915. DOI:10.1038/nbt.1482 |
| [2] |
Bleve-Zacheo T, Melillo M T, Castagnone-Sereno P. The contribution of biotechnology to root-knot nematode control in tomato plants[J]. Pest Technology, 2007, 1(1): 1-16. |
| [3] |
朱斌, 王军, 乔永信. 陕南烟草根结线虫病发病规律研究初报[J]. 陕西农业科学, 2005(1): 6-8. ZHU Bin, WANG Jun, QIAO Yong-xin. Preliminary report on the pathogenesis of tobacco root-knot nematode disease in southern Shaanxi[J]. Shaanxi Agricultural Science, 2005(1): 6-8. DOI:10.3969/j.issn.0488-5368.2005.01.003 |
| [4] |
杨铭, 秦西云, 段玉琪, 等. 云南烟草根结线虫病发生及防治研究[J]. 云南农业大学学报, 1995, 10(2): 10-15. YANG Ming, QIN Xi-yun, DUAN Yu-qi, et al. Occurrence and control of tobacco root-knot nematode disease in Yunnan[J]. Journal of Yunnan Agricultural University, 1995, 10(2): 10-15. |
| [5] |
张广民, 王兴利. 烟草根结线虫病综合防治技术的研究[J]. 中国烟草科学, 1996(4): 1-6. ZHANG Guang-min, WANG Xing-li. Study on integrated control technology of tobacco root-knot nematode disease[J]. Chinese Tobacco Science, 1996(4): 1-6. |
| [6] |
Sasser J N. Identification and host-parasite relationships of certain root-knot nematodes(Meloidogyne spp.)[M]. College Park: Agricultural Experiment Station, University of Marylan, 1954.
|
| [7] |
Gamel S, Huchet E, Le R N A, et al. Assessment of PCR-based tools for the specific identification of some temperate Meloidogyne species including M. chitwoodi, M. fallax and M. minor[J]. European Journal of Plant Pathology, 2014, 138(4): 807-817. DOI:10.1007/s10658-013-0355-8 |
| [8] |
宋志强.江苏省蔬菜根结线虫的分布调查、种类鉴定及定量检测技术研究[D].南京: 南京农业大学, 2013: 32-34. SONG Zhi-qiang. Distribution survey, species identification and quantitative detection of root-knot nematodes on vegetables in Jiangsu Province[D]. Nanjing: Nanjing Agricultural University, 2013: 32-34. http://cdmd.cnki.com.cn/Article/CDMD-10307-1014219745.htm |
| [9] |
Georgis R, Manweiler S A. Entomopathogenic nematodes: A developing biological control technology[J]. Agricultural Zoology Reviews, 1994, 6: 63-94. |
| [10] |
宋洁, 许艳丽, 姚钦. 昆虫病原线虫共生细菌对植物寄生线虫卵的毒性研究[J]. 大豆科学, 2014, 33(6): 896-899. SONG Jie, XU Yan-li, YAO Qin. Toxicity of entomopathogenic nematode symbiotic bacteria to eggs of plant parasitic nematodes[J]. Soybean Science, 2014, 33(6): 896-899. |
| [11] |
Molina J P, Dolinski C, Souza R M, et al. Effect of entomopathogenic nematodes(Rhabditida: Steinernematidae and Heterorhabditidae)on Meloidogyne mayaguensis Rammah and Hirschmann(Tylenchida: Meloidoginidae)infection in tomato plants[J]. Journal of Nematology, 2007, 39(4): 338-342. |
| [12] |
Valle E E D, Doucet M E. Effects of Galleria mellonella cadavers infected with Heterorhabditis bacteriophora and Steinernema rarum, their macerates and dead infective juveniles on Meloidogyne javanica suppression[J]. Revista De La Facultad De Ciencias Agrarias, 2014, 46(1): 205-211. |
| [13] |
Valle E E D, Lax P, Rondán Dueñas J, et al. Effects of insect cadavers infected by Heterorhabditis bacteriophora and Steinernema diaprepesi on Meloidogyne incognita parasitism in pepper and summer squash plants[J]. Ciencia E Investigación Agraria, 2013, 40(1): 109-118. DOI:10.4067/S0718-16202013000100009 |
| [14] |
王宇坤, 徐冰, 王小平, 等. 昆虫病原线虫对烟草根结线虫及蚜虫病虫害以及蚜茧蜂寄生的影响[J]. 农业资源与环境学报, 2017, 34(3): 293-298. WANG Yu-kun, XU Bing, WANG Xiao-ping, et al. Effects of entomopathogenic nematodes on the development of root-knot nematode and aphid, and on the parasitism of aphid parasitoid in tobacco[J]. Journal of Agricultural Resources and Environment, 2017, 34(3): 293-298. |
| [15] |
张瑞平, 曾庆宾, 余伟, 等. 烟草根结线虫病不同防控措施的田间筛选[J]. 中国烟草科学, 2016, 37(4): 54-59. ZHANG Rui-ping, ZENG Qing-bin, YU Wei, et al. Field screening of different control measures for tobacco root knot nematode[J]. Chinese Tobacco Science, 2016, 37(4): 54-59. |
| [16] |
Meng Q P, Long H, Xu J H. PCR assays for rapid and sensitive identification of three major root-knot nematodes, Meloidogyne incognita, M. javanica and M. arenaria[J]. Acta Phytopathologica Sinica, 2004, 34(3): 204-210. |
| [17] |
Zijlstra C, Donkers-Venne D, Fargette M. Identification of Meloidogyne incognita, M. javanica and M. arenaria using sequence characterised amplified region(SCAR)based PCR assays[J]. Nematology, 2000, 2(8): 847-853. DOI:10.1163/156854100750112798 |
| [18] |
卓侃, 廖金铃. 植物线虫分子鉴定研究进展[J]. 植物保护, 2015(6): 1-8. ZHUO Kan, LIAO Jin-ling. Advances in molecular identification of plant nematodes[J]. Plant Protection, 2015(6): 1-8. DOI:10.3969/j.issn.0529-1542.2015.06.001 |
| [19] |
杨艳梅, 梁艳, 袁绍杰, 等. 云南省部分烟区根结线虫形态和分子鉴定[J]. 南方农业学报, 2017, 48(2): 284-291. YANG Yan-mei, LIANG Yan, YUAN Shao-jie, et al. Morphological and molecular identification of root-knot nematodes in some tobacco areas of Yunnan Province[J]. Southern Agricultural Journal, 2017, 48(2): 284-291. |
| [20] |
Aït Hamza M, Ali N, Tavoillot J, et al. Diversity of root-knot nematodes in Moroccan olive nurseries and orchards: Does Meloidogyne javanica disperse according to invasion processes?[J]. BMC Ecology, 2017, 17(1): 41. DOI:10.1186/s12898-017-0153-9 |
| [21] |
喻盛甫, 胡先奇, 王扬. 云南烟草根结线虫优势种群动态规律研究[J]. 云南农业大学学报, 1998(1): 52-58. YU Sheng-fu, HU Xian-qi, WANG Yang. Study on dynamic law of dominant population of tobacco root-knot nematode in Yunnan[J]. Journal of Yunnan Agricultural University, 1998(1): 52-58. |
| [22] |
张喆.云南烟草根结线虫的种类鉴定[D].广州: 仲恺农业工程学院, 2016. ZHANG Zhe. Identification of tobacco root-knot nematodes in Yunnan[D]. Guangzhou: Zhongkai University of Agriculture and Engineering, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11347-1016153944.htm |
| [23] |
Kepenekci I, Hazir S, Lewis E E. Evaluation of entomopathogenic nematodes and the supernatants of the in-vitro culture medium of their mutualistic bacteria for the control of the root-knot nematodes Meloidogyne incognita and M. arenaria[J]. Pest Management Science, 2016, 72(2): 327-334. DOI:10.1002/ps.2016.72.issue-2 |
| [24] |
Sun Y, Bai G Y, Wang Y X, et al. The impact of Cu, Zn and Cr salts on the relationship between insect and plant parasitic nematodes: A reduction in biocontrol efficacy[J]. Applied Soil Ecology, 2016, 107(2): 108-115. |
| [25] |
Bi Y H, Gao C Z, Yu Z G. Rhabdopeptides from Xenorhabdus budapestensis SN84 and their nematicidal activities against Meloidogyne incognita[J]. Journal of Agricultural & Food Chemistry, 2018, 66(15): 3833-3836. |
| [26] |
An R, Orellana D, Phelan L P, et al. Entomopathogenic nematodes induce systemic resistance in tomato against Spodoptera exigua, Bemisia tabaci, and Pseudomonas syringae[J]. Biological Control, 2016, 93: 24-29. DOI:10.1016/j.biocontrol.2015.11.001 |
| [27] |
Srinivasan J, Kaplan F, Ajredini R, et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans[J]. Nature, 2008, 454(7208): 1115-1118. DOI:10.1038/nature07168 |
| [28] |
Macosko E Z, Pokala N, Feinberg E H, et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans[J]. Nature, 2009, 458(7242): 1171-1175. DOI:10.1038/nature07886 |
| [29] |
Kaplan F, Alborn H T, von Reuss S H, et al. Interspecific nematode signals regulate dispersal behavior[J]. PLoS ONE, 2012, 7(6): 1398-1408. |
| [30] |
Lacey L A, Granatstein D, Arthurs S P, et al. Use of entomopathogenic nematodes(Steinernematidae)in conjunction with mulches for control of overwintering coding moth(Lepidoptera: Tortricidae)[J]. Journal of Entomological Science, 2006, 41(2): 107-119. DOI:10.18474/0749-8004-41.2.107 |
| [31] |
白光瑛, 沈广爽, 马海鲲, 等. 施用方式和土壤深度对昆虫病原线虫越冬的影响[J]. 农业环境科学学报, 2015, 34(11): 2162-2168. BAI Guang-ying, SHEN Guang-shuang, MA Hai-kun, et al. Effects of application approach and soil depth on overwintering persistence of entomopathogenic nematodes[J]. Journal of Agro-Environment Science, 2015, 34(11): 2162-2168. DOI:10.11654/jaes.2015.11.018 |
| [32] |
Shapiro-Ilan D I, Hazir S, Lete L. Viability and virulence of entomopathogenic nematodes exposed to ultraviolet radiation[J]. Journal of Nematology, 2015, 47(3): 184-189. |
| [33] |
王鑫鹏, 王从丽, 李春杰. 昆虫病原线虫共生细菌对南方根结线虫卵孵化的影响[J]. 土壤与作物, 2017, 6(4): 256-262. WANG Xin-peng, WANG Cong-li, LI Chun-jie. Effect of symbiotic bacteria of entomopathogenic nematodes on egg hatching of Meloidogyne incognita[J]. Soils and Crops, 2017, 6(4): 256-262. |
 2019, Vol. 36
2019, Vol. 36