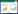文章信息
- 陆仲烟, 宋正国, 郭军康, 张长波, 沈跃, 刘仲齐
- LU Zhong-yan, SONG Zheng-guo, GUO Jun-kang, ZHANG Chang-bo, SHEN Yue, LIU Zhong-qi
- 伯克氏菌对水稻种子萌发及初生幼苗耐镉性的影响
- Effects of Burkholderia on Rice Seed Germination and Cd-tolerance of Rice Seedlings
- 农业资源与环境学报, 2013, 30(6): 87-90
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/
-
文章历史
- 收稿日期:2013-07-22
镉污染已经成为我国最严峻的土壤污染问题之 一,并因其毒性大、污染范围广而备受关注[1]。镉是植物 生长发育的非必需元素,在体内积累到一定程度就会 影响植物的生理代谢过程,抑制作物生长,最终导致 产量降低,甚至颗粒无收[2, 3, 4]。由于传统的物理、化学修 复方法成本很高,而且容易造成二次污染,新兴的生 物修复技术尚未成熟,仍处在探索完善阶段[5]。在镉污 染稻区寻求一种有效的途径来提高水稻的耐镉能力, 并降低籽粒对镉的积累,使稻米镉含量低于国家标准 是解决镉污染稻区稻米安全生产的一种有效方法。
根系促生菌(PGPR)是指生活于植物根系,并能 直接或间接促进植物生长的微生物[6]。PGPR 能通过 产生生长素、铁载体、ACC 脱氨酶和增加根系溶磷量 等途径来促进植物生长,提高植物抗病性和抗逆性[7]。 陈佛保等[8]研究了芽孢杆菌对缓解水稻锌胁迫的作 用,结果发现:在水稻受600 mg·kg-1的锌胁迫条件 下,接种芽孢杆菌DBM 仍能有效缓解锌毒害,显著促 进水稻生长,加菌处理比不加菌对照的地上部和根部 干重分别高出97.8%和77.2%,锌含量分别降低了 15.1%和19.9%。耐镉促生菌在提高水稻耐镉能力和 促进产量形成中具有很大的发展潜力和应用价值。
本研究通过接种耐镉促生菌伯克氏菌D54 于水稻生长环境中,研究了耐镉促生菌对水稻种子萌发的 影响,并分析了初生幼苗的根系形态,揭示耐镉促生 菌对水稻初生幼苗耐镉性的影响,为耐镉促生菌的应 用提供理论参考。 1 材料与方法 1.1 供试材料
水稻品种:湘24,购于湖南农丰种业有限公司; 伯克氏菌D54,中国农业部环境保护科研监测所生态 毒理与环境修复中心提供。 1.2 伯克氏菌生长曲线的测定
分别设置0、50、100、300、500、1 000 mg·L-1 的镉 浓度处理,每个处理重复3 次,测定伯克氏菌的生长 曲线。取培养液保存的菌液2 mL 加入200 mL的改良 SMN 液体培养基中,在38 ℃的摇床上以150 r·min-1 的转速培养72 h,作为种子液。取2 mL 种子液接入 100 mL 无菌及含各浓度镉的改良SMN 液体培养基 中,在38 ℃、150 r·min-1条件下振荡培养128 h。每8 h取样测定菌液在波长660 nm下的OD 值。以时间为 横坐标,OD 值为纵坐标绘制菌株在不同镉浓度下的 生长曲线。培养基的组成为:甘露醇,1%;(NH4)2SO4, 0.2%;蛋白胨,0.2%;K2HPO4,0.05%;MgSO4,0.05%; NaCl,0.01%;FeSO4,0.005%;MnSO4,0.005%;pH 值, 7.0。 1.3 发芽实验
分别设置①无菌水(CK),②1×108 cfu·mL-1 的菌 液(B),③10 mg·L-1Cd(Cd1),④10 mg·L-1Cd+1×108 cfu·mL-1 的菌液(Cd1+B),⑤50 mg·L-1Cd(Cd2),⑥50 mg·L-1Cd +1×108 cfu·mL-1的菌液(Cd2+B),⑦100 mg· L-1Cd(Cd3)⑧100 mg·L-1Cd+1×108 cfu·mL-1 的菌液 (Cd3+B)8 个处理,采用完全随机设计,随机排列,重 复3次。选取饱满均一的水稻种子在5%NaClO 溶液 中浸泡15 min 后,用无菌水洗净,浸种催芽24 h后, 转入盛有10 mL 无菌水或含菌液或含各浓度镉的溶 液的铺有双层滤纸的培养皿中,每皿50 粒。在培养箱 中以光照16 h,黑暗8 h,28 ℃的条件连续培养7 d。 期间喷洒无菌水使滤纸保持湿润。 1.4 测定指标与方法
发芽期间每日记录发芽的种子数,第7 d结束 后,每皿分别随机取5株用根系扫描仪(EPSON STD 1600,WinRhizo system V.4.0b)进行扫描,测定幼苗的 总根长、表面积、体积和根尖数。再随机取10 株分别 测定幼苗的根鲜质量和芽鲜质量,计算各处理下水稻 种子的发芽率、发芽指数、活力指数和耐性系数。
发芽率(G)=(发芽种子数/供试种子数)×100%
发芽指数(GI)=∑(Gt/Dt)(Gt为t d 的发芽数,Dt为发芽日数)
活力指数(VI)=S×GI(S为幼苗总根长)[9]
耐性系数(TI)=RLm/RLc(RLm 为各处理中根系的长度,RLc 为对照的根系长度)[10]
1.5 数据分析所得数据采用Excel 和SAS8.0 进行统计分析, 单方面分类的方差分析(one-way ANOVA),Duncan's multiple-range test 多重比较检验显著性差异(P≤ 0.05)。 2 结果与分析 2.1 镉胁迫对伯克氏菌生长的影响
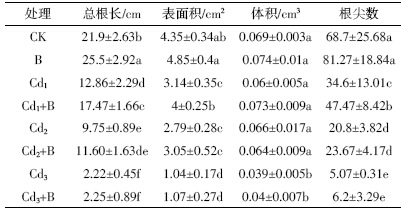
如图 1 所示,菌株在各浓度的镉胁迫下都能生 长,显示出极强的耐镉能力。当镉胁迫浓度在500mg·L-1以下时,菌株进入各生育期的时间基本一致。 进入稳定期后,50 mg·L-1的镉浓度处理的OD 值与对 照基本一致。从100 mg·L-1的镉处理开始随着镉浓度 的提高,OD 值逐渐降低。但其降幅不大,表明高浓度 镉胁迫虽对菌株的生长有所抑制,但作用不明显。在 1 000 mg·L-1的镉胁迫下,菌株进入对数期和稳定期 的时间延缓,生长相对滞后,进入稳定期后其细胞浓 度也较低。表明只有在极高的镉胁迫下,伯克氏菌 D54 的生长才会受到抑制。
|
| 图 1 不同浓度镉胁迫下伯克氏菌的生长曲线 |
如表 1 所示,随着镉处理浓度的提高,种子的萌 发率、发芽指数、活力指数和初生幼苗的根鲜重和芽 鲜重都降低。在10 mg·L-1的镉胁迫下,水稻种子的萌 发率与对照无显著差异。当镉胁迫浓度提高到50 mg·L-1和100 mg·L-1时,水稻种子的萌发才明显受到 抑制。在50 mg·L-1的镉胁迫下,接种伯克氏菌能显著 提高水稻种子的萌发率(P≤0.05),但在其他镉处理 下,接种伯克氏菌对种子萌发的影响不显著。接种伯 克氏菌对水稻种子的发芽指数无影响。在10 mg·L-1 的镉胁迫下,接种伯克氏菌处理的活力指数显著提 高,但在其他浓度镉处理下,接菌与不接菌处理的活 力指数无显著差异。在0、10、50 mg·L-1的镉胁迫下, 接菌处理能显著提高初生幼苗的根鲜重,但在100 mg·L-1的镉胁迫下,接菌处理与不接菌处理的根鲜重 无显著差异。在各浓度的镉胁迫下,芽鲜重都无显著 差异。接菌处理的芽鲜重较相同浓度镉处理的不接菌 对照有所提高,但其差异不显著。
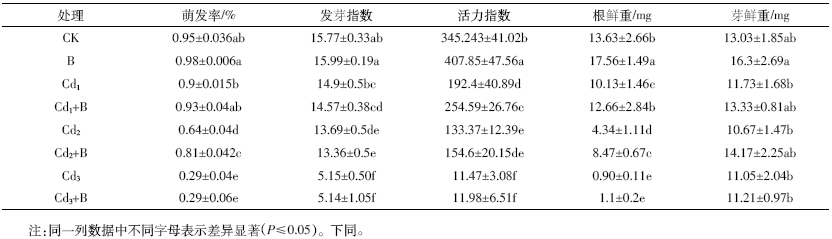
如表 2 所示,随着镉处理浓度的提高,水稻初生 幼苗的总根长、表面积和根尖数都有所降低。在10 mg·L-1的镉胁迫下,初生幼苗的总根长、表面积、根尖数都显著高于相同浓度镉胁迫下的不加菌对照(P≤ 0.05)。在其他浓度镉处理下,接菌处理的总根长、表 面积、体积、根尖数比相同镉处理下的不加菌对照都 有所增加,但其差异不显著。与其他形态指标相比,镉 胁迫对根系体积的影响较小,当镉胁迫浓度在100 mg·L-1时,才表现出明显的抑制作用。
如图 2 所示,随着镉处理浓度的提高,水稻初生 幼苗的耐性系数显著降低。在0 mg·L-1和10 mg·L-1 的镉浓度下,接菌处理的耐性系数显著高于不接菌处 理(P≤0.05)。在50 mg·L-1 的镉胁迫下,接菌处理的 耐性系数较不接菌处理有所提高,但其差异不显著。 在100 mg·L-1的镉胁迫下,接菌处理的耐性系数与不 接菌处理无显著差异。
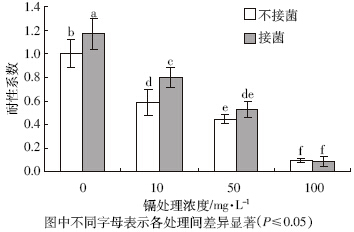
|
| 图 2 各浓度镉胁迫下,接种伯克氏菌对水稻初生幼苗耐镉性的影响 |
伯克氏菌D54 能产生生长素、ACC 脱氨酶、铁载 体和具有溶磷能力等植物促生菌的基本特性,能显著 提高番茄、美洲商陆和籽粒苋的生物量和对重金属的 耐性[11, 12]。当植物遭受重金属胁迫时,植物最先感应的 是根系器官,通过根系生长发育和代谢来适应逆境胁 迫[13]。研究表明,在镉胁迫下,根系较长的植物对重金属表现出较强的耐性,镉胁迫下各处理根长和对照根 长的比值能很好地指示植物对镉的耐受性[10, 14]。本试 验中,在10 mg·L-1的镉胁迫下,接种伯克氏菌能显著 提高水稻种子的活力指数和初生幼苗的根系鲜重、根 系总长、表面积、根尖数和耐性系数,但在高浓度的镉 胁迫下,接种伯克氏对根系的生长没有促进作用。这 可能是因为高浓度的镉胁迫已经对水稻种子和初生 幼苗造成了不可逆的损伤,使菌株的促生效果不明 显。本实验整个过程都是在无菌条件下完成,根系总 长度、根表面积和根尖数的提高可能是伯克氏菌产生 的植物激素的促进作用。
水稻种子的萌发率不易受镉影响,只有遭受很高 浓度的重金属胁迫时,萌发率才会明显受到抑制,镉 胁迫对芽鲜重的抑制作用也较弱,接种伯克氏菌对其 影响也较小。在较低浓度镉胁迫下,接种伯克氏菌显 著促进了根系生长,使种子的活力指数也显著提高。 在种子萌发时期,种子的生根易受镉的抑制,当镉浓 度提高到100 mg·L-1后,根系几乎没有生长。Madhaiyan 等[15]研究发现,在无菌条件下,接种甲基杆菌 CBMB20 和伯克氏菌CBMB40 都能显著提高番茄种 子在镍和镉胁迫下的生根能力,接菌后番茄对重金属 的耐性系数也显著提高。接种伯克氏菌能在一定程度 上缓解根系受镉的毒害,可能是因为菌株本身对镉的 吸附作用,使环境中的镉浓度降低,也可能是菌株产 生的铁载体降低了根系对镉的吸收[16, 17]。 4 结论
镉胁迫对水稻种子的萌发影响较小,只有在极高 浓度胁迫下,才会表明出明显的抑制作用;初生水稻 幼苗的根系对镉极其敏感;接种伯克氏菌D54 对水 稻种子的萌发率和发芽指数没有影响,但在低浓度的 镉胁迫下,接种伯克氏菌D54 能提高水稻种子萌发 的活力指数,对水稻初生幼苗的生根具有较好的促进 作用,提高水稻初生幼苗的耐镉能力。
| [1] | 陈志良,莫大伦,仇荣亮.镉污染对生物有机体的危害及防治对策[J].环境保护科学,2001,27 (4):37-39. |
| [2] | Seregin I V, Ivanov V B. Physiological aspects of cadmium and lead tox-ic effects on higher plants[J]. Russian J of Plant Physiology, 2001,48:523-544. |
| [3] | Dalcorso G, Farinati S, Maistri S, et al. How plants cope with cadmium:staking all on metabolism and gene expression[J]. J Integr Plan t Biol,2008, 50: 1268 -1280. |
| [4] | Sch俟tzend俟bel A, Schwanz P, Teichmann T, et al. Cadmium-inducedchanges in anti-oxidative systems, hydrogen peroxide content, and dif-ferentiation in Scot spine roots[J]. Plant Physiol, 2001, 127: 887-898. |
| [5] | 梁家妮,马友华,周 静.土壤重金属污染现状与修复技术研究[J].农业环境与发展,2009 (4):45-49. |
| [6] | Kloepper J W, Leong T, Teintze M, et al. Enhanced plant growth bysiderphones produced by plant growth-promoting rhizobacteria [J]. Na-ture, 1980, 286 (1):885-886. |
| [7] | 康贻均,程 洁. 植物根系促生菌作用机制研究进展[J]. 应用生态学报,2010,21 (1):232-238. |
| [8] | 陈佛保,柏 珺,林庆祺,等. 植物根际促生菌 (PGPR) 对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报,2012,31 (1):67-74. |
| [9] | 何俊瑜,任艳芳,周国强,等.不同水稻品种种子萌发期耐镉性的研究[J]. 华北农学报,2010,25 (3):108-112. |
| [10] | Wilkins D A. The measurement of tolerance to edaphic factors bymeans of root growth[J]. New Phytol,1978, 80: 623-633. |
| [11] | Guo Junkang, Tang Shirong, Ju Xuhai, et al. Effects of inoculation of aplant growth promoting rhizobacterium Burkholderia sp. D54 on plantgrowth and metal uptake by a hyperaccumulator Sedum alfredii hancegrown on multiple metal contaminated soil[J]. World J MicrobiolBiotechnol, 2011, 27 (1): 2835-2844. |
| [12] | 廖上强,郭军康,王芳丽,等.美洲商陆和籽粒苋对接种伯克氏菌的生理生化响应及其对富集铯的影响[J]. 环境科学学报,2012,32(1):213-223. |
| [13] | 何俊瑜,任艳芳,王阳阳,等.不同耐性水稻幼苗根系对镉胁迫的形态及生理响应[J]. 生态学报,2011,31 (2):522-528. |
| [14] | Di Toppi L S, Gabbrielli R. Response to cadmium in higher plants [J].Environmental and Experimental Botany, 1999, 41 (2): 105-130. |
| [15] | Madhaiyan M, Poonguzhali S, Tongmin Sa. Metal tolerating methy-lotrophic bacteria reduces nickel and cadmium toxicity and promotesplant growth of tomato (Lycopersicon esculentum L.) [J]. Chemosphere,2007,69 (1): 220-228. |
| [16] | Zaidi S, Musarrat J. Characterization and nickel sorption kinetics of anew metal hyper-accumulator Bacillussp[J]. J Environ Sci Health A,2004,39 (1):681-691. |
| [17] | Kuffner M, Puschenreiter M, Wieshammer G, et al. Rhizosphere bacte-ria affect growth and metal uptake of heavy metal accumulating willows[J]. Plant and Soil,2008,304 (1):35-44. |
 2013, Vol. 30
2013, Vol. 30