2. 俄罗斯圣彼得堡国立大学地球科学研究所, 圣彼得堡 199034;
3. 黑龙江大学生命科学学院, 哈尔滨 150080
2. Institute of Earth Sciences, Saint-Petersburg State University, Saint Petersburg 199034, Russia;
3. School of Life Sciences, Heilongjiang University, Harbin 150080, China
腐殖质(Humic substances,HS)是土壤有机质(Soil organic matter,SOM)的主要组分,占SOM总量70%,占土壤有机碳总量80%[1],广泛存在于自然水体、木炭、泥炭以及海洋沉积物中。SOM在微生物作用下的腐殖化按其规模被认为是光合作用之后的第二大过程[2],对土壤肥力及理化性质具有重要作用。HS化学组成和官能团取决于提取物的起源、年龄、获取提取物时气候和环境条件等因素,因此HS无严格恒定的化学组成,而分子量取决于提取方法[3]。传统上将HS分为3类:溶于碱但不溶于酸的腐植酸(Humic acid,HA),既溶于碱又溶于酸的富里酸(Fulvic acid,FA),既不溶于碱也不溶于酸的胡敏素(Humin,Hu)[4]。然而,此种分类方法无法提供HS化学行为和分子结构等信息[5]。
HS研究有近200年的历史,其腐殖化作用区别于活细胞中由遗传密码控制合成生物大分子的过程,发生在生物体外,缺乏既定合成程序,合成产物也不同于前体形式化合物。此外,土壤腐殖化作用持续进行,终产物和中间产物混淆不清,加之HS的分散性、来源的多样性、形成环境的不确定性、形成途径和稳定条件的复杂性等限制了对HS分子结构的深入研究[6]。HS生理学活性一直以来都是科研人员研究的热点,近年来,越来越多的学者试图揭示HS生理活性与其化学组成、性质和分子结构的相关性,但由于上述瓶颈问题,至今关于生理活性机制的研究仍停留在理论假设阶段。本文结合已报道的研究成果,综述了HS化学组成和结构特征、生理活性及其作用机制,并探讨了HS化学组成与其生理活性的相关性,旨在为HS生理学效应的深入研究及农业应用提供理论参考。
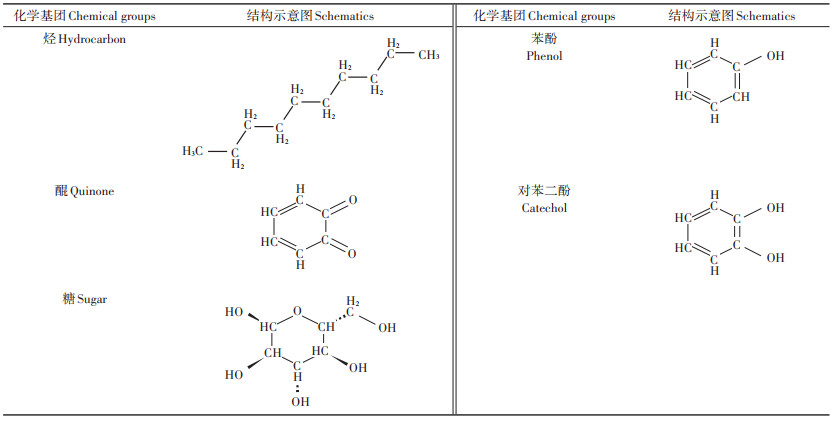
1 HS化学组成和结构特征土壤腐殖化作用受多种因素的影响,如微生物群、温度、湿度、土壤化学组成和物理结构,以及参与腐殖化作用有机分子的异质性等[7]。HS形成途径因原始材料不同存在不同假说,如木质素假说、多酚假说、细胞自溶假说等。窦森等[6]认为功能相似但结构各异的HS是由四类生物分子单体——木质素、糖类、蛋白质和脂质经缩合转化而成,形成的HS不是前体分子的简单加和,而是前体材料发生了新的生物化学反应,形成了特殊化学组合比例、特殊化学结合方式,甚至是形成了某种有机化学结构未知的化合物,表现为HS特异性。HS化学组成具有不确定性,不同来源HS、相同来源不同分子量HS片段都有着不同的化学组成。无论HS起源如何,HS高分子化合物间存在一系列共有化学基团,如表 1[8]所示。
HS是多分散和多功能有机化合物的混合物,是由异类分子单糖、脂肪酸、多肽、脂肪链和芳香环通过随机氧化、聚合、疏水作用(如范德华力,π-π,CH-π)、电荷转移和氢键等形成的超分子聚合物[9-10],Stevenson[11]提出了经典HA结构模型,除了芳香环或脂肪族结构,还包括多肽和碳水化合物。Orlov等[12]认为HA结构单元包含不可水解芳香环核心骨架结构和可水解的由糖类、脂类和蛋白质等组成的外围结构,整个大分子结构单元的组成和结构具有可变性,该模型能够解释HS氧化还原、酸性和光学性质,但是由于缺乏分子种类信息,因此无法得出HS参与过程机制的结论。Popov等[13]认为HS是具有内部疏水区和外部亲水区的胶束结构。Dmitrieva等[14]认为HS由芳香环和脂肪链组成,包含极性基团(含O、S、N官能团)和非极性基团。Nardi等[15]认为,外部亲水区由极性基团组成,内部疏水区由植物大分子组成。由于分子间相互作用非常弱,可利用凝胶色谱分离HS,在不同pH值下,有机酸处理可改变亲水疏水平衡,破坏胶束结构,使胶束分解成不同的小聚集体。这些聚集体可能会重新形成胶束,胶束化和分解可能会无限期地进行[15-16]。然而胶束结构假设没有考虑凝胶色谱分离过程中非体积排除效应对分馏结果的影响,即HS在低pH下与凝胶的氢键结合,以及在高pH与离子强度下的静电相互作用,因此HS胶束结构模型也遭到了质疑[17]。HS超分子结构的假设目前被普遍接受。HS实际上是由不同分子大小但相似化学结构的纳米级超分子缔合而成[18]。HS超分子结构能够解释一系列化学行为[19],如金属腐植酸盐热行为很难通过将HS视为大分子聚合物来解释,而将HS视为超分子组装体则完全可以理解[19-20],同样,在HS和Fe离子互作过程中,Fe含量较低,HS分子自组织成致密结构,Fe含量增加,HS胶体的重排明显减少,因此HS和Fe离子互作导致HS网状结构的重排与亚稳态胶体的碰撞速率之间的竞争[19, 21]。研究证实,随着Fe含量的增加,HA逐渐与Fe形成络合物,HA分子量降低,与Fe络合破坏了稳定HS构象结构的疏水键,迫使HS超分子结构变成较小的聚集体,但构象稳定性更高,实验结果支持HS超分子结构模型[19, 22]。Piccolo[23-24]将FA定义为较小亲水分子缔合物,其包含较多的酸性官能团,使得FA在任何pH溶液中保持分散状态,而HA主要由疏水化合物(聚亚甲基链、脂肪酸和类固醇化合物)组成[18],由于疏水作用的存在,其在中性pH值下保持稳定。Cao等[18]近期研究认为,HS具有天然生物大分子(蛋白质、纤维素、木质素以及微生物代谢产物等)中不存在的特殊结构特征。HS超分子结构特征包括C=O基团在高度取代芳香族化合物和高度共轭体系的脂肪族化合物中的分布,以及C—O烷基链的存在[18, 25]。HS顽固性和不溶性被认为与脂肪烃的存在有关[18]。HS长链分子在水溶液中呈球状结构[26-27],其中疏水HA朝向分子内部,亲水FA朝向外部[28]。HS超分子结构由高分子量和低分子量有机物组成[29],并随着有机物和转化时间的不同,以及土壤性质和类型的改变而具有不同的结构[18]。HS在水溶液中形成稳定的两性聚集体,可将其视为“假分子”,据此确定其理化性质,包括结构和功能组成、分子量和反应能力。HS作为线性或分支链状聚合物在空间结构上存在一定程度的构象折叠,提高其对微生物降解的稳定性,延长其在土壤中的循环周期,同时也确保SOM水平和土壤肥力。
目前,傅里叶红外光谱(FTIR)、核磁共振(NMR) 以及热裂解气相色谱-质谱联用(Py-GC/MS)等技术能够提供HS化学组成和结构等方面信息,但由于研究技术和方法的限制,HS分子内部立体骨架结构尚未明确。HS作为天然存在的高分子化合物,除了碱溶性、暗色、相对分子量较高、异质性、胶体性质等共性外[6, 28],其HS化学组成和分子结构至今还存在诸多争议。争议的焦点为:①HS来源与化学组成的相关性。植物组织是HS形成的主要原料,木质素可能构成了HS芳香族成分,而角质和木栓质形成了脂肪族结构[30]。此外,煤中所含HA和FA的化学成分在不同煤层之间和煤层之内有所不同,煤炭矿床的形成受植被类型、植被在空间和时间上的变化,以及土壤和环境条件的影响,所有这些因素都会影响煤化学性质(如芳香度)和无机成分(即灰分)的数量和质量,并导致HS化学组成的变化。研究还证实,各种固体化石燃料中HS含量不同,HS的组成和数量取决于化石燃料的碳化阶段、岩相组成以及氧化度等[31]。外界环境因素的不可控导致不同来源HS化学组成的差异,进而转化为HS与植物互作机制的差异。②HS分子是否存在“结构独特性”。HS是一类物质,在化学组成和结构特征方面与前体物质不同。腐殖化过程中,新的生化反应在不同的前体物质(包括动物、植物和微生物)之间,发生二级合成。Kleber等[32]认为二级合成是不可证明的,因为碱提取无法将二级合成产物与其他可电离的有机物分开,而且在二级合成中会形成特殊的化学组合或特殊比例的化合物,以及未知化合物的某些化学结构,即HS“结构独特性”。异质性只是“结构独特性”的一部分。由于技术限制和HS的异质性,科学家一直未找到“结构独特性”的证据[33]。此外,元素分析(C、H、O)和酸性官能团的测定数据表明,不同土壤HA和FA相对类似[34]。虽然这种简单的相关性不基于任何分子层面,但要考虑将HS视为具有特定性质的化学实体,而不是非特异化合物的复杂混合物[23-24]。③HS形成和稳定机制。HS的异质性反映了HS形成途径和稳定机制的复杂性。由于HS异质性和外界环境条件的影响,HS的组成和结构极其复杂[33],而且微生物在腐殖化过程中的作用观点尚未统一,这些都是限制HS生物化学研究的重要原因。④Hu、HA和FA形成顺序。HA在木质素蛋白理论和微生物合成理论中比FA形成得早,而FA在微生物多酚理论和木质素多酚理论中形成得早[12]。上述均可能影响土壤中HS形成,但其在不同土壤中参与程度不同或重要性不同[33]。⑤土壤中是否存在HS。有研究认为HS是由植物和动物残留物在微生物作用下分解形成的异质有机混合物,在土壤中不存在,通过现代分析技术无法在土壤中检测到HS,而且HS合成中涉及的矿物质和酶与自然系统无关[35-36]。研究者还提出了一种土壤连续体模型(Soil continuum model,SCM),该模型将HS视为逐步分解有机化合物的连续体[36-37],因而能够很好地解释HS的异质性,但HS不存在的观点尚未得到学术界的认可。土壤系统中,在苯环和吡咯环参与形成环状结构的基础上[38],形成了具有随机性质的HS大分子和超分子系统,它们在固体颗粒表面形成了稳定的双层两亲性质膜。当土壤中SOM的转化达到平衡状态、SOM的组成和结构参数不变时[38],氧化自由基聚合过程逐渐被HS的片段更新过程所取代。在环境因素发生剧变情况下,SOM系统开始朝着新平衡状态转化。HS作为有机实体在土壤系统中发挥多种功能,上述问题的存在限制了HS生物化学的深入研究,然而正是HS化学组成和理化性质的多样性、分子结构的复杂性,才使其在植物-土壤系统中发挥多样的信号作用和营养功效。
2 HS生理活性及其作用机制HS作为天然高分子含氮化合物,是生物体外最稳定的具备生物学活性的有机物形式之一。HS可以通过改良土壤结构、孔隙度来调节土壤微生物群落,间接影响植物生长发育[39-41]。HS生理活性使其复杂的化学组成和特异的化学性质能够直接参与细胞内的生物化学和生物物理学代谢过程,如光合作用、细胞发育、激素合成和信号转导等,促进植物生长发育。HS在土壤中矿化速率较慢,理论上不适宜作为植物营养的直接来源,因此HS生理活性似乎与HS营养含量无关,而与HS促进营养物质的摄取和运输,以及参与调节与细胞生长发育相关的植物激素信号传导密切相关。
2.1 HS促进矿质元素的吸收植物根系能够吸收HS,不同分子量HS影响效果不同,低分子量HS促生效果较为明显[42-43],HS能够促进种子萌发和生长发育[44],其中对根的促生作用尤为明显[45-46]。研究表明,HS突出特点是能够促进根毛形成和侧根发育[47-49],增加根系对水分和营养元素的吸收面积。
HS促进植物细胞对无机营养元素的吸收[50-53],如N、P、K、S、Fe、Mn、Cu、Zn等。Baldotto等[54]研究发现HS使菠萝(Ananas comosus)叶片中N、P、K、Ca和Mg含量分别增加52%、71%、50%、58%和59%。HS影响植物对离子的选择性吸收,该过程受HS来源和浓度、植物种类以及培养环境组分和pH值等影响[55-56]。Kim等[57]和Hita等[58]认为HS通过提高土壤微生物的活性增强细胞对矿质元素的吸收利用。硝酸盐是植物生长发育过程中的主要无机氮源。Vaccaro等[59]比较了不同浓度(0、1、5 mg · L-1,以C计)HA对玉米(Zea mays)幼苗氮代谢和氨基酸代谢的影响,结果表明,1 mg·L-1 HA处理的幼苗根长和鲜质量与对照差异不显著,5 mg·L-1 HA处理表现出负生长,1 mg·L-1 HA处理叶片中可溶性蛋白含量高于空白对照7%,硝酸还原酶(NR)和亚硝酸还原酶(NiR)活性分别增加10% 和12%,谷氨酰胺合成酶(GS)和NADH依赖性谷氨酸合成酶(NADH-GOGAT)活性分别增加11%和64%,而游离氨基酸天冬氨酸(Asp)、苏氨酸(Thr)、异亮氨酸(Ile)和赖氨酸(Lys)含量增加10%~13%,因此HA通过增加可溶性蛋白含量和氨基酸合成促进硝酸盐代谢。HS能够促进植物对NO3-的吸收利用[60-62],其作用机制研究结论不一。Nardi等[63]认为NO3-穿过细胞质膜依靠的是H+-ATPase与有利的H+电化学梯度相偶联,而蛋白质组学研究证实HS与高亲和及低亲和NO3-转运蛋白对NO3-的吸收之间不存在相关性,因此HS对NO3-吸收的影响不是直接影响该物质的主动运输,而是通过降低根表pH值,促进了H+/NO3-同向运输[64]。P元素是细胞内磷脂、核酸和酶等组成的必需元素。Urrutia等[65]研究证实HS可促进植物细胞对P元素的吸收,HS通过形成金属桥与磷酸盐相互作用,将根际土壤不溶性磷酸盐转变成可溶形式。Gerke[66-67]的研究印证了上述结论,HS与正磷酸盐(P)通过Fe(Ⅲ)或Al(Ⅲ)桥形成的络合物普遍存在于土壤中。土壤HA竞争性吸附P元素形成HA-Fe(Al)-P复合物,P可以通过有机酸阴离子或HS酸化被激活,提高生物可利用性。K+是高等植物普遍需要的一价阳离子,是植物细胞代谢不可缺少的元素。HS促进根细胞对K+的吸收利用,作用机制一方面类似细胞对NO3-的吸收转化,由H+-ATPase在细胞膜上产生有利的电化学梯度,促进K+转运[68],另一方面K+也可与HA络合位点相互作用,但由于化学键的高度离子性,金属结合的稳定性较低,目前HA对K+吸收转运机制尚未明确,仍有待进一步研究。
此外,HS是两性分子,其分子结构中亲水区和疏水区能够增强HS与细胞膜的亲和性,影响细胞膜的渗透性和流动性,促进细胞对矿质元素的吸收。HS分子结构中的酸性官能团,能够与微量元素(如Fe、Mn、Cu、Zn等)形成螯合物,转变成能够被植物细胞吸收利用的形式,促进细胞对微量元素的吸收利用。研究证实,土壤中微量元素(如Zn、Mn、Cu等)稀缺时,HS作用效果更为明显[5]。近期研究证实,HA能够促进Fe2+吸收和同化,其作用机制是HA能够诱导编码Fe3+螯合物还原酶和Fe2+转运蛋白基因CsFRO1和CsIRT1的表达,而且HA组成中羧基(—COOH)和酚羟基(Ar—OH)能够络合Fe2+,促进Fe2+的吸收和转化[69-70]。HS也可作为转运载体[71],直接参与细胞膜内外离子跨膜运输。
2.2 HS类激素活性HS类激素活性一直都是研究人员关注的焦点。研究发现,不同来源HA和低浓度吲哚-3-乙酸(IAA) (10-10 mol·L-1和10-15 mol·L-1)均能够诱导侧根增殖,促进根的伸长,激活细胞质膜H+-ATPase、液泡膜H+-ATPase和H+-PPases[61, 72]。IAA响应报告基因DR5: : GUS在对HS响应研究中也证实HS的IAA活性,外源施加HS能够诱导DR5: : GUS在侧根中的表达[73-75]。此外,HS对IAA作用的特定分子靶标具有诱导作用,HS能够诱导早期IAA响应基因IAA5和IAA19的表达,并诱导质膜H+-ATPase的应答[76]。研究表明,除了IAA活性外,HS还具有其他植物激素的活性,如赤霉素(GA)、细胞分裂素(CK)和多胺(PA)等[77-78]。
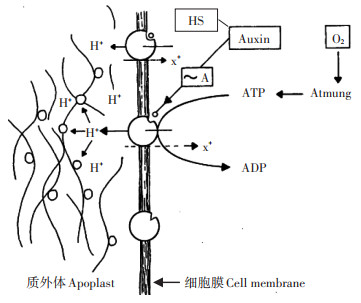
HS自体组成是否包含类激素,现有研究结论存在争议。Canellas等[79]认为HS自身不包含植物激素。游离于土壤或附生于植物根际的促生细菌(Plant growth promoting rhizobacteriam,PGPR)是激素来源之一。作用机制是PGPR分泌的生物活性小分子(如IAA)包埋在HS超分子结构疏水区,植物根系分泌的有机酸(主要是柠檬酸)分解HS超分子结构,IAA等被释放出来作用于细胞质膜H+-ATPase,将细胞内H+泵出细胞外,H+泵送降低了质外体pH,激活了细胞壁松散酶,使细胞壁松动、细胞体积膨胀。H+质外体分泌由阳离子的反向泵入补偿,此种方式确保在细胞伸长期间内部膨压保持在恒定值,作用机制如图 1[77]所示。HS作为根际土壤信号分子,能够引起土壤微生物群产生激素,刺激根系生长发育。此外,HS还能够增加内源植物激素的水平,Elmongy等[80]将不同浓度(0、0.5、1、2、5 mg·L-1)HA添加到杜鹃花(Rhododendron subgenus Tsutusi)外植体培养基中,结果表明,1 mg·L-1和2 mg·L-1 HA处理培养56 d后,根长、根数和生根率明显增加,植物内源激素IAA和GA水平显著升高,尤其是在根发育的起始阶段(培养7 d),1 mg· L-1和2 mg·L-1 HA处理IAA含量分别为72.57、70.21 ng·g-1(鲜质量),GA含量比对照增加56.6%和52.5%。García等[81]研究证实,HS促生作用与内源激素IAA、乙烯(ETH)、NO和脱落酸(ABA)浓度增加密切相关。此外,Moscolo等[82]认为HS本身包含类激素组分,免疫测定等方法检测到不同来源(如堆肥、土壤、有机废物等)HS分子均具有类似IAA活性组分。植物根系分泌的有机酸可分解HS超分子结构,由于HS来源和化学组成的多样性、分子结构的非均一性,以及有机酸作用部位的随机性,HS超分子结构能够释放出多种类型小分子片段,与细胞质膜上的受体结合诱导不同的生理生化反应。HS分子结构域的组合和拆分,以及不同活性分子的动态释放可以解释HS具有IAA、GA、CK和PA等多种植物激素的活性。
|
图 1 HS类生长素物质以活性形式(~A)激活质膜上的H+-ATPase[77] Figure 1 Auxin-like substances present in HS in active form (~A) activates H+-pumping ATPase at plasma membrane[77] |
HS类激素活性组分作为诱导因子影响植物生理代谢,作用途径和机制尚未明确。Trevisan等[83]采用cDNA-AFLP技术研究HS对拟南芥(Arabidopsis thaliana)初级代谢和生长发育相关基因表达的影响,利用160个基因组合引物,鉴定出133个基因参与HS与植物互作,序列分析结果表明HS作用后大量基因参与拟南芥生长发育和代谢调节,以及RNA转录和代谢等,RT-PCR进一步分析了32个HS调节基因的转录水平,结果表明,转录组水平上HS通过复杂的基因转录网络调节生理代谢,而且HS的促生作用与类激素活性相关,涉及IAA非依赖性信号传导途径的参与。HS通过多方面机制发挥促生作用,在H+-ATPase激活的同时,类激素活性还能够激活转录因子和蛋白代谢,触发细胞分裂和生长[5]。HS类激素活性影响细胞呼吸作用。Canellas等[84]研究发现,HS处理玉米叶片后总碳水化合物含量减少50%,当葡萄糖和果糖含量降低时,淀粉含量增加。HS影响糖酵解(Glycolysis)和三羧酸循环(Tricarboxylic acid cycle,TCA)关键酶活性,分子量越小作用效果越好,原因是HS分子柔性构象易于扩散进入细胞[85]。Shah等[5]研究与上述结论一致,认为低分子量HS能够作为类激素物质(IAA,GA或细胞因子等)促进植物生长发育。HS的IAA活性能够调节根系C、N代谢,IAA极性运输,NO3-的根吸收,以及由地下向地上的转运等[86],HS生理活性除了与IAA信号传导途径相关外,HS还参与其他的一些独立互补途径,这些途径与SO42-和Fe2+运输吸收密切相关[15]。
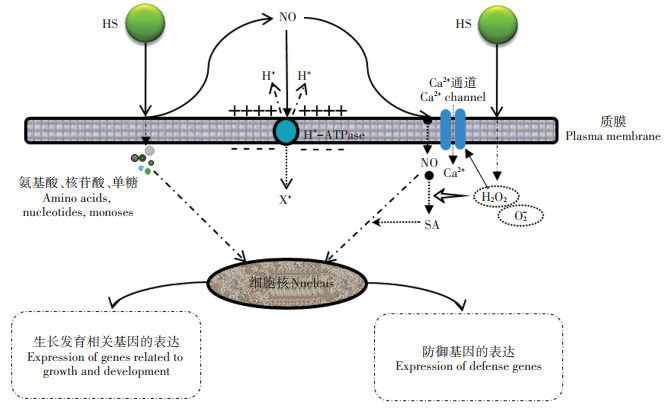
2.3 HS介导信使NO的作用信使NO是参与许多植物生理过程(如根生长、侧根形成、细胞凋亡、防御代谢等)的重要生物活性分子[87]。Zandonadi等[72]研究指出,20 mg·L-1(以C计) HA处理影响玉米幼苗初生根和侧根形态变化,初生根长度大于对照但差异不显著,侧根数量增加2.5倍,在幼苗侧根特定部位诱导NO的出现[88-89],产生机制可能是HS酸化胞内环境,提高NO还原酶活性,诱导NO合成[90]。Cordeiro等[91]研究了在0.5 mmol·L-1和5 mmol·L-1 N-NO3水平下HA和NO供体(SNP)促进罗勒(Ocimum basilicum)毛状根生长的机制,结果表明,在0.5 mmol·L-1 N-NO3水平下,3 mmol·L-1(以C计) HA和100 µmol·L-1 SNP促进毛状根生长,NO和活性氧(Reactive oxygen species,ROS)水平增加,而NO清除剂(cPTIO)的使用抑制了毛状根的生长,降低了NO和ROS水平,说明HA依赖信使NO和ROS促进根系生长。NO作用于细胞质膜参与调节多条胞内代谢途径,如图 2所示。HS小分子片段进入细胞转变成氨基酸、核苷酸、单糖等结构单元,参与合成生物大分子,调节与生长发育相关基因的表达[92]。NO分子能够激活细胞质膜H+-ATPase[93-94],研究认为,IAA和NO浓度的增加是HS激活质膜H+-ATPase的必要条件[76]。Carcía等[95]研究还证实,HS作用于根部后H2O2和O2-浓度增加,同时清除酶活性增强,而NO能够清除胞内ROS[96],降低ROS毒害作用。此外,胞内产生的ROS靶向作用于细胞膜Ca2+通道,使Ca2+细胞内流,促进侧根生长[75]。HS作用产生的NO能够与激素互作,参与根和茎生长发育的调节。在根系中,HS通过激活根细胞中NO、IAA和ETH联合调节的信号通路诱导侧根形成,同时ABA浓度增加[94],水通道蛋白被激活,促进根系水力传导率和茎、叶的生长。HS对茎生长发育的调节与IAA、NO和ABA信号传导途径相关,这些信号分子通过相关受体蛋白调节H+-ATPase活性[97]。此外,NO信号分子还能够协同其他信号分子激活细胞防御代谢。NO穿越细胞膜,在胞内H2O2参与下,诱导合成水杨酸(Salioylic acid,SA),SA和NO协同作用诱导防御基因表达,提高抗氧化酶活性。近年来研究发现HS在根细胞中触发ROS信号,HS通过NO和抗氧化酶调节胞内ROS稳态,介导根系发育和形态结构,因此HS对根表型的影响具有激素和ROS依赖性[98-99]。总之,HS通过NO分子激活H+-ATPase并参与多条激素信号传导,调节植物生长发育,如IAA-NO-ETH、IAA-NO-ABA、ROS和Ca2+信号等[100]。
|
图 2 HS通过信使NO分子激活细胞质膜H+-ATPase和相关生理代谢过程 Figure 2 HS activates the cytoplasmic membrane H+-ATPase and related physiological metabolic pathways through messenger NO molecule |
HS是超分子胶体簇,穿过植物细胞壁的概率非常小,研究认为HS仅作用于细胞膜,HS生理活性与其在细胞膜上的局部靶向和非靶向作用相关[101],激活细胞内代谢过程。还有研究指出HS组分能够穿透根部质外体和表皮细胞,但至今尚未有明确定论[102]。采用14C同位素标记HA和FA的研究发现,在HS和豌豆(Pisum sativum)根系最初作用的3 h内,HA和FA大量地结合在细胞壁上,18 h后HA和FA转变成了植物细胞内可溶性组分,且HA仍主要结合在细胞壁上,而FA更多地进入细胞内[103-104],可能是由于大量氢键和疏水作用的存在使HS同细胞壁组分有效结合,吸附在细胞表面,FA分子量相对较小能够转运进入细胞。目前关于HS化学组成、理化性质、分子结构与生理活性的相关性已有一些研究成果,如表 2所示。
|
|
表 2 HS化学组成、性质、分子结构与生理活性的相关性 Table 2 The correlation of chemical composition, properties and molecular structure of HS with physiological activity |
HS由多样的化学官能团组成,包括—COOH、Ar—OH、醇羟基(R—OH)、—C=O—、—NH2、甲氧基(CH3O—)等,具有酸性、亲水性、界面活性、阳离子交换能力、螯合-络合作用及吸附分散能力等[113],能够参与细胞膜内外多种生化反应。不同来源HS生理活性的差异是由其分子组成中官能团组成和含量的差异决定的。研究证实,土壤HS分子量较大,—COOH含量较低,Ar—OH含量较高,而水体HS酸性基团较多,分子量较小,芳香基团、Ar—OH、CH3O—含量和C/N较低,—COOH含量较高[114]。土壤HS组成中低分子量组分生理活性较大,原因是迁移率较高,易扩散进入细胞,而高分子组分易吸附在细胞壁上,阻碍其他营养物质进入细胞,因此高分子量HS组分生理活性较低,但也有研究认为高分子量HS能够促进根细胞分化[63]。HS分子量与其生理活性相关性研究存在争议,Muscolo等[108, 115]认为低分子量HS组分(< 3 500 Da)具有IAA活性,高分子量HS组分(>3 500 Da)对植物根系没有任何影响。Scaglia等[109]认为HS生理活性似乎与分子量相关性不大,而与HS化学组成、性质和分子结构密切相关。Filatova等[116]研究认为,HS分子量与化学组成相关,随着分子量的减小,H和N元素含量降低,O元素和—COOH含量增加,氧化度和环状结构比例、年龄和顺磁性中心浓度增加,而高分子量组分富含脂肪酸、多糖、多肽,而且光敏生色团浓度较低,因此分子量和生理活性的相关性还需深入研究。HS各组分分子量按照Hu-HA-FA顺序逐渐减小,元素组成中O含量依次增加,C和N含量依次减小,酸度和阳离子交换能力增强。研究证实FA生理活性相对较大[117],不仅是因为FA分子量相对较小,更可能是因为含氧量及酸性官能团含量较高。HS官能团分布于整个超分子结构,其中含氧官能团是重要基团,如—COOH、—OH、—CH3O—、—C=O—等,在FA组成中几乎所有的氧元素都分布在含氧官能团中,而且FA酸性含氧基团中—COOH、—OH和—C=O—含量较高[118]。HA分子结构中—COOH、—OH是主要化学官能团,HA多种功能归因于组成中—COOH、Ar—OH,它们是发生吸附、络合、螯合、离子交换和光降解等活性作用的位点,OH/OOH能够去质子化,络合金属元素[119],增强与细胞膜的靶向作用,激活H+-ATPase[106-109],改善植物生长和营养状况。因此,官能团—COOH和—OH活性位点的作用与生理活性密切相关。
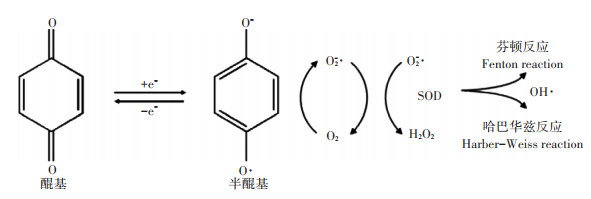
3.2 醌基的电子传递对HS生理活性的影响HS作为胞外电子穿梭体可以作为微生物电子受体和难溶金属氧化物电子供体,参与生物地球化学的氧化还原过程,如重金属由难溶的氧化态向相对易溶的还原态转化。HS传递电子能力取决于分子组成中Ar—OH和醌基,其中醌基含量越高,传递电子能力越强[120]。研究证实,不同来源和年龄的HA供给电子和接受电子的能力不同,13C NMR分析结果表明,水体HA包含电子供体较多,电子受体较少[121-122]。在土壤环境中,电子供体(如葡萄糖、有机酸、乙酸、H2等)在腐殖质还原菌(Humic-reducing bacteria,HRB)作用下将电子传递给氧化态HS,醌基得到电子被还原,转变为半醌,半醌通过不同机制产生ROS,如图 3 [119]所示。在O2存在下,半醌产生超氧离子(O2-·),在超氧化物歧化酶(Superoxide dismutase,SOD)作用下转化为H2O2。O2-·通过与过渡金属(芬顿反应)或过氧化氢(哈巴华兹反应)反应产生OH·,OH·能够积极参与细胞内氧化还原反应,调节胞内ROS稳态,参与细胞内信号传导,而且自由基可以掺入各种有机和无机分子,包括氨基酸、肽、糖、木质素等[66],调节植物根系的形成和发育。此外,半醌还能将电子传递给可还原金属氧化物,自身又转变成醌基,准备参与下一轮氧化还原反应,因此醌基以循环往复方式作为氧化还原反应的催化剂,参与土壤中重金属元素的生物地球化学循环,提高金属元素生物可利用性和植物根系的生长发育。此外,Ar—OH能够与醌基通过氧化还原反应相互转化,酚类化合物具有类激素活性,能够增加植物光合色素,提升蒸腾速率和CO2同化作用等[9],因此醌基的电子传递也是影响HS生理活性的重要因素。
3.3 HS亲水疏水平衡对HS生理活性的影响HS是胶体分散系统,具有表面活性和表面电荷特性,反映在相界面处HS的亲水疏水平衡和静电相互作用[13]。Piccolo[23]发现亲水/疏水比影响它们在环境中的反应。HS亲水和疏水性是由分子表面化学官能团决定的,HS在溶液中处于亲水疏水动态平衡,极性基团—OH、—COOH、—C=O等决定亲水性,烃类或芳香烃类决定疏水性。HS球状结构易于通过细胞壁孔隙,影响细胞膜的结构,增强细胞膜的流动性和渗透性。烃类或芳香族片段决定的疏水性能够促进HS与细胞质膜的融合,—OH、—COOH、—C=O决定的亲水性更易于其与细胞膜发生靶向作用,激活质膜H+-ATPase[78, 106]。HS超分子结构的稳定性由分子内和分子间的疏水作用、范德华力、氢键等决定,HS亲水疏水动态平衡受到周围环境pH的影响,pH值升高,疏水作用减弱,反之,疏水作用增强。在碱性溶液中,HS超分子结构分子内和分子间氢键和范德华力被破坏、—COOH和R—OH被去质子化,导致负电荷基团相互排斥,使得分子结构呈现分散状态。在酸性溶液中,HS非共价键(如范德华力、π-π和CH-π)等被破坏,使得分子逐渐变小。在pH < 3的情况下,溶液中—COOH数量增加,—COOH质子化促使分子内部和分子间氢键数量增加,呈现卷曲结构[9],HS分子结构取决于溶液离子强度和pH,HS分子结构、化学基团空间排列影响其在细胞膜上扩散难易程度,研究证实,HS引起细胞膜去极化和膜电阻的变化,以及膜结构的重排[15]。因此,HS亲水疏水平衡是影响其分子结构的重要因素之一,而且其与HS生理活性的相关性受到外界环境pH的影响。
4 结论与展望 4.1 结论HS是土壤中稳定的胶体分散系统,稳定性是由其结构单元分解和合成的动态平衡来决定,受环境因素的调控。HS超分子结构是目前被普遍接受的结构模型。综合国内外相关研究进展,对HS生理活性及其作用机制总结如下:
(1) HS可通过促进根毛形成和侧根发育、激活H+-ATPase产生有利的电化学梯度以及自身酸性官能团的螯合作用等促进植物对矿质元素的吸收利用。
(2) HS具有类激素活性,植物根际促生细菌(PGPR)分泌物或HS自体组分IAA能够激活细胞质膜H+-ATPase,HS还能够增加内源植物激素水平,促进植物生长发育。
(3) HS通过介导信使NO激活质膜H+-ATPase,清除HS与细胞作用产生的活性氧(ROS),HS通过NO和抗氧化酶调节细胞内ROS稳态,介导根系发育和形态结构。
(4) HS生理活性与化学组成密切相关,其中官能团—COOH和Ar—OH活性位点的作用、醌基的电子传递以及HS亲水疏水平衡是影响HS生理活性的重要因素。
4.2 展望(1) 鉴于HS生物化学研究的复杂性以及生理活性研究中存在的诸多问题,未来的研究工作重点是采用现代分析技术研究HS分子结构,探究HS形成途径和稳定机制,明确不同HS组分具备生理活性的“共性结构原件”,探索“共性结构原件”生理活性作用机制。
(2) HS通过IAA和NO等信使分子介导细胞内多条信号传导途径,其中防御信号传导途径与促生作用发生交叉反馈的调节机制、HS介导ROS稳态机制以及微生物介导的醌基参与细胞质膜内外电子传递等机制仍需进一步研究。
(3) 未来可借助基因组学、蛋白质组学和代谢组学技术,明确HS对细胞内物质和能量代谢相关基因表达的调节机制,通过代谢轮廓对比和相关代谢通路关键代谢产物的定性和定量分析,明确关键代谢产物变化规律,为HS生理活性机制的深入研究及农业应用提供理论参考。
| [1] |
Trevisan S, Francioso O, Quaggiotti S, et al. Humic substances biological activity at the plant-soil interface[J]. Plant Signaling & Behavior, 2010, 5(6): 635-643. |
| [2] |
Hedges J I, Oades J M. Comparative organic geochemistries of soils and marine sediments[J]. Organic Geochemistry, 1997, 27(7/8): 319-361. |
| [3] |
Li H, Li Y K, Zou S X, et al. Extracting humic acids from digested sludge by alkaline treatment and ultrafltration[J]. Journal of Material Cycles and Waste Management, 2014, 16(1): 93-100. DOI:10.1007/s10163-013-0153-6 |
| [4] |
Grinhut T, Hadar Y, Chen Y. Degradation and transformation of humic substances by saprotrophic fungi: Processes and mechanisms[J]. Fungal Biology Reviews, 2007, 21: 179-189. DOI:10.1016/j.fbr.2007.09.003 |
| [5] |
Shah Z H, Rehman H M, Akhtar T, et al. Humic substances: Determining potential molecular regulatory processes in plants[J]. Frontiers in Plant Science, 2018, 9: 263. DOI:10.3389/fpls.2018.00263 |
| [6] |
窦森, 李艳, 关松, 等. 腐殖物质特异性及其产生机制[J]. 土壤学报, 2016, 53(4): 821-831. DOU Sen, LI Yan, GUAN Song, et al. The structural distinctiveness of humic substances and its formation mechanism in simulated incubation[J]. Acta Pedologica Sinica, 2016, 53(4): 821-831. |
| [7] |
Pinton R, Cesco S, Varanini Z. Role of humic substances on the rhizosphere[M]//Senesi N, Xing B S, Huang D M. Biophysico-chemical processes involving natural nonliving organic matter in environmental systems. Hoboken: John Wiley & Sons, Inc., 2009: 341-366.
|
| [8] |
Orsi M. Molecular dynamics simulation of humic substances[J]. Chemical and Biological Technologies in Agriculture, 2014, 1(10): 1-14. DOI:10.1186/s40538-014-0010-4 |
| [9] |
Savy D, Nebbioso A, Mazzei P, et al. Molecular composition of watersoluble lignins separated from different non-food biomasses[J]. Fuel Processing Technology, 2015, 131: 175-181. DOI:10.1016/j.fuproc.2014.11.011 |
| [10] |
Savy D, Cozzolino V, Nebbioso A, et al. Humic-like bioactivity on emergence and early growth of maize(Zea mays L.) of water-soluble lignins isolated from biomass for energy[J]. Plant and Soil, 2016, 402: 221-233. DOI:10.1007/s11104-015-2780-2 |
| [11] |
Stevenson F J. Humus chemistry[M]. New York: John Wiley & Sons, Inc., 1982: 443.
|
| [12] |
Orlov D S, Kulakov V V, Nikiforov V J, et al. Humic substances from ashed brown coal of Moscow coal basin[C]. Humic Substances in Biosphere, Moscow: Nauka, 1993: 189-207.
|
| [13] |
Popov A I, Zenekov V N, Teplyakova T V. Biological activity and biochemistry of humic substances. Part 1. Biochemical aspect(a review)[J]. Bulletin of Russian Academy of Naturalsciences, 2016(1): 11-17. |
| [14] |
Dmitrieva E D, Goryacheva A A, Perelomov L V, et al. Sorption abilities of humic substances from different origin peats in Tula region to Pb (Ⅱ)[J]. Tula State University (Natural Sciences), 2015(4): 205-219. |
| [15] |
Nardi S, Ertani A, Francioso O. Soil-root cross-talking: The role of humic substances[J]. Journal of Plant Nutrition and Soil Science, 2017, 180(1): 5-13. DOI:10.1002/jpln.201600348 |
| [16] |
Piccolo A, Conte P, Spaccini R, et al. Effects of some dicarboxylic acids on the association of dissolved humic substances[J]. Biology and Fertility of Soils, 2003, 37: 255-259. DOI:10.1007/s00374-003-0583-8 |
| [17] |
Perminova I V, Frimmel F H, Kudryvtsev A V, et al. Molecular weight characteristics of humic substances from different environments as determined by size exclusion chromatography and their statistical evaluation[J]. Environmental Science & Technology, 2003, 37(11): 2477-2485. |
| [18] |
Cao X Y, Schmidt-Rohr K. Abundant nonprotonated aromatic and oxygen-bonded carbons make humic substances distinct from biopolymers[J]. Environmental Science & Technology, 2018, 5(8): 476-480. |
| [19] |
Piccolo A, Spaccini R, Savy D, et al. The soil humeome: Chemical structure, functions and technological perspectives[M/OL]//Sustainable Agrochemistry, 2019: 183-222.
|
| [20] |
Buurman P, Lagen B V, Piccolo A. Increase in stability against thermal oxidation of soil humic substances as a result of self-association[J]. Organic Geochemistry, 2002, 33(3): 367-381. DOI:10.1016/S0146-6380(01)00167-X |
| [21] |
Siéliéchi J M, Lartiges B S, Kayem G J, et al. Changes in humic acid conformation during coagulation with ferric chloride: Implications for drinking water treatment[J]. Water Research, 2008, 42(8/9): 2111-2123. |
| [22] |
Nuzzo A, Piccolo A. Oxidative and photo-oxidative polymerization of humic suprastructures by heterogeneous biomimetic catalysis[J]. Biomacromolecules, 2013, 14(5): 1645-1652. DOI:10.1021/bm400300m |
| [23] |
Piccolo A. The supramolecular structure of humic substances[J]. Soil Science, 2001, 166(11): 810-832. DOI:10.1097/00010694-200111000-00007 |
| [24] |
Piccolo A. The supramolecular structure of humic substances: A novel understanding of humus chemistry and implications in soil science[J]. Advances in Agronomy, 2002, 75: 57-134. |
| [25] |
Olaetxea M, Mora V, Bacaicoa E, et al. Root ABA and H+-ATPase are key players in the root and shoot growth-promoting action of humic acids[J]. Plant Direct, 2019, 3(10): e00175. |
| [26] |
Łominska D. Humic substances as by-product precursors generated during oxidation and disinfection-review of the literature[J]. Czasopismo Techniczne, 2016, 11: 73-85. |
| [27] |
Cook R L, Langford C H. Structural characterization of a fulvic acid and a humic acid using solid-state Ramp-CP-MAS 13C nuclear magnetic resonance[J]. Environmental Science & Technology, 1998, 32(5): 719-725. |
| [28] |
Pereira M M A, Morais L C, Marques E A, et al. Humic substances and efficient microorganisms: Elicitation of medicinal plants: A review[J]. Journal of Agricultural Science, 2019, 11(7): 268-280. DOI:10.5539/jas.v11n7p268 |
| [29] |
Hayes M H B, Swift R S. An appreciation of the contribution of Frank Stevenson to the advancement of studies of soil organic matter and humic substances[J]. Journal of Soils and Sediments, 2018, 18: 1212-1231. DOI:10.1007/s11368-016-1636-6 |
| [30] |
Lamar R T. Possible role for electron shuttling capacity in elicitation of plant biostimulant activity of humic substances on plant growth enhancement[M]//Geelen D, Xu L. The Chemical Biology of Plant Biostimulants. Hobken: John Wiley & Sons, Inc., 2020: 97-121.
|
| [31] |
Golubkov V A, Vorozhtsov E P, Bortnikov S V. The use of coal a source of humic acids[J]. International Journal of Humanities and Natural Sciences, 2020, 40(11): 196-200. |
| [32] |
Kleber M, Lehmann J. Humic substances extracted by alkali are invalid proxies for the dynamics and functions of organic matter in terrestrial and aquatic ecosystems[J]. Journal of Environmental Quality, 2019, 48(2): 207-216. DOI:10.2134/jeq2019.01.0036 |
| [33] |
Dou S, Shan J, Song X Y, et al. Are humic substances soil microbial residues or unique synthesized compounds? A perspective on their distinctiveness[J]. Pedosphere, 2020, 30(2): 159-167. DOI:10.1016/S1002-0160(20)60001-7 |
| [34] |
Kononova M M. Soil organic matter: Its nature, its role in soil formation and in soil fertility[M]. New York: Pergamon Press, 1961: 450.
|
| [35] |
Filho J F D C L, Thomason W, Evanylo G K, et al. The synergistic effects of humic substances and biofertilizers on plant development and microbial activity: A review[J]. International Journal of Plant & Soil Science, 2020, 32(7): 56-75. |
| [36] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16069 |
| [37] |
Lipczynska-Kochany E. Humic substances, their microbial interactions and effects on biological transformations of organic pollutants in water and soil: A review[J]. Chemosphere, 2018, 202: 420-437. DOI:10.1016/j.chemosphere.2018.03.104 |
| [38] |
Chukov S N. Formation and role of humic substances in the biosphere[J]. Theoretical Problems of Ecology, 2015, 1: 8-12. |
| [39] |
Maji D, Misra P, Singh S, et al. Humic acid rich vermicompost promotes plant growth by improving microbial community structure of soil as well as root nodulation and mycorrhizal colonization in the roots of Pisum sativum[J]. Applied Soil Ecology, 2017, 110: 97-108. DOI:10.1016/j.apsoil.2016.10.008 |
| [40] |
Kobierski M, Kondratowicz-Maciejewska K, Banach-Szott M, et al. Humic substances and aggregate stability in rhizospheric and non-rhizospheric soil[J]. Journal of Soils and Sediments, 2018, 18(8): 2777-2789. DOI:10.1007/s11368-018-1935-1 |
| [41] |
Spaccini R, Cozzolino V, Di Meo V, et al. Bioactivity of humic substances and water extracts from compost made by ligno-cellulose wastes from biorefinery[J]. Science of the Total Environment, 2019, 646: 792-800. DOI:10.1016/j.scitotenv.2018.07.334 |
| [42] |
Qian S, Ding W M, Li Y C, et al. Characterization of humic acids derived from leonardite using a solid-state NMR spectroscopy and effects of humic acids on growth and nutrient uptake of snap bean[J]. Chemical Speciation & Bioavailability, 2015, 27(4): 156-161. |
| [43] |
David J, Šmejkalová D, Hudecová Š, et al. The physico-chemical properties and biostimulative activities of humic substances regenerated from lignite[J]. Springerplus, 2014, 3: 156. DOI:10.1186/2193-1801-3-156 |
| [44] |
Belopukhov S, Dmitrevskaya I, Grishina E, et al. Effects of humic substances obtained from shives on flax yield characteristics[J]. Journal of Natural Fibers, 2017, 14(1): 126-133. DOI:10.1080/15440478.2016.1167648 |
| [45] |
Rose M T, Patti A F, Little K R, et al. A meta-analysis and review of plant-growth response to humic substances: Practical implications for agriculture[J]. Advances in Agronomy, 2014, 124: 37-89. |
| [46] |
Pizzeghello D, Francioso O, Ertani A, et al. Isopentenyladenosine and cytokinin-like activity of different humic substances[J]. Journal of Geochemical Exploration, 2013, 129: 70-75. DOI:10.1016/j.gexplo.2012.10.007 |
| [47] |
Tanase C, Boz I, Stingu A, et al. Physiological and biochemical responses induced by spruce bark aqueous extract and deuterium depleted water with synergistic action in sunflower(Helianthus annuus L.) plants[J]. Industrial Crops and Products, 2014, 60: 160-167. DOI:10.1016/j.indcrop.2014.05.039 |
| [48] |
Zandonadi D B, Santos M P, Caixeta L S, et al. Plant proton pumps as markers of biostimulant action[J]. Scientia Agricola, 2016, 73(1): 24-28. DOI:10.1590/0103-9016-2015-0076 |
| [49] |
Clapp C E, Chen Y, Hayes M H B, et al. Plant growth promoting activity of humic substances[C]. St. Paul: International Humic Science Society, 2001: 243-255.
|
| [50] |
Khaled H, Fawy H A. Effect of different levels of humic acids on the nutrient content, plant growth, and soil properties under conditions of salinity[J]. Soil and Water Research, 2011, 6(1): 21-29. DOI:10.17221/4/2010-SWR |
| [51] |
Danyaei A, Hassanpour S, Baghaee M A, et al. The effect of sulfurcontaining humic acid on yield and nutrient uptake in olive fruit[J]. Open Journal of Ecology, 2017(7): 279-288. |
| [52] |
Clapp C, Chen Y, Magen H. Stimulation of plant growth by humic substances: Effects on iron availability[C]. Cambridge: Royal Society of Chemistry, 1999: 255-263.
|
| [53] |
Canellas L P, Olivares F L, Aguiar N O, et al. Humic and fulvic acids as biostimulants in horticulture[J]. Scientia Horticulturae, 2015, 196: 15-27. DOI:10.1016/j.scienta.2015.09.013 |
| [54] |
Baldotto L E B, Baldotto M A, Giro V B, et al. Performance of 'Vitória' pineapple in response to humic acid application during acclimatization[J]. Revista Brasileira de Ciência do Solo, 2009, 33(4): 979-990. DOI:10.1590/S0100-06832009000400022 |
| [55] |
Chen Y, Nobili M, Aviad T. Stimulatory effects of humic substances on plant growth[M]. Florida: Boca Raton CRC Press, 2004: 103-129.
|
| [56] |
Marino G, Francioso O, Carletti P, et al. Mineral content and root respiration of in vitro grown kiwifruit plantlets treated with two humic fractions[J]. Journal of Plant Nutrition, 2008, 31(6): 1074-1090. DOI:10.1080/01904160802115276 |
| [57] |
Kim D, Park H J, Kim J H, et al. Passive warming effect on soil microbial community and humic substance degradation in maritime Antarctic region[J]. Journal of Basic Microbioology, 2018, 58(6): 513-522. DOI:10.1002/jobm.201700470 |
| [58] |
Hita D D, Fuentes M, Zamarreño A M, et al. Culturable bacterial endophytes from sedimentary humic acid-teated plants[J]. Frontiers in Plant Science, 2020, 11: 1-12. DOI:10.3389/fpls.2020.00001 |
| [59] |
Vaccaro S, Ertani A, Nebbioso A, et al. Humic substances stimulate maize nitrogen assimilation and amino acid metabolism at physiological and molecular level[J]. Chemical and Biological Technologies in Agriculture, 2015, 2(1): 1-12. DOI:10.1186/s40538-014-0028-7 |
| [60] |
Quaggiotti S, Ruperti B, Pizzeghello D, et al. Effect of low molecular size humic substances on nitrate uptake and expression of genes involved in nitrate transport in maize(Zea mays L.)[J]. Journal of Experimental Botany, 2004, 55(398): 803-813. DOI:10.1093/jxb/erh085 |
| [61] |
Tavares O C H, Santos L A, Ferreira L M, et al. Humic acid differentially improves nitrate kinetics under low- and high-affinity systems and alters the expression of plasma membrane H+-ATPases and nitrate transporters in rice[J]. Annals of Applied Biology, 2017, 170(1): 89-103. DOI:10.1111/aab.12317 |
| [62] |
Miller A, Smith S. Nitrate transport and compartmentation in cereal root cells[J]. Journal of Experimental Botany, 1996, 47(7): 843-854. DOI:10.1093/jxb/47.7.843 |
| [63] |
Nardi S, Pizzeghello D, Gessa C, et al. A low molecular weight humic fraction on nitrate uptake and protein synthesis in maize seedlings[J]. Soil Biology & Biochemistry, 2000, 32(3): 415-419. |
| [64] |
Urrutia O, Erro J, Guardado I, et al. Physico-chemical characterization of humic-metal-phosphate complexes and their potential application to the manufacture of new types of phosphate-based fertilizers[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(2): 128-136. DOI:10.1002/jpln.201200651 |
| [65] |
Urrutia O, Guardado I, Erro J, et al. Theoretical chemical characterization of phosphate-metal-humic complexes and relationships with their effects on both phosphorus soil fixation and phosphorus availability for plants[J]. Journal of the Science of Food and Agriculture, 2013, 93(2): 293-303. DOI:10.1002/jsfa.5756 |
| [66] |
Gerke J. Concepts and misconceptions of humic substances as the stable part of soil organic matter: A review[J]. Agronomy, 2018, 8(5): 76. DOI:10.3390/agronomy8050076 |
| [67] |
Gerke J. Humic(organic matter)-Al(Fe)-phosphate complexes: An underestimated phosphate form in soils and source of plant-available phosphate[J]. Soil Science, 2010, 175(9): 417-425. DOI:10.1097/SS.0b013e3181f1b4dd |
| [68] |
Aguirre E, Lemenager D, Bacaicoa E, et al. The root application of a purified leonardite humic acid modifies the transcriptional regulation of the main physiological root responses to Fe deficiency in Fe-sufficient cucumber plants[J]. Plant Physiology and Biochemistry, 2009, 47(3): 215-223. DOI:10.1016/j.plaphy.2008.11.013 |
| [69] |
Fuentes M, Olaetxea M, Baigorri R, et al. Main binding sites involved in Fe(Ⅲ) and Cu(Ⅱ) complexation in humic-based structures[J]. Journal of Geochemical Exploration, 2013, 129: 14-17. DOI:10.1016/j.gexplo.2012.12.015 |
| [70] |
Jia W L, Wang C P, Ma C X, et al. Element uptake and physiological responses of Lactuca sativa upon co-exposures to tourmaline and dissolved humic acids[J]. Environmental Science and Pollution Research, 2018, 25(16): 15998-16008. DOI:10.1007/s11356-018-1751-6 |
| [71] |
Jindo K, Martim S A, Navarro E C, et al. Root growth promotion by humic acids from composted and non-composted urban organic wastes[J]. Plant and Soil, 2012, 353: 209-220. DOI:10.1007/s11104-011-1024-3 |
| [72] |
Zandonadi D B, Canellas L P, Façanha A R. Indolacetic and humic acids induce lateral root development through a concerted plasmalemma and tonoplast H+ pumps activation[J]. Planta, 2007, 225(6): 1583-1595. DOI:10.1007/s00425-006-0454-2 |
| [73] |
Trevisan S, Pizzeghello D, Ruperti B, et al. Humic substances induce lateral root formation and expression of the early auxin-responsive IAA19 gene and DR5 synthetic element in Arabidopsis[J]. Plant Biology, 2010, 12(4): 604-614. |
| [74] |
Canellas L P, Dantas D J, Aguiar N O, et al. Probing the hormonal activity of fractionated molecular humic components in tomato auxin mutants[J]. Annals of Applied Biology, 2011, 159(2): 202-211. DOI:10.1111/j.1744-7348.2011.00487.x |
| [75] |
Berbara R L L, García A C. Humic substances and plant defense metabolism[M]. New York: Springer, 2014: 297-319.
|
| [76] |
Zandonadi D B, Santos M P, Dobbss L B, et al. Nitric oxide mediates humic acids-induced root development and plasma membrane H+-ATPase activation[J]. Planta, 2010, 231(5): 1025-1036. DOI:10.1007/s00425-010-1106-0 |
| [77] |
Canellas L P, Olivares F L. Physiological responses to humic substances as plant growth promoter[J]. Chemical and Biological Technologies in Agriculture, 2014, 1(1): 1-11. DOI:10.1186/2196-5641-1-1 |
| [78] |
Olaetxea M, Mora V, Bacaicoa E, et al. Abscisic acid regulation of root hydraulic conductivity and aquaporin gene expression is crucial to the plant shoot growth enhancement caused by rhizosphere humic acids[J]. Plant Physiology, 2015, 169(4): 2587-2596. |
| [79] |
Canellas L P, Olivares F L, Okorokova-Facanha A L, et al. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence, and plasma membrane H+-ATPase activity in maize roots[J]. Plant Physiology, 2002, 130(4): 1951-1957. DOI:10.1104/pp.007088 |
| [80] |
Elmongy M S, Zhou H, Cao Y, et al. The effect of humic acid on endogenous hormone levels and antioxidant enzyme activity during in vitro rooting of evergreen azalea[J]. Scientia Horticulturae, 2018, 227: 234-243. DOI:10.1016/j.scienta.2017.09.027 |
| [81] |
García A C, Santos L A, Souza De L G A, et al. Vermicompost humic acids modulate the accumulation and metabolism of ROS in rice plants[J]. Journal of Plant Physiology, 2016, 192: 56-63. DOI:10.1016/j.jplph.2016.01.008 |
| [82] |
Muscolo A, Sidari M, Nardi S. Humic substance: Relationship between structure and activity[J]. Journal of Geochemical Exploration, 2013, 129: 57-63. DOI:10.1016/j.gexplo.2012.10.012 |
| [83] |
Trevisan S, Botton A, Vaccaro S, et al. Humic substances affect Arabidopsis physiology by altering the expression of genes involved in primary metabolism, growth and development[J]. Environmental and Experimental Botany, 2011, 74: 45-55. DOI:10.1016/j.envexpbot.2011.04.017 |
| [84] |
Canellas L P, Balmori D M, Médici L O, et al. A combination of humic substances and Herbaspirillum seropedicae inoculation enhances the growth of maize (Zea mays L.)[J]. Plant and Soil, 2013, 366(1/2): 119-132. DOI:10.1007/s11104-012-1382-5 |
| [85] |
Nardi S, Muscolo A, Vaccaro S, et al. Relationship between molecular characteristics of soil humic fractions and glycolytic pathway and krebs cycle in maize seedlings[J]. Soil Biology and Biochemistry, 2007, 39(12): 3138-3146. DOI:10.1016/j.soilbio.2007.07.006 |
| [86] |
Tahiri A, Delporte F, Muhovski Y, et al. Change in ATP-binding cassette B1/19, glutamine synthetase and alcohol dehydrogenase gene expression during root elongation in Betula pendula Roth and Alnus glutinosa L. Gaertn in response to leachate and leonardite humic substances[J]. Plant Physiology and Biochemistry, 2016, 98: 25-38. DOI:10.1016/j.plaphy.2015.11.004 |
| [87] |
Lamattina L, Garcia-Mata C, Graziano M, et al. Nitric oxide: The versatility of an extensive signal molecule[J]. Annual Review of Plant Biology, 2003, 54: 109-136. DOI:10.1146/annurev.arplant.54.031902.134752 |
| [88] |
Bezuglova O S, Polienko E A, Gorovtsov A V, et al. The effect of humic substances on winter wheat yield and fertility of ordinary chernozem[J]. Annals of Agrarian Science, 2017, 15(2): 239-242. DOI:10.1016/j.aasci.2017.05.006 |
| [89] |
Giannattasio M, Vendramin E, Fornasier F, et al. Microbiological features and bioactivity of a fermented manure product(Preparation 500) used in biodynamic agriculture[J]. Journal of Microbiology and Biotechnology, 2013, 23(5): 644-651. DOI:10.4014/jmb.1212.12004 |
| [90] |
张艳艳, 章文华, 薛丽, 等. 一氧化氮在植物生长发育和抗逆过程中的作用研究进展[J]. 西北植物学报, 2012, 32(4): 835-842. ZHANG Yan-yan, ZHANG Wen-hua, XUE Li, et al. Advance on NO function in plant growth, develoment and abiotic stress tolerance[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(4): 835-842. DOI:10.3969/j.issn.1000-4025.2012.04.032 |
| [91] |
Cordeiro F C, Santa-Catarina C, Silveira V, et al. Humic acid-induced hairy root growth in basil ismodulated by nitric oxide and reactive oxygen species[J]. American Journal of Plant Sciences, 2017, 8(12): 3140-3161. DOI:10.4236/ajps.2017.812212 |
| [92] |
Aydin A, Kant C, Turan M. Humic acid application alleviates salinity stress of bean(Phaseolus vulgaris L.) plants decreasing membrane leakage[J]. African Journal of Agricultural Research, 2012, 7(7): 1073-1086. |
| [93] |
Lombardo M C, Lamattina L. Nitric oxide is essential for vesicle formation and trafficking in Arabidopsis root hair growth[J]. Journal of Experimental Botany, 2012, 63(13): 4875-4885. DOI:10.1093/jxb/ers166 |
| [94] |
Mora V, Baigorri R, Bacaicoa E, et al. The humic acid-induced changes in the root concentration of nitric oxide, IAA and ethylene do not explain the changes in root architecture caused by humic acid in cucumber[J]. Environmental and Experimental Botany, 2012, 76: 24-32. DOI:10.1016/j.envexpbot.2011.10.001 |
| [95] |
García A C, Olaetxea M, Santos L A, et al. Involvement of hormoneand ROS-signaling pathways in the beneficial action of humic substances on plants growing under normal and stressing conditions[J]. BioMed Research International, 2016, Special issue: 3747501. |
| [96] |
Siddiqui M H, Al-Whaibi M H, Basalah M O. Role of nitric oxide in tolerance of plants to abiotic stress[J]. Protoplasma, 2011, 248: 447-455. DOI:10.1007/s00709-010-0206-9 |
| [97] |
Hita D D, Fuentes M, Fernández V, et al. Discriminating the shortterm action of root and foliar application of humic acids on plant growth: Emerging role of jasmonic acid[J]. Frontiers in Plant Science, 2020, 11: 493. DOI:10.3389/fpls.2020.00493 |
| [98] |
García A C, Santos L A, Izquierdo F G, et al. Potentialities of vermicompost humic acids to alleviate water stress in rice plants(Oryza sativa L.)[J]. Journal of Geochemical Exploration, 2014, 136: 48-54. DOI:10.1016/j.gexplo.2013.10.005 |
| [99] |
Olaetxea M, Mora V, García A C, et al. Root-shoot signaling crosstalk involved in the shoot growth promoting action of rhizospheric humic acids[J]. Plant Signaling & Behavior, 2016, 11(4): e1161878. |
| [100] |
Olaetxea M, Hita D D, Garcia C A, et al. Hypothetical framework integrating the main mechanisms involved in the promoting action of rhizospheric humic substances on plant root- and shoot-growth[J]. Applied Soil Ecology, 2018, 123: 521-537. DOI:10.1016/j.apsoil.2017.06.007 |
| [101] |
Oosten Van M J, Pepe O, Pascale De S, et al. The role of biostimulants and bioeffectors as alleviators of abiotic stress in crop plants[J]. Chemical and Biological Technologies in Agriculture, 2017, 4(1): 1-12. DOI:10.1186/s40538-016-0083-3 |
| [102] |
Mora V, Bacaicoa E, Baigorri R, et al. NO and IAA key regulators in the shoot growth promoting action of humic acid in Cucumis sativus L.[J]. Journal of Plant Growth Regulation, 2014, 33(2): 430-439. DOI:10.1007/s00344-013-9394-9 |
| [103] |
Vaughan D, Ord B G. Uptake and incorporation of 14C-labelled soil organic matter by roots of Pisum sativum L.[J]. Journal of Experimental Botany, 1981, 32(129): 679-687. |
| [104] |
Hose E, Steudle E, Hartung W. Abscisic acid and hydraulic conductivity of maize roots: A study using cell- and root-pressure probes[J]. Planta, 2000, 211(6): 874-882. DOI:10.1007/s004250000412 |
| [105] |
García A C, Souza De L G A, Pereira M G, et al. Structure-propertyfunction relationship in humic substances to explain the biological activity in plants[J]. Scientific Reports, 2016, 6: 20798. DOI:10.1038/srep20798 |
| [106] |
Aguiar N O, Novotny E H, Oliveira A L, et al. Prediction of humic acids bioactivity using spectroscopy and multivariate analysis[J]. Journal of Geochemical Exploration, 2013, 129: 95-102. DOI:10.1016/j.gexplo.2012.10.005 |
| [107] |
Traversa A, Loffredo E, Gattullo C E, et al. Comparative evaluation of compost humic acids and their effects on the germination of switchgrass(Panicum vigatum L.)[J]. Journal of Soils and Sediments, 2014, 14(2): 432-440. DOI:10.1007/s11368-013-0653-y |
| [108] |
Muscolo A, Sidari M, Francioso O, et al. The auxin-like activity of humic substances is related to membrane interactions in carrot cell cultures[J]. Journal of Chemical Ecology, 2007, 33(1): 115-129. |
| [109] |
Scaglia B, Nunes R R, Rezende M O O, et al. Investigating organic molecules responsible of auxin-like activity of humic acid fraction extracted from vermicompost[J]. Science of the Total Environment, 2016, 562: 289-295. DOI:10.1016/j.scitotenv.2016.03.212 |
| [110] |
Dobbss L B, Canellas L P, Olivares F L, et al. Bioactivity of chemically transformed humic matter from vermicompost on plant root growth[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3681-3688. DOI:10.1021/jf904385c |
| [111] |
Vaccaro S, Muscolo A, Pizzeghello D, et al. Effect of a compost and its water-soluble fractions on key enzymes of nitrogen metabolism in maize seedlings[J]. Journal of Agricultural and Food Chemistry, 2009, 57(23): 11267-11276. DOI:10.1021/jf901808s |
| [112] |
García A C, Tavares O C H, Balmori D M, et al. Structure-function relationship of vermicompost humic fractions for use in agriculture[J]. Journal of Soils and Sediments, 2018, 18(4): 1365-1375. DOI:10.1007/s11368-016-1521-3 |
| [113] |
王亚军, 马军. 水体环境中天然有机质腐植酸研究进展[J]. 生态环境学报, 2012, 21(6): 1155-1165. WANG Ya-jun, MA Jun. Reseach advances of humic acid in aquatic environments[J]. Ecology and Environmental Sciences, 2012, 21(6): 1155-1165. |
| [114] |
楼涛, 汪学军, 何昆鹏, 等. 腐殖质的光化学降解及其对环境污染物环境行为的影响[J]. 生态环境学报, 2014, 23(4): 716-720. LOU Tao, WANG Xue-Jun, HE Kun-Peng, et al. Photodegradation of humic substance and its effects on the environmental pollutant behavior[J]. Ecology and Environmental Sciences, 2014, 23(4): 716-720. DOI:10.3969/j.issn.1674-5906.2014.04.028 |
| [115] |
Muscolo A, Sidari M, Attinà E, et al. Biological activity of humic substances is related to their chemical structure[J]. Soil Science Society of America Journal, 2009, 71(1): 75-85. |
| [116] |
Filatova A I, Mamontov V G, Panova P Y. Molecular weight composition of humic acids in urban soils(the Northern Administarative District of Moscow City taken as an example)[J]. Bulletin of V V Dokuchaev Soil Science Institute, 2019, 97: 113-128. |
| [117] |
Ikeya K, Sleighter R L, Hatcher P G, et al. Characterization of the chemical composition of soil humic acids using Fourier transform ion cyclotron resonance mass spectrometry[J]. Geochimica et Cosmochimica Acta, 2015, 153: 169-182. DOI:10.1016/j.gca.2015.01.002 |
| [118] |
Guo D, Ren C Y, Ali A, et al. A phytoextraction trial strengthened by Streptomyces pactum and plant nutrients: In view of plant bioindicators and phytoextraction indices[J]. Environmental Pollution, 2020, 265: 114867. DOI:10.1016/j.envpol.2020.114867 |
| [119] |
Melo De B A G, Motta F L, Santana M H A. Humic acids: Structural properties and multiple functionalities for novel technological developments[J]. Materials Science and Engineering: C, 2016, 62: 967-974. DOI:10.1016/j.msec.2015.12.001 |
| [120] |
李丽, 檀文炳, 王国安, 等. 腐殖质电子传递机制及其环境效应研究进展[J]. 环境化学, 2016, 35(2): 254-266. LI Li, TAN Wenbing, WANG Guo-an, et al. Electron transfer mechanisms of humic substances and their environmental implications: A review[J]. Environmental Chemistry, 2016, 35(2): 254-266. |
| [121] |
Scott D T, Mcknight D M, Blunt-Harris E L, et al. Quinone moieties act as electron acceptors in the reduction of humic substances by humicsreducing microorganisms[J]. Environmental Science & Technology, 1998, 32(19): 2984-2989. |
| [122] |
Aeschbacher M, Graf C, Schwarzenbach R P, et al. Antioxidant properties of humic substances[J]. Environmental Science & Technology, 2012, 46(9): 4916-4925. |
 2021, Vol. 38
2021, Vol. 38