2. 江西省农业生态与资源保护站, 南昌 330046
2. Jiangxi Agricultural Ecology and Resource Protection Station, Nanchang 330046, China
生猪养殖是我国畜禽养殖业的重要组成部分,保障了国内肉制品的稳定供应,但也产生了大量养殖废弃物。据2016年统计数据显示,我国每年约产生不少于10亿t的生猪养殖粪污,需要进行无害化处理和资源化利用。由于生猪粪便中易降解有机物的含量高,具有较高的产气潜力[1],因此,长期以来一直是我国沼气工程发酵原料的首选。
目前,我国大型沼气工程多采用以高浓度有机废弃物联合消化为特点的CSTR工艺,发酵罐内加装搅拌系统,并配备热电联产系统,发酵原料的进料浓度需达到6%~12%[2]。由于传统收集方式(如水冲粪、水泡粪等)获得的粪污的固形物(TS)浓度较低(3%~ 4%),沼气工程未能充分利用,产气率低、经济效益差。而近年来,随着猪舍节水、用水设施改造和粪污收集方式升级,生猪养殖粪污的TS浓度有明显提高,满足了沼气工程对高浓度进料的需求。但相关研究[3-6]发现,猪粪单独进行厌氧发酵虽然可以获得较佳的产气效率,但容易形成游离氨的累积,抑制产甲烷菌的活性并降低甲烷产率,尤其是在进料TS浓度提升时,游离氨对甲烷的抑制效果越发明显。丁福贵等[7]采用不同进料TS浓度(TS=4%~14%)的猪粪开展厌氧发酵产沼气试验,发现TS浓度在8%时的中温连续厌氧产气效果最佳;在超过8% 时,沼气产量和COD去除率出现不同程度的下降。勒系意等[8]在水力停留时间(Hydraulic retention time,HRT)为30 d的条件下,开展了猪粪的进料负荷梯度提升试验(TS= 4.6%~12.1%),研究发现猪粪的日产甲烷量随进料浓度提升而增加;但进料TS浓度超过9.6% 后,猪粪的甲烷产率因游离氨的抑制出现明显下降。此外,也有研究发现猪粪发酵会出现酸累积风险,常华等[9]研究不同进料TS浓度(4%~12%)对猪粪中温连续厌氧发酵的影响,试验结果表明TS浓度为6% 时,其发酵系统稳定、产气性能最好;当进料TS浓度超过6%后,发酵系统因丁酸和乙酸累积出现酸化风险。
为规避猪粪高浓度进料引发的发酵失稳、挖掘沼气工程的运营潜力,研究人员引入高含碳的农作物秸秆与猪粪进行混配,通过筛选原料组合及优化配比来实现更高的进料浓度和沼气产率。陈广银等[10]在挥发性固形物(Volatile solids,VS)负荷5% 的批次发酵试验中,比较了稻草与猪粪的VS配比为1∶1、3∶1和1∶3的产气量,发现VS=3∶1的处理日产气量比较稳定,累积产气量达12 080 mL,较稻草与猪粪VS配比为1∶1和1∶3的处理分别高11.8% 和16.8%。石利军等[11]在猪粪与稻草混合发酵原料C/N=25~30、TS= 20%、(36±1)℃的条件下进行干式发酵,发酵仅持续了一周,发酵过程可能受到了氨氮的抑制。Shen等[12]考察了有机负荷对预处理的稻草与猪粪共发酵的影响,发现有机负荷在0.4~2.5 kg COD·m-3·d-1时发酵过程稳定。Darwin等[13]报道不同TS浓度(2%~4%)对稻草与猪粪水的产甲烷量的影响,发现TS=3%的稻草,C/N=10.6∶1时,具有最高的甲烷产量,达到(141.4± 3.70)mL·g-1 VS。Li等[14]在恒定HRT为19 d的条件下开展了猪粪混合稻秆(VS配比为1∶1)的连续产气试验,研究发现容积产气率随进料浓度提升而不断增加,且沼气产率相对稳定。综上所述,混合原料发酵较单一原料可以承受更高的有机负荷,合适的进料浓度和配比可以提高发酵效率,同时防止抑制的发生。然而上述研究多为批次发酵试验,未系统研究进料浓度对混合发酵的稳定运行机制,尤其是涉及进料浓度提升对猪粪混合稻秆的连续厌氧发酵特性研究更为缺乏,对沼气工程周年稳定运行的技术支撑有限。
为此,本研究选择我国存储量大、易规模化收集的稻秆与猪粪进行发酵原料的组配,通过批次发酵试验摸清猪粪与稻秆的原料配比规律;然后选择不同配比进行连续厌氧发酵试验,在进料浓度梯度提升(TS= 4.6%~12.1%)的条件下,研究发酵系统的甲烷产率(Specific methane production,SMP)、容积产甲烷率(Volumetric methane production rate,VMPR)以及发酵过程监测指标pH值、氨氮(Ammonia nitrogen,NH4+-N)浓度、小分子挥发酸(Volatile fatty acids,VFAs)浓度、碳酸氢盐碱度(Total inorganic carbonate,TIC)和VFAs/TIC值的变化趋势,分析其连续厌氧产甲烷特性,以期为猪粪混合稻秆厌氧发酵工艺的工程应用提供理论依据和技术支撑。
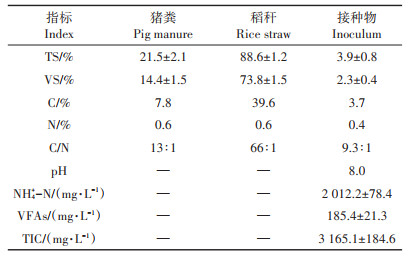
1 材料与方法 1.1 发酵原料与接种物新鲜猪粪取自江西省农业科学院畜牧兽医研究所猪场,经简单剔除动物毛发和大块石子等杂物后置于4 ℃冰柜保存备用;稻秆取自江西省农业科学院水稻研究所试验田,自然晾干后用粉碎机粉碎,过16目筛(约1 mm),备用。接种物取自江西省新余市罗坊镇沼气站稳定运行的沼气工程发酵罐中段(发酵原料为猪粪,HRT为30 d)。发酵原料和接种物的基本理化性质见表 1。
|
|
表 1 沼气发酵原料及接种物的基本特性 Table 1 Basic characteristics of raw materials and inoculum |
本试验采用全自动产甲烷潜力分析测试系统(AMPTA3),由瑞典Nova Skantek公司研制。该系统分为A(发酵单元)、B(酸性气体吸附单元)、C(甲烷气体计量单元)3个单元。其中:A单元有15个发酵瓶,每个发酵瓶配有可调转速及搅拌频率的机械搅拌系统;B单元有15个吸收瓶,每个吸收瓶内装有3 mol· L-1的NaOH溶液,用以吸附沼气中的酸性气体(H2S和CO2等);C单元为甲烷气体计量系统,内置模型与算法能结合温度、压力传感器,以弱化水蒸气和发酵瓶中高估气量对实际产甲烷量的影响,最终记录的甲烷气体数值为标准状况(0 ℃,101.3 kPa)下的体积。实验温度为(37±1)℃,持续时间为30~68 d(以当日甲烷量小于总产气量的1%为止)。
1.2.2 连续厌氧发酵装置连续厌氧发酵装置采用自行改装的厌氧发酵反应器(图 1),该装置分A(发酵单元)、B(酸性气体吸附)和C(甲烷体积测量)3个单元。其中:A单元是购自瑞典Nova Skantek的2 L装厌氧发酵罐,每个发酵瓶配有可调转速的机械搅拌系统;B单元配有3 mol· L-1的NaOH溶液以吸附沼气中的酸性气体(CO2和H2S等,溴百里酚酞指示剂显示吸收容量上限);C单元采用排水法收集、测量甲烷体积。

|
A为发酵单元(1进料斗,2搅拌轴,3出料阀,4出气阀,5水浴锅);B为CO2吸收单元;C为测气单元(6集气瓶,7集水瓶) Unit A: Fermetation unit (including 1:feed hopper, 2:stirring shaft, 3:bleeder valve, 4:biogas outlet valve, 5:water bath); Unit B: CO2 absorption unit); Unit C(including 6:gas collecting bottle, 7:water 图 1 厌氧发酵反应器示意图 Figure 1 Sketch map of anaerobic fermentation reactor |
为避免厌氧发酵罐管路堵塞和原料膨胀,发酵总容积控制在1.8 L。在试验启动环节,加入接种物7.688 kg(TS=3.9%)和猪粪2.456 kg(TS=6%),纯净水加到1.8 L,使混合发酵物TS=4.6%。随即使用橡胶塞密封,并通过橡胶塞顶部的排气孔向反应器中吹氮气30~45 s,以排出发酵罐内部空气,确保发酵的厌氧环境;在37 ℃条件下进行接种物的活化,直至发酵罐内日产甲烷量低于100 mL·d-1后,进入连续厌氧发酵阶段;在连续厌氧发酵期间,水浴锅温度控制在(37± 1)℃;发酵罐每日搅拌6次,每次30 min。
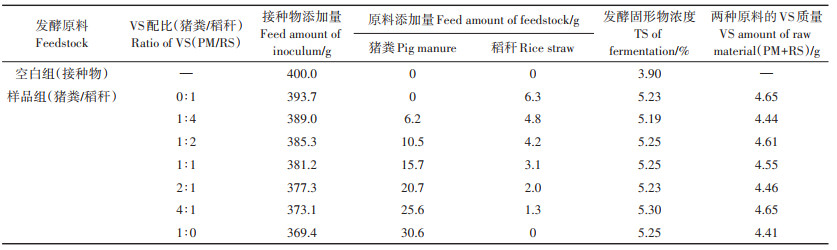
1.3 试验设计 1.3.1 批次厌氧发酵试验厌氧发酵接种物在37 ℃条件下厌氧培养5~7 d,以减少接种物自身的产甲烷量。混合原料中猪粪与稻秆的VS配比(PM/RS)设7个处理(表 2),依次为0∶1、1∶4、1∶2、1∶1、2∶1、4∶1、1∶0(下文VS配比均以PM/RS计),每个处理设3个重复[15];实验过程中接种物和混合原料的VS配比为2∶1,接种物和混合原料的总湿质量共400 g,TS浓度平均值为5.24%,原料的VS质量平均值为4.54 g。
|
|
表 2 沼气发酵原料及接种物的添加量 Table 2 Feed amount of raw materials and inoculum |
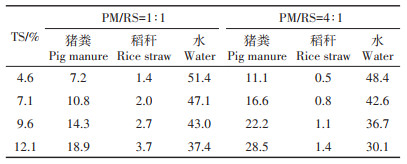
基于批次厌氧发酵试验结果,选择混合原料的VS配比为1∶1和4∶1分别进行连续厌氧发酵试验。HRT设为30 d,每日进料总湿质量为60 g,进料TS浓度分别为4.6%、7.1%、9.6% 和12.1%,当混合原料的TS浓度超过13% 时,稻秆吸水溶胀会降低发酵原料的流动性,使得试验装置存在进料、出料困难和搅拌效果差等情况,故本研究中的进料浓度上限设为12% 左右;每日上午9:00记录甲烷体积;每隔3 d取样品检测pH、TIC、NH4+-N和VFAs浓度;不同进料浓度下的发酵原料的日进料量见表 3。
|
|
表 3 连续厌氧发酵试验中发酵原料的日进料量(g) Table 3 Daily amount of substrate feed in the continuous bench experiments(g) |
总固形物浓度和挥发性固体浓度采用质量法测定[16]。C和N含量采用Vario EL Ⅲ元素分析仪进行测定(C和N含量以总固形物计)。甲烷产量采用沼气通过3 mol·L-1的NaOH溶液后排水法测定体积。发酵液pH在取样后立即采用上海雷磁PHS-3C型酸度计测定。发酵液在室温条件下12 000 r·min-1离心10 min,取上清液分别进行VFAs、TIC和NH4+-N浓度的测定,其中:VFAs和TIC采用Nordmann联合滴定法[17]测定,NH4+-N浓度采用纳氏分光光度法[18]测定。
1.5 计算方法 1.5.1 混合原料的总C/N猪粪与稻秆混合后C/N采用公式(1)进行计算:
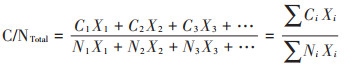
|
(1) |
式中:Ci是单一i原料中碳的质量分数,%;Ni是单一i原料中氮的质量分数,% TS;Xi是混合原料中i原料的质量,g。三者均以TS计。
1.5.2 甲烷产率的计算方法甲烷产率由公式(2)[15]进行计算:
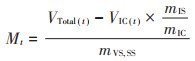
|
(2) |
式中:Mt是每克挥发性固体混合原料产甲烷的量,即甲烷产率,mL·g-1 VS;VTotal (t)是样品组中混合原料和接种物的总产甲烷量,mL;VIC (t)是空白组(接种物)中的产甲烷量,mL;mIS是样品组中接种物的挥发性固体质量,g;mIC为空白组中接种物的挥发性固体质量,g;mVS, SS为样品组中原料的挥发性固体质量,g;t为厌氧发酵天数,d,取值为0,1,2,…,n。
1.5.3 甲烷产率数据的拟合采用修正的Gompertz模型(公式3)对由公式2计算获得的甲烷产率数据进行拟合处理[14, 19]:
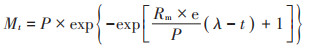
|
(3) |
式中:Mt为发酵期间某一时间t的甲烷产率,mL·g-1VS;P为反应终止时的累积甲烷产率,即产甲烷潜力,mL·g-1 VS;Rm为最大产甲烷速率,mL·g-1 VS·d-1;e= 2.718 28;λ为延滞时间,d;P、Rm和λ通过指数回归分析获得。
tmax为甲烷产率达到最大值的时间,d,由公式(4)计算获得:
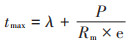
|
(4) |
k为反应动力学常数,d-1,代表发酵原料的转化速率,由公式(5)计算获得:
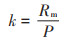
|
(5) |
FVFAs和FAN浓度由公式(6)和公式(7)计算获得[20]:
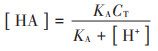
|
(6) |

|
(7) |
式中:[HA]和[NH3]分别为FVFAs和FAN的浓度,mL·g-1 VS;CT和CTotal为总VFAs和总NH4+-N浓度,mg·L-1;[H+]为氢离子浓度,mg·L-1;KA和KB为VFAs和NH3的解离平衡常数,pKA和pKB在37 ℃时为4.8和8.9。
1.5.5 数据处理实验数据的显著性差异分析采用SPSS软件对数据进行处理;甲烷产率数据的拟合采用Origin软件中修正的Gompertz模型进行处理。
2 结果与讨论 2.1 猪粪与稻秆原料在不同VS配比下的厌氧产甲烷变化日产甲烷量(Daily methane production,DMP)和累积甲烷产量(Cumulative methane production,CMP)能够直观反映发酵原料在一个厌氧发酵周期中产甲烷的动态变化过程。图 2a和图 2b分别为不同VS比例混合原料的DMP和CMP,二者在产甲烷过程中变化趋势基本一致。其中:DMP在第4~7 d内出现产甲烷高峰期,随后迅速回落,并在第13 d后进入平缓下降阶段,直至产气结束。在第一个产气高峰时,VS配比为1∶0、4∶1、2∶1、1∶1、1∶2、1∶4、0∶1处理发酵原料的产甲烷峰值分别为(200.7±4.1)、(236.5±7.7)、(227.6±7.7)、(208.7±9.5)、(198.3±5.3)、(172.7±4.3)、(144.8±3.6)mL·d-1。表明当VS配比>1∶1后,混合物料的DMP在第一个产气高峰时的表现等于或优于猪粪原料。这与Li等[14]在牛粪与稻秆的混合厌氧试验结果基本一致。在第13 d之后的平缓下降阶段中,纯稻秆处理(PM/RS=0∶1)出现第二个坡度较为平缓的产气峰(43.3 mL·d-1);而纯猪粪处理(PM/RS=1∶0)无明显的第二个产气峰,表明在厌氧发酵过程中,稻秆的降解与猪粪相比存在滞后性。当产气结束后,原料VS配比为1∶0、4∶1、2∶1、1∶1、1∶2、1∶4、0∶1的CMP依次为(397.31±4.23)、(396.33±11.16)、(392.79 ± 9.85)、(389.23±11.26)、(373.00±9.60)、(347.72 ± 8.68)、(300.80±10.03)mL·g-1 VS。

|
图 2 猪粪混合稻秆批次厌氧发酵的日产甲烷量(DMP)及累积产甲烷量(CMP) Figure 2 Daily methane production(DMP)and cumulative methane production(CMP)in the anaerobic batch co-digestion of PM with RS |
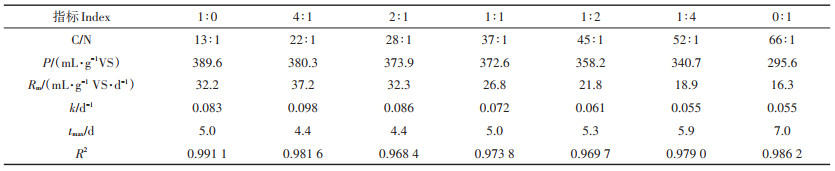
动力学常数是化学动力学中一个重要的物理量,它的大小反映了体系反应的快慢。在实际应用中,最终产甲烷潜力可以通过数学模型进行估计,得到产甲烷动力学常数,产气速率、发酵迟滞期时长等。本研究先通过公式(2)对试验数据进行甲烷产率计算,后采用修正的Gompertz模型及公式3~公式5对获得的数据进行拟合处理,其产甲烷潜力(P)、最大产甲烷速率(Rm)、反应动力常数(k)和甲烷产率达到峰值的时间(tmax)等计算结果见表 4。
|
|
表 4 不同VS配比条件下甲烷产率的拟合 Table 4 Fitting model parameters of methane production for anaerobic digestion with various VS ratios |
从表 4可知,产甲烷潜力P值在VS配比1∶0、4∶ 1、2∶1、1∶1、1∶2、1∶4、0∶1处理分别为389.6、380.3、373.9、372.6、358.2、340.7、295.6 mL·g-1 VS。猪粪的P值最高,之后随猪粪VS比例降低,P值逐渐降低,纯稻秆的P值最小。分析其原因是稻秆中存在不能转化为甲烷的木质素,混合物料中稻秆VS占比越高,可甲烷化的物质量越少。结合Rm、tmax和k值做进一步分析发现:VS配比为4∶1、2∶1的两个试验组的表现均优于猪粪,其中VS配比为4∶1的数值最高,Rm、k和tmax分别为37.2 mL·g-1 VS·d-1、0.098 d-1和4.4 d。表明当原料组配合适时(C/N 20~30∶1),混合发酵能够提升发酵原料的降解速度和转化效率、缩短达到产甲烷高峰的时间。另外,当VS配比为1∶1时,除tmax外,Rm和k值均弱于猪粪原料。综合上述研究发现,猪粪与稻秆组合时,提高猪粪的比例有助于加快甲烷转化速度和转化效率。
通过批次发酵试验,发现VS配比4∶1为最佳配比。但文献[14, 21]报道VS配比1∶1为最佳配比,为此,本研究后续连续发酵试验,选择VS配比为4∶1(优于猪粪原料)和1∶1(弱于猪粪原料)的两组不同配比开展连续厌氧产甲烷特性对比分析。
2.2 进料浓度提升下的混合物料厌氧发酵产甲烷特性VMPR和SMP是评估发酵系统产甲烷性能的两个重要指标。其中,VMPR用于评价发酵原料在发酵系统中的产甲烷能力,SMP则反映发酵原料的利用效率。图 3a和图 3b分别为两种不同VS配比(PM/RS= 1∶1、4∶1)的混合原料在进料浓度提升过程中的VMPR和SMP变化情况。
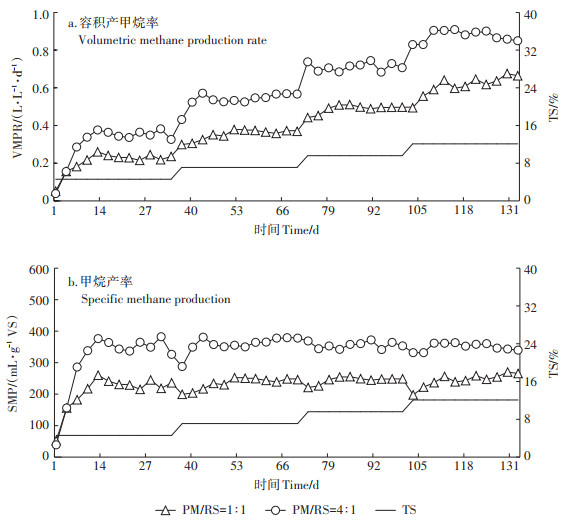
|
图 3 连续厌氧稳定发酵的容积产甲烷率(VMPR)及甲烷产率(SMP) Figure 3 Volumetric methane production rate(VMPR)and specific methane production(SMP)for the anaerobic continuous co-digestion |
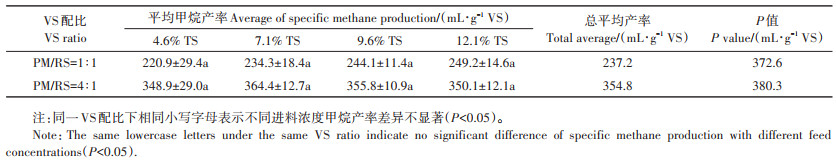
如表 5所示,随进料浓度提升,2个VS配比(1∶1和4∶1)下的SMP平均值均无显著变化,整体保持相对稳定,SMP的总平均值分别237.2 mL · g-1 VS和354.8 mL·g-1 VS。SMP的变化趋势与Li等[14]的研究结论一致。另外,与修正Gompertz模型拟合的P值对比分析发现:VS配比为4∶1的SMP总平均值为P值(380.3 mL·g-1 VS)的93.3%,这表明此条件下混合物料的产甲烷潜力转化率较高,在HRT为30 d的条件下得到较为充分的释放;而VS配比1∶1时混合物料的产甲烷潜力转化率为63.7%,表明仍有一定比例的发酵原料未被充分利用,推测与其较低的k值(0.072 d-1)有关。此外,与本团队前期相关研究[8]相比,同样HRT为30 d,猪粪、稻秆作为单一原料在进料TS浓度达到12.1% 时,其SMP分别下降了13.6% 和25.1%。而混合原料在此进料浓度条件下,优势显现出来,其SMP保持相对稳定。
|
|
表 5 不同进料浓度下的甲烷产率 Table 5 Specific methane production at various feedstock concentrations |
VMPR随进料浓度提升呈不断增加趋势,且与进料浓度呈正相关性(图 4)。依据数据拟合的线性回归方程,计算获得VS配比为1∶1时VMPR在4种进料浓度下分别为0.23、0.36、0.48 L·L-1·d-1和0.61 L·L-1· d-1,VS配比为4∶1时VMPR分别为0.35、0.53、0.71、0.88 L·L-1·d-1。进一步综合分析国内外同类研究的SMP和VMPR数据(表 6)可知,本研究中,猪粪与稻秆混合厌氧发酵的SMP相对稳定,而VMPR随进料浓度提高而增加,这一变化趋势与Li等[14]的研究结论基本一致,但VMPR值低于Li等[14]研究结果,主要原因是该研究采用更短的水力停留时间和更高的进料负荷,进料负荷越高,VMPR也相应越高。此外,与猪粪单独连续厌氧发酵相比,混合发酵的SMP不随进料浓度增加而下降,而且其VMPR也高于猪粪单独发酵,尤其在进料TS浓度达到12.1% 时,VS配比4∶1条件下VMPR(0.88 L·L-1·d-1)优于其他文献[7-9, 14]所报道的结果。
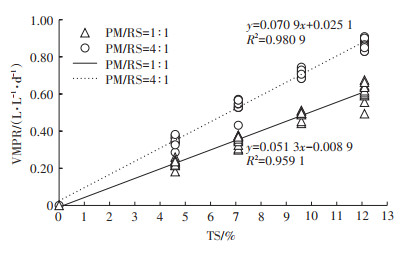
|
图 4 连续厌氧发酵过程中VMPR与进料浓度(TS)的相关性 Figure 4 Relationship between VMPR and TS for the anaerobic continuous co-digestion |
|
|
表 6 不同混合原料在连续厌氧发酵中SMP和VMPR的对比分析 Table 6 Comparison of SMP and VMPR on the continuous co-digestion of different mixed feedstock |
pH值、VFAs、NH4+-N和VFAs/TIC等发酵过程监测指标与厌氧发酵的物质代谢和发酵活动密切相关。2.3.1 pH
pH值是衡量厌氧发酵系统健康性的重要指标之一。Park等[22]和Wang等[23]研究表明,产甲烷菌和产酸菌的最适pH值并不相同。适宜产甲烷菌的pH值在7.0左右,而水解酸化细菌的最适pH则在5.5~6.5之间。单级的全混式厌氧发酵系统将pH维持在6.8~ 8.0之间[24]以降低酸化抑制,因此当pH处于6.5~8.0时,发酵系统被视为正常。本研究中,随着进料浓度的提升,2种不同VS配比的pH值(图 5a)呈逐步下降趋势,但均处于最适pH的稳定范围内,其中进料TS浓度达到12.1%时,2个不同VS配比(PM/RS=1∶1和4∶ 1)的pH分别降至7.54和7.65。
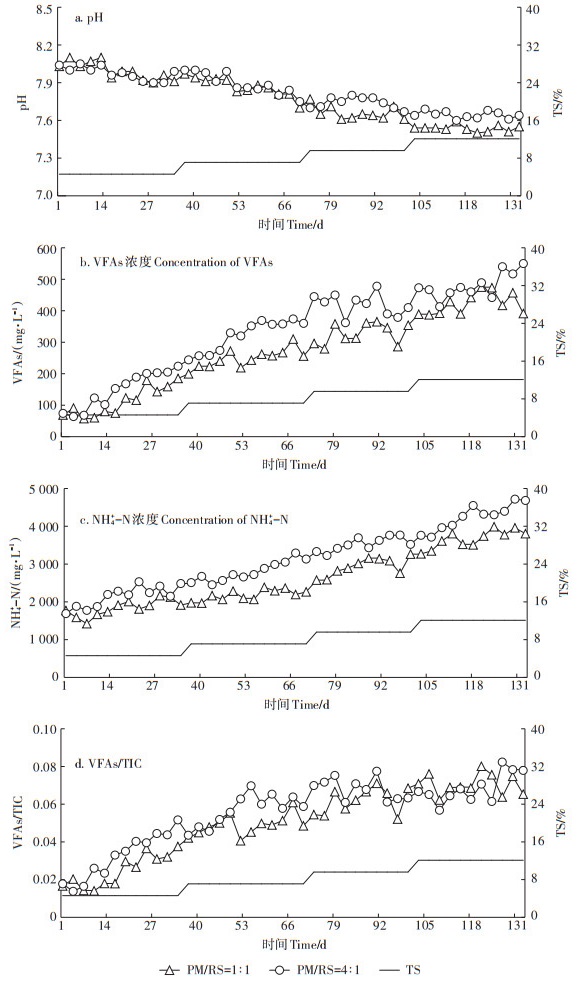
|
图 5 连续厌氧发酵过程中pH值、VFAs浓度、NH4+-N浓度和VFAs/TIC值的变化 Figure 5 Change of pH, VFAs, NH4+-N and ratio of VFAs/TIC during the anaerobic continuous co-digestion |
VFAs主要是指厌氧发酵过程中由水解酸化细菌产生的一系列小分子挥发酸,主要包括乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸等,它们不仅是发酵原料水解酸化的产物,同时也是甲烷合成的底物。因此,相对稳定的VFAs浓度表明水解酸化细菌和甲烷古菌之间处于动态平衡状态,而且对于稳定的厌氧发酵系统来说[25],VFAs浓度始终稳定在一个较低水平,则表明水解酸化产生的VFAs能够迅速被产甲烷菌用于烷合成,VFAs未过量积累而致使甲烷菌的活性受到抑制。为此,VFAs浓度是监测厌氧发酵系统正常运行的一个重要指标[26-27],当VFAs低于1 000 mg·L-1时,发酵系统被视为正常;当VFAs>1 000 mg·L-1时,发酵系统稳定性与发酵原料的种类与进料浓度有关。由图 5b可知,2种不同VS配比的VFAs浓度随进料浓度增加而提升;在进料TS浓度达到12.1%时,VS配比1∶1、4∶1的VFAs浓度的平均值分别达到(388.4± 41.0)mg·L-1和(447.5±49.1)mg·L-1,远远低于1 000 mg·L-1的稳定范围上限[28]。此外,VFAs/TIC比值常作为判断发酵系统是否受到抑制的重要指标[28],当VFAs/TIC比值小于0.3时,发酵系统被视为稳定;当VFAs/TIC比值处于0.3~0.8之间时,发酵系统被视为不稳定;当VFAs/TIC比值大于0.8时,发酵系统处于严重失稳状态。如图 5d所示,2种不同VS比例的VFAs/TIC比值始终低于0.1,发酵系统处于稳定状态,均未出现VFAs累积抑制的情况。
2.3.3 氨氮(NH4+-N)氨是由蛋白质、多肽以及氨基酸等物质降解形成,它不仅为微生物生长繁殖提供氮源,而且是中和VFAs的一个关键性pH值稳定分子,然而高浓度的氨也会抑制产甲烷菌的活性。当进料浓度提升时,氨浓度随混合原料中猪粪用量的增加而增加,必然促使反应NH3 + H2O + CO2(aq) → NH4+ + HCO3- (TIC) 向右进行,使得发酵系统的NH4+-N浓度也不断增加。在本研究中,2种不同VS配比的NH4+-N浓度(图 6)随进料浓度提升呈不断增加的趋势。在进料TS浓度达到12.1% 时,VS配比1∶1、4∶1条件下NH4+-N浓度分别达到(3 666.4±224.1)mL·g-1和(4 245.9±328.2)mL·g-1,低于出现氨抑制的安全阈值(NH4+-N浓度超过5 000 mg·L-1)[29]。而猪粪在进料TS浓度为9.6% 的单独发酵时,其NH4+-N浓度已经超过5 000 mg·L-1[8],这表明稻秆的添加有助于减缓发酵系统中NH4+-N浓度的增加,而且稻秆占比越高,NH4+-N浓度的增幅越小。

|
图 6 NH4+-N与TIC的相关性 Figure 6 Relationship between TIC and NH4+-N for the anaerobic continuous co-digestion |
厌氧发酵系统中的pH值是由一个以总碱度进行定量的缓冲体系予以控制[20]。当pH值在6.0~8.0之间时,缓冲作用则主要来自TIC碱度[17]。如图 6所示,2种不同VS配比的TIC与NH4+-N浓度之间呈现一定的正相关性,说明TIC与NH4+-N碱度同步增加,符合反应式的变化规律,表明猪粪降解产生的NH3是缓冲体系中最主要的碱度物质来源。
2.3.4 游离挥发酸(FVFAs)和游离氨(FAN)FVFAs和FAN能够自由穿透细胞膜[30],被认为是引起厌氧发酵抑制的主要因素。这类疏水性分子常以被动扩散的形式进入细胞中,引起质子失稳和钾离子流失[5]。其中FVFAs对水解酸化细菌和产甲烷菌均有抑制作用;但FVFAs对产甲烷菌(抑制浓度为30~60 mg·L-1)的抑制作用强于水解酸化细菌(抑制浓度为2 400~3 000 mg·L-1)[5, 31]。FAN在中温厌氧发酵条件下抑制的是产甲烷菌,特别是嗜乙酸型产甲烷菌(甲烷鬃毛菌),对嗜氢型产甲烷菌和酸化细菌无显著抑制作用[5]。对FAN最低抑制浓度的研究,不同学者结论也各有不同,Koster等[32]和De Baere等[33]的研究发现FAN的最低抑制浓度为80 mg·L-1;Mccarty[34]和Braun等[35]的研究认为150 mg·L-1为最小抑制浓度;而Liu等[6]发现在200 mg·L-1以内,FAN有助于厌氧发酵,但超过200 mg·L-1之后,厌氧发酵受到抑制。此外,Hashimoto[36]研究也发现,产甲烷菌对FVFAs和FAN的抑制具有可逆性和适应性,对于长期驯化下已适应的产甲烷菌,其FVFAs和FAN的IC50(具备50% 抑制能力的浓度)较对照组分别提高了1.6倍和1.7倍。
在本研究中,2种不同VS配比的VFAs浓度整体较低,依据公式(6)折算,约1 mg·L-1不会对厌氧发酵产生不利影响;而猪粪中的富氮类物质降解产生的氨则是形成抑制的潜在风险因子,图 7所示为采用公式(7)折算出的2种不同VS配比的FAN浓度。与NH4+-N浓度不断增加的趋势相比,FAN浓度并未出现相应增加趋势,即使是在进料TS浓度达到12.1%时,VS配比1∶1、4∶1条件下FAN浓度分别为(152.1±9.6)mg·L-1和(223.2±15.6)mg·L-1,未超过发酵起始的FAN浓度(237.8、266.4 mg·L-1)。其原因是在发酵温度恒定时,pH值是影响FAN浓度的唯一因素,氢离子浓度增加(pH值下降)从一定程度上抑制NH4+-N浓度增加对FAN浓度的影响。此外,考虑到接种物是取自以猪粪为发酵原料且稳定运行3年的沼气工程,厌氧发酵微生物在长期的发酵过程中已经适应富氮类的猪粪原料,因此,即使是FAN浓度略高于相似的研究[6, 34-36],其发酵系统也未发生明显抑制情况[36]。但不能忽略的是,猪粪的占比越高,发酵系统面临FAN的抑制风险越高。

|
图 7 连续厌氧发酵过程中的游离氨浓度变化 Figure 7 Change of free ammonia during the anaerobic continuous co-digestion |
(1)批次厌氧发酵试验表明:混合发酵能够提高发酵原料的降解速率和甲烷产率。经修正后的Gompertz模型拟合数据显示,猪粪与稻秆VS配比为4∶1时产甲烷特性最好,产甲烷潜力(P值)为380.3 mL· g-1 VS;该配比的反应动力常数(k)、最大产甲烷速率(Rm)及甲烷产率达到峰值的时间(tmax)分别为0.098 d-1、37.2 mL·g-1 VS·d-1和4.4 d,均优于猪粪单独发酵(0.083 d-1、32.2 mL·g-1 VS·d-1和5.0 d)。
(2)连续厌氧发酵试验表明:混合物料VS配比为4∶1时产甲烷特性优于1∶1配比,表现为更高的甲烷产率(354.8 mL·g-1 VS)和容积产甲烷率(0.88 L·L-1· d-1),单位原料的甲烷转化效率更好,能够释放出93.3% 的产甲烷潜力,明显高于VS配比1∶1时的63.7%。在进料TS浓度达到12.1%时,VS配比4∶1条件下,游离氨浓度达到223.2 mg·L-1,发酵系统面临游离氨的抑制风险。建议江西省商业沼气工程的运行条件为:猪粪与秸秆混合原料VS配比为4∶1,原料组配的C/N=22~23∶1,进料TS浓度低于12.1%(有机负荷率为2.87 g VS·L-1·d-1)。
| [1] |
宋香育. 不同调控措施下猪粪厌氧干发酵特性研究[D]. 北京: 中国农业科学院, 2017. SONG Xiang-yu. Study of solid-state anaerobic digestion characteristics of pig manure in different control measures[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. |
| [2] |
刘弘博. CSTR集中型沼气工程建设运行成本比较研究[D]. 重庆: 西南大学, 2013. LIU Hong-bo. The comparative study of running cost in CSTR centralized methane engineering construction[D]. Chongqing: Southwest University, 2013. |
| [3] |
李海红, 巴琦玥, 闫志英, 等. 不同原料厌氧发酵及其微生物种群的研究[J]. 中国环境科学, 2015, 35(5): 1449-1457. LI Hai-hong, BA Qi-yue, YAN Zhi-ying, et al. Studies on microbial community of different materials and anaerobic fermentation[J]. China Environmental Science, 2015, 35(5): 1449-1457. DOI:10.3969/j.issn.1000-6923.2015.05.023 |
| [4] |
Angelidaki I, Ahring B K. Anaerobic thermophilic digestion of manure at different ammonia loads: Effect of temperature[J]. Water Research, 1994, 28(3): 727-731. DOI:10.1016/0043-1354(94)90153-8 |
| [5] |
Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: A review[J]. Bioresource Technology, 2008, 99(10): 4044-4064. DOI:10.1016/j.biortech.2007.01.057 |
| [6] |
Liu T, Sung S. Ammonia inhibition on thermophilic aceticlastic methanogens[J]. Water Science & Technology, 2002, 45(10): 113-120. |
| [7] |
丁福贵, 李欣, 张炳宏, 等. 进料浓度对猪粪批式和连续厌氧发酵产沼气的影响[J]. 中国沼气, 2014, 32(5): 36-39. DING Fu-gui, LI Xin, ZHANG Bing-hong, et al. Effect of feed input concentration on batch and continuous biogas fermentation of pig manure[J]. China Biogas, 2014, 32(5): 36-39. DOI:10.3969/j.issn.1000-1166.2014.05.008 |
| [8] |
勒系意, 黄运红, 任雨涵, 等. 梯度有机负荷下农业废弃物厌氧发酵特性及微生物群落[J]. 农业工程学报, 2017, 33(17): 239-247. LE Xi-yi, HUANG YUN-hong, REN Yu-han, et al. Anaerobic digestion characteristics and microbial structure of agricultural wastes under gradient organic loadings[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 239-247. DOI:10.11975/j.issn.1002-6819.2017.17.032 |
| [9] |
常华, 李海红, 闫志英. 总固体浓度对猪粪中温连续厌氧发酵的影响[J]. 陕西科技大学学报(自然科学版), 2017, 35(4): 27-31. CHANG Hua, LI Hai-hong, YAN Zhi-ying. The effect of total solid concentration on swine manure continuous anaerobic fermentration under medium temperature[J]. Journal of Shaanxi University of Science & Technology (Natural Science Edition), 2017, 35(4): 27-31. DOI:10.3969/j.issn.1000-5811.2017.04.006 |
| [10] |
陈广银, 郑正, 邹星星, 等. 稻草与猪粪不同比例混合的厌氧消化特性[J]. 环境化学, 2009, 28(1): 21-25. CHEN Guang-yin, ZHENG zheng, ZOU Xing-xing, et al. Characteristics of anaerobic co-digestion of rice straw and swine feces in various ratios[J]. Environmental Chemistry, 2009, 28(1): 21-25. DOI:10.3321/j.issn:0254-6108.2009.01.004 |
| [11] |
石利军, 班立桐, 刘惠芬, 等. 温度对畜禽粪便稻草混合干式厌氧发酵的影响[J]. 农业环境科学学报, 2011, 30(4): 782-786. SHI Li-jun, BAN Li-tong, LIU Hui-fen, et al. Effect of different temperature on dry anaerobic digestion of animal manure and straw[J]. Journal of Agro-Environment Science, 2011, 30(4): 782-786. |
| [12] |
Shen F, Li H G, Wu X Y, et al. Effect of organic loading rate on anaerobic co-digestion of rice straw and pig manure with or without biological pretreatment[J]. Bioresource Technology, 2018, 250: 155-162. DOI:10.1016/j.biortech.2017.11.037 |
| [13] |
Darwin, Cheng J J, Liu Z M, et al. Anaerobic co-digestion of rice straw and digested swine manure with different total solid concentration for methane production[J]. International Journal of Agricultural & Biological Engineering, 2014, 7(6): 79-90. |
| [14] |
Li D, Liu S C, Mi L, et al. Effects of feedstock ratio and organic loading rate on the anaerobic mesophilic co-digestion of rice straw and pig manure[J]. Bioresource Technology, 2015, 187: 120-127. DOI:10.1016/j.biortech.2015.03.040 |
| [15] |
Badshah M, Lam D M, Liu J, et al. Use of an automatic methane potential test system for evaluating the biomethane potential of sugarcane bagasse after different treatments[J]. Bioresource Technology, 2012, 114: 262-269. DOI:10.1016/j.biortech.2012.02.022 |
| [16] |
贺延龄. 废水的厌氧生物处理[M]. 北京: 中国轻工业出版社, 1998: 536-537. HE Yan-ling. Anaerobic biological treatment of wastewater[M]. Beijing: China Light Industry Press, 1998: 536-537. |
| [17] |
刘芳, 张万钦, 吴树彪, 等. 厌氧发酵中挥发酸含量与碳酸氢盐碱度的滴定法修正[J]. 农业机械学报, 2013, 44(9): 91-96, 106. LIU Fang, ZHANG Wan-qin, WU Shu-biao, et al. Titration method for total inorganic carbon and volatile fatty acids determination in anaerobic digestion[J]. Transactions of the Chinese Society of Agricultural Machinery, 2013, 44(9): 91-96, 106. |
| [18] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002: 279-280. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2002: 279-280. |
| [19] |
李超, 刘刚金, 刘静溪, 等. 基于产甲烷潜力和基质降解动力学的沼气发酵物料评估[J]. 农业工程学报, 2015, 31(24): 262-268. LI Chao, LIU Gang-jin, LIU Jing-xi, et al. Organic substrates evaluation based on biochemical methane potential and degradation kinetic[J]. Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(24): 262-268. DOI:10.11975/j.issn.1002-6819.2015.24.040 |
| [20] |
Mei Z L, Liu X F, Huang X B, et al. Anaerobic mesophilic codigestion of rice straw and chicken manure: Effects of organic loading rate on process stability and performance[J]. Applied Biochemistry and Biotechnology, 2016, 179: 846-862. DOI:10.1007/s12010-016-2035-6 |
| [21] |
付尹宣, 夏嵩, 付嘉琦, 等. 基于TG-FTIR技术的猪粪与稻草混合厌氧发酵产甲烷特性研究[J]. 生态科学, 2018, 37(5): 33-38. FU Yin-xuan, XIA Song, FU Jia-qi, et al. Evaluation of methane production by anaerobic co-digestion of pig manure and rice straw based on TG-FTIR technology[J]. Ecological Science, 2018, 37(5): 33-38. |
| [22] |
Park S, Li Y. Evaluation of methane production and macronutrient degradation in the anaerobic co-digestion of algae biomass residue and lipid waste[J]. Bioresource Technology, 2012, 111: 42-48. DOI:10.1016/j.biortech.2012.01.160 |
| [23] |
Wang F, Hidaka T, Tsuno H, et al. Co-digestion of polylactide and kitchen garbage in hyperthermophilic and thermophilic continuous anaerobic process[J]. Bioresource Technology, 2012, 112: 67-74. DOI:10.1016/j.biortech.2012.02.064 |
| [24] |
Pöeschl M, Ward S, Owende P, et al. Evaluation of energy efficiency of various biogas production and utilization pathways[J]. Applied Energy, 2010, 87(11): 3305-3321. DOI:10.1016/j.apenergy.2010.05.011 |
| [25] |
Li D, Mei Z L, He W, et al. Biogas production from thermophilic codigestion of air-dried rice straw and animal manure[J]. International Journal of Energy Research, 2016, 40(9): 1245-1254. DOI:10.1002/er.3517 |
| [26] |
Feitkenhauer H, Jürgen von Sachs, Meyer U. On-line titration of volatile fatty acids for the process control of anaerobic digestion plants[J]. Water Research, 2002, 36(1): 212-218. DOI:10.1016/S0043-1354(01)00189-0 |
| [27] |
Molina F, Ruiz-Filippi G, Garcia C, et al. Pilot-scale validation of a new sensor for on-line analysis of volatile fatty acids and alkalinity in anaerobic wastewater treatment plants[J]. Environmental Engineering Science, 2009, 26(3): 641-649. DOI:10.1089/ees.2007.0308 |
| [28] |
Drosg B. Process monitoring in biogas plants[M//OL]. IEA Bioenergy, 2013.
|
| [29] |
Kroeker E J, Schulte D D, Sparling A B, et al. Anaerobic treatment process stability[J]. Journal Water Pollution Control Federation, 1979, 51(4): 718-727. |
| [30] |
Wang G, Wang D I. Elucidation of growth inhibition and acetic acid production by clostridium thermoaceticum[J]. Applied and Environmental Microbiology, 1984, 47(2): 294-298. DOI:10.1128/AEM.47.2.294-298.1984 |
| [31] |
Zeeman G, Wiegant W M, Koster-Treffers M E, et al. The influence of the total ammonia concentration on the thermophilic digestion of cow manure[J]. Agricultural Wastes, 1985, 14(1): 19-35. DOI:10.1016/S0141-4607(85)80014-7 |
| [32] |
Koster I W, Lettinga G. The influence of ammonium-nitrogen on the specific activity of pelletized methanogenic sludge[J]. Agricultural Wastes, 1984, 9(3): 205-216. DOI:10.1016/0141-4607(84)90080-5 |
| [33] |
De Baere L A, Devocht M, Van assche P, et al. Influence of high NaCl and NH4Cl salt levels on methanogenic associations[J]. Water Research, 1984, 18(5): 543-548. DOI:10.1016/0043-1354(84)90201-X |
| [34] |
Mccarty P L. Anaerobic waste treatment fundamentals[J]. Public Works, 1964, 95(9): 91-94. |
| [35] |
Braun R, Huber P, Meyrath J. Ammonia toxicity in liquid piggery manure digestion[J]. Biotechnology Letters, 1981, 3(4): 159-164. DOI:10.1007/BF00239655 |
| [36] |
Hashimoto A G. Ammonia inhibition of methanogenesis from cattle wastes[J]. Agricultural Wastes, 1986, 17(4): 241-261. DOI:10.1016/0141-4607(86)90133-2 |
 2021, Vol. 38
2021, Vol. 38