文章信息
- 李晓贝, 张腾, 周昌艳, 白冰, 陈珊珊
- LI Xiao-bei, ZHANG Teng, ZHOU Chang-yan, BAI Bing, CHEN Shan-shan
- 四种蔬菜对DBP和DEHP及其代谢物的吸收累积研究
- Absorption and Accumulation of Di-n-butyl phthalate(DBP) and Di(2-ethylhexyl) phthalate(DEHP) and Metabolites in Four Vegetables
- 农业资源与环境学报, 2018, 35(1): 87-94
- Journal of Agricultural Resources and Environment, 2018, 35(1): 87-94
- http://dx.doi.org/10.13254/j.jare.2017.0202
-
文章历史
- 收稿日期: 2017-08-08
录用日期: 2017-10-23
2. 上海海洋大学食品学院, 上海 201306
2. College of Food Sciences & Technology, Shanghai Ocean University, Shanghai 201306, China
邻苯二甲酸酯(Phthalic acid esters,PAEs)是邻苯二甲酸酐与同种或不同的醇类物质进行酯化反应生成的酯或混合酯类化合物。日常使用中最常见的PAEs有邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二异癸酯(DIDP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二(2-乙基已基)酯(DEHP)和邻苯二甲酸二异壬酯(DINP)。PAEs作为增塑剂和软化剂,被广泛用于塑料制品、纺织品、包装材料等。在农业生产中,塑料薄膜被大量使用,导致了PAEs的污染无处不在。例如,珠江三角洲的一些污水灌溉区以及蔬菜基地的土壤都发现了PAEs的污染[1]。尽管大多数PAEs的急性毒性较低,但由于PAEs表现出类雌激素的活性,被认定为环境内分泌干扰物[2]。长期暴露于PAEs环境中,会引起生殖毒性、肝脏毒性、细胞毒性以及致畸致突变作用[3]。美国环保局早已将DBP、DEHP、DEP、邻苯二甲酸二甲酯(DMP)、邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸正二辛酯(DOP)这6种PAEs列为优先监控的污染物[4]。同时,美国环保局、世界卫生组织下属的国际肿瘤研究机构和美国疾病与有毒物质注册管理局都把DEHP列为B2致癌物,即被认为对人体来说可能会有慢性致癌作用的物质。蔬菜能够从周边的空气、水和土壤中吸收PAEs。在农业生产过程中温室大棚的塑料薄膜覆盖物、塑料地膜以及灌溉用水等都是PAEs的重要污染源。Fu等[5]研究了9种蔬菜中DEHP的检出量和温室大棚所使用的塑料薄膜之间的关系,结果显示温室大棚的高度越低,投入使用的时间越短,塑料膜越薄,蔬菜中DEHP的检出量越高。邻苯二甲酸单酯(Phthalate monoester,MPEs)是PAEs通过酯类水解产生的初级代谢产物和生物转化反应的中间产物。研究表明邻苯二甲酸单酯不但未消除PAEs原有的毒性,其毒性反而更强。邻苯二甲酸单酯的代谢通常不代表PAEs毒性的消解,MPEs对生物的毒性主要分为:雄性毒性、雌性毒性和胚胎毒性。雌性大鼠在怀孕期间摄入MBP后出现体重和进食量的显著下降,胎儿的体重和成活率相较于对照组要小,胎儿出现脊柱的畸形与肾盂扩张的现象增加,雄性胎儿的肛门生殖器距离(AGD)显著下降,MBP能够诱发处于怀孕期的大鼠对DBP产生抗雄激素效应[6-7]。Davis等[8]通过体外实验证明:在培养卵巢颗粒细胞时加入MEHP会改变固醇类合成通路中芳香化酶的活性和绝对量,抑制睾丸酮向雌二醇转化从而减少雌二醇的合成量。蔡晓辉等[9]研究结果表明:低剂量的MEHP能明显地抑制颗粒细胞孕酮的合成,推测其原因可能是MEHP通过抑制孕酮的合成,从而影响胚胎着床和早期胚胎的发育。
为了明确两种PAEs及其单酯代谢物在蔬菜中的吸收累积和残留动态,我们选择两种污染程度最广泛的邻苯二甲酸酯和有代表性的蔬菜品种,采用盆栽实验,通过单酯衍生化和气相色谱-串联质谱(GC-MS/MS)测定的方法,对4种蔬菜中DBP和DEHP及其代谢物MBP和MEHP的吸收累积进行测试,计算生物富集因子,比较不同蔬菜的富集差异。另外,我们还研究了青菜和菠菜中DBP和DEHP及其代谢物的残留动态,以期发现其中的规律。本文对两种最常见的邻苯二甲酸酯类化合物在蔬菜中的吸收代谢和富集研究,为消费者的膳食暴露风险评估提供了实验数据。利用衍生化的方法,一次提取和净化可以同时完成母体化合物和代谢物的残留量测定,为完善蔬菜中邻苯二甲酸酯类污染物的食品安全标准提供参考。
1 材料与方法 1.1 材料与设备实验蔬菜品种青菜(Brassica campestris L.)、菠菜(Spinacia oleracea)、莴苣(Lactuca sativa)和萝卜(Raphanus sativus)种子由上海市农业科学院园艺所提供。土壤为上海农业科学院质标所DUS蔬菜新品种测试中心提供的专门栽培蔬菜的测试土壤。
DBP、DEHP、MBP、MEHP和氘代邻苯二甲酸二己酯(D4-DEHP)购自德国Dr. Ehrenstorfer GmbH公司;N-丙基乙二胺(PSA)、无水MgSO4、石墨化炭黑(GCB)购自Agilent Technologies公司;色谱纯正己烷、乙腈和丙酮购自Merck公司;石油醚、双(三甲基硅烷基)三氟乙酰胺(BSTFA)和三甲基氯硅烷(TMCS)购自上海安谱科学仪器有限公司。
试验仪器有Thermo Scientific TSQ 8000三重四极杆气相色谱-质谱联用仪(GC-MS/MS);HP-5MS UI超惰性气相色谱柱;高速离心机(美国赛默飞世尔科技公司);氮吹仪(上海安谱科学仪器有限公司)。试验全程使用玻璃器具,使用前先将器具用清洗液洗涤,之后用自来水洗净,再分别用蒸馏水和正己烷淋洗烘干后使用。同时采样及试验过程中未接触一切塑料用具。
1.2 土壤老化实验称取DBP和DEHP各1 g,溶解于1 000 mL的石油醚中,配制成浓度为1 000 μg·mL-1的溶液,取500 mL溶液添加到1 000 g的供试土壤中,待石油醚挥发完全后即配成污染浓度为500 mg·kg-1的样品,放置于蔬菜大棚中,按期浇水保持田间持水量,定期采集土壤样品测定其中的PAEs含量。土壤中PAEs的吸附量计算方法:吸附量=外源添加量+土壤本底值-溶剂提取量。
1.3 盆栽实验准确称取DBP、DEHP各150 mg和DBP、DEHP各1 500 mg两份样品,分别溶解于石油醚,配成高、低两个浓度溶液;然后分别添加到3 kg经风干磨碎后的土壤中混匀,得到两个添加浓度分别为50 mg·kg-1和500 mg·kg-1的土壤样品;放置于空旷场地待石油醚全部挥发后以蒸馏水调节至田间持水量,作为盆栽实验用土,同时设置不添加DBP和DEHP的对照组。
4种蔬菜均是直接将种子撒入装有不同浓度DBP和DEHP土壤的盆中进行栽培,盆栽场所为通风的蔬菜大棚,种植期间以蒸馏水进行灌溉。青菜和菠菜从出苗的第2 d开始每10 d采样1次,采样6次。莴苣和萝卜在成熟后采样1次。所有蔬菜样品匀浆后放于-20 ℃冰箱内保存。
1.4 样品处理土壤样品中DBP和DEHP及其代谢物的提取条件参考文献[10]的加速溶剂萃取方法:称取5 g烘干后的土壤装入不锈钢萃取罐,上下用硅藻土填紧实,淋洗液为正己烷,压力103.5 MPa,温度80 ℃,预热0 min,加热5 min,静态时间5 min,冲洗体积30%,吹扫时间60 s,静态循环次数3次。萃取后溶液在氮吹仪上吹近干,用5 mL正己烷复溶,弗罗里硅土(Florisil)柱净化。洗脱液中加入0.1 mL的1.0 μg·mL-1的内标溶液D4-DEHP,氮气吹近干,之后用0.8 mL吡啶复溶,装入进样小瓶中后再加入20 μL BSTFA和1 μL TMCS,40 ℃衍生化反应90 min,然后加入0.2 mL吡啶,内标法定量。实际采集的样品测试设置3个平行,n=3。
蔬菜样品采用QuEChERS方法处理,代谢物用硅烷化试剂进行衍生化[11]。取10 g蔬菜样品加入50 mL玻璃离心管中,加入10 mL乙腈,快速涡旋15 s;加入5 g无水Na2SO4和1 g NaCl,涡旋快速提取约1 min;室温离心10 min,取上清液4 mL于装有净化填料(900 mg无水MgSO4、200 mg PSA和25 mg GCB,其中萝卜无需加入GCB净化)的10 mL玻璃离心管中,涡旋混匀约1 min,室温离心10 min。取上清液2 mL,加入0.1 mL的1.0 μg·mL-1的内标溶液D4-DEHP,氮气吹近干;0.8 mL吡啶复溶,装入进样小瓶中后再加入20 μL BSTFA和1 μL TMCS,40 ℃衍生化反应90 min,然后加入0.2 mL吡啶,内标法定量。实际采集的样品测试设置3个平行,n=3。
1.5 样品分析 1.5.1 标准溶液配制准确称取DBP、DEHP、MBP、MEHP和D4-DEHP标准品各0.05 g,分别用正己烷稀释定容至50 mL,配制成1 000 mg·L-1的标准溶液储备液,转入棕色储液瓶中,-20 ℃冷冻保存。移取DBP和DEHP的标准溶液储备液各0.1 mL,MBP和MEHP的标准溶液储备液各0.1 mL,分别用乙腈定容至10 mL,配制成10 mg·mL-1的两组混合标准溶液D和M,4 ℃冷藏保存。上述两组溶液再分别用乙腈逐级稀释配制成标准溶液工作曲线,至浓度0.001、0.005、0.01、0.02、0.05、0.2、0.5 μg·mL-1用于测定仪器的检出限和线性范围。其中MBP和MEHP的各浓度混合标准溶液需要通过氮气吹近干后,按照上文确定的衍生化反应条件进行衍生化反应之后,进行GC-MS/MS测定。
为消除基质效应对实验结果所造成的影响,实验采用青菜样品的空白提取液来配置所需的标准溶液,绘制基质标准曲线来进行定量。设计基质标准曲线的浓度为0.01、0.02、0.05、0.2、0.5 μg·mL-1。
1.5.2 GC-MS/MS仪器分析条件气相色谱分离的条件为:采用Thermo TG-5 MS(30 m×0.25 mm×0.25 μm)色谱柱,程序升温,不分流进样,恒流模式,载气流速1.2 mL·min-1;载气为纯度99.99%的高纯氦气,进样口温度280 ℃,升温程序为初始柱温60 ℃(1 min),以20 ℃·min-1速率升温至220 ℃(0 min),再以5 ℃·min-1速率升温至280 ℃,保持3 min。质谱部分通过多反应监测模式(SRM)分段采集并准确定性定量,DBP、DEHP、MBP和MEHP衍生物及内标D4-DEHP的定性、定量离子对,优化的碰撞能量等参数见表 1。
 |
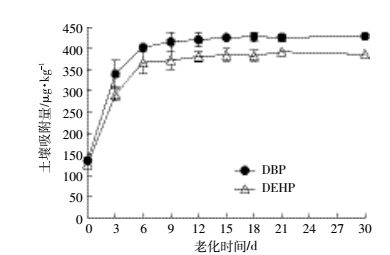
土壤中的有机质和微生物对PAEs的生物利用度有决定性影响。一般来说,分子量越大,疏水性越强,辛醇-水分配系数(Kow值)越大的有机化合物,它在土壤中的吸附能力就越强,老化程度越高。实验中DBP、DEHP在土壤中的老化规律见图 1。两者被土壤吸附的量随着时间的增加而增加,开始阶段吸附的速率较快,在第9 d之后达到基本稳定的状态。第9~30 d,吸附量增加很少,可以认为在第9 d时土壤中两种PAEs的老化已经趋于稳定。因此当土壤中添加过PAEs后9 d再进行盆栽实验就能够有效地避免DBP、DEHP在土壤中的吸附对于实验结果的影响。
|
| 图 1 DBP和DEHP的土壤老化曲线 Figure 1 Ageing of DBP and DEHP in soil |
4种目标物DBP、DEHP、MBP和MEHP浓度线性范围为0.01~500 μg·mL-1,检出限范围为0.001~0.005 μg·mL-1,表 2列出了4种目标物在浓度范围为0.01~500 μg·mL-1时的回归方程,在该浓度范围内都具有良好的线性关系,R2≥0.98;检出限范围在1~5 μg·L-1,满足测定要求。对收集得到的空白青菜样本,分别添加6个不同浓度水平(0.005、0.01、0.02、0.05、0.2、0.5 mg·kg-1)的4种目标物的两组混合标准溶液,用上文所述的QuEChERS方法前处理,每个浓度水平作6个平行样本,获得方法的准确度、精密度。表 3列出了4种目标物在青菜样本中的添加回收率平均值和相对标准偏差RSD。添加浓度在0.005~0.5 mg·kg-1的范围内,4种目标物的添加回收率范围是70.5%~114.7%,RSD在6.9%~15.2%之间,这表明该检测方法具有较好的精密度和准确度。
 |
 |
实验选取了4种日常生活中十分常见的蔬菜作为实验材料,在实验中选取其可食部分的鲜样进行分析,其中青菜和菠菜是叶菜类蔬菜,可食部分位于土壤之上,莴苣是茎叶类蔬菜,可食用的茎叶大部分也在土壤之上,萝卜是根茎类蔬菜,主要可食部分是位于土壤之下的根系部分。生长在高、低两个不同浓度DBP和DEHP土壤中的4种蔬菜的可食部分中都有DBP、DEHP及其代谢物MBP和MEHP的检出(图 2),萝卜中DBP和DEHP残留总量(Σ2PAEs)及其代谢物残留总量均明显高于其他3种蔬菜,从高到低排序为萝卜、莴苣、青菜、菠菜。而对照组土壤中生长的4种蔬菜可食部分均未检出DBP、DEHP及其代谢物MBP和MEHP。实验之初,采集供试土壤样本风干,用土壤球磨机粉碎研磨,并经过100目筛筛分后获得均匀土壤,测试其中的DBP和DEHP含量,其本底值分别为9.32±0.48 μg·kg-1、11.38±0.52 μg·kg-1(n=6),远低于实验中的土壤处理浓度及老化土壤的吸附量。因此测定对照组中蔬菜可食部分中含有的DBP、DEHP及其代谢物的残留量均低于检出限。此处还有一点需要说明的是,即使已经做到避免一切塑料制品,并对溶剂本身不含目标化合物DBP和DEHP做了确认,考虑到环境中可能存在DBP和DEHP,实验前处理各步骤中还可能引入目标化合物DBP和DEHP引起误差,我们还设置了溶剂空白组按照前处理全流程测试。结果表明污染存在极少,与处理组比较其数值非常低,约为百分之零点几至千分之零点几之间。

|
| 注:H为高浓度处理组(500 mg·kg-1),L为低浓度处理组(50 mg·kg-1)。 图 2 高、低处理浓度下四种蔬菜中DBP、DEHP及其代谢物MBP、MEHP的最终残留量 Figure 2 The final residues amount of DBP, DEHP, MBP and MEHP in four kinds of vegetable |
有研究表明,植物组织内脂质含量的不同是造成各种蔬菜吸收PAEs能力存在较大区别的原因,脂质含量与吸收PAEs能力呈正相关关系[12]。PAEs及其代谢物都是亲脂类物质,其Kow值分别为:DBP:lg Kow= 4.45,DEHP:lg Kow= 7.50,这两类物质被植物根系吸收能力的强弱可能就是由植物根系组织中的脂质含量决定,而植物吸收能力的强弱是决定植物体内有机物累积量的重要原因之一。在植物各个部位中,根系部分的脂质含量远高于其他部分,更容易积累亲脂性的有机化合物[13];所以植物根系部分积累的DBP、DEHP及其代谢物的含量应该要高于其他部位,这一点在萝卜与其他3种叶菜类、茎叶类蔬菜的残留累积对比中得到了印证。
生物富集因子(BCF值)是描述难降解的化合物在生物体内累积情况的重要指标。BCF值是生物组织中难降解的化合物的浓度和试验结束后该化合物在土壤中的浓度之比。在本实验中即植株中DBP、DEHP及其代谢物的检出量与相应盆栽后土壤中残留的DBP、DEHP及其代谢物的检出量之比。如表 4所示,青菜、菠菜和莴苣中DBP的BCF值远小于1,而萝卜对DBP的BCF值大于1。DBP的代谢物MBP在不同蔬菜中BCF值与DBP类似,DEHP及其代谢物MEHP在4种蔬菜中的BCF值差异不大。值得注意的是,在萝卜根系部分,DBP的BCF值大于DEHP;而在青菜、菠菜和莴苣这3种蔬菜的地上部分,DBP的BCF值小于DEHP,这种差异和其他研究者的结果相吻合[14-16],可能是DBP和DEHP在植物体内的迁移能力不同所造成的。植物可以通过其根系从土壤间隙水中吸收有机化合物,而这种能力的强弱与被吸收的有机物的Kow值有关,Kow值与化合物的极性成反比,即弱极性的亲脂性化合物Kow值越大,而亲脂性强的化合物更容易被植物根系吸收[17]。从理论上来说,DBP的Kow值和相对分子量较DEHP低,所以DBP在土壤中更容易挥发和降解,它在植物体内代谢也会比DEHP快;而DEHP亲脂性强、支链较长,所以它难以在土壤中降解从而更容易在蔬菜体内累积。实际结果是:3种茎叶类蔬菜中DBP的检出量远小于DEHP,与理论相符合,只有萝卜可食部分根系中的DBP检出量高于DEHP。分析原因可能是由于不同植物中PAEs从根部向其他部位扩散转移能力的不同或者是有机物在植物各部位代谢强度的差别造成了这种差异。
 |
为了研究DBP和DEHP及其代谢物在蔬菜中残留动态,我们分别测定了生长于污染浓度为500 mg·kg-1土壤的青菜和菠菜生长过程中DBP和DEHP及其代谢物MBP和MEHP的残留量(图 3和图 4)。实验结果显示DBP在青菜和菠菜的生长过程中残留变化不显著;而其代谢物MBP的残留量在10~20 d中迅速增加,20 d之后呈现稳定增长趋势。青菜和菠菜中的DEHP含量在第20 d最高,之后快速降低,30 d以后残留量基本稳定。DEHP的代谢物MEHP的残留量呈现逐步上升趋势。该结果与Sun等[11]研究证明在胡萝卜和草莓茎叶中DBP迅速降解成MBP,并且在采样间隔期内MBP的含量均高于母体化合物DBP的结果相一致。Sun等[11]通过DBP和DEHP处理的植物细胞离体培养试验,共计120 h的动态采集样本测试,证明了DBP比DEHP更容易被植物体所代谢和降解,其他学者的研究也有相似的结论[13, 18]。在全过程中其DBP降解成MBP的含量大约是DEHP降解成MEHP的20多倍,造成这种差异的原因是两种物质的分子结构不同,DBP比DEHP的烷基链长度短,亲脂性相比较弱;前文也提到DBP和DEHP的物理化学性质决定了DEHP更易被植物吸收和积累,而DBP在植物体内代谢速度又显著比DEHP快。结合该研究结论,本实验青菜和菠菜中MBP的含量在整个实验过程中其含量均高于母体化合物DBP的原因就是DBP并非很难被青菜吸收而是其在青菜体内的代谢速度太快,在第一次采样的10 d这个时间点之前DBP降解成的MBP含量就已经超过了母体化合物本身的含量。实际的盆栽实验由于对所采集的蔬菜样品量和代表性有要求,出苗后第10 d才够采集样本量,所以没能监测到该代谢变化的过程。而相对代谢速度较慢的DEHP含量在第20 d达到最高后迅速降低,到30 d左右达到吸收和代谢平衡。在第20 d的时候其代谢物MEHP的含量并未显著增加,分析原因可能是进一步产生了次级代谢产物。具有羧酸酯结构的PAEs在植物体内的主要代谢途径就是水解反应,其初级代谢产物是MPEs。此外,Koch等[19]证明了DEHP在体内还会发生氧化反应等生成其他代谢物,用多级质谱的方法鉴定了邻苯二甲酸(2-乙基-5羟基己基)酯(5 OH-MEHP)和邻苯二甲酸(2-乙基-5-氧己基)酯(5 oxo-MEHP)两种代谢产物。在此基础上Silva等[20]又发现了邻苯二甲酸(2-乙基-3-羟基丙基)酯(MECPrP)、邻苯二甲酸(2-乙基-4-羟基丁基)酯(MECBP)和邻苯二甲酸(2(1-氧乙基)己基)酯(MOEHP)共3种代谢物。从图 3和图 4中也可以看出随着时间的延长,代谢物MEHP的残留量逐渐稳定,这也是因为DEHP不仅会降解为单酯代谢物,还有可能会降解成其他代谢物。

|
| 图 3 青菜生长过程中DBP、DEHP及其代谢物MBP和MEHP的残留量变化 Figure 3 Changes of DBP, DEHP, MBP and MEHP during the Brassica campestris L. growth |

|
| 图 4 菠菜生长过程中DBP、DEHP及其代谢物MBP和MEHP的残留量变化 Figure 4 Changes of DBP, DEHP, MBP and MEHP during the Spinacia oleracea growth |
土壤中的微生物也能降解DBP和DEHP产生MBP和MEHP。但是与此降解过程相关的微生物种类、降解反应的条件和强度有待深入研究,本实验中没有涉及。此外,有机物在植物体内经过代谢反应后的代谢产物还会发生进一步的化学变化生成共轭代谢物,要对共轭代谢物进行分析就只有用特定的酶对其进行水解或者是使用放射性同位素标记[21-22]。在目前对于PAEs代谢物的研究中,都只考虑了非共轭形态的单酯,这将有可能低估了PAEs在植物体内代谢反应的强度。
3 结论(1)生长在不同处理浓度DBP和DEHP污染土壤中的青菜、菠菜、莴苣和萝卜的可食部分中都有DBP、DEHP及其代谢物MBP和MEHP的检出,其中萝卜中DBP、DEHP及其代谢物MBP和MEHP残留量均明显高于其他3种蔬菜。4种蔬菜对土壤中的DEHP的BCF值都大于1,有明显的富集效应;而对于土壤中DBP有富集效应的则只有萝卜,其他3种蔬菜对DBP的BCF值都远小于1,萝卜对DEHP和DBP的生物富集系数(BCF)都是最高的。
(2)残留动态实验发现,在青菜和菠菜生长过程中,DBP、DEHP及其代谢物MBP、MEHP的残留量变化有着相似的规律,DBP的残留量在整个生长周期基本稳定;DEHP的残留量在10~20 d之间迅速增加,在20 d后残留量下降,直至稳定;代谢物MBP和MEHP的残留量逐日增加,但随着时间的推移,最终趋于稳定。
(3)以往的研究主要关注于PAEs本身,对于其代谢物的残留及其动态变化没有涉及。本文实验结果表明4种蔬菜种植于存在DBP和DEHP污染的土壤中,不仅会存在DBP和DEHP的残留,其代谢物MBP和MEHP也被检出,并且存在不同程度的富集效应。关注PAEs的代谢物与关注PAEs同样重要。
| [1] |
蔡全英, 莫测辉, 李云辉, 等. 广州、深圳地区蔬菜生产基地土壤中邻苯二甲酸酯(PAEs)研究[J]. 生态学报, 2005, 25(2): 283-288. CAI Quan-ying, MO Ce-hui, LI Yun-hui, et al. The study of PAEs in soils from typical vegetable fields in areas of Guangzhou and Shenzhen, South China[J]. Acta Ecologica Sinica, 2005, 25(2): 283-288. (in Chinese) |
| [2] |
Bolger R, Wiese T E, Ervin K, et al. Rapid screening of environmental chemicals for estrogen receptor binding capacity[J]. Environmental Health Perspectives, 1998, 106(9): 551-556. DOI:10.1289/ehp.98106551 |
| [3] |
Seth P K. Hepatic effects of phthalate esters[J]. Environmental Health Perspectives, 1982, 45: 27-34. DOI:10.1289/ehp.824527 |
| [4] |
Keith L, Telliard W. Priority pollutants I:A perspective view[J]. Environmental Science & Technology, 1979, 13(4): 416-423. |
| [5] |
Fu X, Du Q. Uptake of di-(2-ethylhexyl) phthalate of vegetables from plastic film greenhouses[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11585-11588. DOI:10.1021/jf203502e |
| [6] |
Ema M, Kurosaka R, Amano H, et al. Developmental toxicity evaluation of mono-n-butyl phthalate in rats[J]. Toxicology Letters, 1995, 78(2): 101-106. DOI:10.1016/0378-4274(94)03241-X |
| [7] |
Ema M, Miyawaki E. Adverse effects on development of the reproductive system in male offspring of rats given monobutyl phthalate, a metabolite of dibutyl phthalate, during late pregnancy[J]. Reproductive Toxicology, 2001, 15(2): 189-194. DOI:10.1016/S0890-6238(01)00111-3 |
| [8] |
Davis B, Weaver R, Gaines L, et al. Mono-(2-ethylhexyl) phthalate suppresses estradiol production independent of FSH-cAMP stimulation in rat granulosa cells[J]. Toxicology and Applied Pharmacology, 1994, 128(2): 224-228. DOI:10.1006/taap.1994.1201 |
| [9] |
蔡晓辉, 沈浣, 鹿群, 等. 邻苯二甲酸-单-乙基己基酯对人卵巢颗粒细胞活性及分泌功能的影响[J]. 中国妇产科临床杂志, 2010, 11(5): 335-338. CAI Xiao-hui, SHEN Huan, LU Qun, et al. The effect of mono (2-ethylhexyl) phthalate on human granulosa cells viability and steroid production[J]. Chinese Journal of Clinical Obstetrics and Gynecology, 2010, 11(5): 335-338. (in Chinese) |
| [10] |
邵海洋, 徐刚, 吴明红, 等. 加速溶剂萃取-气相色谱串联质谱法检测沉积物中痕量增塑剂[J]. 分析化学, 2013, 41(9): 1315-1321. SHAO Hai-yang, XU Gang, WU Ming-hong, et al. Determination of phthalate esters in sediment using accelerated solvent extraction and gas chromatography-mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2013, 41(9): 1315-1321. (in Chinese) |
| [11] |
Sun J, Wu X, Gan J. Uptake and metabolism of phthalate esters by edible plants[J]. Environmental Science & Technology, 2015, 49(14): 8471-8478. |
| [12] |
Coleman J, Blake-Kalff M, Davies E. Detoxification of xenobiotics by plants:Chemical modification and vacuolar compartmentation[J]. Trends in Plant Science, 1997, 2(4): 144-151. DOI:10.1016/S1360-1385(97)01019-4 |
| [13] |
Dodgen L, Li J, Parker D, et al. Uptake and accumulation of four PPCP/EDCs in two leafy vegetables[J]. Environmental Pollution, 2013, 182(6): 150-156. |
| [14] |
Cai Q Y, Mo C H, Wu Q T, et al. Polycyclic aromatic hydrocarbons and phthalic acid esters in the soil-radish(Raphanus sativus) system with sewage sludge and compost application[J]. Bioresource Technology, 2008, 99(6): 1830-1836. DOI:10.1016/j.biortech.2007.03.035 |
| [15] |
Briggs G G, Bromilow R H, Evans A A. Relationships between lipophilicity and root uptake and translocation of non-ionised chemicals by barley[J]. Pesticide Science, 1982, 13(5): 495-504. DOI:10.1002/ps.v13:5 |
| [16] |
Mackintosh C E, Maldonado J A, Ikonomou M G, et al. Sorption of phthalate esters and PCBs in a marine ecosystem[J]. Environmental Science & Technology, 2006, 40(11): 3481-3488. |
| [17] |
Wang Y, Liu W, Yang Q, et al. Di(2-ethylhexyl) phthalate exposure during pregnancy disturbs temporal sex determination regulation in mice offspring[J]. Toxicology, 2015, 336(10): 10-16. |
| [18] |
Wu Z, Zhang X, Wu X, et al. Uptake of di(2-ethylhexyl) phthalate(DEHP) by the plant Benincasa hispida and its use for lowering DEHP content of intercropped vegetables[J]. Journal of Agricultural and Food Chemistry, 2013, 61(22): 5220-5225. DOI:10.1021/jf401378u |
| [19] |
Koch H M, Bolt H M, Preuss R, et al. New metabolites of di(2-ethylhexyl)phthalate(DEHP) of single oral doses with deuterium-labelled DEHP[J]. Archives of Toxicology, 2005, 79(7): 367-376. DOI:10.1007/s00204-004-0642-4 |
| [20] |
Silva M J, Reidy J A, Preau J R, et al. Measurement of eight metabolites of di(2-ethylhexyl) phthalate as biomarkers for human exposure assessment[J]. Biomarker, 2006, 11(1): 1-13. |
| [21] |
Yu M, Liu J, Wang T, et al. Metabolites of 2, 4, 4-tribrominated diphenyl ether(BDE-28) in pumpkin after in vivo and in vitro exposure[J]. Environmental Science & Technology, 2013, 47(23): 13494-13501. |
| [22] |
Macherius A, Eggen T, Lorenz W, et al. Metabolization of the bacteriostatic agent triclosan in edible plants and its consequences for plant uptake assessment[J]. Environmental Science & Technology, 2012, 46(19): 10797-804. |
 2018, Vol. 35
2018, Vol. 35