文章信息
- 王龙, 马杰, 邓迎璇, 陈雅丽, 彭皓, 任宗玲, 王进进, 翁莉萍, 李永涛
- WANG Long, MA Jie, DENG Ying-xuan, CHEN Ya-li, PENG Hao, REN Zong-ling, WANG Jin-jin, WENG Li-ping, LI Yong-tao
- 金属离子在铁(氢)氧化物与腐殖质微界面上的吸附机理和模型研究进展
- Micro-interfacial Mechanism and Model of Metal Ions Adsorption on the Iron(Hydr)Oxides and Humic Substances:A Review
- 农业资源与环境学报, 2017, 34(5): 405-413
- Journal of Agricultural Resources and Environment, 2017, 34(5): 405-413
- http://dx.doi.org/10.13254/j.jare.2017.0125
-
文章历史
- 收稿日期: 2017-05-12
2. 华南农业大学资源环境学院, 广东 广州 510642
2. College of Resources and Environment, South China Agriculture University, Guangzhou 510642, China
近年来,伴随着我国工业化和城镇化进程的推进,矿产资源开发和冶炼过程中的污染,工业三废的不合理排放,化肥和农药的过量施用及污水灌溉引发的农田重金属污染日趋严峻[1-2]。农田一旦遭受重金属污染,不仅会使土壤肥力降低,而且直接影响农产品产量和品质,最终通过食物链威胁人类健康[3-5]。近几年来发生的“镉大米”、“血铅”、重金属蔬菜等食品安全事件引起了广泛的社会关注。2016年5月正式颁布并启动的《土壤污染防治行动计划》,标志着我国对土壤污染问题的整治进人战略性阶段。由于土壤重金属污染来源复杂、污染隐蔽且具有累积性,并且不同重金属在土壤中的吸附、迁移和转化过程不尽相同。因此,掌握重金属污染物在土壤中的环境行为才能更有针对性地做好土壤污染防治工作。
在自然环境中,重金属的迁移转化主要受吸附/解吸、沉淀/溶解、氧化/还原、络合/螯合等反应过程控制,决定了不同的重金属元素在环境中的形态、生物有效性和归宿[6-7]。土壤中的铁(氢)氧化物是地球环境中最为丰富的金属氧化物之一,而腐殖质是土壤有机质的主体,可占天然有机质组分70%以上[8-9],两者是土壤中最重要、最活跃的组分。铁(氢)氧化物和腐殖质具有很大的比表面积,并且铁(氢)氧化物表面的-OH与腐殖质表面的-COOH、-OH等活性官能团可通过静电作用、配体交换等多种机制对重金属离子产生较强吸附。同时,腐殖质与铁(氢)氧化物之间也可发生强烈的反应[10-11],它们之间可以通过一定的作用力结合在一起。这一过程对土壤中的各种物理、化学和生物过程均有重要的影响。例如,土壤腐殖质结合在铁(氢)氧化物表面,影响其在土壤中的团聚、迁移、沉积以及矿物表面的吸附、溶解、结晶等过程; 与此同时,铁(氢)氧化物通过表面吸附或表面催化作用促进腐殖质的化学分解与缩合,反过来影响腐殖质在土壤中的迁移转化过程及环境效应。这些变化会进一步控制重金属污染物在土壤中的形态分布和迁移特征[12-14]。因此,深入了解重金属离子在铁(氢)氧化物-腐殖质复合体微界面相互作用的分子机理,对于阐明重金属在环境中的迁移、转化过程具有重要意义。
1 重金属离子在铁(氢)氧化物上的吸附 1.1 重金属离子在铁(氢)氧化物上的吸附机理铁(氢)氧化物具有稳定的化学性质,较高的比表面积和细微的颗粒结构,广泛存在于土壤、河流、海洋、湖泊的沉积物中,在污染物的环境过程中扮演着重要角色[15-16]。铁(氢)氧化物表面本身具有大量的 > Fe-OH两性基团,以其是否发生质子化或去质子化而具有可变电荷特性[17]。铁(氢)氧化物表面的电荷性质主要是由单配位位点( > FeOH-0.5)或三配位位点( > Fe3O-0.5)表面氧质子化引起的。公式(1) 与公式(2) 中0.5是表面基团的平均电荷,是根据波尔键价理论计算的,质子亲和常数logK与铁(氢)氧化物的PZC(零电荷点)相等[18]。

|
(1) |

|
(2) |
这种在铁(氢)氧化物界面质子化或去质子化后—406—产生的可变电荷可与溶液中带相反电荷的离子发生表面配合,从而产生吸附。铁(氢)氧化物对金属离子的吸附可分为专性吸附和非专性吸附[19]。非专性吸附主要是指离子交换反应和静电吸附,主要作用力为弱的范德华力和库仑引力,吸附产物位于静电层的外层,被称作外圈络合物。由于碱金属(Li、Na、K、Rb、Cs)和碱土金属(Be、Mg、Ca、Sr、Ba)离子水合半径较大,这些离子在铁(氢)氧化物表面的吸附均属于非专性吸附; 而水合半径较小的金属离子和过渡金属离子(如Cu、Pb、Cr、Ni、As等),因其具有较强的极化能力和变形力,可与铁(氢)氧化物表面活性基团通过配位交换或共价键形成稳定的内圈络合物,从而发生专性吸附[20]。Weng等[10]比较了Ca和Cu在针铁矿上吸附行为,研究结果表明Ca2+在静电层的电荷量比Cu2+多,因此在低pH下,Cu与单配位位点(-FeOH-0.5),形成内圈络合物,Ca与单配位位点形成外圈络合物。熊娟[9]和Hiemstra等[21]通过同步辐射X射线吸附精细结构(ExtendedX-ray Adsorption Fine Structure,EXAFS)分析研究表明,二价金属离子(M2+)可能以多种形式吸附在八面体结构的针铁矿的[110]、[021]面和[001]面上(图 1和表 1)。它们的结合包括单齿形式、双齿形式和三齿形式[22-23]。

|
近几十年来,国内外许多学者基于铁(氢)氧化物对重金属吸附机理的研究进展,对相关模型研究也取得了丰硕的成果,先后提出了两类反应模型。一类是较早提出的通过实验手段获得的经验性模型,如Langmuir、Freundlich模型[29-30],该模型认为单分子层吸附位点在固相表面均勻地分布着,每个吸附位点的能量都是相同的。这显然与真实固体表面实际不符,经验模型的参数是条件参数,依赖外界环境条件的变化,不同实验条件获取的模型参数不同,不能用来解释吸附机理和计算形态分布,但因其公式形式简单,而且结合数学模型,在实际中的应用十分广泛。另一类是机理性的表面络合模型(SCMs),主要是恒电容模型[31]、双电层模型[32]和三电层模型[33]。这类模型以质量平衡定律、物料平衡定律和电荷平衡定律为基础,不仅考虑吸附位点的实际类型和特性、也考虑吸附反应的非理想性、以及吸附活性位点的位置、电荷分布和其对表面电势的影响等,由于吸附模型的机理性,模型参数不受外界环境条件的影响,能够计算吸附态离子的形态和分布[34]。Selim等[35]对微量元素在土壤活性胶体上的吸附模型进行了比较,认为Langmuir、Freundlich模型虽然能够很好地拟合实验数据,但其参数只适用于特定的条件,而SCMs的参数能够适用于较宽泛的环境条件。
在SCMs模型中应用广泛、最成功的模型是CD-MUSIC模型(Charge Distribution -Multisite Surface Complexation), 主要包括两个部分:电荷分布(CD)和多位点表面络合(MUSIC)。模型构建分为两个方面:(1) 表面组成,从晶体学、形貌学角度揭示金属氧化物的物理特性。(2) 化学反应,从静电特征、化学反应揭示金属氧化物吸附反应的化学特性[36]。该模型主要用于计算离子在金属(氢)氧化物上的吸附(表 2),认为氧化物表面的电荷是由于表面基团的单配位位点(-FeOH-0.5)和三配位位点(-Fe3O-0.5, 质子化引起的,金属离子能够与这两类表面位点形成不同类型的内圈或外圈络合物[10]。熊娟[9]用CD-MUSIC模型对Pb2+在针铁矿上的吸附形态进行研究,认为在低浓度下Pb2+主要吸附在针铁矿[021]面,与两个单配位位点和一个双配位位点形成三齿配位复合物;在高浓度下Pb2+主要吸附在针铁矿[110]面,与两个单配位位点形成双齿配位络合物。Rietra等[37]和Weng等[10]对Ca2+在针铁矿上的吸附进行了研究,认为当pH < 4.5时,Ca2+与单配位位点(-FeOH-0.55)主要形成单齿络合物;当pH > 6时,单体双齿的水解态占主导地位,并且吸附Ca2+的电荷主要位于扩散层。

|
腐殖质是动植物有机残体经过一系列复杂的物理、化学、生物变化过程后,形成的一类褐色或黑色的高聚合物质,广泛分布在自然土壤、水体(包括河流、湖泊和海洋)和沉积物中[42-43]。腐殖质结构十分复杂,表面含有羧基、羟基、酚羟基、氨基、酿基、酮基、及巯基等多种活性基团。根据它们在碱和酸中的溶解度,可以将腐殖质分为三类[44]: (1) 胡敏酸(Humic Acid,HA),相对分子质量约在6~20kDa之间,溶于稀碱液,易在酸中沉淀析出;(2) 富里酸(Fulvic Acid,FA),相对分子质量一般在1~5kDa之间,既可溶于酸又可溶于碱((3) 胡敏素(Humin,Hmi),相对分子质量约在20~1 000kDa之间,既难溶于酸又难溶于碱。HA与FA的基本结构相似,但其分子量和表面活性基团存在一些差异。HA苯环数量较多,彼此连接紧密,FA苯环数量较少,以脂肪链为主; 单个HA分子的酸性位点含量远高于FA[45]。
2.2 重金属离子在腐殖质上的吸附机理腐殖质对环境中的重金属离子有极强的络合吸持能力,这和腐殖质内在结构有密切联系。腐殖酸与金属离子之间的作用基团,最主要的是酚羟基和羧基,表现为两种反应类型,如图 2。腐殖酸分子中羧基的邻位存在酚羟基时,可以加强其对金属离子的螯合能力。螯合物的形成方式取决于金属离子的质量浓度,浓度高时以交换吸附方式为主,浓度低时则以螯合作用为主。
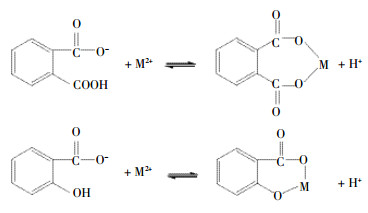
|
| 图 2 腐殖质与二价金属离子的交换模式 Figure 2 The cation exchange model between humic substances and divalent metal ions |
腐殖质与重金属离子结合能力的强弱可用亲和力常数的大小来表示,不同官能团与金属离子之间具有特定的结合能力。其中羧基的pKa介于3~6, 而酚羟基pKa在9~11之间,其他官能团包括茁-二羧基化合物、氨基、酿基、酮基、及巯基的pKa介于两者之间[46]。根据腐殖酸与金属离子相互作用时生成键的性质,可分为两种反应类型:"(1) 与金属离子主要生成离子键,主要是碱金属离子及碱土金属离子; (2) 与二价或多价金属离子形成配位化合物,这些金属阳离子不易和腐殖酸形成离子键,主要是过渡元素和重金属元素。另外,腐殖质还能与变价金属元素如铁(Fe)、汞(Hg)、铬(Cr)、砷(As)等发生氧化还原反应,其原因是分子中的羧基、酚羟基、半酿等基团具有一定的还原能力,同时,—408—腐殖质分子中的芳香结构能够接受和传递电子,与变价金属离子发生还原反应[47]。这种电子转移能力受较多因素影响,既有内在结构因素(如有机碳骨架排列方式),也有外在环境因素(pH值、氧气含量等),不同来源腐殖质对于同种因素的敏感性也存在一定差异。
2.3 重金属离子在腐殖质上的吸附模型近几年来,许多用于腐殖质吸附重金属离子的化学形态模型相继被提出,其中以Saito等[48]提出的NICA (Non-Ideal Competitive Adsorption)-Donnan模型和Tipping[49]提出的ModelsV/VI最具代表性。NICA-Donnan模型以扩展Henderson-Hasselbalch模型或Hill模型作为局部吸附等温模型,采用连续亲和分布解释了吸附剂异相性,并引人Donnan模型来解释非特异吸附和静电吸附[50-52]。NICA-Donnan模型是由NICA方程和Donnan模型两部分组成。NICA方程假设腐殖质的化学非均一性是由其表面的羧基类配体(低亲和性)和羟基类配体(高亲和性)引起的,这两类配体是连续分布的。与此同时,采用Donnan静电模型描述静电层特征,计算静电作用吸附的离子数量。因此,非理想性吸附是NICA模型的一个特点,模型参数可由pH-电荷曲线拟合得到,模型参数包含配位数、位点异相性、亲和常数等信息,具有确切的物理意义。而ModelsV/VI假设腐殖质是大小一致的规则球体,其表面具有羧基(A类)和羟基(B类)两类位点,每类位点有4种(共8种)酸性位点,不同位点亲和常数不同,且不连续分布[53]。NICA-Donnan模型不仅考虑腐殖质酸性位点的化学异质性、反应的化学计量数和专性吸附离子与质子之间的竞争,还考虑腐殖质与离子之间的静电相互作用。因此,在计算离子在腐殖质上的吸附更具有优势,已成功预测不同pH值下Ca2+、Cd2+、Pb2+、Zn2+和Cu2+在腐殖质上的吸附竞争行为[10, 54]。Saito等[48]对Cu2+在HA上吸附进行了研究,结果表明NICA-Donnan模型对Cu2+在HA上的吸附在较宽的pH(3~ll)范围都适用,Cu2+与-COOH和-OH位点的O原子能够以单齿和双齿的形式结合。Ge等[55]用NICA-Donnan模型对Cd2+、Hg2+和Pb2+在土壤有机质上的吸附数据进行了拟合,发现土壤有机质能够增强Cd2+、Hg2+和Pb2+的络合。
3 重金属离子在复合物微界面上的吸附 3.1 铁(氢)氧化物与腐殖质交互作用的机理铁(氢)氧化物对腐殖质的吸附模式有:阴离子交换、配体交换表面配位、疏水性作用、熵效应、氢键作用及阳离子桥[8, 56]。腐殖质中的羧基、酚羟基等酸性官能团能够与铁(氢)氧化物表面羟基(-OH)发生配位反应形成配合物,被认为是腐殖质和铁(氢)氧化物间主要的作用机理。腐殖质与铁氧化物配位交换的反应式如下:
铁(氢)氧化物吸附腐殖质在形成铁(氢)氧化物-腐殖质复合体的过程中,富含芳香结构比富含碳氢化合物结构的腐殖质更易被吸附,并且吸附量会随总酸度的增加而增加,由于HA的总酸度小于FA总酸度,因此分子量小的亲水性FA较之分子量大的疏水性HA更容易在铁(氢)氧化物表面上吸附,且吸附量随芳香环碳含量的增高而增大或随O/C比值的减小而增大[58]。在铁(氢)氧化物对腐殖质的吸附过程中,最初先被吸附的是腐殖质中大分子量的那部分,随后才逐步被小分子量的那部分取代而最终达到吸附平衡[57]。铁(氢)氧化物对腐殖质的吸附主要受pH值和离子强度的影响。当pH < PZC时,铁(氢)氧化物表面带大量正电荷,pH值越低,正电荷数量越多,对腐殖质的吸附能力越强。当pH > PZC时,铁(氢)氧化物表面带负电荷,pH值越高,负电荷数量越多,对自身带负电荷的腐殖质吸附能力越弱。pH值的变化还能影响腐殖质的分子形态、极性及空间排列,pH值越低,腐殖质的酸性官能团(-COOH、-OH)发生质子化反应,疏水作用越强,越容易被铁(氢)氧化物吸附[59-60]。离子强度通过改变铁(氢)氧化物表面的双电层厚度,影响腐殖质与铁(氢)氧化物之间相互作用力。离子强度增大使铁(氢)氧化物表面双电层将被压缩,静电作用增强,同时可能存在的桥架作用,使得铁(氢)氧化物对腐殖质吸附量增加[61]。
3.2 重金属离子在复合物微界面上的吸附机理腐殖质与铁(氢)氧化物同时存在于土壤中,但腐殖质很少以游离态的形式存在,而是与铁(氢)氧化物和阳离子紧密结合;同时,腐殖质自身具有氧化还原特性,能够在变价重金属化学降解转化过程中作为电子传递媒介[62-63]。重金属离子在铁(氢)氧化物-腐殖质复合物表面吸附,能够改变铁(氢)氧化物和腐殖质表面的理化性质,溶解态的腐殖质与铁氧化物表面也能够竞争吸附重金属离子,影响重金属离子在微界面环境中的迁移[64-65]。在三元体系中,腐殖质以及金属离子可以结合到铁(氢)氧化物表面,并且两两都具有交互作用。金属离子在铁(氢)氧化物-腐殖质复合物上通常有三种吸附方式:(1) 腐殖质与金属离子竞争铁(氢)氧化物表面的活性位点;(2) 在溶液中形成腐殖质-离子配合物,减少在铁(氢)氧化物表面的吸附; (3) 形成三元配合物[10, 66]。这些三元配合物通常有两种类型:① 金属离子在铁(氢)氧化物表面活性位点和腐殖质之间形成“桥”的形式(即 > (Fe)-M-HS); ② 金属离子结合在腐殖质的配体上,不与表面位点络合(即 > (Fe)-HS-M)[67]。研究表明,这种“桥”结合的方式大部分由氢键作用引起,架“桥”的阳离子价态越高,越容易形成“阳离子桥”[68]。因此,高价态阳离子对腐殖酸在铁氧化物上的吸附影响比低价态的阳离子大。
当腐殖质浓度较低时以溶解态的离子形式存在,在浓度较高或与阳离子、质子反应时则以胶粒或团聚体的形式存在,由于其粒径较小(通常由几个纳米至几个微米),使其具有较大的比表面积和较高的反应活性,并且在溶液中仍然保持悬浮状态,有利于重金属离子的迁移[69]。因此,重金属离子在铁(氢)氧化物-腐殖质复合物表面的吸附主要受腐殖质的溶解性与铁(氢)氧化物结合态的相对含量以及两者的微界面结合形态所调控。张磊等[70]对Pb、As在溶解性有机质与铁氧化物相互作用的研究中发现,溶解性有机质与铁氧化物的相互作用能明显增强还原环境下铁氧化物中Pb和As的再释放,使它们在溶液中的浓度增高。Fakour等[71]对As在水铁矿-胡敏酸复合体的研究表明,AsO33-、AsO43-能够与有机质竞争水铁矿表面的活性位点,使A(Ⅲ)和A(Ⅴ)的吸附量降低。Lai等[72]的研究表明,HA的存在增加了Cd2+在针铁矿表面的吸附量。Cui等[38]对土壤中的Cu2+、Zn2+和Cd2+的形态进行模型计算,结果表明Cu2+和Cd2+主要以有机结合形态为主,而Zn2+则以有机结合态和氧化物结合态为主要结合形态。
3.3 重金属离子在复合物微界面上的吸附模型20世纪初,Filius等[73]、Weng等[74]、Hiemstra等[21]以CD-MUSIC模型、NICA-Donnan模型为基础,提出配位-电荷分布(Ligand Charge Distribution,LCD)模型。发展初期,LCD模型主要用于描述针铁矿对弱的有机酸的吸附,如乳酸、草酸、柠檬酸等[75]。随后,LCD模型逐渐对复杂的二元体系进行描述和预测,现已成功用于针铁矿-HS复合物对Ca2+、Cu2+、PO43-和AsO43-的吸附[10, 60, 73, 76-77]。Saito等[66]用LCD模型对Cu2+/HA/针铁矿三元共存的体系研究表明,Cu2+的吸附量随二元体系中吸附量的增加而增加,这是因为针铁矿表面存在HA时,改变了针铁矿表面的静电势,从而削弱了质子的竞争作用。Weng等[10]的研究进一步表明,Cu2+在三元体系中用线性叠加模型和LCD模型计算的结果十分相近,FA的存在增加了Cu2+在针铁矿表面的吸附,但Ca2+在三元体系中的吸附,只能用LCD模型进行计算,在FA存在下,Ca2+在针铁矿表面的吸附量要高于Cu2+,这是因为Ca2+对FA的静电作用要强于Cu2+。不仅如此,Weng等[77]在实验理论的基础上,将CD-MUSIC模型和NICA-Donnan模型应用到真实的砂质土中,首次成功预测不同吸附剂在砂质土中对Cu2+、Cd2+和Zn2+活度的贡献度,其中有机结合形态分别占的比例0.3%~2.9%、0.6%~4.8%和0.3%~2.1%。随后她将重新推导的带可变电荷纳米颗粒的自由能变化的数学表达式代替最初的LCD中原来的相关表达式以后,从根本上纠正了原来的错误,发展了LCD模型,使其成为迄今为止唯一的既可用于土壤有机质在矿物颗粒上的吸附反应,同时也可用于离子在有机质包被的矿物颗粒体系中吸附的机理模型,使化学形态机理模型向更接近环境体系中的真实过程跨越了一大步[38]。
4 结论与展望金属离子在铁(氢)氧化物-腐殖质复合体微界面上的吸附,能够改变铁(氢)氧化物和腐殖质表面的理化性质。同时,腐殖质与金属离子能够形成络合物,减少在铁(氢)氧化物表面的吸附。溶解态的腐殖质与铁(氢)氧化物表面的相互作用也能对重金属离子的吸附产生抑制作用。在复合体系中能够形成两种类型的三元配合物:(1) 金属离子在铁(氢)氧化物表面活性位点和腐殖质之间形成“桥”的形式(即 > (Fe)-M-HS); (2) 金属离子结合在腐殖质的配体上,不与表面位点络合(即 > (Fe)-HS-M)。LCD模型以NICA-Donnan模型和CD-MUSIC模型为基础,不仅能够定量描述金属离子在活性组分上的吸附行为,还可计算金属离子在土壤中的形态分布,已成功预测Cs+、Zn2+、Ni2+、Cu2+、Co2+、Cd2+、Pb2+、Cr3+和As3+等不同价态的金属离子在三元体系中的吸附机制和结合形态。
不同类型土壤腐殖质的分子结构存在很大的差异,对铁(氢)氧化物表面的交互作用也不尽相同,导致重金属离子在不同的腐殖质-铁(氢)氧化物复合物表面的吸附行为也有很大差异。目前对于不同重金属离子在复合物表面的竞争吸附,还主要围绕单一或者两种重金属混合的情况。因此,今后的研究应该多加强多种金属离子共存情况下,不同类型腐殖质-铁(氢)氧化物复合物表面对其在水体中吸附行为的影响。同时,应借助同步辐射X射线吸收近边分析(XANES)、X射线吸收精细结构光谱(EXAFS)、核磁共振光谱(13C NMRS)、纳米颗粒粒径及组分分析、原位ATR-FTIR红外光谱、原子力显微技术(AFM)等高精度的结构和形态分析技术,结合多表面模型和配体与电荷分配模型,精细研究重金属离子在土壤天然活性物质表面的微观吸附过程,揭示重金属离子在土壤中的形态变化、迁移累积特征,为重金属在污染土壤中的风险评估和控制提供理论依据。
| [1] | Chen G L, Li D W, Liu J, et al. Heavy metal pollution and health risk assessment in the vicinity of the abandoned pyrite smelting slag[J]. Disaster Advances, 2010, 3(4): 362–366. |
| [2] | Abuduwailil J, Zhang Z Y, Jiang F Q. Evaluation of the pollution and human health risks posed by heavy metals in the atmospheric dust in Ebinur Basin in Northwest China[J]. Environmental Science and Pollution Research, 2015, 22: 14018–14031. DOI:10.1007/s11356-015-4625-1 |
| [3] | Li Z Y, Ma Z W, Van der Kuijp T J, et al. A review of soil heavy metal pollution from mines in China:Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468: 843–853. |
| [4] | Jiang X, Lu W X, Zhao H Q, et al. Potential ecological risk assessment and prediction of soil heavy-metal pollution around coal gangue dump[J]. Natural Hazards and Earth System Sciences, 2014, 14: 1599–1610. DOI:10.5194/nhess-14-1599-2014 |
| [5] |
王龙, 高子平, 李文华, 等.
水稻幼苗镉吸收动力学特性的遗传多样性分析[J]. 植物生理学报, 2016, 521(1): 125–133.
WANG Long, GAO Zi-ping, LI Wen-hua, et al. Genetic diversity of cadmium adsorption kinetic characteristics[J]. Plant Physiology Journal, 2016, 521(1): 125–133. (in Chinese) |
| [6] | Gao T, Yang L, Pang H. Effect of dissolved organic matter on migration of heavy metals in soils[J]. International Conference on Multimedia Technology, IEEE, 2010, 10: 1–4. |
| [7] | 胡少平. 土壤重金属迁移转化的分子形态研究[D]. 杭州: 浙江大学, 2009. HU Shao-ping. Molecular speciation of heavy metals transportation in soil[D]. Hangzhou:Zhejiang University, 2009. (in Chinese) |
| [8] | Han L, Sun K, Jin J, et al. Some concepts of soil organic carbon characteristics and mineral interaction from a review of literature[J]. Soil Biology & Biochemistry, 2016, 94: 107–121. |
| [9] | 熊娟. 土壤活性组分对Pb(Ⅱ)的吸附及其化学形态模型模拟[D]. 武汉: 华中农业大学, 2015. XIONG Juan. Adsorption of Pb(Ⅱ) to soil active components:Chemical speciation modeling[D]. Wuhan:Huazhong Agricultural University, 2015. (in Chinese) |
| [10] | Weng L P, Riemsdijk W H V, Hiemstra T. Cu2+ and Ca2+ adsorption to goethite in the presence of fulvic acids[J]. Geochimica Et Cosmochimica Acta, 2008, 72: 5857–5870. DOI:10.1016/j.gca.2008.09.015 |
| [11] | 李梦婕. 腐殖酸、铁氧化物及其共存时对土壤汞赋存状态及生物活性的影响[D]. 重庆: 西南大学, 2012. LI Meng-jie. The effect of humic acid, iron oxides and their combinations on the occurrence state and biological activity of mercury in soils[D]. Chongqing:Southest University, 2012. (in Chinese) |
| [12] | Honghai W U, Lin Y, Jiayi W U, et al. Surface adsorption of iron oxide minerals for phenol and dissolved organic matter[J]. Earth Science Frontiers, 2008, 15: 133–141. DOI:10.1016/S1872-5791(09)60013-0 |
| [13] | Refaey Y, Jansen B, Parsons J R, et al. Effects of clay minerals, hydroxides, and timing of dissolved organic matter addition on the competitive sorption of copper, nickel, and zinc:A column experiment[J]. Journal of Environmental Management, 2017, 187: 273–285. |
| [14] | Tan W F, Koopal L K, Weng L P, et al. Humic acid protein complexation[J]. Geochimica Et Cosmochimica Acta, 2008, 72: 2090–2099. DOI:10.1016/j.gca.2008.02.009 |
| [15] | Sheha R R, Elshazly E A. Kinetics and equilibrium modeling of Se(Ⅳ) removal from aqueous solutions using metal oxides[J]. Chemical Engineering Journal, 2010, 160: 63–71. DOI:10.1016/j.cej.2010.03.004 |
| [16] | Choo K H, Kang S K. Removal of residual organic matter from secondary effluent by iron oxides adsorption[J]. Desalination, 2003, 154: 139–146. DOI:10.1016/S0011-9164(03)80014-0 |
| [17] | Liu H, Chen T, Frost R L. An overview of the role of goethite surfaces in the environment[J]. Chemosphere, 2014, 103(5): 1–11. |
| [18] | Hiemstra T, Riemsdijk W H V. A surface structural approach to ion adsorption:The charge distribution(CD) model[J]. Journal of Colloid & Interface Science, 1996, 179(2): 488–508. |
| [19] | Landry C J, Koretsky C M, Lund T J, et al. Surface complexation modeling of Co(Ⅱ) adsorption on mixtures of hydrous ferric oxide, quartz and kaolinite[J]. Geochemical Transactions, 2008, 9: 302–309. |
| [20] |
刘娟, 王津, 陈永亨, 等.
铊在矿物胶体和天然有机质界面上迁移转化行为的研究进展[J]. 地球与环境, 2013, 41(3): 326–333.
LIU Juan, WANG Jin, CHEN Yong-heng, et al. Overview of the research on transfer and transform behavior of Thallium on the interface between mineral and natural organic matter[J]. Earth and Environment, 2013, 41(3): 326–333. (in Chinese) |
| [21] | Hiemstra T, Riemsdijk W H V. A surface structural model for ferrihydrite I:Sites related to primary charge, molar mass, and mass density[J]. Geochimica Et Cosmochimica Acta, 2009, 73: 4423–4436. DOI:10.1016/j.gca.2009.04.032 |
| [22] | Ghose S K, Waychunas G A, Trainor T P, et al. Hydrated goethite(α-FeOOH)(001) interface structure:Ordered water and surface functional groups[J]. Geochimica Et Cosmochimica Acta, 2010, 74(7): 1943–1953. DOI:10.1016/j.gca.2009.12.015 |
| [23] | Ponthieu M, Juillot F, Hiemstra T, et al. Metal ion binding to iron oxides[J]. Geochimica Et Cosmochimica Acta, 2006, 70: 2679–2698. DOI:10.1016/j.gca.2006.02.021 |
| [24] | Cui Y S, Weng L P. Arsenate and phosphate adsorption in relation to oxides composition in soils:LCD modeling[J]. Environmental Science & Technology, 2013, 47: 7269–7276. |
| [25] | Juillot, Morin F, Ildefonse G, et al. Occurrence of Zn/Al hydrotalcite in smelter-impacted soils from northern France:Evidence from EXAFS spectroscopy and chemical extractions[J]. American Mineralogist, 2003, 88: 509–526. DOI:10.2138/am-2003-0405 |
| [26] | Ostergren J D, Trainor T P, Bargar J R, et al. Inorganic ligand effects on Pb(Ⅱ) sorption to goethite(α-FeOOH):I. Carbonate[J]. Journal of Colloid & Interface Science, 2000, 225: 466–482. |
| [27] | Bochatay L, Persson P, Lövgren L, et al. XAFS study of Cu(Ⅱ) at the water-goethite(α-FeOOH) interface[J]. Le Journal De Physique Ⅳ, 1997, 7: 2819–2830. |
| [28] | Alcacio T E, Hesterberg D, Chou JW, et al. Molecular scale characteristics of Cu(Ⅱ) bonding in goethite-humate complexes[J]. Geochimica Et Cosmochimica Acta, 2001, 65(9): 1355–1366. DOI:10.1016/S0016-7037(01)00546-4 |
| [29] | Katz L E, Hayes K F. Surface complexation modeling:I. Strategy for modeling monomer complex formation at moderate surface coverage[J]. Journal of Colloid & Interface Science, 1995, 170: 477–490. |
| [30] | Jeppu G P, Clement T P. A modified Langmuir-Freundlich isotherm model for simulating pH-dependent adsorption effects[J]. Journal of Contaminant Hydrology, 2012, 130: 46–53. |
| [31] | And B A M, Goldberg S. Adsorption and stability of Arsenic(Ⅲ) at the clay mineral-water interface[J]. Environmental Science & Technology, 1997, 31: 2005–2011. |
| [32] | Tessier A, Fortin D, Belzile N, et al. Metal sorption to diagenetic iron and manganese oxyhydroxides and associated organic matter:Narrowing the gap between field and laboratory measurements[J]. Geochimica Et Cosmochimica Acta, 1996, 60: 387–404. DOI:10.1016/0016-7037(95)00413-0 |
| [33] | Yates D E, Levine S, Healy T W. Site-binding model of the electrical double layer at the oxide/water interface[J]. Journal of the Chemical Society Faraday Transactions, 1974, 70: 1807–1818. DOI:10.1039/f19747001807 |
| [34] | Weng L P, Riemsdijk W H V, Hiemstra T. Adsorption of humic acids onto goethite:Effects of molar mass, pH and ionic strength[J]. Journal of Colloid & Interface Science, 2007, 314: 107–118. |
| [35] | Selim H M, Zhang H. Modeling approaches of competitive sorption and transport of trace metals and metalloids in soils:A review[J]. Journal of Environmental Quality, 2013, 42: 640–653. DOI:10.2134/jeq2012.0323 |
| [36] | Venema P, Hiemstra T, van Riemsdijk W H. Multisite adsorption of cadmium on goethite[J]. Journal of Colloid & Interface Science, 1996, 183(2): 515–527. |
| [37] | René P J J Rietra, Tjisse Hiemstra, Willem H van Riemsdijk. Interaction between calcium and phosphate adsorption on goethite. Interaction between calcium and phosphate adsorption on goethite[J]. Environmental Science & Technology, 2001, 35(16): 3369–3374. |
| [38] | Cui Y, Weng L. Interpretation of heavy metal speciation in sequential extraction using geochemical modelling[J]. Environmental Chemistry, 2015, 12(2): 163–173. DOI:10.1071/EN13216 |
| [39] | Mangold J E, Park C M, Liljestrand H M, et al. Surface complexation modeling of Hg(Ⅱ) adsorption at the goethite/water interface using the charge distribution multi-site complexation(CD-MUSIC) model[J]. Journal of Colloid & Interface Science, 2014, 418: 147–161. |
| [40] | Xie J, Gu X, Tong F, et al. Surface complexation modeling of Cr(Ⅵ) adsorption at the goethite-water interface[J]. Journal of Colloid & Interface Science, 2015, 455: 55–62. |
| [41] | Stachowicz M, Hiemstra T, Riemsdijk W H V. Multi-competitive interaction of As(Ⅲ) and As(Ⅴ) oxyanions with Ca2+, Mg2+, PO43-, and CO32-, ions on goethite[J]. Journal of Colloid & Interface Science, 2008, 320(2): 400–414. |
| [42] | Hankins N P, Lu N, Hilal N. Enhanced removal of heavy metal ions bound to humic acid by polyelectrolyte flocculation[J]. Separation & Purification Technology, 2006, 51: 48–56. |
| [43] |
袁英, 何小松, 席北斗, 等.
腐殖质氧化还原和电子转移特性研究进展[J]. 环境化学, 2014, 33(12): 2048–2057.
YUAN Ying, HE Xiao-song, XI Bei-dou, et al. Research progress on the redox and electron transfer capacity of humic substances[J]. Environmental Chemistry, 2014, 33(12): 2048–2057. DOI:10.7524/j.issn.0254-6108.2014.12.019 (in Chinese) |
| [44] |
蔡金娟, 史衍玺.
不同腐殖酸组分对湖泊沉积物中重金属释放的影响[J]. 水土保持学报, 2006, 20(1): 108–110.
CAI Jin-juan, SHI Yang-xi. Release of heavy metals on sediments and influence factors of humic acids[J]. Journal of Soil and Water Consernation, 2006, 20(1): 108–110. (in Chinese) |
| [45] | Weng L P, Riemsdijk W H V, Koopal L K, et al. Adsorption of humic substances on goethite:Comparison between humic acids and fulvic acids[J]. Environmental Science & Technology, 2006, 40: 7494–7500. |
| [46] | 李放. 铁氧化物-腐殖酸复合物对重金属汞的吸持特性研究[D]. 重庆: 西南大学, 2012. LI Fang. Study on adsorption/desorption characteristics of Hg2+ on/from iron oxides, humic acid and their complex[D]. Chongqing:Southest University, 2012. (in Chinese) |
| [47] | Weerasooriya R, Aluthpatabendi D, Tobschall H J. Charge distribution multi-site complexation(CD-MUSIC) modeling of Pb(Ⅱ) adsorption on gibbsite[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2001, 189: 131–144. |
| [48] | Saito T, Nagasaki T, Tanaka S, et al. Application of the NICA-Donnan model for proton, copper and uranyl binding to humic acid[J]. Radiochimica Acta/International Journal for Chemical Aspects of Nuclear Science & Technology, 2004, 92: 567–574. |
| [49] | Tipping E. Humic ion-binding model VI:An improved description of the interactions of protons and metal ions with humic substances[J]. Aquatic Geochemistry, 1998, 4: 3–47. DOI:10.1023/A:1009627214459 |
| [50] | Benedetti M F, Riemsdijk W H V, Koopal L K. Humic substances considered as a heterogeneous donnan gel phase[J]. Environmental Science & Technology, 1996, 30: 1805–1813. |
| [51] | Kinniburgh D G, Riemsdijk W H V, Koopal L K, et al. Ion binding to natural organic matter:Competition, heterogeneity, stoichiometry and thermodynamic consistency[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 1999, 151: 147–166. |
| [52] |
赵雪涛, 郜洪文.
NICA-Donnan模型对重金属吸附的应用进展[J]. 离子交换与吸附, 2009, 25(2): 185–192.
ZHAO Xue-tao, GAO Hong-wen. Application of NICA-Donnan model to heavy metal adsorption[J]. Ion Exchange and Adsorption, 2009, 25(2): 185–192. (in Chinese) |
| [53] | Tipping E, Hurley M A. A unifying model of cation binding by humic substances[J]. Geochimica Et Cosmochimica Acta, 1992, 56: 3627–3641. DOI:10.1016/0016-7037(92)90158-F |
| [54] | Xiong J, Koopal L K, Tan W, et al. Lead binding to soil fulvic and humic acids:NICA-Donnan modeling and XAFS spectroscopy[J]. Environmental Science & Technology, 2013, 47: 11634–11642. |
| [55] | Ge Y, Hendershot W. Modeling sorption of Cd, Hg and Pb in soils by the NICA-Donnan model[J]. Soil & Sediment Contamination An International Journal, 2005, 14: 53–69. |
| [56] | Riemsdijk W H V, Weng L P. Fundamental aspects of interaction between metals and humics in the environment[J]. Geochimica Et Cosmochimica Acta, 2005, 69: 537–547. |
| [57] | Rahman M S, Whalen M, Gagnon G A. Adsorption of dissolved organic matter(DOM) onto the synthetic iron pipe corrosion scales(goethite and magnetite):Effect of pH[J]. Chemical Engineering Journal, 2013, 234: 149–157. DOI:10.1016/j.cej.2013.08.077 |
| [58] |
魏世勇, 谭文峰, 刘凡.
土壤腐殖质-矿物质交互作用的机制及研究进展[J]. 中国土壤与肥料, 2009, 5(1): 1–6.
WEI Shi-yong, TAN Wen-feng, LIU Fan. Advances on the study of mineral-humus interactins in soils[J]. Soil and Fertilizer Sciences in China, 2009, 5(1): 1–6. (in Chinese) |
| [59] | Guan X H, Li D L, Shang C, et al. Role of carboxylic and phenolic groups in NOM adsorption on minerals:A review[J]. Water Science & Technology Water Supply, 2006, 6: 154–171. |
| [60] | Shi H L, Ding J, Timmons T, et al. pH effects on the adsorption of saxitoxin by powered activated carbon[J]. Harmful Algae, 2012, 19(19): 61–67. |
| [61] | El Badawy A M, Luxton T P, Silva R G, et al. Impact of environmental conditions(pH, ionic strength, and electrolyte type) on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environmental Science & Technology, 2010, 44: 1260–1272. |
| [62] | Dietrich L A S, Mcinnis D P, Bolster D, et al. Effect of polydispersity on natural organic matter transport[J]. Water Research, 2013, 47(7): 2231–2240. DOI:10.1016/j.watres.2013.01.053 |
| [63] | Saito T, Koopal L K, van Riemsdijk W H, et al. Adsorption of humic acid on goethite:Isotherms, charge adjustments, and potential profiles[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2016, 20(3): 689–700. |
| [64] | Refaey Y, Jansen B, Parsons J R, et al. Effects of clay minerals, hydroxides, and timing of dissolved organic matter addition on the competitive sorption of copper, nickel, and zinc:A column experiment[J]. Journal of Environmental Management, 2017, 187: 273–285. |
| [65] | Zhang Y, Han L, Yu K, et al. The role of dissolved organic matter in the competitive adsorption to goethite, during arsenic mobilization[J]. Procedia Earth & Planetary Science, 2017, 17: 424–427. |
| [66] | Saito T, Koopal L K, Nagasaki S, et al. Analysis of copper binding in the ternary system Cu2+/humic acid/goethite at neutral to acidic pH[J]. Environmental Science & Technology, 2005, 39: 4886–4893. |
| [67] | Conroy N A, Zavarin M, Kersting A B, et al. Effect of natural organic matter on plutonium sorption to goethite[J]. Environmental Science & Technology, 2017, 17(1): 424–427. |
| [68] | Jong Sup Park, Heechul Choi, Kyu Hong Ahn, et al. Removal mechanism of natural organic matter and organic acid by ozone in the presence of goethite[J]. Ozone Science & Engineering, 2004, 26(2): 141–151. |
| [69] | Otero-Fariña A, Fiol S, Arce F, et al. Effects of natural organic matter on the binding of arsenate and copper onto goethite[J]. Chemical Geology, 2017, 459: 119–128. DOI:10.1016/j.chemgeo.2017.04.012 |
| [70] |
张磊, 宋柳霆, 郑晓笛, 等.
溶解有机质与铁氧化物相互作用过程对重金属再迁移的影响[J]. 生态学杂志, 2014, 33(8): 2193–2198.
ZHANG Lei, SONG Liu-ting, ZHENG Xiao-di, et al. The remobilization of heavy metals influenced by interaction of DOM and iron oxides[J]. Chinese Journal of Ecology, 2014, 33(8): 2193–2198. (in Chinese) |
| [71] | Fakour H, Lin T F, Lo S L. Equilibrium modeling of arsenic adsorption in a ternary arsenic-iron oxide-natural organic matter system[J]. CLEAN-Soil, Air, Water, 2016, 44(10): 1287–1295. DOI:10.1002/clen.v44.10 |
| [72] | Lai C H, Chen C Y, Wei B L, et al. Cadmium adsorption on goethite-coated sand in the presence of humic acid[J]. Water Research, 2002, 36: 4943–4950. DOI:10.1016/S0043-1354(02)00009-X |
| [73] | Filius J D, Meeussen J C L, Lumsdon D G, et al. Modeling the binding of fulvic acid by goethite:The speciation of adsorbed FA molecules[J]. Geochimica Et Cosmochimica Acta, 2003, 67: 1463–1474. DOI:10.1016/S0016-7037(02)01042-6 |
| [74] | Weng L P, Riemsdijk W H V, Hiemstra T. Effects of fulvic and humic acids on arsenate adsorption to goethite:Experiments and modeling[J]. Environmental Science & Technology, 2009, 43: 7198–7204. |
| [75] | Ali MA, Dzombak DA. Effects of simple organic acids on sorption of Cu2+ and Ca2+ on goethite[J]. Geochimica Et Cosmochimica Acta, 1996, 60: 291–304. DOI:10.1016/0016-7037(95)00385-1 |
| [76] | Hiemstra T, Mia S, Duhaut P B, et al. Natural and pyrogenic humic acids at goethite and natural oxide surfaces interacting with phosphate[J]. Environmental Science & Technology, 2013, 47: 9182–9189. |
| [77] | Weng L P, Temminghoff E J M, Lofts S, et al. Complexation with dissolved organic matter and solubility control of heavy metals in sandy soil[J]. Environmental Science & Technology, 2002, 36: 4804–4810. |
 2017, Vol. 34
2017, Vol. 34