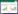文章信息
- 秦旭, 徐应明, 孙扬, 赵立杰, 刘烨潼
- QIN Xu, XU Ying-ming, SUN Yang, ZHAO Li-jie, LIU Ye-tong
- 氟啶虫胺腈在棉花和土壤中的检测方法与残留动态研究
- Residue Determination and Degradation of Sulfoxaflor in Cotton and Soil
- 农业资源与环境学报, 2014, 31(4): 381-387
- Journal of Agricultural Resources and Environment, 2014, 31(6): 513-520
- http://dx.doi.org/10.13254/j.jare.2014.0064
-
文章历史
- 收稿日期:2014-03-24
2. 天津市农业质量标准与检测技术研究所 天津 300381
2. Tianjin Institute of Agricultural Quality Standard and Testing Technology Research, Tianjin 300381, China
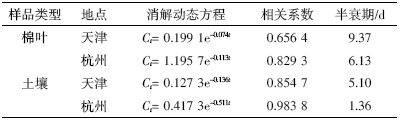
氟啶虫胺腈(sulfoxaflor)是由陶氏农业科学(Dow AgroSciences)在2010 年公开报道的一种防治吸汁害 虫的新型杀虫剂。其化学名称为[1-[6-(三氟甲基)吡 啶-3-基]乙基]-λ4-巯基氨腈;分子式:C10H10F3N3OS; 分子量:277.27;CAS:[946 578-00-3];CIPAC No:820; 结构式见图 1[1]。
|
| 图 1 氟啶虫胺腈的结构式 Figure 1 Structural formula of sulfoxaflor |
氟啶虫胺腈的制剂规格为水分散粒剂,外观为白 色颗粒状固体,有轻微的味道,pH值为5~9,悬浮率和 分散性≥60%,湿筛试验(通过75 μm试验筛)≥80%,54 ℃、14 d热贮稳定[2]。氟啶虫胺腈是磺酰亚胺杀虫 剂,作用于昆虫的神经系统,即作用于胆碱受体内独 特的结合位点而发挥杀虫功能[3]。可经叶、茎和根吸收 进入植物体。适用于防治棉花田盲蝽[4]、叶蝉[5]、蚜虫、 飞虱[6]等害虫,对非靶标节肢动物毒性低,是害虫综合 防治的优选药剂[7]。氟啶虫胺腈具有高效、广谱活性和 使用量低等特点,且与其他化学类别的杀虫剂无交互 抗性,所以同已上市的产品相比具有优越性[8, 9, 10, 11, 12]。
目前国内外对于氟啶虫胺腈残留检测方法的研 究较少,陈九星等[13]应用高效液相色谱-质谱(HPLCMS) 和气相色谱-电子捕获检测器(GC-ECD)研究了 氟啶虫胺腈在不同光源下和不同溶剂中的降解趋势 及代谢产物,黄庆等[14]应用GC-ECD 建立了氟啶虫胺 腈在柑橘和土壤中的残留检测方法。但有关氟啶虫胺 腈在棉花田中的检测方法及残留趋势研究则尚未见 到报道。GC-ECD灵敏度较高,但在稳定性方面不如 液相色谱[15];HPLC-MS 选择性较好,但价格昂贵且后 期维护和保养费用较高,难以普遍推广。笔者采用高 效液相色谱-紫外检测器(HPLC-VWD)建立了一套 稳定、灵敏、通用性强的方法用于检测棉花中的氟啶 虫胺腈的残留量,并通过田间试验测定了其在棉花田 中的消解动态情况及在收获期的最终残留情况,为以 后指导此农药更为科学合理的使用和建立相关的 MRL值提供依据。 1 材料与方法 1.1 药剂及仪器
纯度为99.7%的氟啶虫胺腈(sulfoxaflor)标准品 和50%氟啶虫胺腈水分散粒剂,均由陶氏化学(中国) 投资有限公司提供。乙腈为分析纯和色谱纯,正己烷、 丙酮、氟罗里硅土和无水硫酸钠均为分析纯,甲醇为 色谱纯,自制超纯水(作流动相)。
UltiMate 3000型高效液相色谱仪,可变波长紫外 检测器(VWD)(美国戴安公司)。Heidolph LABORO原 TA 4000 型旋转蒸发仪(德国海道尔夫公司);ZHWY- 2102C 型调速多用振荡器(中国上海智诚分析仪器 制造有限公司);T-25 basic ULTRA-TURRAX 高速植 物组织捣碎机(德国IKA 公司);MILLI-Q 超纯水仪 (美国Millipore 公司);SL-302 电子天平(中国上海民 桥精密科学仪器有限公司);SHZ-D(III)循环水式真 空泵(中国河南巩义市予华仪器有限公司)及抽滤装 置等。 1.2 田间试验
参照《农药残留试验准则》(NY/T 788—2004)的 相关要求,2010 年8 月—10 月和2011 年8 月—9 月 分别在天津市和浙江省杭州市进行了50%氟啶虫胺 腈WDG 在棉花上的残留消解动态试验和最终残留 试验。 1.2.1 试验地点信息
天津试验点选在天津市西青区辛口镇王家村,土 壤为粘壤土,pH 值7.18,有机质含量2.03%,阳离子 代换量:18.01 cmol·kg-1。棉花品种为国欣棉8 号。
杭州试验点选在浙江省杭州市萧山区十三工段, 土壤为沙壤土,pH 值6.9,有机质含量1.85%,阳离子 代换量:17.76 cmol·kg-1。棉花品种为中棉所59。 1.2.2 棉花植株上的消解动态试验
设3 个重复小区,每小区面积30 m2。在棉花生 长至约0.3 m 高时手动喷雾施药,施药制剂量为0.9 g·30 m-2。施药后2 h、1、3、7、14、21 d和28 d采样,每 个小区间均设隔离区,另设清水空白对照。棉花植株 样本的采集:采用五点法在每个试验小区随机采集2 kg 生长正常、无病害、半成熟或成熟的棉花植株,切 碎、混匀后采用四分法留样500 g,装入样本容器中, 粘好标签,贮存于-20 ℃冰柜中保存。 1.2.3 土壤中的消解动态试验
在试验地块附近选一块10 m2表面平整、墒情适 中且不种植任何植物的地块做土壤消解动态试验,与 棉花上消解动态试验同时喷雾施药,施药制剂量为 0.3 g·10 m-2。施药后2 h、1、3、7、14、21 d和28 d采样, 另设清水空白对照。土壤样本的采集:用五点法随机 用土钻采集0~10 cm 的土壤1~2 kg,除去土壤中的碎 石、杂草和植物根茎等杂物,混匀后采用四分法留样 500 g,装入样本容器中。粘好标签,贮存于-20 益冰柜 中保存。 1.2.4 最终残留试验
2 个施药剂量,分别为低剂量0.6 g·30 m-2 和高剂量0.9 g·30 m-2,在棉花盛花期开始首次施药,各设 3 次和2 次施药,小区面积30 m2,重复3 个小区,2 次 施药间隔为7 d。距最后1次施药7、14 d和21 d每小 区采用五点法随机采集棉籽2 kg,磨碎、混匀后按四 分法留样250g;每小区五点法随机采集土壤(0~15cm) 2 kg,土壤样品去除杂物后充分混匀,按四分法各留 样250 g,所有样品用塑料袋封装、编号,-20 ℃以下 低温冰柜保存待测。 1.2.5 空白对照试验
在试验点附近选取未施药的棉花田,采集土壤、 棉叶和棉籽作为空白对照。 1.3 分析方法
1.3.1 样品提取
棉叶样品:称取20 g切碎的样品置于250 mL 烧 杯中,加入80 mL 乙腈,在组织捣碎机上匀浆提取2 min。抽滤,用50 mL乙腈清洗滤渣。全部乙腈倒入分 液漏斗内,用正己烷萃取2 次,每次50 mL,弃去正己 烷相。乙腈用无水硫酸钠脱水并置于平底烧瓶中,旋 转蒸发至干,平底烧瓶先用0.5 mL 丙酮充分润洗,再 加入10 mL正己烷,待柱净化。层析柱内依次装入2 g 无水硫酸钠、2 g弗罗里硅土和2 g无水硫酸钠。先用 5 mL 丙酮和10 mL 正己烷混合溶液预淋,弃去淋出 液。上样,待柱内溶液流尽时用10 mL 正己烷/丙酮 (20:1,V/V)混合溶液润洗圆底烧瓶,倒入柱内,待流 尽后使用相同的淋洗液再重复1次,弃去淋洗液。最 后用20 mL 正己烷/丙酮(6:4,V/V)混合溶液淋洗,收 集淋洗液,旋转蒸发至干,5 mL 甲醇定容待测。
棉籽和土壤样品:称取20 g 土壤或粉碎的棉籽 样品置于250 mL磨口带塞三角烧瓶中,加入80 mL乙 腈,震荡提取30 min。抽滤,用50 mL 乙腈清洗滤渣。 以下步骤同棉叶样品。 1.3.2 色谱条件
色谱柱:Agilent ZORBAX SB-C18 柱(25 cm×4.6 mm×5 μm),柱温:30 ℃;流动相:乙腈:水=25:75(V/V); 检测波长:260 nm;流速:1 mL·min-1;进样量:10 μL。 在此条件下,氟啶虫胺腈的2个手性异构体的保留时 间分别为16.3 min 和17.8 min。定量时采用2个色谱 峰面积之和来计算。 2 结果与讨论 2.1 仪器条件及前处理方法的选择 2.1.1 检测波长的选择
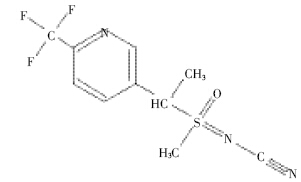
通过紫外全波长扫描发现(图 2),氟啶虫胺腈在213 nm 处有较大的吸收峰,但其他杂质在此波长处 也有较大吸收,会对氟啶虫胺腈的分析产生干扰。而 在260 nm处氟啶虫胺腈的吸收峰也较大,杂质的干 扰则相对较小,故选择260 nm作为检测波长。
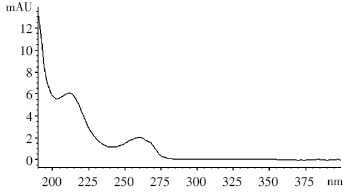
|
| 图 2 氟啶虫胺腈紫外吸收光谱图 Figure 2 UV absorption spectra of sulfoxaflor |
分别使用甲醇、乙腈和丙酮3 种常见的提取试剂 进行提取实验,由于丙酮和萃取剂正己烷互溶,而甲 醇则对油脂和色素等杂质也有较强的提取效果,故选 用对油脂和色素提取效果较弱的乙腈作为提取剂。
经实验发现,氟啶虫胺腈几乎不溶于正己烷,所 以本实验采用正己烷来初步去除样品中的色素和油 脂等杂质。用正己烷萃取2 次,每次50 mL 所取得的 效果最为理想,既保证了杂质的去除效果,又不会影 响方法的回收率且不浪费试剂。 2.1.3 柱净化条件的选择
由于棉叶和棉籽的杂质含有较多的油脂和色素 等杂质,而氟啶虫胺腈几乎不溶于正己烷,所以在柱 净化步骤中先用含有大比例正己烷的混合溶液(正己 烷:丙酮=20:1,V/V)淋洗去除杂质,再用正己烷比例 较低的混合溶液洗脱目标化合物。通过对不同比例的 正己烷/丙酮混合淋洗溶液进行对比实验,发现当丙 酮的比例大于等于40%时,方法的回收率较为理想, 但随着丙酮的比例升高,淋出液的颜色会随之加深, 说明洗脱出来的色素和杂质也随之增多,所以当正己 烷/丙酮为6:4(V/V)时方法的回收率和净化效果均较 为理想(表 1)。分别使用硅胶、中性氧化铝和氟罗里硅土作为层析柱的填料进行相同淋洗条件下的对比 试验,发现使用3种填料后的添加回收率均很理想, 但氟罗里硅土的净化效果最好,与上述淋洗步骤和仪 器条件配合使用,氟啶虫胺腈在色谱图上的双峰完全 分离且无杂质干扰,灵敏度和回收率都能满足农药残 留分析试验的要求。
 |
用甲醇分别配制浓度为0.1、0.2、0.5、2.0 μg·mL-1 和10 μg·mL-1 的氟啶虫胺腈标准溶液,在1.3.2 的液 相色谱条件下进行测定,求出线性回归方程为y= 0.022 6x+0.001 8,相关系数r=1.000,可见氟啶虫胺腈 在此浓度区间内有良好的线性关系。 2.2.2 方法的准确度、精密度和灵敏度
分别称取空白棉叶、土壤和棉籽样品,向其中分 别添加适量的氟啶虫胺腈标准溶液,使其在样品中的 添加浓度为0.05、0.5 mg·kg-1和2.5 mg·kg-1,每个浓 度设5 个平行试验,测定其添加回收率。分析结果表 明(表 2),对于5 种平行实验样本,氟啶虫胺腈的平 均添加回收率在76.81豫~94.43%之间,相对标准偏差 (RSD)在0.54%~7.20豫之间;按照信噪比(S/N)为3 确定仪器对氟啶虫胺腈的最小检出量(LOD)为1 ng; 通过向空白样品中添加不同浓度的氟啶虫胺腈标准 品,确定棉叶、棉籽和土壤中氟啶虫胺腈的最低检出 浓度(LOQ)均为0.05 mg·kg-1。
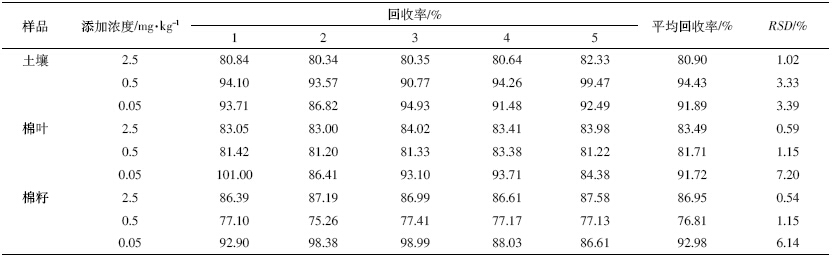 |
从棉籽和棉叶的色谱图中可以看到(图 3),在氟 啶虫胺腈的出峰位置基线不呈水平状态,基质干扰效 应较为明显,这会影响到样品添加回收率和最低检出 浓度的制定,如表 2 中所示在低添加浓度时样品的回 收率会高于中、高浓度的添加回收率。
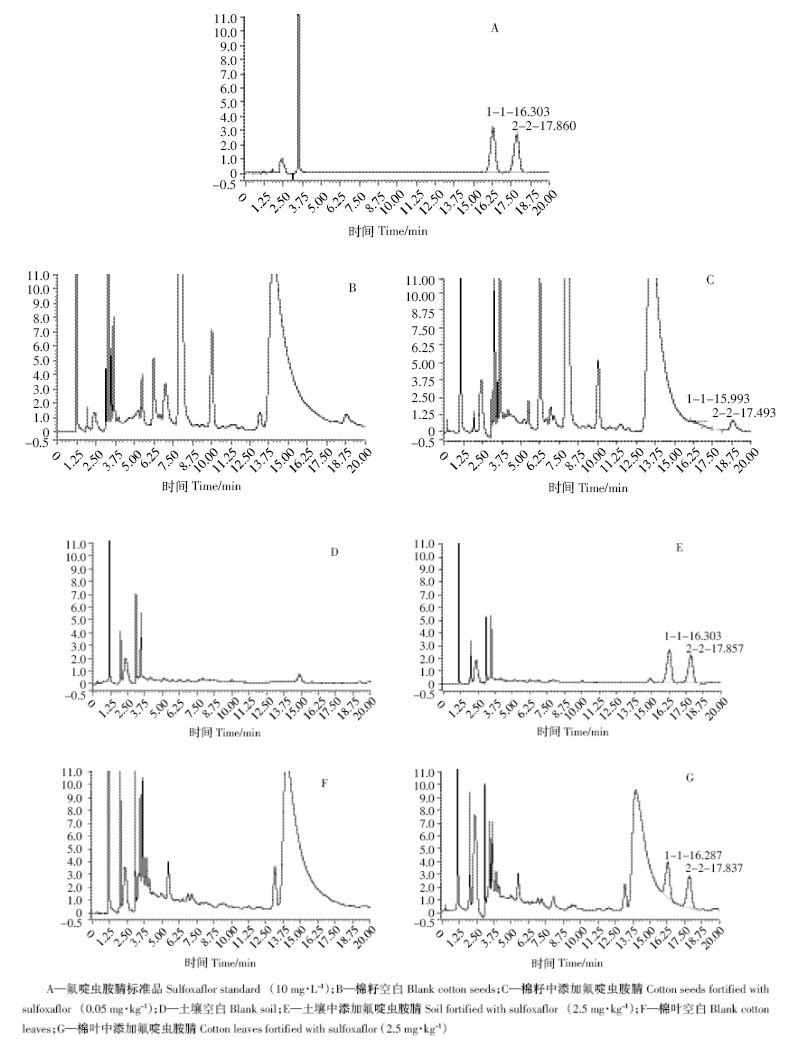
|
| 图 3 氟啶虫胺腈的高效液相色谱图 Figure 3 HPLC chromatogram of sulfoxaflor |
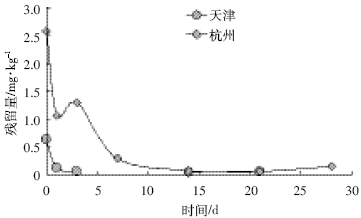
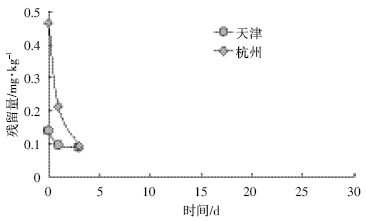
氟啶虫胺腈在天津和杭州两地棉叶和土壤中的 消解动态情况见图 4、图 5和表 3。
|
| 图 4 氟啶虫胺腈在棉叶中的消解动态曲线 Figure 4 Degradation curve of sulfoxaflor in cotton leaves |
|
| 图 5 氟啶虫胺腈在土壤中的消解动态曲线 Figure 5 Degradation curve of sulfoxaflor in soil |
从表 3中可以看出,氟啶虫胺腈在棉叶和土壤中 均属于易降解农药。在棉叶中的消解速率要比在土壤 中慢,这可能是由于土壤中的微生物对氟啶虫胺腈的 降解作用加快了其在土壤中的消解速率[16];氟啶虫胺 腈在天津试验点的消解速率要慢于杭州试验点,这可 能是两地气候差异所致,天津试验点的消解动态试验 时间在2011年夏季,同期天津的降水量为419.6 mm, 平均气温为25.6 ℃,日照时数为627 h;杭州的消解 动态试验时间在2010年夏季,同期杭州的降水量为 612.1 mm,平均气温为27.3℃,日照时数为674 h。所以 地处南方的杭州与北方的天津相比拥有更丰沛的雨 水、更大的湿度、更高的温度和更长的日照时间,这几 个因素是导致氟啶虫胺腈在杭州消解更快的原因[17]。 2.4 最终残留试验结果
2010—2011 年施用50%氟啶虫胺腈水分散粒剂 按低剂量0.6 g·30 m-2 和高剂量0.9 g·30 m-2,在棉花 盛花期开始首次施药,各设3 次和2 次施药,2 次施 药间隔为7 d。在距最后1 次施药7、14 d和21 d时氟啶虫胺腈在棉籽和土壤中的最终残留量均低于方法 最低检出浓度,视为未检出。 3 结论
建立了一套氟啶虫胺腈在棉花中的提取和检测 的方法,样品采用乙腈提取,正己烷萃取除杂,氟罗里 硅土柱层析净化,正己烷/丙酮(体积比6:4)混合液洗 脱,甲醇定容,高效液相色谱进行检测。方法稳定、可 靠,准确性、灵敏度和精确性均完全满足棉花这种富 含色素和油脂的农作物的农药登记残留试验要求。
田间消解动态试验结果表明,氟啶虫胺腈在供试 两地棉叶和土壤中的半衰期均小于10 d,按照《化学 农药环境安全评价试验准则》[18]的评价标准,氟啶虫 胺腈在棉叶和土壤中均属于易降解农药。
2010—2011 年南北两地最终残留试验结果表 明:分别设置低剂量0.6g·30m-2和高剂量0.9 g·30m-2, 在棉花盛花期开始首次施药,各设3 次和2 次施药,2 次施药间隔为7 d,在棉花收获期时氟啶虫胺腈在距 最后1次施药的7、14 d和21 d的棉籽中的最终残留 量均低于方法最低检出浓度0.05 mg·kg-1,由于世界 各国均未制定氟啶虫胺腈在棉花中的最大残留限量 值,所以本试验的研究结果将为各国制定此项标准提 供依据。
| [1] | 石小丽. 2010 年世界农药会议新品种——氟啶虫胺腈[J]. 农药研究与应用, 2010(6): 42-43. SHI Xiao-li. New pesticide at 2010 world congress--sulfoxaflor[J]. A grochemicals Research & A pplication, 2010(6): 42-43.(in Chinese) |
| [2] | 崔元英. 50%氟啶虫胺腈 WDG 对棉花盲蝽蟓和烟粉虱的防治效果研究[J]. 农业灾害研究, 2012, 2(2): 14-16. CUI Yuan-ying. The study of 50% sulfoxaflor water dispersible granuleto control blind stinkbugs and Bemisia tabaci of cotton[J]. Journal of A gricultural Catastrophology, 2012, 2(2): 14-16.(in Chinese) |
| [3] | Rasoulpour R J, Ellis-hutchings R G, Terry C, et al. A novel mode-ofaction mediated by the fetal muscle nicotinic acetylcholine receptor resulting in developmental toxicity in rats[J]. Toxicological Sciences, 2012,127(2): 522-534. |
| [4] | Siebert M W, Thomas J D, Steve P N, et al. Field evaluations of sulfoxaflor, a novel insecticide, against tarnished plant bug(Hemiptera: miridae) in cotton[J]. The Journal ofCotton Science, 2012, 16: 129-143. |
| [5] | Lysandrou M, Ahmad M, Longhurst C. Comparative efficacy of sulfoxaflor against cotton leafhopper, amrasca devastans(distant)(Cicadellidae: homoptera) under field conditions of Punjab and Sindh[J]. J A gricRes, 2010, 48(4): 517-524. |
| [6] | 林仁魁, 邹华娇, 吴德飞. 氟啶虫胺腈对褐飞虱的田 间防治效果[J]. 农药, 2012, 51(8): 619-620. LIN Ren-kui, ZOU Hua-jiao, WU De-fei. Field efficacy of sulfoxaflor240 g/L SC against Nilaparvata lugens(Stål) [J]. A grochemicals, 2012,51(8): 619-620.(in Chinese) |
| [7] | Oliveira E E, Schleicher S, Büschges A, et al. Desensitization of nicotinicacetylcholine receptors in central nervous system neurons of the stickinsect(Carausius morosus) by imidacloprid and sulfoximine insecticides[J]. Insect Biochemistry and Molecular Biology, 2011, 41: 872-880. |
| [8] | Sparks T C, Deboer G J, Wang N X, et al. Differential metabolism of sulfoximine and neonicotinoid insecticides by drosophila melanogastermonooxygenase CYP6G1[J]. Pesticide Biochemistry and Physiology, 2012,103: 159-165. |
| [9] | Perry T, Chan J Q, Batterham P, et al. Effects of mutations in drosophilanicotinic acetylcholine receptor subunits on sensitivity to insecticidestargeting nicotinic acetylcholine receptors[J]. Pesticide Biochemistry andPhysiology, 2012, 102: 56-60. |
| [10] | Watson G B, Loso M R, Babcock J M, et al. Novel nicotinic action of thesulfoximine insecticide sulfoxaflor[J]. Insect Biochemistry and Molecular Biology, 2011, 41(7): 432-439. |
| [11] | Babcock J M, Gerwick C B, Jim X H, et al. Biological characterizationof sulfoxaflor, a novel insecticide[J]. Pest Manag Sci, 2011, 67: 328-334. |
| [12] | Zhu Y M, Loso M R, Watson G B, et al. Discovery and characterizationof sulfoxaflor, a novel insecticide targeting sap-feeding pests[J]. J A gricFood Chem, 2011, 59, 2950-2957. |
| [13] | 陈九星, 付启 明, 陈力华, 等. 氟啶虫胺腈在不同有机溶剂中的光化学降解[J]. 环境科学学报, 2012, 32(12): 3015-3020. CHEN Jiu-xing, FU Qi-ming, CHEN Li-hua, et al. Photodegradationof sulfoxaflor in various organic solvents[J]. A cta Scientiae Circumstantiae, 2012, 32(12): 3015-3020.(in Chinese) |
| [14] | 黄 庆, 欧晓明, 陈力华, 等. 气相色谱法测定柑橘与土壤中氟啶虫胺腈的残留量[J]. 光谱实验室, 2013, 30(2): 985-990. HUANG Qing, OU Xiao-ming, CHEN Li-hua, et al. Determination ofsulfoxaflor residue in citrus fruits and soil by gas chromatography withelectron capture detector[J]. Chinese Journal ofSpectrosopy Laboratory,2013, 30(2): 985-990.(in Chinese) |
| [15] | 孙建琴. 色谱技术的分析比较及其新发展趋势[J]. 凯里学院学报,2009, 27(6): 42-43. SUN Jian-qin. Comparison of chromatographic technique and its newtrend of development[J]. Journal of Kaili University, 2009, 27(6):42-43.(in Chinese) |
| [16] | 郭荣君, 李世东, 章力建, 等. 土壤农药污染与生物修复研究进展[J]. 中国生物防治, 2005, 21(3): 129-135. GUO Rong-jun, LI Shi-dong, ZHANG Li-jian, et al. Soil contamination by chemical pesticides and its bioremediation[J]. Chinese JournalofBiological Control, 2005, 21(3): 129-135.(in Chinese) |
| [17] | 李晓亮, 秦智伟, 候利园, 等. 土壤环境因素对残留农药降解的影响[J]. 东北农业大学学报, 2009, 40(4): 132-135. LI Xiao-liang, QIN Zhi-wei, HOU Li-yuan, et al. Influence of environmental factors on degradation of residual pesticide in soil[J]. Journal ofNortheast A gricultural University, 2009, 40(4): 132-135.(in Chinese) |
| [18] | 国家环保局.化学农药环境安全评价试验准则[J]. 农药科学与管理,1990(4): 4-9. State Environmental Protection Administration. Test guidelines of chemical pesticide environmental safety evaluation[J]. Pesticide Science andA dministration, 1990(4): 4-9.(in Chinese) |
 2014, Vol. 31
2014, Vol. 31