2. 华南农业大学资源环境学院,广州 510642;
3. 广东省温氏集团研究院,广东 云浮 527400
2. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China;
3. Research Institute of Wen′s Foodstuff Group Co., Ltd., Guangdong, Yunfu 527400, China
我国的畜禽养殖产业规模逐年扩大,畜禽养殖业已成为农业面源污染的主要来源之一,大量未能妥善处置的畜禽粪污对生态环境造成恶劣影响[1-2]。养殖业废弃物中沼液作为可利用再生水资源,在解决干旱和半干旱地区缺水的同时可提供大量氮、磷养分,因此,沼液灌溉是目前养殖业废弃物资源化的重要方式之一[3-4]。然而,沼液还含有大量钠离子、钾离子以及碳酸氢根离子等,灌溉不当可能引起土壤盐分过量累积,导致土壤盐渍化,对农田土壤产生潜在污染风险。
利用强抗逆性高值作物品种运筹减轻长期沼液灌溉农田负荷是目前缓解沼液引起农田盐碱化的重要手段,其中油葵作为盐碱地的先锋作物,具有较强的抗盐碱能力,能够改善土壤物理性质(使土壤容重减小,土壤孔隙度增加),增加土壤有机质含量,改善微生物环境[5]。同时油葵具有观赏与经济价值,是目前畜禽粪污农田安全消纳与高效资源化利用的优选作物。油葵对于盐胁迫抗逆性已有较多研究[6-8],但沼液含较多碱性盐离子成分,碱胁迫很可能成为粪污农田利用的主要限制因素,因此,同时研究油葵盐、碱胁迫抗逆性将能够更好地应对长期沼液灌溉产生的农田污染风险。
植物种子萌发是作物成苗的前提,也是植物整个生命周期最敏感的阶段[9],前期研究显示盐、碱胁迫对植物种子萌发产生的重要作用将直接影响植物整个生长周期。盐胁迫主要通过渗透胁迫和离子胁迫影响种子萌发[10]。渗透作用产生低水势抑制种子水分吸收;离子作用通过大量有害盐离子进入细胞内,造成代谢紊乱,破坏酶和其他大分子的结构,损坏细胞器和质膜,抑制呼吸、光合作用和蛋白质合成[11-13];碱胁迫涉及到的高pH胁迫[14],对细胞内的细胞器结构有很大的影响[15]。
本研究将室内与大田实验结合,在室内通过盐、碱胁迫下油葵种子发芽过程,明确油葵发芽的盐、碱耐受阈值,探讨盐、碱离子对油葵种子发芽的影响,在大田设置不同沼液灌溉量灌溉油葵,观测沼液产生的盐、碱胁迫对油葵生长状况与农艺性状的影响,确定其受胁迫程度,探讨油葵耐盐、碱机制,为油葵安全消纳养殖业废弃物、缓解盐害提供理论依据。
1 材料与方法 1.1 供试材料供试油葵(Helianthus annuus Linn)品种为当地普遍种植品种。室内实验所用NaCl、Na2SO4、NaHCO3和Na2CO3均为分析纯。
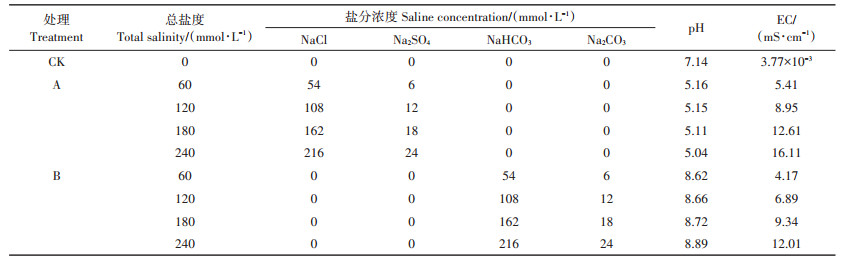
1.2 试验设计 1.2.1 油葵种子萌发实验依畜禽养殖废水中盐分类型可将胁迫分为中性盐胁迫和碱性盐胁迫,故实验选择两种中性盐(NaCl、Na2SO4)和两种碱性盐(NaHCO3、Na2CO3),模拟畜禽养殖废水中不同盐离子产生的胁迫作用,以去离子水作为对照(CK),将NaCl、Na2SO4按9︰1比例混合(A处理组),NaHCO3、Na2CO3按9︰1比例混合(B处理组),A、B处理各设4个盐浓度,分别为60、120、180、240 mmol·L-1(表 1)。
|
|
表 1 各处理盐碱组成、pH及电导率(EC) Table 1 Salt composition, pH and EC of each treatment |
随机选用籽粒饱满,大小一致的油葵种子用于发芽实验,油葵种子用3% 的NaClO消毒10 min并用蒸馏水反复冲洗数次后,放置在铺有2层滤纸的直径90 mm培养皿中,每个培养皿50粒种子。将各培养皿内滤纸润湿后加入20 mL处理溶液,重复3次。将培养皿置于25 ℃生化培养箱培养。每日更换一次相应浓度的处理液,保证培养稳定。
1.2.2 大田实验本研究地点位于咸阳市淳化县咸阳温氏园林猪场附近(北纬34°83′,东经108°63′)。设立小区实验,于2021年6月9日种植油葵,2021年9月24日收获,实验田分为自然生长区域、低沼液灌溉量区域和高沼液灌溉量区域,种植油葵期间不另外添加化肥,每块小区面积为3 m ×24 m,种植密度为50 cm ×60 cm。实验地0~20 cm土层理化性质见表 2,土壤阴阳离子含量见表 3,沼液理化性质及阴阳离子含量见表 4,沼液Na+浓度约为35 mmol·L-1。油葵种植一个月后开始灌溉沼液,低沼液灌溉量区每次灌溉沼液量为150 m3· hm-2,高沼液灌溉量区每次灌溉沼液量为600 m3·hm-2,油葵整个生育期共灌溉5次,油葵成熟后随机选取15株进行株高、花盘直径、含油率等农艺性状测定。
|
|
表 2 土壤理化性质 Table 2 Physical and chemical properties of soil |
|
|
表 3 土壤中阴阳离子含量 Table 3 Content of anion and cation in soil |
|
|
表 4 沼液理化性质及阴阳离子含量 Table 4 Content of anion and cation in biogas slurry |
当胚根突破种皮长度约等于种子时,视为种子萌发,连续7 d每日记录种子萌发数,并计算相关的萌发参数。
(1)发芽率(GR)
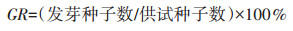
|
(1) |
(2)耐盐指数(K)
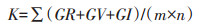
|
(2) |
式中:GR为发芽率;GV为发芽势(GV=第3 d发芽的种子数/供试种子数×100%);GI为发芽指数(GI=∑Gt/Dt,Gt为t日内的发芽数,Dt为相应的发芽天数);m为计算指标项数,n为盐浓度梯度个数。
(3)相对盐害率(RSH)
RSH=(对照种子萌发率-处理种子萌发率)/对照种子萌发率×100%。
1.3.2 叶片细胞膜相对透性细胞膜相对透性:取0.5 g新鲜的油葵叶片组织,用无菌蒸馏水冲洗干净,用滤纸吸干叶片表面的水分,剪碎叶片后置入50 mL小烧杯,加入30 mL蒸馏水,使叶片完全浸没在水中,静置24 h,混匀后用电导仪测量烧杯内液体的电导率,称为电导率L1,读取数值后,将烧杯内水分煮沸5 min后,冷却至室温,混匀后再测量电导率L2,细胞膜相对透性用公式(3)计算:

|
(3) |
(1)株高(cm):开花终期,随机取15株,测量从子叶节到茎秆顶端的高度;
(2)花盘直径(cm):在成熟期随机取15个花盘量其直径,重复3次;
(3)生物量(g·株-1):在成熟期随机取6株油葵,洗净、烘干、称质量;
(4)千粒重(g):随机选取15个花盘,随机取1 000粒籽粒,测定质量,重复3次;
(5)实际产量(kg·hm-2):收获后按实际称质量;
(6)籽粒含油率(%):取10个花盘籽粒,每个花盘饱满籽粒50粒进行测量,重复3次;对油葵含油率建立标准曲线进行含油率测定,利用核磁共振仪测定含油率。
1.3.4 离子含量将样品清洗后放入烘箱105 ℃杀青10 min,70 ℃烘至恒质量,干样研磨成粉末,每个干样分别称取0.1 g,置入消解管中,加入10 mL浓硝酸,隔夜,175 ℃消解至溶液清透,ICP-MS检测钠、钾、钙、镁含量。
1.4 数据处理用SPSS 9.0进行显著性差异分析和误差计算,用Origin 2021绘图。
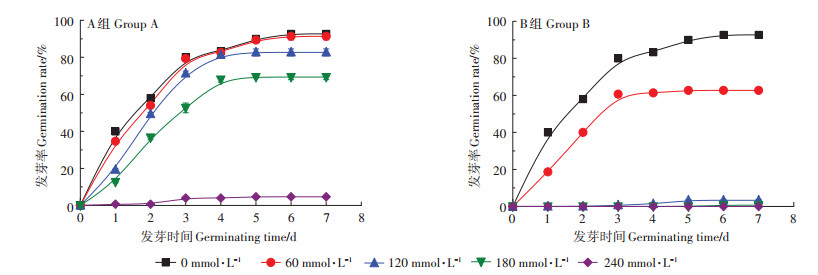
2 结果与分析 2.1 盐、碱胁迫下油葵种子萌发阈值A、B处理组对种子发芽率的影响如图 1所示。A组溶液浓度为60、120 mmol·L-1时发芽率为91.33% 和82.67%,均大于80%,抑制作用不强;180 mmol·L-1时发芽率为69.33%,仍在半数抑制浓度(实验组达到对照组发芽率50%时对应的盐浓度)之下;240 mmol·L-1时,发芽率为4.67%,与CK相比下降88个百分点,即油葵种子耐中性盐极限值在180~240 mmol·L-1之间。B组溶液浓度为60 mmol·L-1时油葵发芽率降为62.67%,已接近半数抑制浓度;120 mmol·L-1时为3.33%,与CK相比下降89个百分点,超出油葵种子耐盐极限;180、240 mmol·L-1时,油葵种子发芽率接近0,即油葵种子耐碱性盐极限值在60~120 mmol·L-1之间。A、B处理组对油葵种子累积发芽曲线趋势相似,随着浓度的增大,发芽率降低。但B组对种子发芽率影响明显大于A组,即碱性盐对种子发芽的抑制作用更强。CK以及A、B处理组溶液浓度为60 mmol·L-1时,油葵种子发芽率在第3 d后只有小幅升高,A组处理浓度为120 mmol·L-1和180 mmol·L-1时,发芽率在第3 d后还有大幅提升,说明正常情况下,油葵种子会在第3 d完成发芽,中性盐会延迟种子发芽,碱性盐则使种子死亡或休眠,产生这一差异的主要原因可能是碱性盐产生的高pH加剧了对种子的破坏作用。
|
图 1 盐碱胁迫下各处理组油葵种子发芽率 Figure 1 Germination rate of seeds under salt and alkali stress treatment |
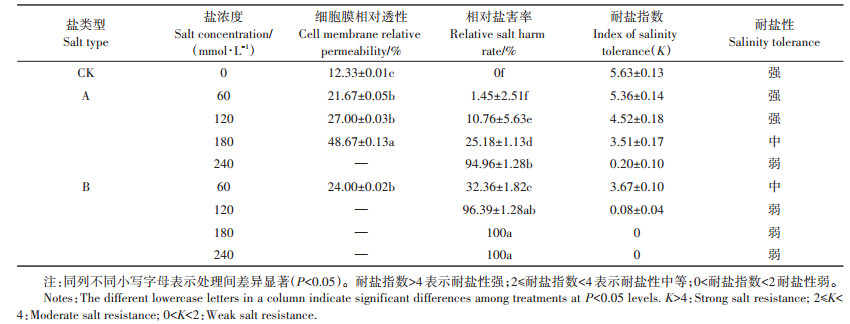
A、B处理组对油葵胚芽细胞膜受害程度即胁迫产生的盐害作用见表 5。A组溶液浓度为60、120、180 mmol·L-1时,胚芽细胞膜相对透性分别是CK的1.76、2.19、3.95倍,240 mmol·L-1时胚芽未生长;B组溶液浓度为60 mmol·L-1时,胚芽细胞膜相对透性是CK的1.95倍,浓度超过60 mmol·L-1后胚芽未生长。A组溶液浓度为60、120、180 mmol·L-1时,种子相对盐害率分别为1.45%、10.76%、25.18%,240 mmol·L-1时达到94.96%;B组溶液浓度为60 mmol·L-1时,种子相对盐害率达到32.36%,120 mmol·L-1时,达到96.39%,即随着中性盐溶液浓度的升高,油葵种子萌发的盐害作用增强,但在0~180 mmol·L-1中性盐胁迫以及0~ 60 mmol·L-1碱性盐胁迫范围内不会对油葵种子萌发产生较大盐害作用。浓度为60、120 mmol·L-1的A组处理与60 mmol·L-1的B组处理,细胞膜相对透性无显著差异(P > 0.05),相对盐害率相差较大;B组溶液浓度为60 mmol·L-1时相对盐害率分别是A组溶液浓度为60 mmol·L-1和120 mmol·L-1时的22.32倍和3.01倍,说明碱性盐产生的高pH值对种子的迫害作用强于盐产生的渗透胁迫作用。同时耐盐指数显示A处理组油葵在盐浓度为120 mmol·L-1时呈强耐盐性,180 mmol·L-1时呈中等耐盐性,240 mmol·L-1时呈弱耐盐性;在B处理组中,在盐浓度为60 mmol·L-1时,表现为中等耐盐性,在120 mmol·L-1时呈弱耐盐性。
|
|
表 5 盐碱胁迫下各处理对种子细胞膜透性、相对盐害率及耐盐指数的影响 Table 5 Relative membrane permeability, relative salt harm rate and salinity tolerance index of seeds under salt and alkali stress treatment |
不同浓度A、B处理组溶液对油葵胚根、胚芽阳离子含量的影响如图 2所示。A、B组溶液处理下,Na+含量均显著高于CK(P < 0.05)。当A组溶液浓度为120 mmol·L-1、B组浓度为60 mmol·L-1时,Na+含量达到最高值,分别是CK的7.45、8.25倍,随后Na+含量不再增加,说明种子一定程度上可以规避Na+的胁迫,对种子本身产生保护作用。低浓度(60~120 mmol·L-1)A处理对K+含量没有显著影响,与CK无显著差异(P > 0.05),高浓度时K+含量明显下降,当A组溶液浓度达到180、240 mmol·L-1时K+含量分别为CK的79.91%、51.86%;B组各处理,K+含量与CK相比均显著下降,是CK的59.48%~47.00%,即碱性盐会影响油葵种子对K+的吸收,盐浓度在120~240 mmol·L-1之间,K+含量无显著差异(P > 0.05)。

|
不同小写字母表示处理间差异显著(P < 0.05)。下同 Different lowercase letters show significant differences among different treatments(P < 0.05). The same below 图 2 盐碱胁迫各处理对种子Na+、K+含量及K+/Na+的影响 Figure 2 Effects of salt and alkali stress treatment on Na+, K+ contents and K+/Na+ of seeds |
K+/Na+比率在A、B组溶液处理下均显著降低(P < 0.05),A组处理下K+/Na+比率与CK相比下降79.90%~87.33%,B组与CK相比下降91.11%~ 92.81%,即碱性盐对K+/Na+比率影响更大,对油葵种子发芽时的离子稳态影响更大。
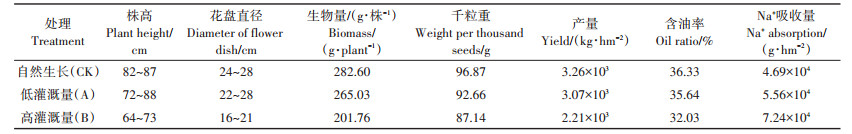
2.3 土壤盐碱化对油葵农艺性状的影响油葵自然生长与在灌溉沼液下生长的各农艺性状如表 6所示。自然生长的油葵株高82~87 cm,盘径24~28 cm,生物量达到282.60 g·株-1,千粒重96.87 g,籽粒含油率36.33%,产量3.26×103 kg·hm-2;低灌溉区,油葵株高72~88 cm,盘径22~28 cm左右,生物量达到265.03 g · 株-1,千粒重92.66 g,籽粒含油率35.64%,产量达到3.07×103 kg·hm-2,各指标与自然生长下油葵相差不大;高灌溉区,油葵株高64~73 cm,与自然生长的油葵相比下降16.09%~26.44%,盘径16~21 cm,平均下降30.77%,生物量201.76 g·株-1,下降28.61%,千粒重87.14 g,下降10.04%,籽粒含油率为32.03%,无明显变化,产量为2.21×103 kg·hm-2,下降32.21%。由此得出当沼液灌溉量较小时对油葵各农艺性状影响不大,当沼液灌溉量过大时,将会对油葵生长产生明显抑制作用。检测油葵Na+含量发现,随着沼液灌溉量的增加,油葵吸收Na+量也逐渐增加,在无沼液灌溉时油葵体内Na+含量为4.69×104 g· hm-2,在低沼液灌溉量下,油葵体内Na+含量为5.56× 104 g·hm-2,在高沼液灌溉量下,油葵体内Na+含量为7.24×104 kg·hm-2,是无沼液灌溉时的1.54倍,即沼液灌溉量的增大会增加油葵对Na+的吸收,油葵可作为抗逆性品种缓解沼渣农用引起的农田盐碱化,但需要合理控制沼液灌溉量。
|
|
表 6 盐碱化土壤种植的油葵各农艺性状统计 Table 6 Statistics of agronomic characters of oil sunflower planted in saline-alkali soil |
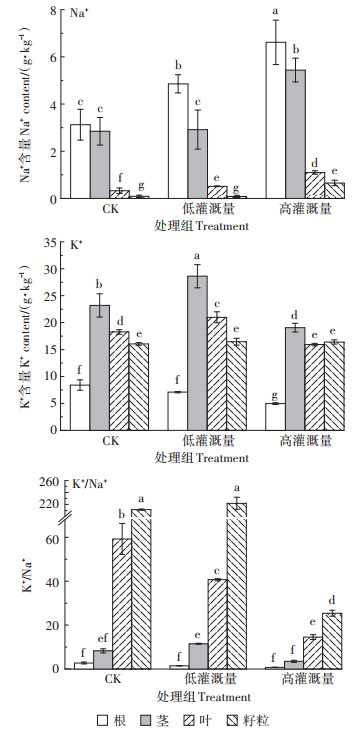
不同沼液灌溉量下油葵各组织Na+、K+含量和各组织K+/Na+比率如图 3所示。随着沼液灌溉量的增加,油葵各组织中Na+含量显著增加(P < 0.05)。在低沼液灌溉量下,油葵根、叶的Na+含量显著增加(P < 0.05),分别是自然生长条件下的1.55、1.57倍,茎、籽粒Na+含量无明显变化。在高沼液灌溉量下,油葵根、茎、叶、籽粒的Na+含量显著增加,分别是自然生长条件下的2.12、1.91、3.34、7.34倍。灌溉沼液对油葵籽粒中K+含量无显著影响(P > 0.05),在低沼液灌溉下茎、叶K+含量显著增加,在高沼液灌溉量下油葵根、茎、叶K+含量显著下降(P < 0.05)。油葵各组织K+/Na+比率在低沼液灌溉量下与自然生长下油葵无显著差异(P > 0.05),在高沼液灌溉量下油葵各组织K+/Na+比率明显下降,根、茎、叶、籽实K+/Na+比率与自然生长下油葵相比分别下降72%、57%、75%、88%,高沼液灌溉量对油葵离子稳态造成较大影响。
|
图 3 沼液灌溉对油葵Na+、K+含量及K+/Na+的影响 Figure 3 Effects of biogas slurry irrigation on Na+, K+ contents and K+/Na+ of sunflower |
利用强抗逆性高值作物消纳养殖业废弃物,是运筹减轻长期沼液灌溉农田负荷、缓解农田盐碱化的重要手段。纳污抗逆高值作物品种选育是实现种养耦合的关键,前期大量研究显示油葵具有耐盐碱、耐水肥、易种植、生物量大、富集系数高等优势[16-19],可作为养殖业废弃物消纳的先锋植物。本研究显示油葵在钠离子浓度为35 mmol·L-1的沼液灌溉下,当灌溉量较小时农艺性状未受显著影响,当灌溉量较大时油葵各农艺指标会受到较大抑制,与NOREEN等[20]研究结果相似。其室内实验探明油葵盐、碱胁迫阈值,发现油葵种子随着不同类型盐溶液浓度的增加,发芽率、耐盐指数指标有不同程度的减小,相对盐害率随浓度的增加而增大,且碱胁迫危害阈值(60~120 mmol·L-1)显著低于盐胁迫危害阈值(180~240 mmol·L-1)。大量研究同样显示种子对盐胁迫的响应主要是随着盐浓度的增加,种子发芽率降低,发芽时间延长[10]。也有研究表明,低浓度盐溶液可以促进种子萌发[21]。在本研究中,低浓度中性盐溶液不会对油葵种子萌发产生促进作用,同时也无抑制作用;但低浓度碱性盐溶液会对种子萌发产生较强的抑制作用,该结果与金梦野等[22]对盐碱复合胁迫水稻种子发芽的研究结果类似,中性盐可能会延迟种子发芽,碱性盐则会直接使种子死亡或休眠,因此养殖业废弃物引入的高浓度碱性离子是限制油葵正常生长的重要因素。
渗透胁迫通常被认为是盐胁迫产生危害的主要因素,但本研究显示当中性盐、碱性盐处理下细胞膜透性无显著差异时,碱性盐产生的相对盐害率是中性盐的3.01~22.32倍,碱性盐带来的pH胁迫对种子萌发的胁迫作用远大于盐本身产生的渗透胁迫作用。由此推断,碱性盐中高pH不仅加剧了渗透胁迫和离子毒性对种子的影响,而且还会分解种子结构,抑制胚芽、胚根生长[10]。
K+/Na+调控是抗逆性作物应对盐胁迫的主要耐性机制[23],在不同类型盐离子胁迫下,由于Na+与K+具有相似的离子半径和水合能,许多酶的结合位点会发生动态的吸收竞争[24]。室内实验结果显示,盐、碱胁迫下油葵在萌发过程中体内Na+含量上升,同时K+含量有不同程度的下降。油葵种子在盐、碱胁迫下保持K+含量,对于调节渗透势、调节酶活性、维持电荷平衡保持正常生理活动具有重要意义。从K+/Na+实验结果来看,在碱胁迫下K+/Na+的下降比率显著大于盐胁迫,该结果与计算得出的耐盐指数规律相符,也与LV等[25]的研究相似,说明碱性盐离子对种子萌发离子稳态破坏更为严重。在大田实验中也发现随着沼液灌溉量的增大,油葵各组织Na+含量上升,K+含量有不同程度的下降,高沼液灌溉量对K+/Na+影响更大。在较高灌溉量下,油葵吸收Na+含量为7.24×104 g·hm-2,是无沼液灌溉时的1.54倍。即使沼液中同时含有较高含量K+,在高沼液灌溉量下,油葵各组织K+/Na+也会大幅下降。
4 结论(1)油葵发芽期对盐、碱胁迫耐受及响应具有一定差异,对中性盐胁迫耐受阈值在180~240 mmol·L-1之间,对碱性盐胁迫耐受阈值在60~120 mmol·L-1之间。油葵对盐胁迫的耐受性高于碱胁迫,碱性盐产生的高pH危害高于盐离子渗透胁迫,且碱性盐会更大程度破坏油葵离子稳态,影响油葵发芽。
(2)150 m3·hm-2低沼液灌溉量对油葵各农艺性状影响不大,但沼液灌溉量较高(600 m3·hm-2)时,会对油葵生长产生明显抑制,产量与含油率均显著下降,Na+吸收量增大,K+吸收量减小,离子稳态受到破坏。
(3)油葵可作为强抗逆性高值作物应用于养殖业废弃物消纳,但应合理控制沼液灌溉量,过高沼液灌溉应注意控制其HCO3-、CO32-的含量,调控废水pH,维持油葵离子稳态平衡,减少盐碱胁迫对农作物伤害。
致谢 感谢温氏秦晋养猪公司咸阳公司园林种猪场畜禽粪污资源化示范基地为本研究提供场地。
| [1] |
刘源, 崔二苹, 李中阳, 等. 再生水和养殖废水灌溉下生物质炭和果胶对土壤盐碱化的影响[J]. 灌溉排水学报, 2018, 37(6): 16-23. LIU Y, CUI E P, LI Z Y, et al. Effects of irrigating biochar- and pectin-amended soil with treated municipal wastewater and swine wastewater on soil salinity and sodicity[J]. Journal of Irrigation and Drainage, 2018, 37(6): 16-23. |
| [2] |
贾爱萍, 孙迎韬, 李文彦, 等. 畜禽粪便农用对土壤氨氧化及其功能微生物的影响[J]. 农业环境科学学报, 2014, 33(3): 415-421. JIA A P, SUN Y T, LI W Y, et al. Effects of manure application on soil ammonia oxidation and functional microorganism[J]. Journal of Agro-Environment Science, 2014, 33(3): 415-421. |
| [3] |
崔丙健, 高峰, 胡超, 等. 非常规水资源农业利用现状及研究进展[J]. 灌溉排水学报, 2019, 38(7): 60-68. CUI B J, GAO F, HU C, et al. The use of brackish and reclaimed waste water in agriculture: A review[J]. Journal of Irrigation and Drainage, 2019, 38(7): 60-68. |
| [4] |
吴根义, 廖新俤, 贺德春, 等. 我国畜禽养殖污染防治现状及对策[J]. 农业环境科学学报, 2014, 33(7): 1261-1264. WU G Y, LIAO X D, HE D C, et al. Current situation and countermeasures of livestock industry pollution control in China[J]. Journal of Agro-Environment Science, 2014, 33(7): 1261-1264. |
| [5] |
肖克飚. 宁夏银北地区耐盐植物改良盐碱土机理及试验研究[D]. 杨凌: 西北农林科技大学, 2013. XIAO K B. Experimental study on mechanism of halophyte-remediation in alkali-saline soil in the north region of Yinchuan City, Ningxia[D]. Yangling: Northwest A & F University, 2013. |
| [6] |
马荣, 王成, 马庆, 等. 向日葵芽苗期离子对复合盐胁迫的响应[J]. 中国生态农业学报, 2017, 25(5): 720-729. MA R, WANG C, MA Q, et al. Ion response of sunflower at sprouting stage to mixed salt stress[J]. Chinese Journal of Eco-Agriculture, 2017, 25(5): 720-729. |
| [7] |
贾秀苹, 岳云, 陈炳东. 盐胁迫对油葵生育时期和农艺性状的影响分析[J]. 作物杂志, 2009(6): 45-48. JIA X P, YUE Y, CHEN B D. Effects of salt stress on growth period and agronomic characters of oil sunflower[J]. Crops, 2009(6): 45-48. DOI:10.3969/j.issn.1001-7283.2009.06.011 |
| [8] |
凌云鹤, 周瑶, 景兵, 等. 盐胁迫对向日葵幼苗生长及生理特性的影响[J]. 干旱地区农业研究, 2019, 37(4): 139-145. LING Y H, ZHOU Y, JING B, et al. Effects of salt stress on growth and physiological characteristics of sunflower at seedling stage[J]. Agricultural Research in the Arid Areas, 2019, 37(4): 139-145. |
| [9] |
UÇARL C. Effects of salinity on seed germination and early seedling stage[M]//Abiotic stress in plants. Intech Open, 2020.
|
| [10] |
IBRAHIM E A. Seed priming to alleviate salinity stress in germinating seeds[J]. Journal of Plant Physiology, 2016, 192: 38-46. DOI:10.1016/j.jplph.2015.12.011 |
| [11] |
HASEGAWA P M, BRESSAN R A, ZHU J K, et al. Plant cellular and molecular responses to high salinity[J]. Annual Review of Plant Biology, 2000, 51(1): 463-499. DOI:10.1146/annurev.arplant.51.1.463 |
| [12] |
PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: A review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3): 324-349. DOI:10.1016/j.ecoenv.2004.06.010 |
| [13] |
PANDA S K, KHAN M H. Growth, oxidative damage and antioxidant responses in greengram(Vigna radiata L.)under short-term salinity stress and its recovery[J]. Journal of Agronomy & Crop Science, 2010, 195(6): 442-454. |
| [14] |
YANG C W, ZHANG M L, LIU J, et al. Effects of buffer capacity on growth, photosynthesis, and solute accumulation of a glycophyte (wheat)and a halophyte(Chloris virgata)[J]. Photosynthetica, 2009, 47(1): 55-60. DOI:10.1007/s11099-009-0010-y |
| [15] |
LIN J, LI X Y, ZHNAG Z J, et al. Salinity-alkalinity tolerance in wheat: Seed germination, early seedling growth, ion relations and solute accumulation[J]. African Journal of Agricultural Research, 2012, 7(3): 467-474. |
| [16] |
CHEN M, KANG Y, WAN S, et al. Drip irrigation with saline water for oleic sunflower (Helianthus annuus L.)[J]. Agricultural Water Management, 2009, 96(12): 1766-1772. DOI:10.1016/j.agwat.2009.07.007 |
| [17] |
SHI D, SHENG Y. Effect of various salt–alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors[J]. Environmental and Experimental Botany, 2005, 54(1): 8-21. DOI:10.1016/j.envexpbot.2004.05.003 |
| [18] |
PEREIRA S I A, MOREIRA H, ARGYRAS K, et al. Promotion of sunflower growth under saline water irrigation by the inoculation of beneficial microorganisms[J]. Applied Soil Ecology, 2016, 105: 36-47. DOI:10.1016/j.apsoil.2016.03.015 |
| [19] |
王旭, 孙兆军, 何俊, 等. 滴灌施沼液改良甘肃盐碱地的效果研究[J]. 中国农村水利水电, 2018(3): 55-58. WANG X, SUN Z J, HE J, et al. Research on the effect of drip irrigation of biogas slurry improved alkaline -saline soil in Gansu[J]. China Rural Water and Hydropower, 2018(3): 55-58. DOI:10.3969/j.issn.1007-2284.2018.03.012 |
| [20] |
NOREEN S, ASHRAF M. Modulation of salt(NaCl)-induced effects on oil composition and fatty acid profile of sunflower(Helianthus annuus L.)by exogenous application of salicylic acid[J]. Journal of the Science of Food & Agriculture, 2010, 90(15): 2608-2616. |
| [21] |
袁飞敏, 权有娟, 陈志国. 不同钠盐胁迫对藜麦种子萌发的影响[J]. 干旱区资源与环境, 2018, 32(11): 182-187. YUAN F M, QUAN Y J, CHEN Z G. Effects of different NaCl stress on seed germination of Quinoa[J]. Journal of Arid Land Resources and Environment, 2018, 32(11): 182-187. |
| [22] |
金梦野, 李小华, 李昉泽, 等. 盐碱复合胁迫对水稻种子发芽的影响[J]. 中国生态农业学报, 2020, 28(4): 566-574. JIN M Y, LI X H, LI F Z, et al. Effects of mixed saline-alkali stress on germination of rice[J]. Chinese Journal of Eco-Agriculture, 2020, 28(4): 566-574. |
| [23] |
DEINLEIN U, STEPHAN A B, HORIE T, et al. Plant salt-tolerance mechanisms[J]. Trends in Plant Science, 2014, 19(6): 371-379. DOI:10.1016/j.tplants.2014.02.001 |
| [24] |
RIAZ M, ARIF M S, ASHRAF M A, et al. A comprehensive review on rice responses and tolerance to salt stress[M]//HASANUZZAMAN M, FUJITA M, NAHAR K, et al. Advances in rice research for abiotic stress tolerance. Woodhead Publishing, 2019: 133-158.
|
| [25] |
LV B S, LI X W, MA H Y, et al. Differences in growth and physiology of rice in response to different saline-alkaline stress factors[J]. Agronomy Journal, 2013, 105(4): 1119-1128. DOI:10.2134/agronj2013.0017 |
 2022, Vol. 39
2022, Vol. 39