铁是植物生长所必需的重要矿物营养元素,其参与了植物光合作用、呼吸作用和固氮作用等重要的生命活动[1-2]。虽然土壤中铁含量丰富,但其多以三价铁的形式存在,这种价态的铁元素在碱性土壤中可利用率非常低[2]。相关研究表明,全球有30% 的地区土壤缺铁[3]。缺铁会导致植物叶绿体结构受损,从而抑制植物生长。农业生产中,往往通过大量施加传统铁肥来改善植物缺铁现象。但是,传统铁肥(如有机铁肥、无机铁肥和螯合铁肥)生物可利用性低,会导致铁肥资源浪费和土壤富营养化、结构恶化等环境问题[4]。近年来,随着纳米技术的快速发展,纳米材料在农业生产中的应用逐渐引起人们的关注。2018— 2020年,Nature Nanotechnology连续发表8篇综述[5-12],论述了纳米材料(Nanomaterials,NMs)作为新型肥料的巨大潜能。其中,KAH等[5]利用Meta分析总结了78篇已发表的关于纳米肥料的文章,表明纳米肥料对植物的促生效果比传统化肥高20%~30%。
铁基NMs对植物生长发育的影响已有相关研究,综合结果表明低浓度铁基NMs对植物生长存在明显促进效应[13]。铁基NMs具有作为纳米铁肥的潜能[14]。如ASKARY等[15]通过比较纳米铁肥与传统铁螯合剂对长春花(Catharanthus roseus)生理生化指标的影响,发现纳米铁肥能更好地促进长春花的生长。徐江兵等[16]的研究表明,中、低浓度Fe3O4 NMs能提高生菜的生物量和叶片光合速率。然而铁基纳米颗粒促进作物生长的内在机制尚不明确。对于植物来说,其产量和品质受到源、库之间相互作用的影响。光合同化产物的源强度由净光合速率和从源端转运光同化产物的速率共同决定[17]。优化源库比是提高作物产量和韧性的有效方法,BUSTOS等[18]的研究表明杂交小麦优良品种库端强度更强,对应产量更高。但是关于铁基NMs对植物光合产物的分配及转运的影响均未见报道。
叶面施用肥料通常为土壤施肥的补充方法,试验表明,在植物营养部位喷洒所需营养物质溶液对养分吸收有显著促进作用[19]。特别是在土壤pH值高、土壤碳酸盐等矿物含量高、根生长不足的情况下,纳米材料因其具有的小尺寸特点,通过叶面喷施的方式能更加快速地作用于植物[20]。一些叶面喷施铁基NMs的研究中也比较了NMs与传统铁肥Fe-EDTA对多种植物的作用效果,肯定了铁基NMs的促生作用[1]。大豆作为一种广泛种植的经济作物,其对全球农业具有重要意义。大豆是缺铁敏感型作物,本研究以大豆为受试生物,综合评估了两种铁基纳米材料(γ-Fe2O3 NMs和Fe3O4 NMs)在不同浓度叶面喷施处理下对大豆生理过程的影响,旨在选择铁基NMs作为铁肥的最佳施用浓度,确定最优铁基NMs类型,比较铁基NMs与传统铁肥作用效果;研究叶面喷施处理下,铁基NMs对大豆光合产物分配、运移的影响及潜在机理,为铁基NMs在农业生态系统中的应用提供理论基础与数据支撑。
1 材料与方法 1.1 试验材料供试大豆品种为中黄13。γ-Fe2O3 NMs购于US Research Nanomaterials(Houston,美国)。Fe3O4 NMs利用WEI等[21]的方法制备。两种NMs的形态和尺寸利用透射电子显微镜(TEM,JEM-2100,日本)观察得到;两种NMs的水力学直径和表面电荷利用纳米粒度仪(Malvern Instrument Inc.,英国)测定。两种NMs的晶型结构利用X射线衍射仪(XRD,D8 Advance,德国)分析,扫描范围为20°~80°,扫描速度为4°·min-1。
NMs喷施液制备:将10 mg NMs加入到100 mL去离子水中,利用超声清洗机超声30 min,形成浓度为100 mg·L-1的均一稳定的悬浮液。利用去离子水进一步稀释得到1、10、50 mg·L-1的NMs喷施液。
1.2 试验设计挑选大小均一、饱满的大豆种子,用3% 次氯酸钠浸洗消毒10 min,用去离子水冲洗3次,再用纯水浸泡2.5 h。随后将种子放到育苗盆中育苗,待根长为3 cm左右用海绵包裹种子并转移到水培盆中,水培盆置于人工气候室中。水培试验采用容积为1.5 L的陶瓷培养盆,培养液为1/2 Hoagland营养液(pH 6.5)。
待幼苗长出第一个三叶后,选取长势一致的幼苗用于试验。对选取的幼苗叶面分别喷施两种铁基NMs(γ-Fe2O3 NMs、Fe3O4 NMs)和Fe-EDTA,其中γ-Fe2O3 NMs、Fe3O4 NMs处理浓度为0、1、10、50 mg·L-1,Fe-EDTA浓度为10 mg·L-1,每个浓度设置15个重复。每日上午8:00—9:00进行叶面喷施,连续喷施5 d,每次每个处理组共喷施30 mL,大豆幼苗继续生长10 d后进行破坏性采样。样品在液氮冷冻后置于-80 ℃冰箱保存待用。
1.3 测定指标 1.3.1 生物量及光合参数测定随机选取6株大豆植株样品,利用超纯水冲洗叶和根的表面,用滤纸吸取水分。根长、根尖数、根体积、根表面积用根系扫描仪(WinRHIZO Pro 2017b,Regent Instruments Inc.,加拿大)进行分析。随后将根、茎、叶分装,置于105 ℃烘箱中杀青30 min,80 ℃烘干至恒质量,用万分之一电子天平(OHAUS,上海)称质量,计算各部分(根、茎、叶)生物量。
净光合速率(mmol·m-2·s-1,以CO2计)、蒸腾速率(mmol·m-2·s-1,以H2O计)、气孔导度(mmol·m-2·s-1,以H2O计)、胞间二氧化碳浓度(μmol·mol-1)由便携式光合测定系统(CIRAS-3,PP-Systems,美国)在上午9:30—11:00测定。
1.3.2 可溶性糖、蔗糖及元素含量测定利用蒽酮比色法测定可溶性糖含量:2 g蒽酮溶解到80% H2SO4中,以80% H2SO4定容至1 L;将植物干样粉末溶于5 mL去离子水中,沸水浴加热10 min,冷却后过0.22 μm水相滤膜,滤液按1∶10与蒽酮硫酸溶液混合后于620 nm波长下测定吸光值。利用间苯二酚法测定蔗糖含量[22]。
取大豆叶、茎、根干样,研磨后称取25 mg放入消解管,加入3 mL HNO3和3 mL H2O,用微波消解仪(MARS 6,CEM,美国)190 ℃消解45 min。消解后液体过0.22 μm滤膜并用超纯水稀释定容,使用电感耦合等离子体质谱(ICP-MS,iCAP-TQ,Thermo Fisher,德国)测定S、P、Mg、Ca、Mn、Cu、Zn、Mo元素含量[23-24]。表 1为ICP-MS的工作参数。
|
|
表 1 ICP-MS工作参数 Table 1 Working parameters of ICP-MS |
矿质元素由外标定量,混合标样稀释成浓度梯度,进样绘制成标准曲线。本方法以Ge为内标,7种元素回收率均在100%~118%。
1.3.3 基因测定基因的相对表达量用-80 ℃冰箱保存的鲜样进行测定。使用MiniBEST植物RNA提取试剂盒(Takara,日本)分离并纯化大豆叶中总RNA。通过超微量分光光度计(Gallop UltraM-QB200,骋克,上海)测量光密度来评估RNA的浓度和完整性。使用PrimeScriptTM RT试剂盒(Takara,日本),利用PCR仪(T100TM Thermal Cycler,Bio-Rad,美国)将总RNA反转录成cDNA。根据UltraSYBR Mixture(康为世纪,北京)试剂使用步骤加入各反应试剂构成qRT-PCR反应体系,利用荧光定量PCR检测系统(CFX96TM Optics Module,Bio-Rad,美国)进行分析。使用以下热循环条件:95 ℃ 5 min,然后在95 ℃ 15 s,60 ℃ 1 min进行40个循环。基因特异性引物分别为SWEET15(Glyma. 06G166800_F CATGACCAAACGGAACTCAACAAG;Glyma.06G166800_RAACTTCGCAACTCACCCTCTCC)和SUT2(Glyma. 16G157100_FGGCCAAGGTTTATC TTTGGGAGTC;Glyma. 16G157100_RCAAGTTGCCA CCACCAAACAAAG)。相对表达根据2-ΔΔCt法确定。使用内参基因GmEF1b(Glyma. 14G039100_FGTTGAAAAGCCAGGGGACA;Glyma. 14G039100_FTCTTACCCCTTGAGCGTGG)作为对照[22]。
1.4 统计分析本研究中生物量、光合参数等数据测试过程中每个处理组设置5个重复,蔗糖、可溶性糖每个处理组设置9个重复。使用Excel 2016和SPSS 25.0分析统计数据。通过单因素方差分析(ANOVA)程序来评估各指标的差异显著性。使用Duncan分析检验评估均值之间的差异(P < 0.05),并以不同字母指示结果[25]。
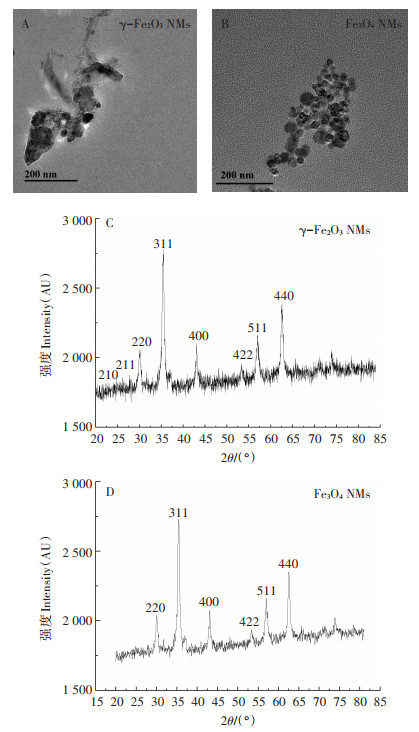
2 结果与讨论 2.1 NMs表征TEM结果(图 1A、1B)表明,γ-Fe2O3 NMs和Fe3O4 NMs主要呈椭圆形或圆形,其中γ-Fe2O3 NMs和Fe3O4 NMs粒径主要分布在50~70 nm和40~50 nm之间。利用XRD对NMs进行物相分析,结果如图 1C、1D所示,通过XRD分析可以得知两种材料分别为γ-Fe2O3 NMs和Fe3O4NMs。γ-Fe2O3 NMs和Fe3O4NMs的水力学直径分别为(495.0±21.7)nm和(817.4±28.3)nm,γ-Fe2O3 NMs团聚效应低于Fe3O4 NMs;两种NMs表面均带负电,γ-Fe2O3 NMs的表面电荷明显多于Fe3O4 NMs(表 2),AVELLAN等[19]的研究表明,表面带负电荷的NMs的生物可利用性更高,且NMs表面电荷越高生物可利用性越高。因此,γ-Fe2O3 NMs的生物可利用性要高于Fe3O4 NMs。
|
图 1 γ-Fe2O3 NMs和Fe3O4 NMs的TEM图(A、B)和XRD图谱(C、D) Figure 1 TEM panel (A, B)and XRD spectrum(C, D)of γ-Fe2O3 NMs and Fe3O4 NMs |
|
|
表 2 γ-Fe2O3 NMs和Fe3O4 NMs的水力学直径与Zeta电位 Table 2 Hydrodynamic diameter and ζ-potential of γ-Fe2O3 NMs and Fe3O4 NMs |
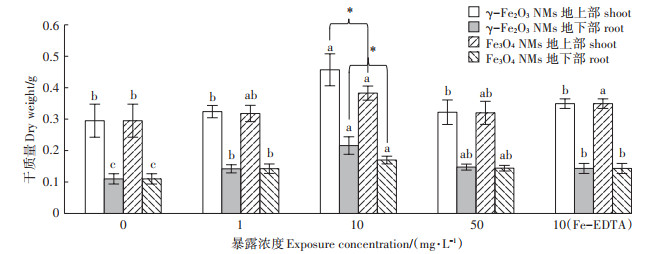
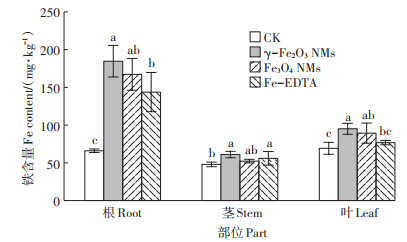
苗期试验周期为24 d,通过生物量、根系参数、光合参数指标明确叶面喷施γ-Fe2O3 NMs(1、10、50 mg·L-1)、Fe3O4 NMs(1、10、50 mg·L-1)、Fe-EDTA(10 mg·L-1 γ-Fe2O3 NMs等量铁浓度)对大豆生长的促进效应,并以此筛选出两种NMs促进大豆生长的最佳培养体系。大豆干质量结果(图 2)表明,叶面喷施两种铁基NMs对大豆的地上部和地下部的生物量均有促进效应,且促进效果随着两种铁基NMs浓度的增加呈现先升高后降低的趋势,对大豆生长的最佳促生浓度为10 mg·L-1。在最佳促生浓度下,叶面喷施γ-Fe2O3 NMs对大豆地上部和地下部干质量的增加效果明显高于Fe3O4 NMs和Fe-EDTA。虽然Fe3O4 NMs地上部干质量与Fe-EDTA处理无显著差异,但地下部干质量明显高于Fe-EDTA处理(图 2)。已有相关研究表明,叶面喷施100 mg·L-1 Fe3O4 NMs明显促进烟草的生长[26];根部暴露γ-Fe2O3 NMs在20 mg·L-1时能显著促进柑橘幼苗生长[27]。本研究对比分析了不同铁基NMs促进作物生长的效果,明确了γ-Fe2O3 NMs的促生效果优于Fe3O4 NMs,同时阐明了铁基NMs比传统铁肥效果更优。一方面NMs具有缓释性,使得NMs的生物可利用性明显高于螯合态铁,且γ-Fe2O3 NMs水力学直径小、表面电荷多,使得进入到植物体内的γ-Fe2O3 NMs多于Fe3O4 NMs[4]。植物根、茎、叶内铁含量结果(图 3)也表明,NMs处理能够显著增加大豆不同部位铁含量,且γ-Fe2O3 NMs处理的大豆不同部位铁含量高于Fe3O4 NMs,其大豆根、茎、叶中铁含量是等量Fe-EDTA处理的1.29、1.09、1.24倍;另一方面NMs具有纳米效应,其提高植物光合作用速率的效果优于螯合铁肥,也可能是由于NMs能够加速光合产物的转运。图 4结果表明,施用铁基NMs提高了大豆的根冠比,表现为γ-Fe2O3 NMs>Fe3O4 NMs> Fe-EDTA,表明铁基NMs的施用促进了光合产物的转运[13]。
|
不同小写字母表示同种材料不同浓度处理间差异显著(P<0.05);*代表相同浓度下γ-Fe2O3 NMs与Fe3O4 NMs处理间具有显著性差异(P<0.05)。下同 Different letters represents the significant difference among different concentrations of NMs exposure(P<0.05); * indicates the biomass of soybean exposed to γ-Fe2O3 NMs and Fe3O4 NMs was significantly different(P<0.05). The same below 图 2 叶面喷施γ-Fe2O3 NMs(1、10、50 mg·L-1)、Fe3O4 NMs(1、10、50 mg·L-1)、Fe-EDTA(10 mg·L-1 γ-Fe2O3 NMs等量铁浓度)对大豆地上部和地下部生物量的影响 Figure 2 Effects of foliar application with γ-Fe2O3 NMs(1, 10, and 50 mg·L-1), Fe3O4 NMs(1, 10, and 50 mg·L-1), and Fe-EDTA(equal Fe concentration to 10 mg·L-1 γ-Fe2O3 NMs)on the dry weight of soybean shoot and root |
|
同一部位不同小写字母表示处理间差异显著(P<0.05)。下同 Different letters in the same part indicate the significant difference among treatments(P<0.05). The same below 图 3 10 mg·L-1不同铁基NMs对大豆根、茎、叶中铁含量的影响 Figure 3 Effects of foliar application with different iron-based NMs on the Fe content in root, stem, and leaf of soybean |

|
图 4 叶面喷施γ-Fe2O3 NMs(1、10、50 mg·L-1)、Fe3O4 NMs(1、10、50 mg·L-1)、Fe-EDTA(10 mg·L-1γ-Fe2O3 NMs等量铁浓度)对大豆根冠比的影响 Figure 4 Effects of foliar application with γ-Fe2O3 NMs(1, 10, and 50 mg·L-1), Fe3O4 NMs(1, 10, and 50 mg·L-1), and Fe-EDTA (equal Fe concentration to 10 mg·L-1γ-Fe2O3 NMs)on the rootshoot ratio of soybean |
利用根际扫描仪对大豆根参数进行详细分析,结果(图 5)表明,叶面喷施γ-Fe2O3 NMs和Fe3O4 NMs明显促进了大豆根长和根尖数,且促进效果与干质量结果类似,施用10 mg·L-1 γ-Fe2O3 NMs对大豆根长和根尖数的促进效果最为明显,其效果优于Fe3O4 NMs和Fe-EDTA处理组。根系形态图(图 5)也验证了以上结论,且能够直接观察到10 mg·L-1 γ-Fe2O3 NMs处理组的大豆根体积明显大于Fe3O4 NMs和Fe-EDTA处理组。

|
图 5 叶面喷施γ-Fe2O3 NMs(1、10、50 mg·L-1)、Fe3O4 NMs(1、10、50 mg·L-1)、Fe-EDTA(10 mg·L-1 γ-Fe2O3 NMs等量铁浓度)对大豆根长、根尖数及根形态的影响 Figure 5 Effects of foliar application with γ-Fe2O3 NMs(1, 10, and 50 mg·L-1), Fe3O4 NMs(1, 10, and 50 mg·L-1), and Fe-EDTA(equal Fe concentration to 10 mg·L-1 γ-Fe2O3 NMs)on the root length, root tips number, and root phenotype of soybean |
铁是植物生长的必需营养元素,其直接参与植物的光合作用,铁是叶绿素中Fe-S簇的重要组分,能够影响光合作用中的电子传递。因此,本研究在证明了铁基NMs对大豆生物量促进作用的基础上进一步分析了铁基NMs对光合作用的影响。图 6结果表明,叶面喷施铁基NMs能够显著提高大豆净光合速率、蒸腾速率、气孔导度及胞间二氧化碳浓度。在10 mg·L-1 γ-Fe2O3 NMs处理下,净光合速率和蒸腾速率达到最大,分别提升了62.7% 和91.5%。10 mg·L-1 Fe3O4 NMs和Fe-EDTA处理下,净光合速率分别提升了41.5% 和30.7%,蒸腾作用速率分别提升了95.3% 和36.3%。两种铁基NMs处理组也显著促进了大豆叶片的气孔导度和胞间二氧化碳浓度,且提升效果明显高于Fe-EDTA。气孔导度的变化会在一定范围内影响植物吸收二氧化碳的能力,气孔导度越高,胞间二氧化碳浓度越高。随着胞间二氧化碳浓度的升高,净光合速率也随之急剧增加。植物吸收水分和养分长距离运移的驱动力主要取决于蒸腾速率[28]。
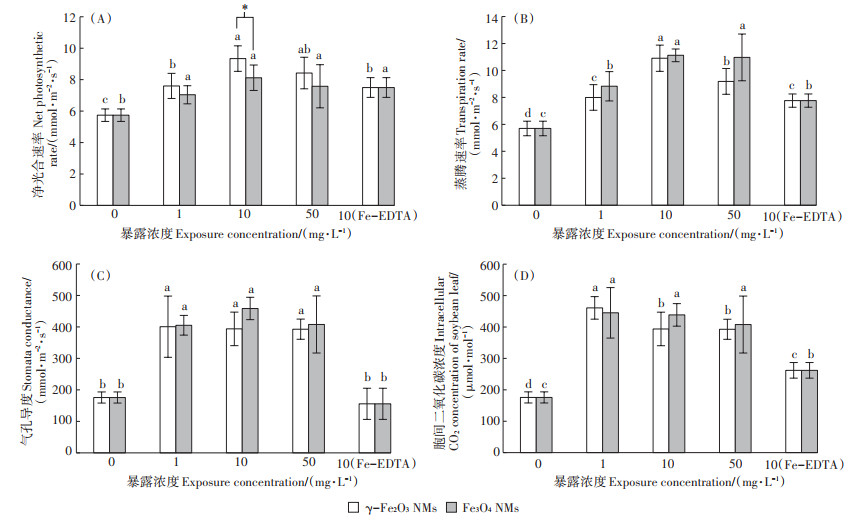
|
图 6 叶面喷施γ-Fe2O3 NMs(1、10、50 mg·L-1)、Fe3O4 NMs(1、10、50 mg·L-1)、Fe-EDTA(10 mg·L-1 γ-Fe2O3 NMs等量铁浓度)对大豆叶片光合作用速率、蒸腾速率、气孔导度和胞间二氧化碳浓度的影响 Figure 6 Effects of foliar application with γ-Fe2O3 NMs(1, 10, and 50 mg·L-1), Fe3O4 NMs(1, 10, and 50 mg·L-1), and Fe-EDTA(equal Fe concentration to 10 mg·L-1 γ-Fe2O3 NMs)on the net photosynthetic rate, transpiration rate, stomatal conductance, and intracellular CO2 concentrations of soybean leaf |
光合作用增强可促进光合产物的产生并最终提高作物产量。光合产物可以通过韧皮部从源端(光合产物的合成部位)转移到库端。为探究大豆光合产物的合成及分布情况,本研究进一步分析了光合产物的主要组成成分——可溶性糖,以及韧皮部光合产物转运的主要形式——蔗糖[29]在大豆根、茎、叶中的含量和分布。根据图 7可知,铁基NMs和Fe-EDTA处理下大豆根、茎、叶中可溶性糖含量均显著增加,且在γ-Fe2O3 NMs处理下大豆叶片中可溶性糖含量最高。蔗糖含量在两种NMs处理下均显著增加,且作用效果比Fe-EDTA更明显。同时通过比较不同部位蔗糖的含量可以发现,根中蔗糖含量的增加量显著高于叶片。其中,根部的蔗糖含量在γ-Fe2O3 NMs、Fe3O4 NMs、Fe-EDTA处理下分别是对照组的5.8、4.5、3.6倍。由此可知,大豆苗期叶面喷施铁基NMs改变了大豆碳水化合物在根的分配。
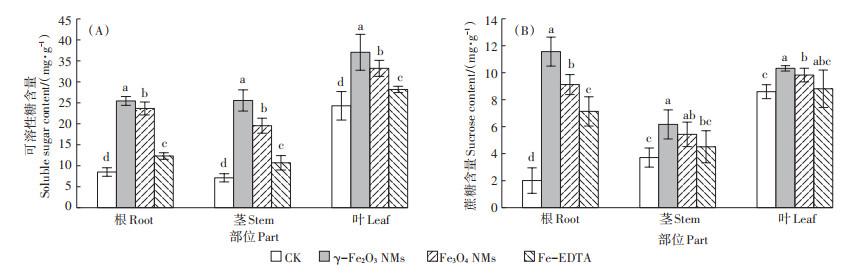
|
图 7 叶面施用γ-Fe2O3 NMs、Fe3O4 NMs及Fe-EDTA对大豆根、茎、叶中可溶性糖和蔗糖含量的影响 Figure 7 Soluble sugar content and sucrose content in root, stem, and leaf of soybean after foliar applied with γ-Fe2O3 NMs, Fe3O4 NMs, and Fe-EDTA |
源、库端碳水化合物的分配对植物生产力具有关键作用[29]。如果仅提高源端光合作用的强度,而无法及时将光合产物转运到库端,源端光合产物的积累会导致碳平衡失调,进而影响叶片的光合效率,降低光合产物的利用率[30]。蔗糖作为植物韧皮部主要的光合产物转运形式,其转运蛋白SUT、SWEET的表达是表明光合产物在植物中转运及分配情况的关键。在拟南芥中AtSWEET 12主要分布在韧皮部薄壁组织的质膜上,是促进蔗糖从叶片装载到韧皮部的主要载体[31]。为进一步探究两种铁基NMs对蔗糖转运的影响,测定了SUT 2和GmSWEET 15(AtSWEET 12类似物)在大豆叶片中的表达量。图 8结果表明,γ-Fe2O3 NMs、Fe3O4 NMs、Fe-EDTA处理后叶片中GmSWEET 15的表达量增加至对照组的5.6、3.6、1.9倍。铁基NMs处理组中GmSUT 2的表达量也显著高于Fe-EDTA处理组,表明铁基NMs能够通过调控蔗糖转运蛋白相关基因表达,进而促进蔗糖从源端向库端的运输。
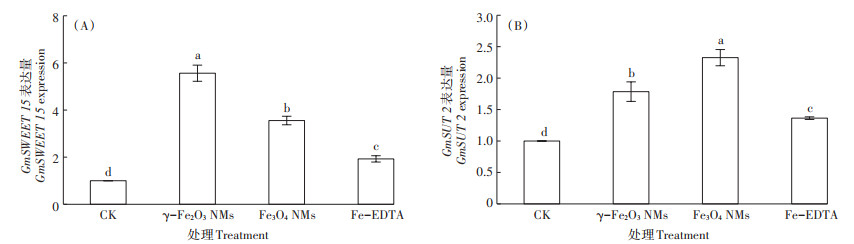
|
图 8 叶面施用γ-Fe2O3 NMs、Fe3O4 NMs及Fe-EDTA对大豆叶片蔗糖转运基因GmSWEET 15、GmSUT 2的影响 Figure 8 The expression level of the genes related to sucrose transporter(GmSWEET 15, GmSUT 2)in leaves of soybean after foliar applied with γ-Fe2O3 NMs, Fe3O4 NMs, and Fe-EDTA |
S、P、Mg、Ca均属于植物生命活动中的大量元素,在植物生长发育过程中具有至关重要的作用。如表 3所示,叶面喷施两种铁基NMs显著提高了大豆叶片中P、Ca的含量,其中叶部Ca含量在γ-Fe2O3 NMs、Fe3O4 NMs处理下分别增加了37.0%、29.3%。Ca在植物生长发育中参与多种生理生化过程并发挥重要作用,如提高大豆膜的稳定性和根瘤固氮能力,促进P、Mg的吸收,提高大豆产量[32]。
除了大量元素外,植物还需要微量元素,如Mn、Cu、Mo、Zn等来调节其正常的生理代谢。由表 3可知,两种铁基NMs均显著提高了大豆叶片中Mo元素含量以及根中Mn、Cu、Mo的含量。其中根系Mn含量在γ - Fe2O3 NMs、Fe3O4 NMs处理下分别增加了56.5%、64.5%。Mn在植物体内可以作为辅助因子,激活植物生长过程中的氧化还原等反应。它还参与呼吸、光合作用、氨基酸合成和激素激活等代谢过程。Mo是植物体内硝酸还原酶、固氮酶等发挥催化活性的核心元素[33],增加钼含量是提高大豆碳、氮代谢效率的有效途径之一。
|
|
表 3 10 mg·L-1γ-Fe2O3 NMs、Fe3O4 NMs、Fe-EDTA处理下大豆根、茎、叶中营养元素含量(mg·g-1) Table 3 Nutrient element content in root, stem, and leaf of soybean after exposed to 10 mg·L-1γ-Fe2O3 NMs, Fe3O4 NMs, Fe-EDTA(mg·g-1) |
上述结论表明,叶面喷施10 mg·L-1铁基NMs不仅可以增加植物体内铁的含量,同时还可以增加植物体对其他营养元素的吸收利用。这与DE SOUZA等[34]的研究得到的叶面喷施铁基NMs显著提高了马齿苋中矿质养分含量的结论一致。叶面喷施铁基NMs使根部的根长、根尖数、根体积增加,增大了根部与养分的接触面积与概率,进而促进了大豆养分的吸收。
3 结论(1)叶面喷施铁基NMs能够促进大豆生长,且随着叶面喷施浓度的升高呈先增加后降低的趋势,10 mg·L-1为最佳施用浓度,不同化学形态铁基肥料对大豆生长的促进效果表现为γ-Fe2O3 NMs>Fe3O4 NMs> Fe-EDTA。
(2)铁基NMs的缓释性及其高表面活性使其比Fe-EDTA具有更高的生物可利用性,γ-Fe2O3 NMs处理的大豆各组分中铁含量明显高于Fe-EDTA处理组,且铁基NMs对大豆叶片的净光合速率、蒸腾速率、气孔导度和胞间二氧化碳浓度的促进效果也明显优于Fe-EDTA。
(3)铁基NMs通过上调蔗糖转运相关基因(GmSWEET 15、GmSUT 2)提高光合产物向根部运输的能力,增加大豆根冠比,促进根部养分(S、P、Ca、Mn、Cu)吸收。
综上所述,本研究初步表明铁基NMs可作为更加高效、安全的新型铁肥,用来促进作物生长及光合产物的转运。
| [1] |
JALALI M, GHANATI F, MODARRES-SANAVI A, et al. Physiological effects of repeated foliar application of magnetite nanoparticles on maize plants[J]. Journal of Agronomy and Crop Science, 2017, 203(6): 593-602. DOI:10.1111/jac.12208 |
| [2] |
GATTULLO C E, YOURY P, ALLEGRETTA I, et al. Iron mobilization and mineralogical alterations induced by iron-deficient cucumber plants(Cucumis sativus L.)in a calcareous soil[J]. Pedosphere, 2018, 28(1): 59-69. DOI:10.1016/S1002-0160(15)60104-7 |
| [3] |
YUAN J, CHEN Y, LI H, et al. New insights into the cellular responses to iron nanoparticles in Capsicum annuum[J]. Scientific Reports, 2018, 8(1): 3228. DOI:10.1038/s41598-017-18055-w |
| [4] |
RALIYA R, SAHARAN V, DIMKPA C, et al. Nanofertilizer for precision and sustainable agriculture: Current state and future perspectives[J]. Journal of Agricultural and Food Chemistry, 2018, 66(26): 6487-6503. DOI:10.1021/acs.jafc.7b02178 |
| [5] |
KAH M, KOOKANA R S, GOGOS A, et al. A critical evaluation of nanopesticides and nanofertilizers against their conventional analogues[J]. Nature Nanotechnology, 2018, 13(8): 677-684. DOI:10.1038/s41565-018-0131-1 |
| [6] |
KAH M, TUFENKJI N, WHITE J C. Nano-enabled strategies to enhance crop nutrition and protection[J]. Nature Nanotechnology, 2019, 14(6): 532-540. DOI:10.1038/s41565-019-0439-5 |
| [7] |
LOMBI E, DONNER E, DUSINSKA M, et al. A one health approach to managing the applications and implications of nanotechnologies in agriculture[J]. Nature Nanotechnology, 2019, 14(6): 523-531. DOI:10.1038/s41565-019-0460-8 |
| [8] |
LOWRY G V, AVELLAN A, GILBERTSON L M. Opportunities and challenges for nanotechnology in the agri-tech revolution[J]. Nature Nanotechnology, 2019, 14(6): 517-522. DOI:10.1038/s41565-019-0461-7 |
| [9] |
MITTER N, HUSSEY K. Moving policy and regulation forward for nanotechnology applications in agriculture[J]. Nature Nanotechnology, 2019, 14(6): 508-510. DOI:10.1038/s41565-019-0464-4 |
| [10] |
MULLEN A. Expectations from nano in agriculture[J]. Nature Nanotechnology, 2019, 14(6): 515-516. DOI:10.1038/s41565-019-0471-5 |
| [11] |
WHITE J C, GARDEA-TORRESDEY J. Achieving food security through the very small[J]. Nature Nanotechnology, 2018, 13(8): 627-629. DOI:10.1038/s41565-018-0223-y |
| [12] |
GILBERTSON L M, POURZAHEDI L, LAUGHTON S, et al. Guiding the design space for nanotechnology to advance sustainable crop production[J]. Nature Nanotechnology, 2020, 15(9): 801-810. DOI:10.1038/s41565-020-0706-5 |
| [13] |
TOMBULOGLU H, SLIMANI Y, TOMBULOGLU G, et al. Uptake and translocation of magnetite(Fe3O4)nanoparticles and its impact on photosynthetic genes in barley(Hordeum vulgare L.)[J]. Chemosphere, 2019, 226: 110-122. DOI:10.1016/j.chemosphere.2019.03.075 |
| [14] |
RUI M, MA C, HAO Y, et al. Iron oxide nanoparticles as a potential iron fertilizer for peanut(Arachis hypogaea)[J]. Frontiers in Plant Science, 2016, 7: 815. |
| [15] |
ASKARY M, AMIRJANI M, SABERI T. Comparison of the effects of nano-iron fertilizer with iron-chelate on growth parameters and some biochemical properties of Catharanthus roseus[J]. Journal of Plant Nutrition, 2016, 40(7): 974-982. |
| [16] |
徐江兵, 王艳玲, 罗小三, 等. 纳米Fe3O4对生菜生长及土壤细菌群落结构的影响[J]. 应用生态学报, 2017, 28(9): 3003-3010. XU J B, WANG Y L, LUO X S, et al. Influence of Fe3O4 nanoparticles on lettuce(Lactuca sativa L.)growth and soil bacterial community structure[J]. Chinese Journal of Applied Ecology, 2017, 28(9): 3003-3010. |
| [17] |
SMITH M R, RAO I M, MERCHANT A. Source-sink relationships in crop plants and their influence on yield development and nutritional quality[J]. Frontiers in Plant Science, 2018, 9: 1889. DOI:10.3389/fpls.2018.01889 |
| [18] |
BUSTOS D V, HASAN A K, REYNOLDS M P, et al. Combining high grain number and weight through a DH-population to improve grain yield potential of wheat in high-yielding environments[J]. Field Crops Research, 2013, 145: 106-115. DOI:10.1016/j.fcr.2013.01.015 |
| [19] |
AVELLAN A, YUN J, ZHANG Y, et al. Nanoparticle size and coating chemistry control foliar uptake pathways, translocation, and leaf-torhizosphere transport in wheat[J]. ACS Nano, 2019, 13(5): 5291-5305. DOI:10.1021/acsnano.8b09781 |
| [20] |
RASTOGI A, ZIVCAK M, SYTAR O, et al. Impact of metal and metal oxide nanoparticles on plant: A critical review[J]. Frontiers in Chemistry, 2017, 5: 78. DOI:10.3389/fchem.2017.00078 |
| [21] |
WEI Y, HAN B, HU X, et al. Synthesis of Fe3O4 nanoparticles and their magnetic properties[J]. Procedia Engineering, 2012, 27: 632-637. DOI:10.1016/j.proeng.2011.12.498 |
| [22] |
DU Y, ZHAO Q, CHEN L, et al. Effect of drought stress on sugar metabolism in leaves and roots of soybean seedlings[J]. Plant Physiology and Biochemistry, 2020, 146: 1-12. DOI:10.1016/j.plaphy.2019.11.003 |
| [23] |
石荣丽, 邹春琴, 芮玉奎, 等. ICP-AES测定中国小麦微核心种质库籽粒矿质养分含量[J]. 光谱学与光谱分析, 2009, 29(4): 1104-1107. SHI R L, ZOU C Q, RUI Y K, et al. Application of ICP-AES to detecting nutrients in grain of wheat core collection of China[J]. Spectroscopy and Spectral Analysis, 2009, 29(4): 1104-1107. DOI:10.3964/j.issn.1000-0593(2009)04-1104-04 |
| [24] |
芮玉奎, 于庆泉, 金银花, 等. 应用ICP-MS快速测定葡萄酒中40种元素的含量[J]. 光谱学与光谱分析, 2007, 27(5): 1015-1017. RUI Y K, YU Q Q, JIN Y H, et al. Application of ICP-MS to the detection of forty elements in wine[J]. Spectroscopy and Spectral Analysis, 2007, 27(5): 1015-1017. DOI:10.3321/j.issn:1000-0593.2007.05.045 |
| [25] |
DU Y, ZHAO Q, LI S, et al. Shoot/root interactions affect soybean photosynthetic traits and yield formation: A case study of grafting with record-yield cultivars[J]. Frontiers in Plant Science, 2019, 10: 445. DOI:10.3389/fpls.2019.00445 |
| [26] |
CAI L, CAI L T, JIA H Y, et al. Foliar exposure of Fe3O4 nanoparticles on Nicotiana benthamiana: Evidence for nanoparticles uptake, plant growth promoter and defense response elicitor against plant virus[J]. Journal of Hazardous Materials, 2020, 393: 122415. DOI:10.1016/j.jhazmat.2020.122415 |
| [27] |
LI J L, HU J, XIAO L, et al. Physiological effects and fluorescence labeling of magnetic iron oxide nanoparticles on citrus(Citrus reticulata)seedlings[J]. Water, Air, & Soil Pollution, 2017, 228(1): 52. |
| [28] |
LIU Y, YUE L, WANG C, et al. Photosynthetic response mechanisms in typical C3 and C4 plants upon La2O3 nanoparticle exposure[J]. Environmental Science: Nano, 2020, 7(1): 81-92. DOI:10.1039/C9EN00992B |
| [29] |
YU S M, LO S F, HO T H D. Source–sink communication: Regulated by hormone, nutrient, and stress cross-signaling[J]. Trends in Plant Science, 2015, 20(12): 844-857. DOI:10.1016/j.tplants.2015.10.009 |
| [30] |
ROSSI M, BERMUDEZ L, CARRARI F. Crop yield: Challenges from a metabolic perspective[J]. Current Opinion in Plant Biology, 2015, 25: 79-89. DOI:10.1016/j.pbi.2015.05.004 |
| [31] |
CHEN L Q, QU X Q, HOU B H, et al. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport[J]. Science, 2012, 335(6065): 207-211. DOI:10.1126/science.1213351 |
| [32] |
李兆林, 才卓伟. 钙素营养对大豆的影响研究概述[J]. 农业系统科学与综合研究, 2009, 25(4): 487-489. LI Z L, CAI Z W. A review of the influence of calcium on soybean[J]. System Science and Comprehensive Studies in Agriculture, 2009, 25(4): 487-489. DOI:10.3969/j.issn.1001-0068.2009.04.022 |
| [33] |
李龙杰, 李忠, 李荀. "钼不暇接"——无处不在的钼元素[J]. 大学化学, 2020, 35(11): 62-65. LI L J, LI Z, LI X. The ubiquitous molybdenum element[J]. University Chemistry, 2020, 35(11): 62-65. |
| [34] |
DE SOUZA A, GOVEA-ALCAIDE E, MASUNAGA S, et al. Impact of Fe3O4 nanoparticle on nutrient accumulation in common bean plants grown in soil[J]. SN Applied Sciences, 2019, 1(4): 308. DOI:10.1007/s42452-019-0321-y |
 2022, Vol. 39
2022, Vol. 39