2. 贵州大学新型肥料资源与技术研究所, 贵阳 550025
2. Institute of New Fertilizer Resources and Technology, Guizhou University, Guiyang 550025, China
近年来,随着化学农药的过度施用,作物农药残留超标,土壤、水源地污染,耕地退化等现象日趋严重。生物防治方法利用微生物及其代谢产物抑制植物病原菌的生长,正逐渐成为一种植物保护新技术,其因无残留和环境友好等优点在植物病害防治中占据越来越重要的地位[1-4]。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)能够分泌蛋白类、脂肽类及其次级代谢产物等抗菌物质以抑制植物病原菌的生长,是主要的生防菌种之一[5-8]。其抗菌物质主要有两类:一是核糖体途径合成的抑菌物质(如几丁质酶、抗菌蛋白、β-1,3-葡聚糖酶等),二是非核糖体途径合成的脂态类物质(包括表面活性素、伊枯草素、丰源素等)[7]。这些抑菌物质,不仅能使病原真菌菌丝发生消融、扭曲[9],还能抑制菌丝的生长及菌核的形成[8],也能破坏细胞结构、抑制孢子增生[10-11],具有耐受性强、抑菌性广等特点[12],对病原菌的生长发育具有高效广谱的抑制效果。因此,解淀粉芽孢杆菌在植物病害防治中发挥着重要的作用。
生防菌的生防机理一直是植物病害生物防治的热点之一,也是其应用于生产实践的必要的理论依据。目前,大多数研究集中于讨论生防菌的抑菌物质分类及鉴定[13-16],较少讨论该类抑菌物质的应用价值及应用的可行性。本课题组前期已筛选、鉴定出一株解淀粉芽孢杆菌F11,本研究分析了该菌株的发酵液和胞外粗提取液对烟草黑胫病菌等12种作物病原菌的抑菌效果及其抑菌物质,以期从发酵液和胞外粗提取液两个方向讨论该生防菌快速高效应用的可行性,为其在植物病害防治中的应用提供理论依据。
1 材料与方法 1.1 供试菌株供试生防菌:解淀粉芽孢杆菌F11,由本课题组在前期研究中从草莓根际土壤中分离筛选所得,其对草莓灰霉病菌具有拮抗性能,对烟草黑胫病菌等12种常见病原菌抑制率均超过79.88%,具有高效、广谱的抑菌效果[17]。
供试病原菌:水稻稻瘟病菌(Pyricularia oryzae)、猕猴桃软腐病菌(Botryosphaeria dothidea)、烟草黑胫病菌(Phytophthora parasitica var. nicotianae)、烟草炭疽病菌(Colletotrichum nicotianae Av.)、樟树炭疽病菌(Colletotrichum gloeosporioides)、高粱斑点病菌(Pseudomonas syringae pv. syringae Van Hall)、玉兰炭疽病菌(Colletotrchum magnoliae Camara)、核盘病菌(Sclerotinia sclerotiorum)、高粱炭疽病菌[Colletotrichum graminicola (Cesati) Wilson]、玉米大斑病菌(Setosphaeria turcica)、辣椒炭疽病菌(Colletotrichum capsici)、烟草赤星病菌[Alternaria alternata (Freis) Keissler],共12种病原菌,均为贵州省山地农业病虫害重点实验室惠赠。
1.2 培养基马铃薯葡萄糖(PDA)液体培养基:马铃薯200.0 g(去皮切块煮沸30 min,纱布过滤后得滤液),蔗糖20.0 g,水1 000 mL,pH自然,1.0×105 Pa灭菌30 min,冷却后备用。
PDA固体培养基:在PDA液体培养基中加入琼脂15.0 g,1.0×105 Pa灭菌30 min,冷却后倒平板,备用。
牛肉膏蛋白胨液体培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,加水至1 000 mL,pH 7.2,1.0×105 Pa灭菌30 min,冷却后备用。
NB固体培养基:在牛肉膏蛋白胨液体培养基中加入15.0 g琼脂粉,1.0×105 Pa灭菌30 min,冷却后备用。
1.3 种子菌液的制备取一环菌株F11斜面菌苔于NB固体培养基平板上划线,30 ℃恒温培养箱(GXZ-258A,宁波江南仪器厂)培养24 h后挑取单菌落接种于牛肉膏蛋白胨液体培养基中,30 ℃、150 r·min-1振荡培养24 h获得F11种子菌液。
1.4 试验设计 1.4.1 菌株F11发酵液浓度对病原菌抑制效果的影响采用混菌法[18-19]进行试验。将菌株F11发酵液原液及5倍浓缩液(5×C)、10倍稀释液(10×)、100倍稀释液(100×)、1 000倍稀释液(1000×)分别与45 ℃左右的PDA固体培养基混匀制成平板。每个浓度重复3次,以无菌培养液为对照。将直径为7.5 mm的病原菌菌饼移至培养皿中央,28 ℃培养6~8 d后测量病原菌菌落直径(mm),按公式(1)计算F11对各病原菌的相对抑制率:

|
(1) |
采用酸沉淀和甲醇提取法对发酵液进行分离[5, 20-21]。菌株F11发酵液10 000 r·min-1离心5 min,收集上清液,用无菌滤膜(直径0.22 μm,水系)过滤除菌后获得无菌上清液(上清液A)。将上清液A倒入灭菌三角瓶中,加入6 mol·L-1的浓盐酸至pH=2后取10 mL液体装于10 mL灭菌离心管中,4 ℃静置24 h,4 ℃下12 000 r·min-1离心10 min,收集沉淀,得到上清液B,并将上清液B的pH调至7.0,装入离心管中备用。用分析纯甲醇溶解沉淀,向每管沉淀中加入0.5 mL pH 7.0的甲醇,混匀后于灭菌离心管中萃取8 h,12 000 r·min-1、4 ℃离心20 min,得上清液1。同样方法萃取2次,分别得上清液2、3,合并上清液1、2、3于灭菌离心管中,保留上清液,用无菌滤膜(直径0.22 μm,有机系)过滤除菌后获得代谢物粗提液。发酵液分离所得的上清液A、上清液B及代谢物粗提液于4 ℃保存备用。
1.4.3 菌株F11发酵液抑菌物质分析采用牛津杯法检测菌株F11发酵液的3种分离液的抑菌效果。用打孔器(直径7.5 mm)取病原菌菌块,将其放置于PDA平板中央,28 ℃培养箱中培养24 h后,在距病原菌块四周2.5 cm处放置无菌牛津杯,每个牛津杯中加入100 μL无菌上清液A,以pH 7的过滤除菌的培养基作对照,重复3次,置于28 ℃培养箱中培养7 d后记录病原菌受抑制情况,测量抑菌圈半径。用同样的方法检测上清液B和代谢物粗提液的抑菌活性,重复3次。其中上清液B的对照为盐酸酸化离心调回初始酸度的培养液,代谢物粗提液的对照为过滤除菌的甲醇。上清液A、上清液B及代谢物粗提液中抑菌效果最好的分离液的抑菌情况用显微镜进行观察。
1.5 数据分析采用Microsoft Excel 2013对试验数据进行整理、分析并作图,采用DPS数据处理系统V14.0(杭州睿丰信息技术有限公司)对试验数据进行单因素方差分析(F11发酵液不同稀释倍数对病原菌的抑菌效果,Duncan法)和t检验(上清液A和粗提液对四种病原菌的抑菌圈半径的影响)。
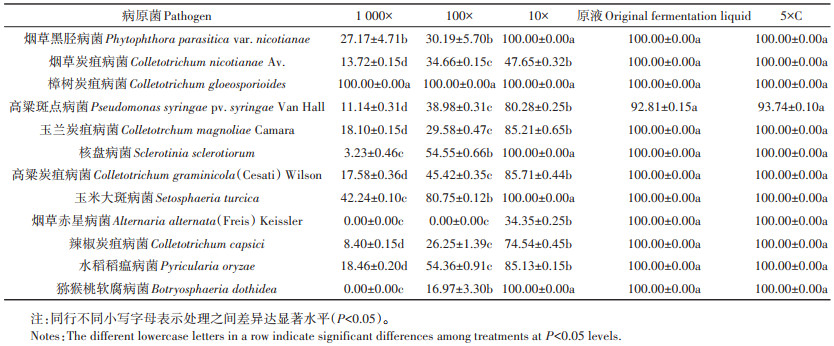
2 结果与分析 2.1 菌株F11发酵液浓度对抑菌率的影响不同稀释浓度的菌株F11发酵液与12种供试病原菌的拮抗试验结果表明,对菌株F11发酵液进行适当稀释均能获得良好的抑菌效果。以玉米大斑病菌(Setosphaeria turcica)和烟草黑胫病菌(P. parasitica var. nicotianae)为例(图 1),当对照玉米大斑病病原菌长满平板时,1 000×处理的病原菌长了约4/5个平板,100×、10×、原液和5×C处理的病原菌仍保持接种时的大小;当烟草黑胫病病原菌长满平板时,1 000×处理无明显抑菌效果,但其余稀释处理抑菌效果均十分明显,尤其是10×、原液和5×C处理,三者病原菌大小与接种时无异。

|
图 1 菌株F11发酵上清液不同稀释倍数对玉米大斑病病原菌(a)和烟草黑胫病病原菌(b)生长的影响 Figure 1 Effects of different dilution fractions of fermentation supernatant of F11 on the growth of Setosphaeria turcica (a) and Phytophthora parasitica var. nicotianae (b) |
菌株F11对不同植物病原菌的抑菌率如表 1所示。F11发酵液对于樟树炭疽病菌(C. gloeosporioides)的抑菌效果最好,不同稀释倍数间抑制效果无显著差异,1 000倍稀释液的相对抑菌率依然达到100%。除樟树炭疽病菌外,发酵液浓度对其余11种病原菌的抑菌效果有显著影响(P < 0.05)。与发酵液原液相比,随着稀释倍数的增加,各病原菌直径都逐渐增大,相对抑制率逐渐下降,而5倍浓缩液和原液之间无显著差异。此外,从烟草黑胫病菌、核盘病菌、玉米大斑病菌、猕猴桃软腐病菌的结果可以看出,10倍稀释液与发酵原液的相对抑制率差异也未达显著水平。可见,在对烟草黑胫病菌、核盘病菌、玉米大斑病菌、猕猴桃软腐病菌进行防治时,利用10倍稀释液即可达到良好的防治效果,而对樟树炭疽病菌防治时,1 000倍稀释液也可达到良好的防治效果。
|
|
表 1 F11发酵液不同稀释倍数对病原菌的相对抑制率(%) Table 1 Relative inhibition rate of different dilution ratios of F11 fermentation broth on pathogenic bacteria (%) |
根据拮抗情况和相对抑制率分析结果,选取猕猴桃软腐病菌、烟草炭疽病菌、玉米大斑病菌及樟树炭疽病菌4种病原菌进行了F11发酵液3种分离液抑菌活性的进一步分析。结果(图 2)显示,上清液A和粗提液对上述4种病原菌有不同程度的抑菌效果,而经上清液A酸化离心后得到的上清液B并没有抑菌效果。可见菌株F11发酵液的上清液A和粗提液中均含有可以抑制病原菌生长的物质,而上清液B中不含有此类物质。由此可推断,F11的抑菌活性物质并非细菌菌体本身,而是一种不溶于酸的蛋白类或脂肽类胞外代谢物。

|
CK1:过滤除菌的培养基;CK2:盐酸酸化离心调回初始酸度的培养基;CK3:甲醇 CK1:A filter-sterilized medium; CK2:A medium in which hydrochloric acid is acidified and centrifuged to adjust the initial acidity; CK3:Methanol 图 2 菌株F11的上清液A、上清液B和粗提液对猕猴桃软腐病菌(a)、烟草炭疽病菌(b)、玉米大斑病菌(c)、樟树炭疽病菌(d)的抑菌拮抗效果 Figure 2 Antibacterial and antagonistic effects of liquid A, B and crude extracts of strain F11 on Botryosphaeria dothidea (a), Colletotrichum nicotianae Av. (b), Setosphaeria turcica (c), Colletotrichum gloeosporioides (d) |
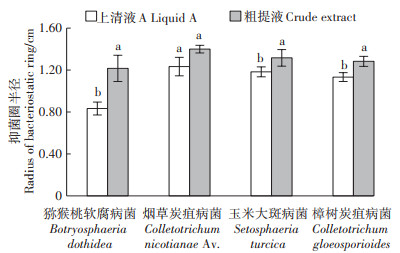
上清液A和粗提液的抑菌圈半径比较结果如图 3所示。上清液A和粗提液对猕猴桃软腐病、玉米大斑病和樟树炭疽病3种病原菌的抑制圈半径表现出显著差异(P < 0.05),且均表现为粗提液的抑制效果优于上清液A,这可能与上清液A和粗提液抑菌物质浓度不一致(粗提液中抑菌物质浓度约为上清液A的5倍)或二者的物质类型差异有关,但二者对烟草炭疽病菌的抑制效果并未表现出显著差异。总体而言,二者对各病原菌的抑菌圈半径超过1.0 cm,表现出较好的抑制效果。由此可见,粗提液中的抑菌物质是上清液A所含抑菌物质的主要组成部分,对上清液A抑菌效果起着重要的作用,该类物质对猕猴桃软腐病菌、玉米大斑病菌、烟草炭疽病菌及樟树炭疽病菌均表现出良好的抑制效果。在不进行抑菌物质提取的情况下,利用无菌体的上清液A进行生物防治也可达到较好的效果。
|
不同小写字母表示同一病原菌的两个处理间差异显著(P < 0.05) The different lowercase letters indicate the difference of inhibition zone radius between liquid A and crude extract against the same pathogen (P < 0.05) 图 3 上清液A和粗提液对四种病原菌的抑菌圈半径 Figure 3 The bacteriostatic ring radius of liquid A and crude extract against four pathogens |
菌株F11发酵液胞外代谢物粗提液的抑菌结果表明4种病原菌菌落生长明显受到抑制,菌株F11对病原菌有较好的抑制效果。抑菌圈边缘病原菌菌丝的镜检结果如图 4所示。正常状态下,各病原菌菌丝体正常生长,菌丝体平滑、均匀、细长;粗提液处理后,受抑制的病原菌菌丝均表现出明显的变形:猕猴桃软腐病菌菌丝体变得粗大、弯曲、形成分隔(图 4b),烟草炭疽病菌菌丝体内原生质聚集成块、生长受到抑制(图 4d),玉米大斑病菌菌丝则出现大泡囊、断裂、畸形溶解(图 4f),樟树炭疽病菌菌丝发生扭曲、蜷缩、缠绕,并出现泡囊(图 4h)。

|
图 4 粗提液对四种病原菌菌丝形态的影响 Figure 4 Effect of crude extract on mycelial morphology of four pathogens |
近年来,生物防治技术已成为现代农业生产中植物病害防治的一项重要措施,探究其生防机理对植物病害防治具有重要意义。大量研究表明,生防菌株对植物病害的防治效果明显。王奕文等[22]从甜瓜表面分离到1株解淀粉芽孢杆菌,该菌株对灰葡萄孢、尖孢镰刀菌、黑曲酶等8种果蔬采后病原真菌具有广谱的拮抗作用。本课题组前期研究指出菌株F11对核盘病、烟草炭疽病等12种植物病原菌的抑菌率均超过79.88%,表现出高效、广谱的抑菌效果[17]。本研究对解淀粉芽孢杆菌F11的生防机理进行了进一步探讨。结果表明,F11发酵液不同稀释倍数对不同病原菌的抑菌效果不尽相同。与发酵原液相比,研究中涉及的稀释倍数基本不影响该菌株对樟树炭疽病菌(Colletotrichum gloeosporioides)的抑制效果,即使稀释1 000倍其抑菌率依然达到100%;而对其他病原菌的抑制效果则表现为随着稀释倍数的增加,抑菌率逐渐降低,但10倍稀释液对烟草黑胫病菌、核盘病菌、玉米大斑病菌、猕猴桃软腐病菌四种病原菌的抑制率仍达100%,100倍稀释液对玉米大斑病菌的抑制率也达80%。说明菌株F11的发酵液在不同稀释倍数下抑菌效果存在着一定的差异,对上述4种病原菌而言,其10倍稀释液可达到原液的抑制效果,因此稀释10倍有望实现菌株F11发酵液应用增值保效的目的。该结果与陈士云等[8]研究结果一致,其研究也指出解淀粉芽孢杆菌CH-2稀释10倍后对油菜核盘病仍具有强烈的抑制作用。
芽孢杆菌属(Bacillus)能够产生大量潜在的抑制植物病原菌生长的生物活性分子,对逆境具有较强的抵抗力,因而被广泛应用于植物病害防治之中[23]。此外它还能够分泌蛋白类、脂肽类和次级代谢物等抗菌物质来抑制有害病原物的生长,是一类重要的生防菌种[24]。柴庆凯等[25]研究表明,解淀粉芽孢杆菌LJ02能通过分泌β-1,3-葡聚糖酶、几丁质酶等胞外物质抑制黄瓜灰霉病,抑制率达44.26%。汪静杰等[24]研究发现,解淀粉芽孢杆菌SWB16粗提物中的芬枯草素、伊枯草素等脂肽类抗菌物质能抑制球孢白疆菌的发生。也有研究表明,解淀粉芽孢杆菌的粗提液中所含的嗜铁素、伊枯草素、丰源素、酶、酸等物质能破坏细胞结构,抑制孢子增生,防治番茄灰霉病和青枯病[10-11]。此外,解淀粉芽孢杆菌还能产生环二肽等次级代谢产物,抑制植物病原菌的形成[26]。本研究对菌株F11发酵液进行分离得到发酵上清液A(发酵液离心所得)、上清液B(经上清液A酸化离心所得)和胞外代谢物粗提液,三种分离液对猕猴桃软腐病、烟草炭疽病、玉米大斑病及樟树炭疽病等病原菌的抑制试验得到了一致的结论。结果表明,上清液A和粗提液对受试病原菌具有良好的抑制作用,而上清液B对受试病原菌并无抑制作用。可见菌株F11发酵液的上清液A及粗提液均含有抑制病原菌生长的物质,但上清液B中并不含有该物质,说明菌株F11是通过分泌胞外代谢抑菌物质来拮抗、抑制病原菌生长,该物质不溶于酸,根据刘文波等[27]和程敏等[28]的相关研究,进一步推测该物质为蛋白类或脂肽类胞外代谢物。镜检结果进一步发现,该胞外代谢活性物质还能够造成该病原菌菌丝消融、溶解、断裂、扭曲,原生质体凝集渗漏、形成泡囊结构,菌丝体扭曲缠绕变形等。该现象与郭金鹏等[9]和邓建良等[21]的研究结果类似,前者指出芽孢杆菌HSY-8-1及其分泌物能使立枯病菌和根腐病菌的菌丝发生消融、扭曲、分枝及形成泡状物等现象,且对酸、碱等环境具有较强的耐受性,该特性与脂肽抗生素相一致;后者则通过定性和定量分析指出解淀粉芽孢杆菌YN-1的粗提液中能够产生使棉花枯萎病菌菌丝消融变细,菌丝体扭曲变形、形成泡囊结构的抑菌活性物质C16Iturin A、C14Fengycin A等9种脂肽抗生素。因此,进一步推测菌株F11的胞外代谢抑菌物质为脂肽抗生素类,但其具体种类还有待进一步分析研究。综上可见,菌株F11具有高效、广谱的抑菌效果,具有作为生防菌株的潜能。
4 结论(1)解淀粉芽孢杆菌F11对烟草炭疽病等12种病原菌均具有良好的防治效果,其对樟树炭疽病的防治效果最好,发酵液经1 000倍稀释后防治效果仍达100%,对烟草黑胫病菌、核盘病菌、玉米大斑病菌、猕猴桃软腐病菌四种病原菌则可以用10倍稀释液代替发酵原液。
(2)菌株F11对病原菌产生抑制作用的物质并非细菌本身,而是由其产生的脂肽类胞外代谢物,该胞外代谢物能抑制病原菌菌丝生长,使其发生消融、断裂、扭曲等现象。
| [1] |
KAMIL F H, SAEED E E, El-Tarabily K A, et al. Biological control of mango dieback disease caused by Lasiodiplodia theobromae using streptomycete and non-streptomycete actinobacteria in the United Arab Emirates[J]. Frontiers in Microbiology, 2018, 9: 829. DOI:10.3389/fmicb.2018.00829 |
| [2] |
RYU C M, KIM J, CHOI O, et al. Improvement of biological control capacity of Paenibacillus polymyxa E681 by seed pelleting on sesame[J]. Biological Control, 2006, 39(3): 282-289. DOI:10.1016/j.biocontrol.2006.04.014 |
| [3] |
BOUAGGA S, URBANEJA A, RAMBLA J L, et al. Orius laevigatus strengthens its role as a biological control agent by inducing plant defenses[J]. Journal of Pest Science, 2018, 91(1): 55-64. DOI:10.1007/s10340-017-0886-4 |
| [4] |
MAZZOLA M, MANICI L M. Apple replant disease: Role of microbial ecology in cause and control[J]. Annual Review of Phytopathology, 2012, 50(1): 45-65. DOI:10.1146/annurev-phyto-081211-173005 |
| [5] |
张华, 赵辉, 王鹏涛, 等. 解淀粉芽孢杆菌B10-26抑菌物质的稳定性研究与初步分离纯化[J]. 河南农业科学, 2014, 43(5): 93-96. ZHANG H, ZHAO H, WANG P T, et al. Stability determination and prefractionation of antifungal substance produced by Bacillus amyloliquefaciens B10-26[J]. Journal of Henan Agriculture Sciences, 2014, 43(5): 93-96. DOI:10.3969/j.issn.1004-3268.2014.05.021 |
| [6] |
荣艳君. 解淀粉芽孢杆菌R3菌株抗菌脂肽及其作用于病原大肠杆菌的研究[D]. 青岛: 中国海洋大学, 2014. RONG Y J. Antibacterial activity of the lipopeptides produced by Bacillus amyloliquefaciens R3 against multidrug-resistant pathogenic E. coli[D]. Qingdao: Ocean University of China, 2014. |
| [7] |
闫晓妮, 马天有, 杜仁佳, 等. 解淀粉芽孢杆菌胞外抑菌活性物质研究现状[J]. 中国微生态学杂志, 2018, 30(2): 229-234. YAN Xiaoni, MA Tian-you, DU Ren-jia, et al. Extracellar antibacterial compounds produced by Bacillus amyloliquefaciens: Research progress[J]. Chinese Journal of Microecology, 2018, 30(2): 229-234. |
| [8] |
陈士云, 杨宝玉, 高梅影, 等. 一株抑制油菜核盘菌菌核形成的解淀粉芽孢杆菌[J]. 应用与环境生物学报, 2005, 11(3): 373-376. CHEN S Y, YANG B Y, GAO M Y, et al. Inhibition of sclerotia formation of Sclerotinia sclerotiorum by Bacillus amyloliquefaciens[J]. Chinese Journal of Applied and Environmental Biology, 2005, 11(3): 373-376. DOI:10.3321/j.issn:1006-687X.2005.03.027 |
| [9] |
郭金鹏, 刘晓昌, 仝赞华, 等. 芽孢杆菌HSY-8-1对植物病原真菌的抑制及其抑菌产物特性[J]. 吉林农业大学学报, 2010, 32(1): 29-33. GUO J P, LIU X C, TONG Z H, et al. Antagonism of Bacillus sp. HSY-8-1 against plant pathogens and properties of its anti-fungal substance[J]. Journal of Jilin Agricultural University, 2010, 32(1): 29-33. |
| [10] |
李春雨. 解淀粉芽孢杆菌SQRT3防控番茄土传青枯病及其机理研究[D]. 南京: 南京农业大学, 2014. LI C Y. Effects and mechanisms of Bacillus amyloliquefacien SQRT3 on biological control of bacterial wilt in tomato[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [11] |
李红晓. 解淀粉芽孢杆菌抑菌作用机理的探究[D]. 沈阳: 沈阳师范大学, 2016. LI H X. The inhibition mechanism of Bacillus amyloliquefaciens[D]. Shenyang: Shenyang Normal University, 2016. |
| [12] |
KOGLIN A, LOEHR F, BERNHARD F, et al. Structural basis for the selectivity of the external thioesterase of the surfactin synthetase[J]. Nature, 2008, 454: 907-911. DOI:10.1038/nature07161 |
| [13] |
张靖宜, 张倩茹, 项文化, 等. 一株拮抗立枯丝核菌的放线菌筛选、鉴定及生理特性[J]. 生态学杂志, 2014, 33(2): 394-399. ZHANG J Y, ZHANG Q R, XIANG W H, et al. Screening, identification and physiological characteristics of an actinomycete strain against Rhizoctonia solani[J]. Chinese Journal of Ecology, 2014, 33(2): 394-399. |
| [14] |
赖宝春, 戴瑞卿, 林明辉, 等. 一株拮抗放线菌的鉴定及其对香蕉枯萎病的生防效应[J]. 南方农业学报, 2020, 51(4): 836-843. LAI B C, DAI R Q, LIN M H, et al. Identification of an antagonistic actinomycetes and its biological control effect on banana fusarium wilt[J]. Journal of Southern Agriculture, 2020, 51(4): 836-843. |
| [15] |
周东兴, 王恩泽, 刘多, 等. 番茄枯萎病生防细菌的筛选及对植株防御酶活性的影响[J]. 生态学杂志, 2020, 39(5): 1753-1760. ZHOU D X, WANG E Z, LIU D, et al. Screening of biocontrol bacteria against tomato wilt and the effect on defense enzyme activity of plants[J]. Chinese Journal of Ecology, 2020, 39(5): 1753-1760. |
| [16] |
杨蕾, 周国英, 梁军, 等. 防治杨树溃疡病内生菌的分离筛选及鉴定[J]. 植物保护学报, 2014, 41(4): 438-446. YANG L, ZHOU G Y, LIANG J, et al. Isolation, screening and identification of the endogenous microorganisms antagonizing poplar canker[J]. Acta Phytophylacica Sinica, 2014, 41(4): 438-446. |
| [17] |
陈海念, 冯蓉, 杨胜竹, 等. 1株生防菌的鉴定及其发酵条件优化[J]. 浙江大学学报(农业与生命科学版), 2020, 46(2): 177-188. CHEN H N, FENG R, YANG S Z, et al. Identification of a biocontrol strain and optimization of its fermentation conditions[J]. Journal of Zhejiang University (Agricalture & Life Sciences), 2020, 46(2): 177-188. |
| [18] |
吕捷, 陈云, 朱从一, 等. 拮抗菌Bs43的鉴定、抑菌机理及其对采后柑橘绿霉病的生防效果[J]. 果树学报, 2014, 31(5): 885-892. LÜ J, CHEN Y, ZHU C Y, et al. Identification of an antagonistic strain Bs43, its inhibitory mechanism and biocontrol effects on postharvest citrus green mold[J]. Journal of Fruit Science, 2014, 31(5): 885-892. |
| [19] |
王燕, 王春伟, 王琳, 等. 梨灰霉病菌拮抗细菌Pseudomonas extremorientalis的鉴定、发酵条件优化及防效评价[J]. 中国生物防治学报, 2019, 35(3): 437-448. WANG Y, WANG C W, WANG L, et al. Identification, optimization of fermentation conditions of antagonistic bacterium Pseudomonas extremorientalis against Botrytis cinerea on pear and evaluation of its biocontrol efficacy[J]. Chinese Journal of Biological Control, 2019, 35(3): 437-448. |
| [20] |
黄建凤, 张发宝, 逄玉万, 等. 两株香蕉枯萎病拮抗细菌的筛选及抑菌机理[J]. 微生物学通报, 2017, 44(4): 835-844. HUANG J F, ZHANG F B, PANG Y W, et al. Inhibition of banana fusarium wilt by two biocontrol agents[J]. Microbiology China, 2017, 44(4): 835-844. |
| [21] |
邓建良, 刘红彦, 刘玉霞, 等. 解淀粉芽孢杆菌YN-1抑制植物病原真菌活性物质鉴定[J]. 植物病理学报, 2010, 40(2): 202-209. ENG J L, LIU H Y, LIU Y X, et al. Identification of the antifungal substances from Bacillus amyloliquefaciens strain YN-1[J]. Acta Phytopathologica Sinica, 2010, 40(2): 202-209. |
| [22] |
王奕文, 胡文兵, 许玲. 甜瓜果实表面生防芽孢杆菌的类群与鉴别[J]. 植物病理学报, 2008, 38(3): 317-324. WANG Y W, HU W B, XU L. Identification of the antagonistic Bacillus strains on melon fruit surface[J]. Acta Phytopathologica Sinica, 2008, 38(3): 317-324. DOI:10.3321/j.issn:0412-0914.2008.03.015 |
| [23] |
ONGENA M, JACQUES P. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125. DOI:10.1016/j.tim.2007.12.009 |
| [24] |
汪静杰, 赵东洋, 刘永贵, 等. 解淀粉芽孢杆菌SWB16菌株脂肽类代谢产物对球孢白僵菌的拮抗作用[J]. 微生物学报, 2014, 54(7): 778-785. WANG J J, ZHAO D Y, LIU Y G, et al. Antagonism against Beauveria bassiana by lipopeptide metabolites produced by entophyte Bacillus amyloliquefaciens strain SWB16[J]. Acta Microbiologica Sinica, 2014, 54(7): 778-785. |
| [25] |
柴庆凯, 张斌, 常若葵, 等. 解淀粉芽孢杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究[J]. 植物病理学报, 2019, 49(6): 828-835. CHAI Q K, ZHANG B, CHANG R K, et al. Preliminary study on the effect of the induced resistance in cucumber with Bacillus amyloliquefaciens LJ02 against Botrytis cinerea[J]. Acta Phytopathologica Sinica, 2019, 49(6): 828-835. |
| [26] |
张龙来, 康向辉, 魏孝义, 等. 1株解淀粉芽孢杆菌HN011抑菌次级代谢产物的分析[J]. 华南农业大学学报, 2016, 37(1): 63-69. ZHANG L L, KANG X H, WEI X Y, et al. Research on secondary metabolites from Bacillus amyloliquefaciens strain HN011[J]. Journal of South China Agricultural University, 2016, 37(1): 63-69. |
| [27] |
刘文波, 秦春秀, 熊燕红, 等. 解淀粉芽孢杆菌HAB-7对18株植物病原真菌的抑制作用[J]. 热带农业科学, 2017, 37(2): 52-57. LIU W B, QIN C X, XIONG Y H, et al. Analysis of antifungal activity of Bacillus amyloliquefaciens HAB-7 against 18 phytopathogens[J]. Chinese Journal of Tropical Agriculture, 2017, 37(2): 52-57. |
| [28] |
程敏, 徐秋芳. 解淀粉芽孢杆菌植物亚种CGMCC 11640对山核桃干腐病菌的抑制机制[J]. 浙江农林大学学报, 2017, 34(2): 326-331. CHENG M, XU Q F. Inhibitory mechanism of Bacillus amyloliquefaciens subsp. plantarum CGMCC 11640 against Botryosphaeria dothidea, the pathogen of canker disease of Carya cathayensis[J]. Journal of Zhejiang A & F University, 2017, 34(2): 326-331. |
 2021, Vol. 38
2021, Vol. 38