2. 江苏省水处理技术与材料协同创新中心, 江苏 苏州 215009;
3. 昆山市巴城镇农地股份专业合作联社, 江苏 苏州 215311
2. Jiangsu Collaborative Innovation Center of Water Treatment Technology and Material, Suzhou 215009, China;
3. Agricultural Land Stock Professional Cooperative Association of Bacheng Kunshan, Suzhou 215311, China
生物质炭是一种高度芳香化难熔多孔性固态物质,主要是由植物或动物生物质在300~700 ℃低温条件下热解炭化形成[1],研究已证明生物质炭施入土壤具有增加土壤碳库储量、改良土壤、提高土壤肥力、促进作物增产和维持土壤生态系统平衡等作用[2]。同时,生物质炭的高度稳定性、经济性、固碳减排和对氮磷养分的专性吸附与持留特性,成为改良土壤和减少氮磷流失的重要材料之一[3-4]。
施入生物质炭会改变土壤主要功能菌的群落结构和丰度[5]。在晚稻生长期,废弃物施加可以促进细菌群落多样性的提升,生物质炭处理组比对照组的细菌多样性指数提高了2.55%[6]。生物质炭含有较高含量的碳,能够作为一些微生物生存的碳源,促进特定微生物的生长繁殖[7]。生物质炭施入农田土壤后放线菌门、酸杆菌门和疣微菌门的相对丰度升高[8]。生物质炭通过降低水稻土壤氨氮含量,改变了反硝化过程功能基因nirK和nosZ的含量,而narG基因群落结构的变化影响了土壤N2O排放,进而影响整个土壤氮循环[9]。盖霞普等[10]研究表明,生物质炭的输入降低了土壤中各微生物类群磷脂脂肪酸(PLFA)含量,但在各处理间差异不明显,表明其对土壤微生物多样性影响不显著。施用生物质炭和炭基肥对土壤微生物群落的影响不同,施用生物质炭有利于细菌群落的繁殖,而施用炭基肥有利于土壤真菌/细菌比和土壤微生物群落结构多样性的提升[11]。同时,赵长江等[12]研究表明,减肥条件下配施生物质炭可以显著提升作物的产量,提高肥料利用率。然而,不同肥料减量及配施生物质炭对水稻田非根际/根际土壤微生物多样性的影响研究还较少,本研究旨在探索在肥料不同减量施用下,水稻秸秆生物质炭施用对水稻田土壤细菌多样性的影响,为生物质炭改良水稻土微生物群落结构提供理论参考。
1 材料与方法 1.1 试验地概况研究试验地位于江苏省苏州市昆山某农业合作社内,地处东经120°53' 38″、北纬31°29' 18″,属亚热带季风气候区,气候温和湿润,四季分明,光照充足,雨量充沛,年平均气温17.6 ℃,年平均降水量1 200.4 mm,年平均日照时间1 789.2 h。试验地是该合作社典型的水稻田,长期种植单季水稻。生物质炭产自勤丰众成生物质新材料(南京)有限公司,采用滚筒式炭化炉,在450~500 ℃下炭化水稻秸秆1.5 h制备而成。生物质炭基本理化性质:pH值10.2,比表面积31.68 m2·g-1,电导率0.181 S·m-1。供试土壤的基本理化性质:pH值5.5,碱解氮126.5 mg·kg-1,有效磷31.93 mg· kg-1,速效钾257.34 mg·kg-1。
1.2 试验设计本试验在长期种植单季水稻的种植区开展,新设试验小区面积为30 m2(5 m×6 m),设置4个处理:①施肥100%+不添加生物质炭;②施肥100%+生物质炭1%;③施肥90%+生物质炭1%;④施肥80%+生物质炭1%,每个处理3次重复,共计12个小区。施肥100%代表采用稻田常规施肥,施肥分为两次:基肥复合肥每667 m2施用40 kg,在水稻种植前5 d施入;追肥尿素每667 m2施用7.5 kg,水稻种植后8 d施入。其中复合肥购自无锡市太平洋化肥有限公司,总养分N+P2O5+K2O≥ 45%,N、P2O5和K2O的含量分别≥19%、9% 和17%;尿素购自安徽昊源化工集团有限公司,总氮≥46%,粒度范围1.18~3.35 mm。减肥处理中,基肥和追肥均按照比例减少。生物质炭添加量为2.25 kg·m-2(土壤质量的1%),在水稻种植前,翻耕过程中加入生物质炭,与初始土壤充分混合。
1.3 样品采集试验开展时间为2019年6—10月,于当季水稻种植前后对土壤进行采样。水稻种植前初始土壤为水稻田翻耕前土壤,水稻种植后非根际土壤和根际土为水稻收割当日水稻田土壤。初始土壤和非根际土壤均采自0~20 cm土层,分别采集3个,混合均匀后作为土壤样品;随机选取水稻3株,采用抖落法收集水稻根际土壤,将3株水稻的根际土壤收集后混匀,作为根际土壤样品。各处理土壤样品标记见表 1。样品采集后放置于带有冰袋的保温箱,并及时送回实验室保存于-80 ℃冰箱。
|
|
表 1 各处理土壤样品标记 Table 1 Label table of soil samples for each treatment |
土壤样品总DNA的提取采用FastPrep DNA提取试剂盒法,并采用16S rRNA基因V3~V4区通用引物338F(5'-ACTCCTRCGGGAGGCAGCAG-3'),806R (5'-GGACTACCAGGGTATCTAAT-3')进行PCR扩增,后续MiSeq文库构建、MiSeq测序、序列拼接及OTU分类均由上海派森诺生物科技有限公司完成[13-14]。
1.5 数据分析运用SPSS 20.0分析软件对数据进行单因素方差分析(ANOVA,置信水平95%)和LSD-t检验(α = 0.05)。典范对应分析(CCA)是由对应分析相互平均(CA/RA)修改而产生的新方法,将CA/RA和多元回归结合,每一步计算结果都与环境因子进行回归,可以详细分析研究对象与环境之间的关系,该方法能够结合多个环境因子分析,较好地反映研究对象与环境之间的关系[15]。本研究采用CCA对水稻田土壤微生物群落组成和环境因子(采样位置、肥料添加、生物质炭添加等)之间的关系进行分析,利用国际通用标准分析软件Canoco 4.5,将环境数据和微生物数据按lg(x+1)进行处理后排序分析,并得到环境因子间的相关性[16]。
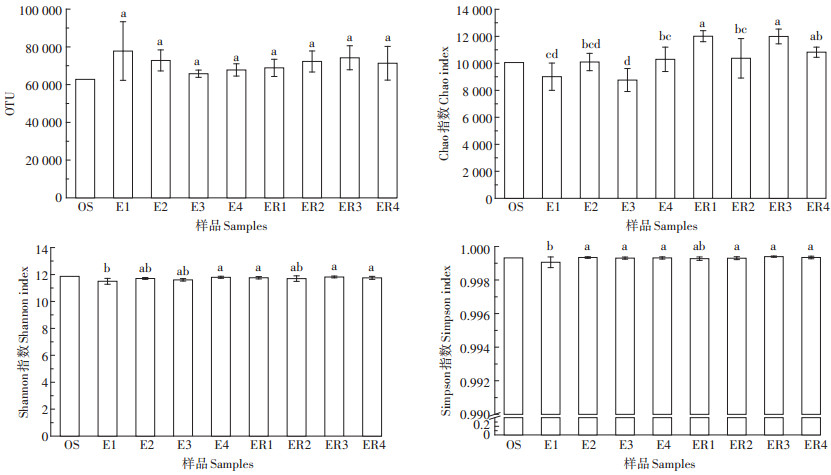
2 结果与讨论 2.1 各处理土壤细菌丰度及多样性分析从图 1可以看出,各处理土壤微生物样品OTU数存在差异,在62 772~77 795之间波动,但差异不显著(P>0.05)。从OTU数量来看,添加生物质炭E2、E3和E4处理OTU低于未添加生物质炭的E1处理,但在根际土壤中,添加生物质炭后OTU总体数量增多。本研究采用Chao、Shannon、Simpson指数表征各处理土壤样品的细菌群落和物种的丰富度。丰富度指数Chao指数可以用来估算土壤微生物群落中含OTU的数目,在生态学中常用来估计物种总数,其数值越大代表物种总数越多[17]。从物种的丰富度来看,E2和E4处理非根际土壤的Chao指数与水稻田初始土壤OS接近,未种植水稻土壤OS的Chao指数明显高于其他非根际土处理,表明水稻种植后细菌多样性总体上呈现持续下降趋势。但在种植后根际土壤中,Chao指数明显高于非根际土处理以及OS,表明水稻根际为微生物生长提供了良好的生长环境。E3(肥料90%)和E4(肥料80%)处理间存在显著差异,表明非根际土中,减施会造成细菌多样性显著差异;而ER2和ER1处理之间存在显著性差异,说明肥料不减施情况下,施用生物质炭会造成土壤微生物差异显著。而Shannon指数反映了基于物种数量的群落种类多样性,其指数越大,表明土壤中群落的复杂程度越高[18],未种植水稻土壤OS的Shannon指数高于其他处理。非根际土壤之间,仅E1与E4处理间存在显著差异(P<0.05);而根际土壤之间,不管是生物质炭添加还是减肥处理,差异均不显著。Simpson指数体现了优势物种生物量占群落生物总量的比例,该指数越大表明优势菌群生物量占总生物量比例越大,反之则优势菌群生物量占总生物量比例越小。从图 1可以看出,Simpson指数在各处理之间变化较小,仅在非根际土壤中,未添加生物质炭的E1处理与添加生物质炭的E2、E3、E4处理间存在显著性差异,而根际土壤中各处理差异不显著,表明在各土壤样品中优势种群变化不大。
|
不同小写字母表示各土壤样品间差异显著(P<0.05)。下同 Different lowercase letters indicate significant difference among soil samples(P<0.05). The same below 图 1 各土壤样品细菌丰度变化情况 Figure 1 Richness and diversity indexes of microbial communities in the soil samples |
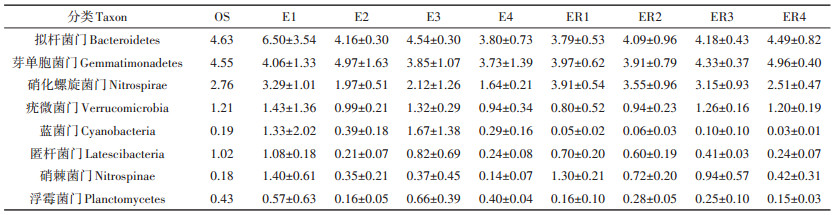
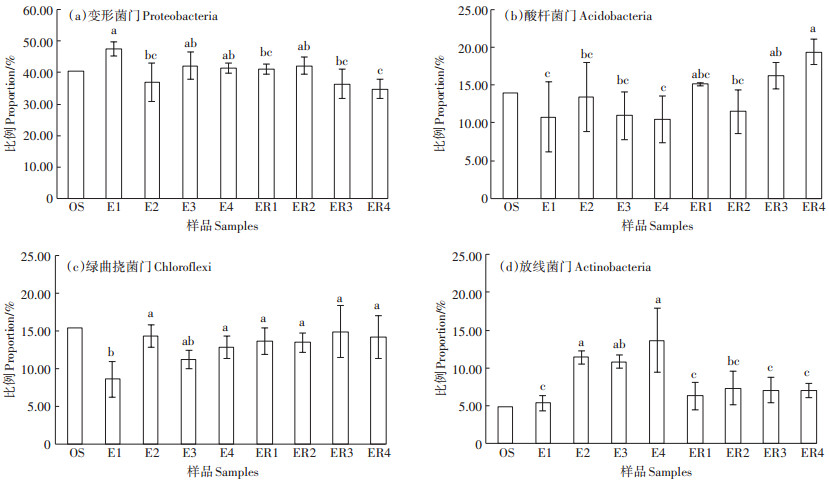
从图 2可以看出,各处理土壤细菌群落结构多样性较为丰富,从门水平来看,按照丰富度排列主要存在变形菌门(Proteobacteria)、酸杆菌门(Acidobacte⁃ ria)、绿曲挠菌门(Chloroflexi)、放线菌门(Actinobacte⁃ ria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmati⁃ monadetes)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Ver⁃ rucomicrobia)、蓝菌门(Cyanobacteria)、匿杆菌门(Lates⁃ cibacteria)、硝棘菌门(Nitrospinae)、浮霉菌门(Plancto⁃ mycetes)等门类,这12类菌占总细菌的81.58%~ 91.86%。其中变形菌门占比最高,为34.85%~ 47.57%,酸杆菌门次之,占10.48%~19.42%。由此可见,变形菌门与酸杆菌门在水稻土壤微生物中具有重要地位。本研究中非根际土变形菌门变化较大,E1处理中变形菌门占比最高,为47.57%,而E2处理占比最小,为36.94%,且E1和E2处理间存在显著性差异(P<0.05)。而减施处理E3和E4比初始土壤OS (40.37%)略有升高,分别为42.11% 和41.34%,差异不显著(P>0.05)。而在水稻根际土壤中,ER2处理占比最高,为42.18%,表明生物质炭可以促进变形菌门在水稻根际土中的富集,而肥料减施明显降低了变形菌门的占比,处理间仅ER2与ER4存在显著性差异(P<0.05)。酸杆菌门与变形菌门变化趋势相反,在非根际土样品中,E2处理最高,为13.45%,各处理间差异不显著(P>0.05),而在根际土中,ER2占比最低,仅11.50%,但减肥处理ER4占比最高,为19.42%,且ER2和ER4处理间差异显著(P<0.05)。陈庆荣等[19]研究了施用烟秆生物黑炭对红壤性稻田根际土壤微生物的影响,同样发现变形菌门和酸杆菌门占比最高,为33.96%~43.37% 和18.93%~28.81%,而且发现施用生物黑炭后,变形菌门占比增大而酸杆菌门占比减小。王晶等[20]研究发现,秸秆炭化还田处理会促进酸杆菌门等相对丰度显著增加。排在第3位的是绿曲挠菌门,其作用是固碳,将CO2固定为最终产物丙酮酸。在各处理中,E1处理与其他处理间均存在显著性差异(P<0.05,E3处理除外)。而第4类检测到较多的微生物是放线菌门,其能够降解复杂的木质素与纤维素,为土壤提供养分[21]。在非根际土中,添加生物质炭的处理E2、E3、E4与未添加生物质炭的E1处理间存在显著差异,且添加生物质炭明显提升了放线菌门的占比,从5.32%升至10.77%~13.60%;在根际土中变化趋势类似,添加生物质炭会提高放线菌门在根际土中的丰度。
|
图 2 各处理土壤样品中4种主要细菌分类(门)的群落组成相对百分比 Figure 2 Taxonomic classification of the four main bacterial communities in the soil samples at the phylum level |
其他8类占比相对较低的微生物丰度见表 2。肥料中主要是氮磷钾等元素,其中氮素在土壤营养元素吸收和转化中具有重要作用。本研究涉及到氮转化功能的微生物有变形菌门、硝化螺旋菌门和浮霉菌门3种。除了变形菌门,硝化螺旋菌门占比在1.64%~ 3.91% 之间,不管是在土壤还是根际土壤中,硝化螺旋菌门在未添加生物质炭的处理中较高,而添加生物质炭降低了硝化螺旋菌门微生物的丰度。硝化螺旋菌门是一类革兰氏阴性细菌,常在土壤中被检测到,其中的硝化螺旋菌属(Nitrospira)是硝化细菌,可将亚硝酸盐氧化成硝酸盐,促进土壤氮素的转化[22]。也就是说,生物质炭添加可以促进水稻对土壤氮素的转化和吸收。而浮霉菌门也是重要的氮转化微生物,占比为0.15%~0.66%,自养脱氮系统中厌氧氨氧化菌属于浮霉菌门,厌氧氨氧化菌可以将氨氮和亚硝态氮转化为氮气,在环境氮转化特别是极端环境氮转化中具有重要作用[23]。浮霉菌门微生物在E2处理中占比最低,而在ER2处理中占比最高。
|
|
表 2 各处理土壤样品中其他细菌分类(门)的群落组成相对百分比(%) Table 2 Taxonomic classification of the others bacterial communities in the soil samples at the phylum level(%) |
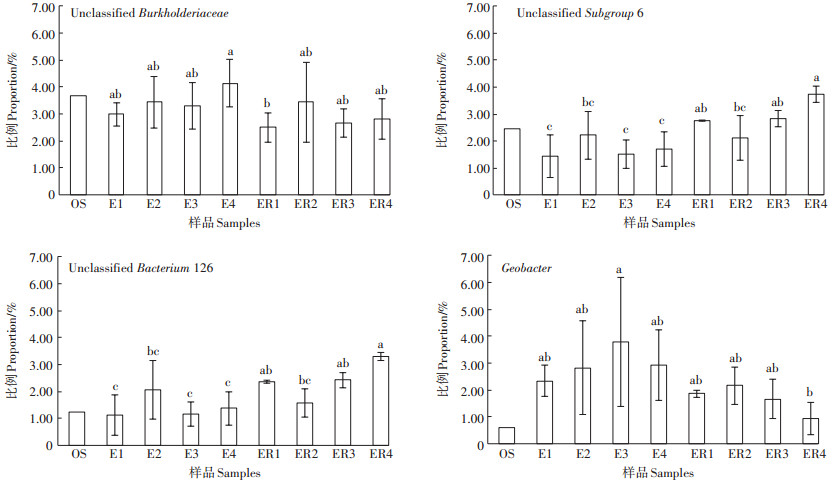
从微生物属水平来看,能够鉴定到属且丰度在0.5% 以上的微生物共计15种,占总细菌比例的19.49%~27.14%。本研究选取占比较高的4种微生物分析了其在各根际/非根际土壤中的占比,见图 3。其中Unclassified Burkholderiaceae属占比最高,在2.51%~4.14% 之间,属于变形菌门伯克氏菌科(Burkholderiaceae),常在土壤中被检测到[24]。Unclassified Burkholderiaceae属微生物被证明与种植植物的枯死病有关。Mendes等[25]研究发现,当土壤中的微生物伯克氏菌科(Burkholderiaceae)、黄色单胞菌科(Xanthomonadaceae)、假单胞菌科(Psedudomonadaceae)和放线菌乳杆菌科(Lactobacillaceae)的相对比例增加到一定程度时,病原菌立枯丝核菌所引起的甜菜枯死病能够得到有效控制,降低甜菜枯死病的发生。Unclassified Burkholderiaceae属微生物在OS土壤中丰度较高,占3.68%,而种植水稻后丰度总体有所下降。在非根际土壤中,添加生物质炭促进了该属微生物的生长,从E1处理的2.99%增至3.30%~4.14%,E4处理最高,但添加生物质炭后影响并不显著(P>0.05);而在根际土壤样品中该属微生物丰度低于非根际土壤,但变化趋势一致,生物质炭添加丰度从2.51% 增至2.66%~3.44%,影响也不显著(P>0.05)。
|
图 3 各处理土壤样品中主要细菌分类(属)的群落组成相对百分比 Figure 3 Taxonomic classification of the main bacterial communities in the soil samples at the genus level |
而从Unclassified Subgroup 6、Unclassified Bacterium 126来看,根际土壤处理丰度高于非根际土壤,与Unclassified Burkholderiaceae属变化趋势相反(图 3)。从非根际土壤来看,两者丰度均随着生物质炭添加而增加,在E2处理中最高,分别为2.22%和2.06%,且肥料减量后丰度下降,但影响不显著(P>0.05);而根际土中ER2处理丰度均最低,随着肥料减施,丰度升高,施用80% 肥料的ER4处理与施肥100% 的ER2处理间差异显著(P<0.05)。而从Geobacter属来看,水稻种植处理明显提升了Geobacter属的丰度,且在非根际土壤中,生物质炭处理提升了该属微生物丰度,从2.34% 升至2.83%~3.78%,肥料减施提升了Geobacter属的丰度,但各处理间差异不显著(P>0.05);从根际土来看,ER2处理占比最高,为2.17%,肥料减施降低了Geobacter属在根际土中的丰度。李坚等[26]研究发现,导电生物质炭作为导电通道,可以促进Geobacter与其他菌共培养体系互营产甲烷,从而促进Geobacter属的丰度。
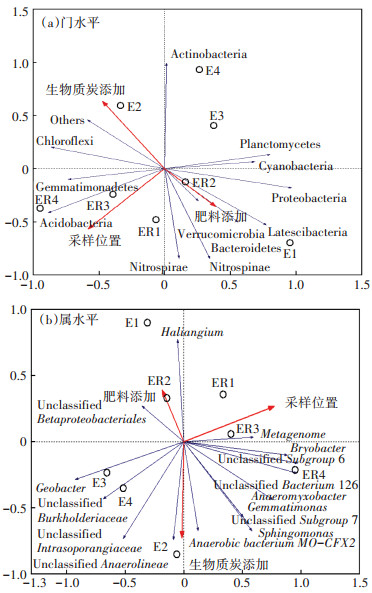
2.4 环境条件与微生物群落之间的相关性典范对应分析(CCA)常用于评估环境条件对土壤及根际土壤中微生物群落动态的影响。CCA的结果揭示了环境参数与土壤微生物群落之间的相关性,如图 4所示。从门的水平来看,变形菌门(Proteobacteria)与肥料添加呈正相关,而与生物质炭添加、采样位置呈负相关,酸杆菌门(Acidobacteria)与肥料添加呈负相关,与采样位置呈正相关,但与生物质炭添加的相关性不明显,这与陈庆荣等[19]的研究一致。水稻秸秆生物质炭pH达10.2,施入农田会提升土壤pH值,而研究发现土壤中酸杆菌门的丰度与土壤pH呈显著负相关[27],也就是说加入生物质炭会降低土壤中酸杆菌门的丰度;也有研究表明,加入生物质炭使红壤剖面酸杆菌门丰度与pH值的相关性不明显[28]。
|
图 4 不同环境参数与菌群的典范对应分析结果 Figure 4 Canonical correspondence analysis of different environmental parameters and bacterial community |
从属的水平看,Unclassified Burkholderiaceae与生物质炭添加呈正相关,而与采样位置呈负相关,与肥料添加相关性不显著。Unclassified Subgroup 6、Unclassified Bacterium 126与肥料添加呈负相关,与采样位置呈正相关,而与生物质炭添加相关性不显著。研究发现Subgroup 6相对丰度与养分有效性呈显著正相关,而与土壤某些(与酸度有关)化学性质呈负相关[29]。本研究水稻秸秆添加改变了土壤酸度,但Subgroup 6与生物质炭添加相关性不显著,具体原因还有待进一步分析。
3 结论(1) 减肥施用条件下生物质炭添加对水稻非根际和根际土壤细菌多样性造成影响,与非根际土相比,水稻根际细菌多样性更加丰富。
(2)水稻土壤微生物中变形菌门和酸杆菌门占主导,分别为34.85%~47.57% 和10.48%~19.42%。生物质炭添加降低了变形菌门在非根际土的丰度,而促进其在根际土中富集,而肥料减施对变形菌门丰度的影响则相反;酸杆菌门变化趋势与变形菌门相反。Unclassified Burkholderiaceae,Unclassified Subgroup 6、Unclassified Bacterium 126等菌属在水稻田土壤占比较高。
(3)典范对应分析(CCA)结果表明,水稻田土壤微生物细菌多样性与采样位置、肥料添加、生物质炭添加等环境因素存在一定的相关性。
| [1] |
Lehmann J, Joseph S. Biochar for environmental management: An introduction[M]. London: Earthscan Publisher, 2009.
|
| [2] |
李力, 刘娅, 陆宇超, 等. 生物炭的环境效应及其应用的研究进展[J]. 环境化学, 2011, 30(8): 1411-1421. LI Li, LIU Ya, LU Yu-chao, et al. Review on environmental effects and applications of biochar[J]. Environmental Chemistry, 2011, 30(8): 1411-1421. |
| [3] |
陈颖, 刘玉学, 陈重军, 等. 生物炭对土壤有机碳矿化的激发效应及其机理研究进展[J]. 应用生态学报, 2018, 29(1): 314-320. CHEN Ying, LIU Yu-xue, CHEN Chong-jun, et al. Priming effect of biochar on the minerialization of native soil organic carbon and the mechanisms: A review[J]. Chinese Journal of Applied Ecology, 2018, 29(1): 314-320. |
| [4] |
Liu Y X, Lonappan L, Brar S K, et al. Impact of biochar amendment in agricultural soils on the sorption, desorption, and degradation of pesticides: A review[J]. Science of the Total Environment, 2018, 645: 60-70. DOI:10.1016/j.scitotenv.2018.07.099 |
| [5] |
陈重军, 刘玉学, 冯宇, 等. 添加竹炭对设施菜地土壤氮磷流失和微生物群落结构的影响[J]. 浙江农业学报, 2018, 30(1): 123-128. CHEN Chong-jun, LIU Yu-xue, FENG Yu, et al. Effects of bamboo charcoal addition on nitrogen and phosphorus loss and microbial community structures in greenhouse vegetable soil[J]. Acta Agriculturae Zhejiangensis, 2018, 30(1): 123-128. DOI:10.3969/j.issn.1004-1524.2018.01.16 |
| [6] |
周雅心, 王晓彤, 王广磊, 等. 炉渣与生物炭施加对稻田土壤细菌多样性及群落组成的影响[J]. 中国环境科学, 2020, 40(3): 1213-1223. ZHOU Ya-xin, WANG Xiao-tong, WANG Guang-lei, et al. Effect of the slag and biochar application on bacterial diversity and community composition of paddy field[J]. China Environmental Science, 2020, 40(3): 1213-1223. DOI:10.3969/j.issn.1000-6923.2020.03.033 |
| [7] |
Zhang Q Z, Dijkstra F A, Liu X R, et al. Effects of biochar on soil microbial biomass after four years of consecutive application in the North China Plain[J]. PLoS ONE, 2014, 9(7): e102062. DOI:10.1371/journal.pone.0102062 |
| [8] |
Kirby R. Actinomycetes and lignin degradation[J]. Advances in Applied Microbiology, 2005, 58: 125-168. |
| [9] |
刘杰云, 邱虎森, 王聪, 等. 生物质炭对双季稻田土壤反硝化功能微生物的影响[J]. 环境科学, 2019, 40(5): 2394-2403. LIU Jie-yun, QIU Hu-sen, WANG Cong, et al. Influence of biochar amendment on soil denitrifying microorganisms in double rice cropping system[J]. Environmental Science, 2019, 40(5): 2394-2403. |
| [10] |
盖霞普, 刘宏斌, 翟丽梅, 等. 生物炭对中性水稻土养分和微生物群落结构影响的时间尺度变化研究[J]. 农业环境科学学报, 2016, 35(4): 719-728. GAI Xia-pu, LIU Hong-bin, ZHAI Li-mei, et al. Temporal fluctuations of impacts of corn-stover biochar on nutrients and microbial community structure in a neutral paddy soil[J]. Journal of Agro-Environment Science, 2016, 35(4): 719-728. |
| [11] |
陈坤, 徐晓楠, 彭靖, 等. 生物炭及炭基肥对土壤微生物群落结构的影响[J]. 中国农业科学, 2018, 51(10): 1920-1930. CHEN Kun, XU Xiao-nan, PENG Jing, et al. Effects of biochar and biochar-based fertilizer on soil microbial community structure[J]. Scientia Agricultura Sinica, 2018, 51(10): 1920-1930. DOI:10.3864/j.issn.0578-1752.2018.10.011 |
| [12] |
赵长江, 鞠世杰, 贝丽霞, 等. 生物炭与化肥不同比例配施对生菜产量和品质的影响[J]. 黑龙江农业科学, 2020(2): 33-37. ZHAO Chang-jiang, JU Shi-jie, BEI Li-xia, et al. Effects of different proportion of fertilizer to biochar on the yield and quality of Lactuca sativa[J]. Heilongjiang Agricultural Sciences, 2020(2): 33-37. |
| [13] |
Zhang X L, Tian X Q, Ma L Y, et al. Biodiversity of the symbiotic bacteria associated with toxic marine Dinoflagellate alexandrium[J]. Journal of Biosciences and Medicines, 2015, 3(6): 23-28. DOI:10.4236/jbm.2015.36004 |
| [14] |
陈重军, 张海芹, 汪瑶琪, 等. 基于高通量测序的ABR厌氧氨氧化反应器各隔室细菌群落特征分析[J]. 环境科学, 2016, 37(7): 2652-2658. CHEN Chong-jun, ZHANG Hai-qin, WANG Yao-qi, et al. Characteristics of microbial community in each compartment of ABR ANAMMOX reactor based on high throughput sequencing[J]. Environmental Science, 2016, 37(7): 2652-2658. |
| [15] |
张金屯. 数量生态学[M]. 三版. 北京: 科学出版社, 2018. ZHANG Jin-tun. Quantitative ecology[M]. 3th Edition. Beijing: Science Press, 2018. |
| [16] |
杨贵军, 贺奇, 王新谱. 盐池四墩子拟步甲昆虫群落组成与环境因子的相关性[J]. 应用生态学报, 2010, 21(9): 2375-2382. YANG Gui-jun, HE Qi, WANG Xin-pu. Darkling beetle community structure and its relations with environmental factors in Sidunzi of Yanchi, Ningxia, China[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2375-2382. |
| [17] |
Shu D T, He Y L, Yue H, et al. Metagenomic insights into the effects of volatile fatty acids on microbial community structures and functional genes in organotrophic anammox process[J]. Bioresource Technology, 2015, 196: 621-633. DOI:10.1016/j.biortech.2015.07.107 |
| [18] |
王智, 张志勇, 张君倩, 等. 水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征[J]. 中国环境科学, 2012, 32(1): 142-149. WANG Zhi, ZHANG Zhi-yong, ZHANG Jun-qian, et al. The fauna structure of benthic macro-invertebrates for environmental restoration in a eutrophic lake using water hyacinths[J]. China Environmental Science, 2012, 32(1): 142-149. DOI:10.3969/j.issn.1000-6923.2012.01.023 |
| [19] |
陈庆荣, 王成己, 陈曦, 等. 施用烟秆生物黑炭对红壤性稻田根际土壤微生物的影响[J]. 福建农业学报, 2016, 31(2): 184-188. CHEN Qing-rong, WANG Cheng-ji, CHEN Xi, et al. Effect of tobacco stalk-derived biochar on microbes in rhizosphere soil at red paddy fields[J]. Fujian Journal of Agricultural Sciences, 2016, 31(2): 184-188. |
| [20] |
王晶, 马丽娟, 龙泽华, 等. 秸秆炭化还田对滴灌棉田土壤微生物代谢功能及细菌群落组成的影响[J]. 环境科学, 2020, 41(1): 420-429. WANG Jing, MA Li-juan, LONG Ze-hua, et al. Effects of straw biochar on soil microbial metabolism and bacterial community composition in drip-irrigated cotton field[J]. Environmental Science, 2020, 41(1): 420-429. |
| [21] |
Palaniyandi S A, Yang S H, Zhang L X, et al. Effects of actinobacteria on plant disease suppression and growth promotion[J]. Applied Microbiology and Biotechnology, 2013, 97(22): 9621-9636. DOI:10.1007/s00253-013-5206-1 |
| [22] |
吴求生, 龙健, 廖洪凯, 等. 贵州茂兰喀斯特森林不同小生境下土壤细菌群落特征[J]. 应用生态学报, 2019, 30(1): 108-116. WU Qiu-sheng, LONG Jian, LIAO Hong-kai, et al. Soil bacterial community characteristics under different microhabitat types on Maolan karst forest, Guizhou, southwest China[J]. Chinese Journal of Applied Ecology, 2019, 30(1): 108-116. |
| [23] |
Adams M, Xie J X, Xie J W, et al. The effect of carrier addition on Anammox start-up and microbial community: A review[J]. Reviews in Environmental Science and Bio/Technology, 2020, 19: 355-368. DOI:10.1007/s11157-020-09530-4 |
| [24] |
何玮, 郭琳微, 樊鹏辉, 等. 黄花棘豆在腐解过程中的化感作用及其土壤细菌群落结构分析[J]. 草业学报, 2015, 24(7): 21-29. HE Wei, GUO Lin-wei, FAN Peng-hui, et al. Allelopathy and the rhizosphere bacterial community structure of Oxytropis ochrocephala[J]. Acta Prataculturae Sinica, 2015, 24(7): 21-29. |
| [25] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |
| [26] |
李坚, 汤佳, 庄莉, 等. 导电性生物炭促进Geobacter和Methanosarcina共培养体系互营产甲烷过程[J]. 生态环境学报, 2018, 27(7): 1260-1268. LI Jian, TANG Jia, ZHUANG Li, et al. Conductive biochar stimulates acetate conversion to methane by syntrophic interaction between Geobacter and Methanosarcina[J]. Ecology and Environment Sciences, 2018, 27(7): 1260-1268. |
| [27] |
Jones R T, Robeson M S, Lauber C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal, 2009, 3(18): 442-453. |
| [28] |
袁超磊, 贺纪正, 沈菊培, 等. 一个红壤剖面微生物群落的焦磷酸测序法研究[J]. 土壤学报, 2013, 50(1): 138-149. YUAN Chaolei, HE Ji-zheng, SHEN Ju-pei, et al. Pyrosequencing approach to study microbial composition in a red soil profile[J]. Acta Pedologica Sinica, 2013, 50(1): 138-149. |
| [29] |
Navarrete A A, Venturini A M, Meyer K M, et al. Differential response of Acidobacteria subgroups to forest-to-pasture conversion and their biogeographic patterns in the western Brazilian Amazon[J]. Frontiers in Microbiology, 2015, 6: 1443. |
 2021, Vol. 38
2021, Vol. 38