孔雀石绿(Malachite green,MG)在渔业养殖中作为一种杀菌剂被广泛使用[1-2]。由于其价格低廉、抗菌效果显著,且没有更好的替代药物,尽管各国已将其列入水产养殖的禁用药物名单,但违规使用孔雀石绿药物的情况屡见不鲜、屡禁不止,在水产品抽样检查中发现孔雀石绿仍然存在残留超标现象[3]。陕西省对2017年和2018年的水产品抽样调查显示,孔雀石绿连续两年均有较高检出率[4],残留风险较高。在渔业环境监测中,渔业生态环境中孔雀石绿药物残留情况较为突出[5],程杏安等[6]对珠三角地区的10个水产养殖池塘抽样调查发现,10个取样点的底泥均有孔雀石绿残留,残留量最高达0.030 7 g·g–1,其中有3个取样点底泥有代谢产物隐性孔雀石绿(Leucomalachite green,LMG)残留,残留量在0.007 3~0.030 9 g· g–1之间。安全有效地去除渔业环境中的孔雀石绿药物残留已成为水产养殖领域亟待解决的问题。
在自然环境中,孔雀石绿和隐性孔雀石绿稳定性较差,受环境中氧化还原物质的影响,极易互相转化[7-8],两者共同残留在环境中,对水产品质量安全构成极大威胁。目前对环境污染物的修复主要有物理、化学和生物法,相比其他修复方式,微生物修复效果好、成本低廉、无二次污染,符合绿色环保理念。微生物修复制剂主要分为液态菌剂和固态菌剂,液态菌剂存在运输不便且容易受污染等缺点,而固态菌剂在运输、贮藏和质量控制等方面都优于液态菌剂,其贮存成本较低,易于大型化、自动化、工业化生产[9],因此,固态微生物菌剂越来越受到关注。但是,国内目前对固态菌剂的研究主要集中于一些益生菌[10-11],且其存在细胞存活率不高的问题,菌剂活性差,应用效果不理想。
目前,国内外对孔雀石绿的降解研究较多[12-13],但因我国养殖水域分布广泛,且对生物修复渔业药物残留的宣传力度不够,生物降解技术尚未发挥出应有的效果。本课题组前期研究分离获得的D3(Citrobacter sp.)和D6(Enterobacter sp.)两株孔雀石绿降解菌对孔雀石绿降解率超过95%,并对其酸性还原产物隐性孔雀石绿降解效果理想,这为复合型降解菌剂的制备提供了良好的菌种来源。本研究旨在将两株孔雀石绿降解菌株通过冷冻干燥法制备成复合型降解菌剂,通过优化制备工艺,获得高性能的孔雀石绿降解菌剂,以解决目前微生物菌剂普遍活性不高、运输不便、不易长期保存等缺点,并将制备的菌剂初步应用于渔业养殖水体及底泥环境,考察菌剂的实际应用效果,以期为利用微生物修复渔业生态环境中的孔雀石绿药物残留提供科学依据。
1 材料与方法 1.1 仪器与试剂仪器:岛津LC-20AD液相色谱仪;AB SCIEX QTRAP® 6500质谱联用仪;涡旋振荡器(IKA MS3);超纯水机(美国Millipore公司);Centrifuge 5810R型离心机(德国Eppendorf公司);恒温培养摇床(上海一恒,THZ-100)
孔雀石绿标准品:孔雀石绿和隐性孔雀石绿购自德国Dr.Ehrenstorfer公司。氘代显性孔雀石绿(Malachite green-D5,MG-D5)和氘代隐性孔雀石绿(Leucomalachite green-D6,LMG-D6)购自德国WITEGA公司。
供试菌种:孔雀石绿降解菌株D3(Citrobacter sp.) 和D6(Enterobacter sp.)
营养培养基:蛋白胨10.0 g,牛肉剂3.0 g,氯化钠5.0 g,葡萄糖1.0 g,过滤养殖水体1 000 mL,pH 7.6~ 7.8,高压蒸汽灭菌(121 ℃,15 min)后制得。
试剂:蔗糖(国药集团)、脱脂乳(美国BD公司)、甘油(麦克林公司)
供试渔业养殖水体采自上海市水产研究所内养殖池塘,水体pH 7.1。
供试渔业养殖底泥采自上海市郊区某养殖池塘,其部分理化性质如下:pH 6.5,有机质含量14.22 g· kg-1,电导率178.3 µS·cm-1,粒径≤0.3 mm。
1.2 菌体的培养及菌悬液的制备菌种活化后,将对数期的菌种以1% 的接种量接种至营养培养基,30 ℃、160 r·min-1摇床培养,培养时间12 h,采用平板稀释涂布的方法对菌液进行计数,获得菌剂制备前的菌落数。富集培养后的菌液转移至离心管中,8 000 r·min-1离心5 min,弃去上清液,磷酸缓冲盐洗涤后,再次离心弃上清,获得菌体。将冻干保护剂与菌体按照不同配比进行混合,制备成不同条件的菌悬液,备用。
1.3 冻干剂的制备将制备好的菌悬液分装,放入-80 ℃的冰箱进行预冷冻24~48 h,冷冻完全后放入冻干机中,真空冷冻干燥16 h。
1.4 菌体成活率检测测定冻干后的菌剂质量,复溶至与菌体来源完全相等的无菌水中,摇匀使其充分溶解,30 ℃水浴30 min,采用平板稀释涂布法对其进行有效活菌计数,置于30 ℃恒温培养箱中,培养时间与冻干前计数平板培养时间相同。
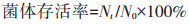
|
式中:Nt为冻干后有效活菌数;N0为冻干前有效活菌数。
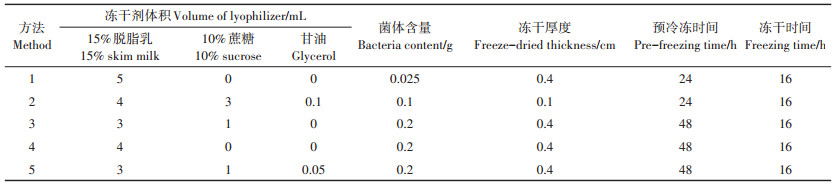
1.5 制备复合菌剂的方法优化分别对冻干保护剂的配比、菌体含量、预冷冻时间和冷冻厚度等因素进行优化,菌剂性能优良程度以菌体成活率为标准,同时参照菌剂的外观特征进行判定。在冻干过程中查阅大量文献初步筛选出5种适用于本菌的冻干保护剂配方,详细的菌剂制备方法及配比如表 1所示。
|
|
表 1 菌剂制备方法优化配比 Table 1 Optimization of preparation method of bacterial agent |
室内模拟自然环境,将制备好的菌剂投洒到渔业水体及底泥环境中,监测菌剂在水体及底泥中对孔雀石绿及其代谢产物隐性孔雀石绿的降解情况,对菌剂制剂的实际应用效果进行初步探究。具体实验步骤如下:取适量菌剂于水体中30 ℃水浴活化,均匀投洒到药物浓度为5 mg·L-1的养殖水体中,菌剂投洒量约0.01 g·L-1,控制环境温度25 ℃左右,分别在12、24 h和5 d后监测孔雀石绿药物残留。底泥实验设置孔雀石绿浓度为2 mg·kg-1,菌剂投加量约为1 g·kg-1,中间追加一次菌剂投放,实际环境温度约20 ℃,保持底泥适当水分,分别在第3、5、7、13 d和25 d定时取样监测。设置空白(CK)、光照(L)、菌剂(BA)和菌剂+光照(L+BA)进行试验结果对比,光照条件均为自然光,三组平行,其降解率计算公式如下:
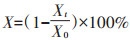
|
式中:X为降解率;Xt为降解后底泥中药物残留浓度;X0为原始添加浓度。
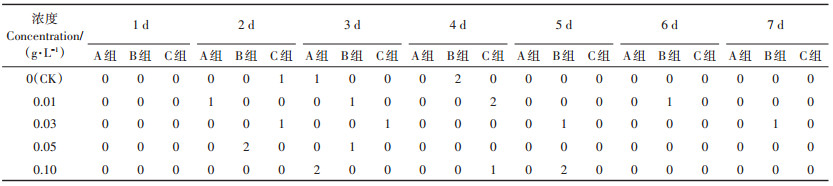
1.7 菌剂对养殖环境中鱼体生长影响选择体长10~12 cm草鱼为研究对象,投加菌剂于养殖水箱中,使其浓度分别为0.01、0.03、0.05 g·L-1和0.10 g·L-1,菌剂预活化3 h,每组试验投放鱼体50尾,期间不换水,泵氧,养殖1周,考察菌剂对鱼体存活影响,每个梯度设置三组平行,设置空白对照(CK)。
1.8 孔雀石绿检测方法水体检测方法:8 000 r·min-1离心,0.45 µm滤膜过滤,取适量水体加入氘代孔雀石绿及氘代隐性孔雀石绿内标。样品采用PRS固相萃取柱进行富集回收,分别用2 mL乙腈、2 mL水活化,采用2 mL水和2 mL乙腈进行淋洗,最后使用3 mL乙腈∶乙酸铵(V∶V=1∶ 1)洗脱,取1 mL洗脱液过0.22 µm滤膜后,通过HPLC-MS/MS进行分析[14]。
底泥检测方法:称取底泥2 g,加入氘代孔雀石绿及氘代隐性孔雀石绿内标,使用15 mL乙腈超声、涡旋,提取两次,合并提取液,8 000 r·min-1离心,取2 mL上清液过PRS固相萃取柱进行富集,PRS柱使用2 mL乙腈活化,2 mL乙腈进行淋洗,最后使用4 mL乙腈∶乙酸铵(V∶V=1∶1)洗脱,取1 mL洗脱液过0.22 µm滤膜后,通过HPLC-MS/MS进行分析。
1.9 数据处理方法采用IBM SPSS Statistics 22.0对数据进行统计分析和计算,所有数据结果均以3次重复的平均值表示,差异显著性分析采用LSD法、S-N-K法和重复测量方差分析,显著性水平设定为α=0.05,极显著水平设定为α=0.01。
2 结果与分析 2.1 离心速度对菌体成活率的影响菌悬液制备过程中,菌体离心速度对菌体成活率具有较大的影响,不同离心速度下菌体的成活率如图 1所示,5 000~8 000 r·min-1时菌体成活率较为稳定,随着离心速度的提高,菌体成活率逐步下降。
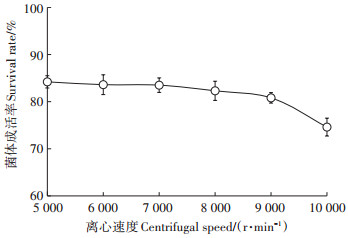
|
图 1 离心速度对菌剂中菌体成活率的影响 Figure 1 The effect of centrifugal speed on the survival rate of bacteria |
采用不同方法制备的孔雀石绿复合菌剂如图 2所示,从外观形态来看,方法3、方法4和方法5获得的降解菌剂外观细腻、色泽均匀、质地疏松饱满,方法1获得的菌剂外观略显粗糙、不平,方法2制备的菌剂有黏稠状大颗粒。

|
图 2 五种不同制备方法获得的复合菌剂外观形态 Figure 2 The appearance of the compound bacterial agent obtained by five different preparation methods |
采用不同制备方法获得复合降解菌剂的菌体成活率如图 3所示。由图 3可知,方法1、方法2和方法5菌体成活率均在80%以上,明显高于方法3和方法4,尤其是方法1和方法2的菌体成活率高达95% 以上,从菌剂制备配方可以发现,菌体含量越低,冻干保护剂含量越高,获得的降解菌剂菌体成活率越高,与方法1相比,方法4降低了冻干剂的含量,同时提高了菌体含量,其获得的菌剂菌体成活率由97.6% 降为21.4%。这说明冻干保护剂对菌剂制剂的菌体成活率具有至关重要的作用,但是过度提高冻干剂的比例,其缺点也很明显,获得的菌剂往往外观形态不理想,菌剂易粗糙、粘连,且造成资源浪费,制备成本高。
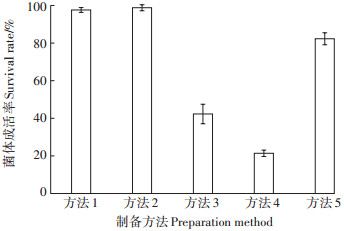
|
图 3 制备方法对菌剂中菌体成活率的影响 Figure 3 The effect of preparation methods on the survival rate of bacteria |
不同冻干剂对菌剂菌体成活率影响较大,不同配方的冻干保护剂制备获得的菌剂见图 2和图 3,相同的菌体含量下,混合配比的冻干保护剂比单一的冻干保护剂效果更理想,菌体含量和冻干剂只有在合理的配比范围,才能获得外观均匀、细腻的菌剂。优良的菌剂以质地均匀细腻、菌体成活率高为佳,综上,方法5制备的菌剂为最优菌剂,将其应用于下一阶段的试验研究。
2.4 菌剂在渔业水体中应用效果孔雀石绿易溶于水,渔业环境中未被代谢的药物极易在渔业水体中残留,试验将制备的孔雀石绿降解菌剂投入到渔业养殖水体中,考察菌剂对孔雀石绿的降解效果(表 2)。
|
|
表 2 不同条件下菌剂对渔业养殖水体中MG的降解 Table 2 Degradation of MG in aquaculture water under different conditions |
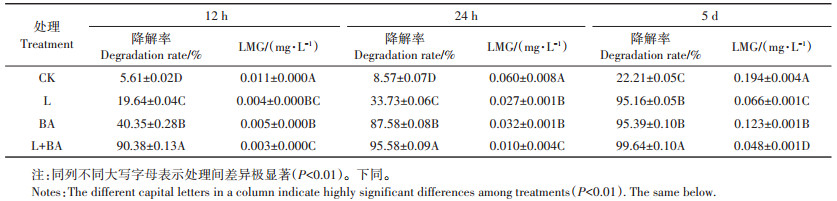
表 2显示,避光处理(CK)的孔雀石绿降解较为缓慢,5 d后降解率仅为22.21%。增加自然光照后,孔雀石绿的降解率大幅提高,5 d降解率可超过95%,说明光照对孔雀石绿有降解效果。而无光照处理仅有菌剂的情况下,孔雀石绿5 d后的降解率同样超过95%,但菌剂对孔雀石绿的降解效率更快,24 h降解效果就达到87.58%。相同条件下添加菌剂并光照处理,5 d后孔雀石绿的降解率提高到99%以上,而且实验数据显示12 h降解率即超过90%,光照对提高菌剂降解效率具有极显著影响(P<0.01)。从水体中隐性孔雀石绿的监测数据可以发现,孔雀石绿在降解过程中有隐性孔雀石绿产生,5 d后光照处理组隐性孔雀石绿的生成量显著低于无光照处理组。
2.5 菌剂在渔业底泥中应用效果孔雀石绿等药物进入水体环境后,未被分解的孔雀石绿及其代谢产物隐性孔雀石绿大部分被底泥吸附和吸收,即底泥沉积物是大部分药物的最后归宿和载体。考虑到两种药物在底泥环境中可通过氧化还原反应互相转化,本试验分别考察两种药物在底泥的残留降解情况。将制备的菌粉制剂投撒到渔业养殖底泥,不同条件下菌剂对渔业养殖底泥中孔雀石绿和隐性孔雀石绿的降解率如图 4所示。

|
不同大写字母表示处理间差异极显著(P<0.01) The different capital letters indicating the highly significant differences among treatments (P<0.01) 图 4 不同条件下菌剂对渔业养殖底泥中MG和LMG的降解率 Figure 4 Degradation rate of MG and LMG in fishery bottom mud under different conditions |
从图 4a可以发现,孔雀石绿在底泥中几乎很难降解,25 d后避光处理CK降解率仅为8.28%,而施加菌剂并辅以光照后其降解率高达73.36%,且光照对提高菌剂在底泥中的降解速率有极显著影响(P<0.01),这一点类似于菌剂在养殖水体中的降解。图 4b显示,25 d后底泥中隐性孔雀石绿的去除效果与孔雀石绿在底泥中的降解效果类似,均为使用菌剂并辅以光照的降解效果最理想,25 d其药物降解率最高可达76.80%,避光条件下隐性孔雀石绿仍然得到一定的降解,这可能与底泥环境微生物含量丰富有关。
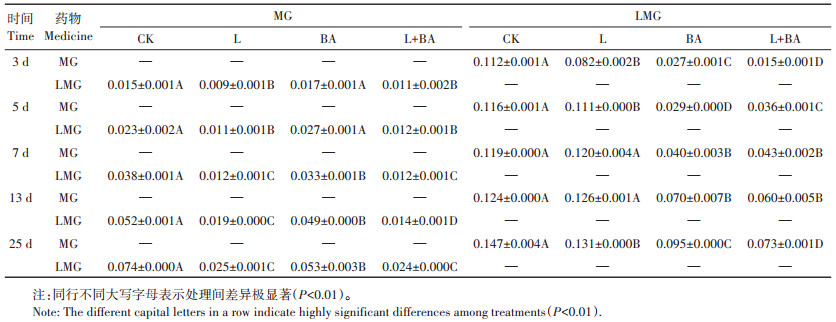
在研究孔雀石绿及隐性孔雀石绿在底泥中降解过程的同时,跟踪监测其在底泥中隐性孔雀石绿和孔雀石绿的生成量,试验结果如表 3所示。
|
|
表 3 不同处理条件下渔业养殖底泥中MG和LMG的生成量(mg·kg-1) Table 3 The production of MG and LMG in fishery bottom mud under different treatment (mg·kg-1) |
表 3数据显示,在孔雀石绿降解过程中,避光条件下隐性孔雀石绿的残留量极显著高于光照条件下(P<0.01),说明避光条件下孔雀石绿更容易被还原为隐性孔雀石绿,这可能与底泥环境中天然存在的一些氧化还原微生物有关。在隐性孔雀石绿降解过程中,未添加菌剂组孔雀石绿的残留量极显著高于添加菌剂组(P<0.01),说明添加降解菌剂的底泥可降低底泥中孔雀石绿的产生。综上,无论是加速孔雀石绿和隐性孔雀石绿在底泥中的降解,还是减弱二者在底泥中的相互转化,增加光照辅加菌剂的作用效果均较好。
2.6 菌剂对养殖环境中鱼体存活的影响不同菌剂浓度下草鱼死亡数如表 4所示,7 d内未添加菌剂组,草鱼死亡4尾,添加菌剂组草鱼死亡3~5尾,试验数据采用重复测量方差分析,分析结果显示,球形检验P=0.021<0.05,不服从球形假设,参看多变量检验结果,结果显示所有P值均大于0.05,因此得出结论,菌剂对鱼体死亡无显著影响(P>0.05),时间对鱼体生长无显著影响(P>0.05),各处理组和对照组在不同时间鱼体的死亡数无显著差异(P>0.05)。
|
|
表 4 不同菌剂浓度下各时间鱼体死亡数 Table 4 The number of fish death under different concentrations of bacterial agents at the different time |
在低离心速度下,菌体成活率稳定,随着离心速度的提高,菌剂中菌体成活率逐渐下降,这是由于随着离心速度的提高,转速会使细胞造成损伤甚至破碎,后经过预冷冻及真空干燥等环节处理,菌体存活率下降。低离心率不会对细胞造成伤害,因此对菌体成活率影响不大,但是离心率过低,容易导致菌体细胞大部分置于上清液中,菌体回收率降低,造成资源浪费,综合考虑菌体的回收率及菌体存活率情况,在制备孔雀石绿降解菌剂过程中,菌体离心速度设置为8 000 r·min-1较为合理。
方法1制备获得的菌剂外观略显粗糙、不平,这是由于菌剂配方中含有过量的脱脂乳,而菌体含量不足。方法2制备的菌剂有黏稠状大颗粒,这主要是由于制备过程中添加甘油过量,且菌体含量低,冻干保护剂与菌体配比不合理。冻干保护剂的种类和配方对菌体成活率和菌剂形态有重要影响,多种类的保护剂比单一的保护剂效果更理想,不同配方的保护剂需要结合菌体含量进行配方优化。菌剂制备过程中的冻干厚度和预冷冻时间也是菌剂制备优良的关键因素[15-16]。冻干厚度低,在预冷冻转至冷冻干燥时容易溶化,之后再次冻结会对细胞造成不同程度的损伤,且冷冻抽真空过程中易产生鼓泡现象,鼓泡会伤害菌体细胞,导致细胞破裂,菌体死亡;而冻干厚度高,则不容易溶化,菌体损伤较少,菌体存活率高;如果冻干厚度过大,单位体积的细胞过多,使结合水不易损失而影响冻干过程中干燥的时间,导致真空冷冻干燥时间长,对菌体成活率产生负面影响。预冷冻一般在-80 ℃条件下进行,预冷冻时间与冻干厚度相关联,冻干厚度越高,预冷冻时间越长,真空冷冻干燥时间越长。所以只有掌握合适的预冷冻时间和冻干厚度才能获得合理的真空冷冻干燥时间,合理节约资源,控制菌剂制备成本。综合分析,采用方法5制备获得的孔雀石绿降解菌剂外观良好,菌剂细腻,菌体成活率约为82.3%,为最佳菌剂。
菌剂性能优良程度主要从产品外观形态和菌体成活率来判断,影响菌体成活率的因素有很多,如菌体培养时间、预冷冻温度、保护剂的pH等[17],本试验仅测定了部分质量指标,菌剂配方仍需继续优化,开展大量实验,确定生产菌剂的最佳工艺条件,以期获得最大经济效益,后续试验可以通过测定不同时间产品的有效活菌数来判断产品的保质期,结合菌剂配方合理延长菌剂制剂的保质期,最后进行产品的生产包装和销售。
降解菌剂在降解水体中孔雀石绿的过程中,光照对降解效率有明显的促进作用。降解菌剂在有光照的情况下可以提高其降解孔雀石绿的速率,药物去除率更高。菌剂使用时需将其溶解于适量水体中活化,然后均匀投洒到水体环境中,该配方菌剂在水体中投洒量约为0.01 g·L-1,在实际应用过程中可根据环境中的药物残留浓度适量增减菌剂的投加量。
降解菌剂降解底泥中孔雀石绿过程中,在投加菌剂的同时辅加光照可以提高其降解速率,且能有效避免孔雀石绿过多地转化为隐性孔雀石绿。菌剂制剂在应用到底泥环境前同样需要先活化,之后均匀投洒到底泥中,本试验条件下菌剂投洒量约为1 g·kg-1,由于本试验研究是在冬季开展,天气较为阴冷且日照不足,其最高降解率为70% 以上,根据前人的研究经验,夏季气温高、光照充足时,微生物活性高,更有利于菌剂对药物的降解[18],其降解效果会更理想。
本研究获得的降解菌剂由于含有脱脂乳,在实际应用过程中经济成本偏高,选择更合适的替代品是接下来的研究方向,将孔雀石绿降解菌利用冻干工艺制备成微生物菌剂并商品化,对解决实际渔业养殖环境中的孔雀石绿药物残留问题具有重要意义。
4 结论(1) 本研究以15% 脱脂乳、10% 蔗糖和甘油作为冻干保护剂,冻干保护剂与菌体配方比例分别为15、5 mL·g-1和0.25 mL·g-1,冻干厚度0.4 cm,预冷冻时间48 h,真空冷冻干燥16 h,该条件下制备的菌剂制剂外观性能良好,色泽均匀、细腻,菌体成活率高达80% 以上。
(2) 本试验将获得的孔雀石绿菌剂制剂在渔业养殖水体及底泥中小规模试验,效果显著,光照条件下,菌剂对渔业养殖水体中浓度为5 mg·L-1的孔雀石绿12 h降解率超过90%,对渔业底泥中浓度为2 mg·kg-1的孔雀石绿及代谢产物隐性孔雀石绿25 d降解率分别为73.36%和76.80%。
(3) 添加降解菌剂可有效减弱底泥中隐性孔雀石绿向孔雀石绿转化,而增加光照又能抑制孔雀石绿转化为隐性孔雀石绿,因此增加光照辅加菌剂无论是对孔雀石绿还是隐性孔雀石绿在底泥中的降解都有促进作用。
(4) 菌剂对养殖环境中的鱼体生长无显著影响,投加菌剂不会导致鱼体死亡率提高。
| [1] |
Eli A, Briyai O F, Abowei J F N. A review of some fungi infection in African fish saprolegniasis, dermal mycoses, branchiomyces infection, systemic mycoses and dermocystidium[J]. Asian Journal of Medical Science, 2011, 3(5): 198-205. |
| [2] |
陈金玉, 刘华, 朱晓琳, 等. 广州市售水产品氯霉素、孔雀石绿、呋喃唑酮和甲醛残留量分析[J]. 食品安全质量检测学报, 2019, 10(17): 5609-5614. CHEN Jin-yu, LIU Hua, ZHU Xiao-lin, et al. Analysis of chloramphenicol, malachite green, furazolidone and formaldehyde residues in aquatic products sold in Guangzhou in 2018-2019[J]. Journal of Food Safety and Quality, 2019, 10(17): 5609-5614. |
| [3] |
宋娟, 毕小玲, 庄晓洪. 超高效液相色谱-串联质谱法测定水产品中孔雀石绿及其代谢物残留量[J]. 理化检验-化学分册, 2016, 52(10): 1164-1168. SONG Juan, BI Xiao-ling, ZHUANG Xiao-hong. UHPLC-MS/MS determination of residual amounts of malachite green and its metabolite in aquatic products[J]. PTCA(Part B: Chem Anal), 2016, 52(10): 1164-1168. DOI:10.11973/lhjy-hx201610010 |
| [4] |
范芳芳, 樊成, 魏宁果. 2018年陕西省水产品中4种兽药残留的风险分析[J]. 农产品加工, 2019(6): 68-70. FAN Fang-fang, FAN Cheng, WEI Ning-guo. Risk analysis of four veterinary drug residues in aquatic products in Shaanxi Province in 2018[J]. Farm Products Processing, 2019(6): 68-70. |
| [5] |
梅光明, 郭远明, 张小军, 等. 超高效液相色谱-串联质谱法测定环境底泥中的孔雀石绿[J]. 浙江大学学报(农业与生命科学版), 2014, 40(3): 330-337. MEI Guang-ming, GUO Yuan-ming, ZHANG Xiao-jun, et al. Determination of malachite green in sediment by ultra performance liquid chromatography-mass spetrometry[J]. Journal of Zhejiang University (Agric & Life Sci), 2014, 40(3): 330-337. DOI:10.3785/j.issn.1008-9209.2014.03.013 |
| [6] |
程杏安, 郑子昭, 蒋旭红, 等. 珠江三角洲水域底泥中孔雀石绿、结晶紫及其代谢物分析[J]. 生态科学, 2015, 34(3): 59-64. CHENG Xing-an, ZHENG Zi-zhao, JIANG Xu-hong, et al. Analysis of malachite green and crystal violet and its metabolites in water sediment of Pearl River Delta[J]. Ecological Science, 2015, 34(3): 59-64. |
| [7] |
Wang J A, Gao F, Liu Z Z, et al. Paheway and molecular mechanisms for malachite green biodegradation in Exiguobacterium sp. MG2[J]. PLoS ONE, 2012, 7(12): e51808. DOI:10.1371/journal.pone.0051808 |
| [8] |
翟毓秀, 郭莹莹, 耿霞, 等. 孔雀石绿的代谢机理及生物毒性研究进展[J]. 中国海洋大学学报, 2007, 37(1): 27-32. ZHAI Yu-xiu, Guo Ying-ying, GENG Xia, et al. Advances in studies on metabolic mechanism and bio-toxicity of malachite green[J]. Periodical of Ocean University of China, 2007, 37(1): 27-32. DOI:10.3969/j.issn.1672-335X.2007.01.006 |
| [9] |
贺金梅, 刘俊轩, 孙颖, 等. 固态微生物菌剂干燥和菌体保存的研究进展[J]. 食品工业科技, 2012, 33(15): 423-427. HE Jin-mei, LIU Jun-xuan, SUN Ying, et al. Research progress in drying of solid microbial agent and protection of cell[J]. Science and Technology of Food Industry, 2012, 33(15): 423-427. |
| [10] |
于红, 彭珍, 黄涛, 等. 高活性益生菌发酵枸杞剂的真空冷冻干燥工艺优化[J]. 食品科学, 2019, 40(20): 255-260. YU Hong, PENG Zhen, HUANG Tao, et al. Optimization of vacuum freeze drying for preparation of fermented Goji Berry(Lycium barbarum L.) powder with probiotics[J]. Food Science, 2019, 40(20): 255-260. DOI:10.7506/spkx1002-6630-20181022-243 |
| [11] |
迟涛, 田木, 张欣宇, 等. 益生菌复合微生态制剂冻干保护剂的优化及活菌变化研究[J]. 中国乳品工业, 2015, 43(6): 16-19. CHI Tao, TIAN Mu, ZHANG Xin-yu, et al. Optimization of protectants of freeze-dried compound probiotics and variation of probiotics[J]. China Dairy Industry, 2015, 43(6): 16-19. DOI:10.3969/j.issn.1001-2230.2015.06.005 |
| [12] |
Yang J, Yang X D, Lin Y H, et al. Laccase-catalyzed decolorization of malachite green: Performance optimization and degradation mechanism[J]. PLoS ONE, 2015, 10(5): e0127714. DOI:10.1371/journal.pone.0127714 |
| [13] |
Song J L, Wang Y W, Song Y, et al. Brevibacillus halotolerans sp. nov., isolated from saline soil sample collected from paddy field[J]. Int J Syst Evol Microbiol, 2017, 67(4): 772-777. DOI:10.1099/ijsem.0.001579 |
| [14] |
刘菁华, 陈琳, 刘云璐. 高效液相色谱-串联质谱法检测3种渔业环境基质中的孔雀石绿及隐性孔雀石绿残留[J]. 水产科技情报, 2019, 46(3): 165-171. LIU Jing-hua, CHEN Lin, LIU Yun-lu. Detection of malachite green and recessive malachite green residues in three kinds of fishery environment substrates with HPLC-MS/MS[J]. Fisheries Science & Technology Information, 2019, 46(3): 165-171. |
| [15] |
Shinji S, Mitsutoshi N, Koji Y. Preparation characteristics of waterin-oil-in-water multiple emulsions using microchannel emulsification[J]. Journal of Colloid & Interface Science, 2004, 270(1): 221-228. |
| [16] |
Zhao G Q, Zhang G. Influence of freeze-drying conditionson survival of Oenococcus oeni for malolactic fermentation[J]. International Journal of Food Microbiology, 2009, 135(1): 64-67. DOI:10.1016/j.ijfoodmicro.2009.07.021 |
| [17] |
刘冬梅, 吴晖, 汤石生, 等. 直投式干酪乳杆菌鼠李糖亚种冻干剂的研制[J]. 食品工业科技, 2010(10): 186-193. LIU Dong-mei, WU Hui, TANG Shi-sheng, et al. Preparation of DVS starter culture of the freeze-dried Lactobacillus casei subsp. Rhamnosus 719[J]. Science and Technology of Food Industry, 2010(10): 186-193. |
| [18] |
陶雁斌, 杨绍贵. 环境中孔雀石绿的研究进展[J]. 四川环境, 2015, 34(5): 123-129. TAO Yan-bin, YANG Shao-gui. Research progress of malachite green in the environment[J]. Sichuan Environment, 2015, 34(5): 123-129. DOI:10.3969/j.issn.1001-3644.2015.05.023 |
 2021, Vol. 38
2021, Vol. 38