从20世纪开始,世界人口数量不断增多,人们的生活和生产活动也随之变化,这使得自然资源和环境资源都面临巨大的威胁。在人们生活生产活动中,许多有毒有害的污染物被排放到了自然环境中,其中包括重金属、持久性有机污染物、挥发性有机物、有机农药等。这些污染物对自然生态造成了十分严重的破坏,所以对于污染物修复和治理方法的研究日益受到关注。在众多污染物修复方法中,生物修复法因修复效果好、修复成本较低,且不会产生二次污染,被广泛应用。
然而,单独的植物修复或者微生物修复方法存在很多不足之处,比如修复效率低、专一性强、只能适用中低浓度污染等。而植物-微生物联合修复是一种更加有效的修复方式,它成功弥补了这些缺陷。微生物和植物联合修复不仅能使植物对污染物的耐受程度大大增加,而且还能够促进植物根系吸收土壤中营养物质,提高植株生物量,并且微生物可以协同植物从土壤中向地上部分转移污染物,并在植物体内富集、转化和利用,从而有效完成对环境污染的修复[1]。因此,利用植物-微生物联合修复体系,尤其是内生菌联合植物修复体系修复污染土壤的研究越来越受到关注。
内生菌(Endophyte)是指定殖在植物表皮细胞层间隙或组织器官内部,并与植物形成互利共生或无病害寄生的一类微生物[2]。越来越多的研究者发现从植物的组织内部可以分离出微生物,故将这些微生物命名为内生菌,并且开始关注内生菌与植物之间的相互作用关系。
在长期的相互作用下,内生菌与宿主植物之间结成了稳定的共生关系。研究报道,内生菌能产生促生物质来促进宿主植物的生长,还能进行生物固氮和溶磷来帮助宿主植物吸收氮磷,而且内生菌还可以增强宿主植物对生长环境中污染物的抗性[3-6]。本研究主要归纳了近几年植物接种内生菌的方法,分析内生菌在植物体内的定殖动态特征,以及内生菌-植物联合修复污染土壤的作用机理和应用前景,并且对今后的研究方向进行了展望,为内生菌-植物联合修复污染土壤研究和应用提供一定的理论依据。
1 内生菌接种植物的方法接种内生菌的方法主要是通过模拟自然环境中内生菌从植物的自然孔口或者伤口入侵到植物组织内部的方法。如图 1所示,人工接种具体来说就是利用植物的自然孔口或者人为制造的切口,使得内生菌可以通过这些空隙进入到植物组织内部,从而在植物体内定殖。对于通过植物自然孔口接种来说,根部接种内生菌的主要途径是根系与土壤等摩擦造成的伤口,而茎部接种则是将茎干上的皮孔、蜜腺等作为侵入通道,叶部侵入则是将气孔、水孔等作为侵染通道进入到植物内部[7]。
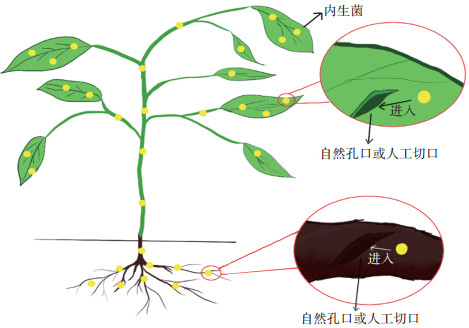
|
图 1 内生菌接种植物的方法 Figure 1 Method of inoculating endophytes to host plants |
从表 1可以看出,人工接种植物内生菌有多种方法,灌根法、浸根法、伤根法、蘸根法等方法是对植物根部进行接种;伤茎法、涂茎法是对植物茎部进行接种;喷雾法、伤叶法等则是对植物叶部的接种方法;另外也可在种子阶段使用浸种法。但目前大多数研究主要集中在对植物根部的接种,这可能是由于植物所需营养物质主要是通过根部吸收,当土壤中内生菌在植物根部吸收营养物质时更容易侵染到植物内部[7]。
|
|
表 1 内生菌的接种及其宿主植物 Table 1 The inoculation of endophytes and their host plants |
因为宿主植物生长在不同的生存环境中,内生菌与宿主植物之间的作用难以分析,所以目前对于内生菌在植物内部的生命活动的认识不够明晰,而对目标内生菌在宿主植物体内进行定殖检测是解决这一问题的重要手段,要对内生菌在宿主植物组织内部的定殖动态进行追踪,就需要采用合适的检测方法,对其进行系统性研究,并探讨内生菌在宿主植物体内的定殖规律、内生现象和内生机制。
目前,对目标内生菌在宿主植物体内的定殖检测有很多方法(表 1),其中抗生素标记法是一种常用的定殖检测方法,主要是通过人工诱变等手段作用于目标内生菌,使目标菌出现具有抗高浓度抗生素的突变体,再将突变体筛选纯化出来作为标记菌株,用含高浓度抗生素的培养基进行回收检测。研究中主要使用利福平、链霉素、四环素、氨苄青霉素、卡那霉素等抗生素作为抗性标记[21]。大多数研究中的抗生素标记法采用利福平作为抗性标记,因为其生物防治性状较易保存。抗生素标记法的优势在于简单、高效、成本低,并且能够对检测结果进行统计分析;但劣势在于不够准确、回收下限较高。姚锦爱等[13]运用抗生素标记法使得菌株BA-3-K(Bacillus amyloliquefaciens) 获得对利福平和卡那霉素的稳定抗性,从而研究其在兰花中的定殖动态。Glandorf等[15]通过免疫检测验证了对利福平的抗性可以作为菌株WCS358(Pseudomonas putida)的稳定标记性状。
除此之外,还有外源基因标记法,其中荧光蛋白标记(Fluorescent protein labeling)是被广泛采用的一种外源基因标记法,这种方法是将不同颜色的荧光质粒结合到其他生物中,使目标生物携带颜色荧光,并且不影响该生物的正常生命活动[22]。荧光蛋白标记不需要生物具备其他辅助系统,发出的荧光可以使标记菌株能够更容易被看见,从而更加方便进行追踪检测。荧光蛋白标记主要有两种转化方法,分别是热激转导和电击转化,且很多研究者致力于荧光蛋白质粒导入细菌的技术研究,使得这项技术不断发展[23]。对于生物来说,荧光蛋白在保持荧光时不会干扰其正常生命活动,因此荧光蛋白在生物研究过程中被许多研究者采用[24-25]。
近年来,随着人们对绿色荧光蛋白(Green fluorescent protein,GFP)结构和功能认识的逐步深入,GFP编码的基因已经成为最具有应用前景的标记物[26-27]。GFP基因来源于水母[28],表达绿色荧光蛋白。绿色荧光蛋白标记的优势在于对标记目标进行检测时可以直接进行活体观察,检测灵敏度高,且被标记目标无需加入其他引物就能够稳定发出绿色荧光。绿色荧光蛋白可用以检测在宿主植物体内标记菌株的实时生命活动,从而更加精确地进行目标内生菌的跟踪研究,与其他外源基因标记相比具有明显的优势[29]。但荧光蛋白标记也有许多问题亟待解决,例如对目标基因转导不成功或者荧光颜色较暗,而且引入外源基因会使细胞正常代谢过程受到影响,使得标记目标的生物学效益降低,同时会因为被标记的细胞死亡后不再发出荧光而无法检测[18, 30]。
2.2 植物内生菌的定殖动态内生菌在宿主植物体内的定殖是一个空间上和时间上的动态过程。迟峰[16]研究了根瘤菌在水稻体内的定殖过程,结果表明根瘤菌先定殖在水稻根际表面,接种6 d后从根部裂隙进入内部,在10~14 d扩散到相邻组织,21 d后开始向地上部分迁移。李强等[31]检测侵染小麦幼苗根部的茎瘤固氮根瘤菌(Azorhizobium caulinodans)的定殖动态,结果显示该菌先通过根尖破损处定殖在根部组织细胞间隙和细胞内,随后向上迁移定殖到叶片部位。这些研究都说明了内生菌会在宿主植物组织间移动,是一个在空间上的动态定殖。不仅如此,内生菌在植物体内的定殖同样也是一个时间上的动态过程,内生菌在宿主植物内的定殖菌量会随着时间变化发生动态变化。Bisht等[10]在美洲黑杨的根部接种内生菌SBER3(Bacillus sp.)后对其定殖菌量进行测定,结果表明这个内生菌的定殖菌量随时间延长而稳定增加。刘文韬等[11]研究表明,在芘污染环境下,功能内生菌株Enterobacter sp. PRd5在小麦和空心菜组织内部的定殖量相较于无污染对照组有显著增加。这说明面对外部污染物的胁迫,对污染物具有抗性或者降解功能的内生菌可以更好地在宿主植物体内定殖。虽然有很多研究已经发现了内生菌在植物体内定殖的部分规律,但宿主植物的种类和生长环境,以及内生菌的种类和接种方式,都会影响内生菌在宿主植物各组织器官间的迁移运动和某一时间段定殖菌数量的动态过程。这给系统总结内生菌在宿主植物体内的定殖动态规律带来了很大困难。
3 内生菌联合植物修复土壤的应用 3.1 对土壤重金属的修复单一的植物或微生物修复土壤重金属污染的效果不佳,而内生菌联合植物修复体系能够有效提升修复土壤重金属污染的能力。万勇[32-33]从镉的超富集植物龙葵中分离筛选出了内生菌DE5(Variovorax paradoxu),经实验测试能够耐受Cd浓度为200 mg·L-1,与未接种的空白对照组相比,接种了DE5的青葙根部生物量增加了125.0%,其对Cd的富集能力增强了81%。Li等[34]将内生细菌K3-2(Enterobacter sp.)定殖到苏丹草中能够有效增加植物的生物量和植物体内Cu2+的积累量,与未接种内生菌的对照组相比,接种了内生菌的植物对Cu2+的吸收量从49%提升至95%。Babu等[35]从樟子松的根中分离得到GSB-1菌株(Bacillus thuringiensis),该菌株可以产生促进植物生长的因子,并提升去除潜在有毒金属的效果,将GSB-1植入宿主植物体内后,植物幼苗中的叶绿素含量、生物量,以及Cu、As、Ni、Zn和Pb等重金提取效果都有所增加。
3.2 对土壤有机污染物的修复随着研究者们对于植物与微生物联合修复的不断探索,已经发现有多个菌属能和宿主植物建立良好的相互作用关系,其中芽孢杆菌属(Bacillus sp.)、假单胞菌属(Pseudomonas sp.)和不动杆菌属(Acinetobacter sp.)等具有降解柴油[36-37]、苯酚[38]、芘[39]等有机污染物的能力。大多数从植物内分离出的内生菌都具有促进植物生长的特点,并且内生菌联合植物修复所表现出的修复潜力相较于单独运用内生菌或植物修复更加具有优势[40-41]。Germaine等[42]构建了一种萘降解内生菌株假单胞菌VM1441(Pseudomonas putida),这种菌株可以有效定殖在植物根际和根部组织内部,帮助宿主植物抵抗萘的侵害,在含有萘的环境中与未接种植物相比,接种后的植物种子发芽率和植物蒸腾率都有所提高,并且有效降解了环境中的萘。Khan等[43]研究发现假单胞菌属PD1(Pseudomonas putida) 接种到柳树和草中均可以促进宿主植物的生长,将接种植株和未接种植株栽种到含菲土壤中,接种植株对菲的去除效率提升了25%~40%。田林双[44]将拟内生菌茎点霉菌B3(Phomopsis liquidambari)定殖到水稻中,与未接种植株一起放置到菲的环境中,发现接种植株可以在菲环境中更好生长,并且接种菌株还能增强水稻中菲的降解效果。这些研究表明接种具有降解有机物功能的内生菌可以有效强化植物对土壤有机物污染的修复能力,为修复土壤有机物污染的方法提供了重要参考。
4 内生菌联合植物修复的机理如图 2所示,内生菌联合植物修复的机理主要包括两部分:一方面,植物可以为内生菌提供适宜的生长环境和生命活动所需的营养物质,使得内生菌生物量增加;另一方面,内生菌能够通过调节生长因子、生物固氮和溶磷等方式促进宿主植物生长,并且内生菌可降解污染物或者降低其毒性,从而提升宿主植物的污染修复能力,使得土壤中污染物向地上部分转运。
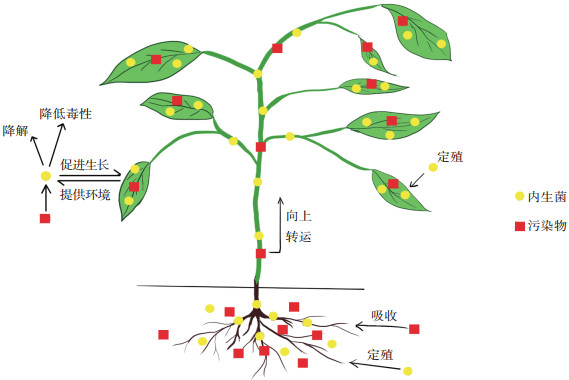
|
图 2 内生菌联合植物修复机理 Figure 2 Mechanism of endophyte-assisted phytoremediation |
许多研究者对内生菌促进植物生长的机制进行了探索。内生菌对宿主植物的生长有一定的促进作用,相较于没有接种内生菌的植物而言,接种内生菌的植株生长情况较好,具体体现在种子发芽、幼苗存活、植株高度、植株干质量和生物量积累等多方面[32-33, 43-44]。
4.1.1 调节植物生长内生菌能够促进宿主植物光合作用,从而促进植物生长。Mirzahossini等[45]将接种了内生菌Epichloe coenophiala的高羊茅(Festuca arundinacea)放置在含高浓度Ni的环境中,与未接种内生菌的对照组相比,接种内生菌植株体内的叶绿素含量有很大的提升。内生菌还能够分泌一些促进植物生长发育的生长调节剂,例如吲哚乙酸(Indole-3-acetic acid,IAA)、细胞分裂素(Cytokinin,CTK)、赤霉素(Gibberrellin acid,GA)等,这些生长调节剂可以在促进植物生长的同时有效缓解环境污染物对植物的毒害作用[46]。内生菌还可以加强植物的蒸腾作用,提升水分利用效率,从而促进宿主植物的生长,提高在缺水环境下的存活率[47]。
4.1.2 生物固氮和溶磷植物的正常生命代谢活动需要氮元素来维持,但是氮元素大多以氮气的形式存在,不能被植物直接利用,所以需要通过生物固氮给植物提供氮元素。生物固氮是将氮气通过微生物的作用,转变成可以让植物吸收的铵根离子,用以维持植物的正常生长[48]。诸如F. tricinctum、A. alternata、Epichloë coenophiala等内生菌能够分泌一些特定的酶,这些酶对于植物吸收氮元素的过程有一定的调控作用,将这些内生菌定殖到植物体内可以促进植物对氮元素的吸收,并且使得宿主植物的根系得到强化[49-50]。
磷也是维持植物生命活动的重要元素之一,但是自然环境中大部分的磷元素以难溶无机复合物的形式存在,植物无法直接吸收,而部分内生菌可以将这些难溶的复合物通过酸化、螯合或者离子交换作用转换成能够被植物利用的磷元素,例如Piriformospora indica和Pseudomonas sp.[51-52]。
4.1.3 分泌铁载体铁元素是植物生长不可或缺的元素, 植物缺少铁元素会导致叶片黄化。虽然铁元素在地壳中的含量很高,但是大部分铁以氧化态或氢氧化态的形式存在,溶解度极低[53]。铁载体是对三价铁离子(Fe3+)和二价铁离子(Fe2+)具有高度亲和力的蛋白质,能与重金属离子结合形成螯合物,部分内生菌可以分泌铁载体,结合宿主植物所需要的金属离子,向植物提供促进生长所需的金属元素[54]。Chen等[55]从龙葵(Solanum nigrum L.)中分离出的内生菌产气肠杆菌(Enterobacter aerogenes)可以分泌铁载体,并有效促进植物生长,提高植物修复土壤中Cd污染的能力。
4.2 内生菌强化植物修复重金属污染物的机制 4.2.1 提高植物对重金属的抗性在重金属胁迫下,内生菌通常比植物更加耐受多种重金属污染,在内生菌与宿主植物相互作用下,宿主植物对重金属的抗性进一步增强。内生菌能够提升宿主植物对污染环境的适应能力,并加强其对污染环境的修复效果[56-57]。重金属胁迫下的植物会在体内积累大量的活性氧(Reactive oxygen species,ROS),这严重影响到植物的正常生命活动,对植物细胞膜的完整性、植物内酶的活性、植物细胞器功能等造成很大的损害[58-60]。研究表明植物体内的超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Cata⁃ lase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、谷胱甘肽还原酶(Glutathione reductase,GR)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)等抗氧化酶能有效减轻重金属对植物的危害[61]。Hamilton等[62]则发现接种内生菌能够有效提高宿主植物内抗氧化酶的活性,进而提升宿主植物对重金属的抗性。
4.2.2 改变重金属的生物有效性内生菌可以产生许多能够与重金属结合、改变重金属生物有效性的物质,例如铁载体、有机酸和表面活性剂等,这些物质能够有效减轻重金属对宿主植物的胁迫[54]。Pan等[63]从东南景天中分离出内生菌荧光假单胞菌(Pseudomonas fluorescens),通过实验验证这种菌能够分泌铁载体,将其接种到含Cd污染的(甘蓝型)油菜(Brassica napus)后,与未接种植株相比,宿主植物对Cd2+的吸收能力显著提高,说明铁载体能够结合植物体内的重金属,强化植物对重金属的吸收。Ma等[64]将内生菌E6S(Achromobacter piechaudii)接种到伴矿景天(Sedum plumbizincicola)之中,发现其在植物体内会产生有机酸及可溶性磷酸盐,可以提高土壤中Cd、Zn、Pb的生物可利用性,进而提升宿主植物对土壤中这些重金属的吸收能力。Long等[65]从东南景天中分离出了多种具有Zn和Cd抗性的内生菌,并且发现铜绿假单胞菌(Pseudomonas aeruginosa)能够分泌一种脂化合物的表面活性剂,可以提高对重金属Zn的溶解能力和东南景天对土壤中重金属Zn的提取效率。
4.3 内生菌强化植物修复有机污染物的机制 4.3.1 内生菌在植物体内的共代谢大多数有机化合物的分子结构复杂,对生物有毒害作用,所以很难被微生物用作直接碳源,并且一些有机物还会对微生物的生长繁殖有抑制作用。但是,研究发现内生菌可能会通过共代谢降解植物体内存在的有机污染物[66-67]。研究者们针对内生菌在植物体内的共代谢提出了两种可能。Stumpe等[68]认为植物通过光合作用合成糖类、有机酸和氨基酸等生长物质,这些物质为内生菌提供了碳源和能源,并且可以促进内生菌产生诱导酶将有机污染物降解,使得植物体内有机物的降解效果增强。Subramanyam等[69]则认为植物会产生诸如黄酮类化合物、水杨酸和木质素衍生物等代谢产物,这些产物可以被内生菌当作初级底物所利用,而且这些物质与许多有机污染物具有相似的结构,甚至是一些有机物污染降解的中间产物或诱导剂,所以会刺激内生菌产生能够降解有机污染物的活性酶,从而提升有机物的降解效果。
4.3.2 内生菌产生特定酶对有机污染物进行逐步降解内生菌可以分泌出多种具有特异性的酶,这些酶对有机污染物的降解具有促进作用。Ning等[70]将黄孢原毛平革菌(Phanerochaete chrysosporium)置于含菲的环境中,可以从内生菌中分离得到细胞色素P450和锰过氧化物酶,通过实验验证了提高锰过氧化物酶的活性可以有效提升菲的降解效果。Corrêa等[71]发现内生菌具有独特的木质素氧化系统,可以分泌出漆酶、木质素酶和过氧化物酶等特异性酶,对有机污染物进行高效降解。Ambrose等[72]研究表明内生菌定殖在植物体内后可以产生水杨酸羟化酶,对植物体内的水杨酸进行降解,提升内生菌在宿主植物内部的稳定性,并且还能够产生其他特异性酶对植物体内的有机污染物进行降解。刘世亮等[73]推测一些能降解多环芳烃的微生物会产生加氧酶,可以在多环芳烃的苯环内加入氧原子使环断裂,从而达到降解多环芳烃的效果。不同的底物会诱导内生菌产生相应的酶,这些酶可以将难降解的有机污染物转化成更容易降解的物质,并且这些转化后的物质还可以当作内生菌的碳源,用来进行生命活动,从而更加高效地降解有机污染物[74]。
5 结论与展望内生菌联合植物修复体系因其降解效率高、修复彻底等优点在环境污染修复领域受到了越来越多的关注,也取得了很多研究成果。内生菌联合植物降解污染物受到土壤质地、土壤养分、温度、降水等难以控制的环境条件的影响较大,在自然环境中应用此方法仍存在难点。
(1) 受植物生长环境等因素的影响,依然无法完全解释在内生菌联合植物修复体系中,内生菌和植物之间通过相互作用来降解污染物的机理。比如内生菌在宿主植物定殖后的转移规律和持久性,以及植物代谢产物对内生菌处理污染物的影响。
(2) 污染物的降解通常是由多种内生菌共同作用,而目前大多数研究只针对单一内生菌联合植物修复,对于多种内生菌组合在宿主植物内相互作用、联合代谢及其在植物内部的分布还鲜有报道。
(3) 就应用范围来看,目前大多数微生物联合植物修复体系主要针对土壤污染,其对空气和水体污染的修复同样具有很大潜力,亟待加强研究。
因此,对于内生菌联合植物修复污染的研究可以从以下几个方面深入:
(1) 将内生菌在植物体内的定殖规律与处理污染物的能力相关联,研究内生菌的定殖对于植物处理污染能力的影响。
(2) 应用内生菌-植物联合修复技术处理空气中的污染物。
(3) 开展多种内生菌与植物联合体系在自然环境中相互作用的模拟研究,探究多种不同的内生菌与植物的联合修复体系,从而为实际应用提供指导。
| [1] |
Ahsan M T, Najam-Ul-Haq M, Idrees M, et al. Bacterial endophytes enhance phytostabilization in soils contaminated with uranium and lead[J]. International Journal of Phytoremediation, 2017, 19(10): 937-946. DOI:10.1080/15226514.2017.1303813 |
| [2] |
Sturz A V, Christie B R, Nowak J. Bacterial endophytes: Potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30. DOI:10.1080/07352680091139169 |
| [3] |
Rajkumar M, Ae N, Freitas H. Endophytic bacteria and their potential to enhance heavy metal phytoextraction[J]. Chemosphere, 2009, 77(2): 153-160. DOI:10.1016/j.chemosphere.2009.06.047 |
| [4] |
Misaghi I J, Donndelinger C R. Endophytic bacteria in symptom-free cotton plants[J]. Phytopathology, 1990, 80(9): 808-811. DOI:10.1094/Phyto-80-808 |
| [5] |
Lodewyckx C, Vangronsveld J, Porteous F, et al. Endophytic bacteria and their potential applications[J]. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606. DOI:10.1080/0735-260291044377 |
| [6] |
Bell C R, Dickie G A, Harvey W L G, et al. Endophytic bacteria in grapevine[J]. Canadian Journal of Microbiology, 1995, 41(1): 46-53. DOI:10.1139/m95-006 |
| [7] |
王吉永, 郭龙妹, 高林怡, 等. 植物内生菌的侵染定殖研究概况[J]. 江苏农业科学, 2019, 47(14): 36-39. WANG Ji-yong, GUO Longmei, GAO Lin-yi, et al. Study overview on infection and colonization of plant endophytes[J]. Jiangsu Agricultural Sciences, 2019, 47(14): 36-39. |
| [8] |
刘涛. 西宁地区番茄内生芽孢杆菌定殖规律及促生效应的研究[D]. 西宁: 青海师范大学, 2010. LIU Tao. A study on the colonization and promoting plant growth of tomato endophytic bacillus in Xining area[D]. Xining: Qinghai Normal University, 2010. |
| [9] |
齐永霞, 陈方新. 球孢白僵菌在玉米根际的定殖及对根际微生物的影响[J]. 热带作物学报, 2013, 34(5): 962-966. QI Yong-xia, CHEN Fang-xin. Colonization of Beauveria bassiana in corn rhizosphere and its effect on rhizosphere microorganisms[J]. Chinese Journal of Tropical Crops, 2013, 34(5): 962-966. DOI:10.3969/j.issn.1000-2561.2013.05.028 |
| [10] |
Bisht S, Pandey P, Kaur G, et al. Utilization of endophytic strain Bacillus sp. SBER3 for biodegradation of polyaromatic hydrocarbons (PAH) in soil model system[J]. European Journal of Soil Biology, 2014, 60: 67-76. DOI:10.1016/j.ejsobi.2013.10.009 |
| [11] |
刘文韬, 朱雪竹, 陈雪梅, 等. 功能内生菌株Enterobacter sp. PRd5定殖降低农作物芘污染技术研究[J]. 南京农业大学学报, 2020, 43(2): 274-283. LIU Wen-tao, ZHU Xue-zhu, CHEN Xue-mei, et al. Colonization of functional endophytic Enterobacter sp. PRd5 to reduce pyrene contamination in crops[J]. Journal of Nanjing Agricultural University, 2020, 43(2): 274-283. |
| [12] |
金勤, 朱丹雪, 周国英, 等. 绿色荧光蛋白标记枯草芽孢杆菌Y13UV在油茶体内的定殖[J]. 林业科学, 2017, 53(7): 111-117. JIN Qin, ZHU Dan-xue, ZHOU Guo-ying, et al. Colonization of GFP-yagged Bacillus subtilis Y13UV in Camellia oleifera[J]. Scientia Silvae Sinicae, 2017, 53(7): 111-117. |
| [13] |
姚锦爱, 黄鹏, 侯翔宇, 等. 海洋细菌解淀粉芽胞杆菌BA-3在兰花的定殖及对根际微生态的影响[J]. 中国生物防治学报, 2019, 35(6): 915-921. YAO Jin-ai, HUANG Peng, HOU Xiang-yu, et al. Colonization dynamics marine bacterium Bacillus amyloliquefaciens BA-3 and its impact on the microbial community of cymbidium rhizosphere[J]. Chinese Journal of Biological Control, 2019, 35(6): 915-921. |
| [14] |
李爽, 左尚武, 王万清, 等. 菌株Serratia sp.PW7不同定殖方式对黑麦草中芘污染去除及其内生菌群的影响[J]. 农业环境科学学报, 2018, 37(12): 2755-2764. LI Shuang, ZUO Shang-wu, WANG Wan-qing, et al. Determining the effects of Serratia sp. PW7 on pyrene removal and the endophytic bacterial community in ryegrass(Lolium multiflorum L.) via different inoculation methods[J]. Journal of Agro-Environment Science, 2018, 37(12): 2755-2764. DOI:10.11654/jaes.2017-1756 |
| [15] |
Glandorf D C M, Brand I, Bakker P A H M, et al. Stability of rifampicin resistance as a marker for root colonization studies of Pseudomonas putida in the field[J]. Plant and Soil, 1992, 147: 135-142. DOI:10.1007/BF00009379 |
| [16] |
迟峰. 根瘤菌在植物内的迁移运动及其与植物相互作用的蛋白质组学研究[D]. 北京: 中国科学院研究生院(植物研究所), 2006. CHI Feng. Migration of rhzobia in plants and proteome analysis of their interaction[D]. Beijing: Graduate School of the Chinese Academy of Sciences(Institute of Botany), 2006. |
| [17] |
Ptociniczak T, Chodór M, Pacwa-Ptociniczak M, et al. Metal-tolerant endophytic bacteria associated with Silene vulgaris support the Cd and Zn phytoextraction in non-host plants[J]. Chemosphere, 2019, 219: 250-260. DOI:10.1016/j.chemosphere.2018.12.018 |
| [18] |
Weyens N, Boulet J, Adriaensen D, et al. Contrasting colonization and plant growth promoting capacity between wild type and a gfp-derative of the endophyte Pseudomonas putida W619 in hybrid poplar[J]. Plant and Soil, 2012, 356(1/2): 217-230. DOI:10.1007/s11104-011-0831-x |
| [19] |
Weyens N, Schellingen K, Beckers B, et al. Potential of willow and its genetically engineered associated bacteria to remediate mixed Cd and toluene contamination[J]. Journal of Soils and Sediments, 2013, 13(1): 176-188. DOI:10.1007/s11368-012-0582-1 |
| [20] |
Germaine K J, Liu X, Cabellos G G, et al. Bacterial endophyte-enhanced phytoremediation of the organochlorine herbicide 2, 4-dichlorophenoxyacetic acid[J]. FEMS Microbiology Ecology, 2006, 57(2): 302-310. DOI:10.1111/j.1574-6941.2006.00121.x |
| [21] |
Lam S T, Ellis D M, Ligon J M. Genetic approaches for studying rhizosphere colonization[J]. Plant and Soil, 1990, 129(1): 11-18. DOI:10.1007/BF00011686 |
| [22] |
周俊初, 史巧娟, 谢波. 绿色荧光蛋白基因(gfp) 在华癸中生根瘤菌与紫云英共生固氮作用研究中的应用[J]. 中国科学基金, 2001, 15(5): 302-305. ZHOU Jun-chu, SHI Qiao-juan, XIE Bo. Application of green fluorescent protein gene(gfp) in the symbiosis between Mesorhizobium huakuii and Astragalus sinicus[J]. Bulletin of National Science Foundation of China, 2001, 15(5): 302-305. DOI:10.3969/j.issn.1000-8217.2001.05.016 |
| [23] |
田尉婧, 殷学仁, 李鲜, 等. 热激转录因子调控植物逆境响应研究进展[J]. 园艺学报, 2017, 44(1): 179-192. TIAN Yu-jing, YIN Xue-ren, LI Xian, et al. Regulation of stress responses by heat stress transcription factors (Hsfs) in plants[J]. Acta Horticulturae Sinica, 2017, 44(1): 179-192. |
| [24] |
Ehrenberg M, 罗文新, 夏宁邵. 绿色荧光蛋白——发现、表达和发展[J]. 生物物理学报, 2008, 24(6): 422-429. Ehrenberg M, LUO Wen-xin, XIA Ning-shao. Green fluorescent protein: Discovery, expression and development[J]. Acta Biophysica Sinica, 2008, 24(6): 422-429. DOI:10.3321/j.issn:1000-6737.2008.06.002 |
| [25] |
Zhao D, Xue C Y, Lin S Y., et al. Notch signaling pathway regulates angiogenesis via endothelial cell in 3D co-culture model[J]. Journal of Cellular Physiology, 2017, 232(6): 1548-1558. DOI:10.1002/jcp.25681 |
| [26] |
Tomblini R, Unge A, Davey M E, et al. Flow cytometrie and microscopie analysis of GFP-tagged Pseudomonas fluorescens bacteria[J]. FEMS Microbiology Ecology, 1997, 22(1): 17-28. DOI:10.1111/j.1574-6941.1997.tb00352.x |
| [27] |
Cormack B P, Valdivia R H, Falkow S. FACS-optimized mutants of the green fluorescent protein(GFP)[J]. Gene, 1996, 173(1): 33-38. DOI:10.1016/0378-1119(95)00685-0 |
| [28] |
Matz M V, Fradkov A F, Labas Y A, et al. Fluorescent proteins from nonbioluminescent Anthozoa species[J]. Nature Biotechnology, 1999, 17(10): 969-973. DOI:10.1038/13657 |
| [29] |
杨晓玫, 周彤, 阿芸, 等. 苜蓿根瘤菌绿色荧光蛋白标记株的构建及对结瘤固氮能力的影响[J]. 草原与草坪, 2018, 38(1): 44-49, 56. YANG Xiao-mei, ZHOU Tong, A Yun, et al. Establishment and nodular nitrogen fixation effect of green fluorescent protein labeled strains of alfalfa rhizobia[J]. Grassland and Turf, 2018, 38(1): 44-49, 56. DOI:10.3969/j.issn.1009-5500.2018.01.007 |
| [30] |
路国兵, 张瑶, 冀宪领, 等. 植物内生细菌的侵染定殖规律研究进展[J]. 生物技术通报, 2007(3): 88-92. LU Guo-bing, ZHANG Yao, JI Xian-ling, et al. Recent advance on the approaching and colonazition of endophytic bacteria[J]. Biotechnology Bulletin, 2007(3): 88-92. DOI:10.3969/j.issn.1002-5464.2007.03.019 |
| [31] |
李强, 刘华伟, 王渭玲. 田菁茎瘤固氮根瘤菌在小麦体内的定殖及营养元素相关miRNA的表达[J]. 植物营养与肥料学报, 2014, 20(4): 930-937. LI Qiang, LIU Hua-wei, WANG Wei-ling. Colonization of Azorhizobium caulinodans in wheat and nutrient-related miRNA expression[J]. Plant Nutrition and Fertilizer Science, 2014, 20(4): 930-937. |
| [32] |
万勇. 超积累植物龙葵内生菌强化镉植物修复的初步研究[D]. 长沙: 湖南大学, 2009. WAN Yong. Application of endophytic bacterium isolated from Cd hyperaccumulator Solanum Nigrum L for phytoremediation enhancement[D]. Changsha: Hunan University, 2009. |
| [33] |
万勇. 内生细菌在重金属植物修复中的作用机理及应用研究[D]. 长沙: 湖南大学, 2013. WAN Yong. A study on mechanism and application of endohytic bacteria in heavy metal phytoremediation[D]. Changsha: Hunan University, 2013. |
| [34] |
Li Y, Wang Q, Wang L, et al. Increased growth and root Cu accumlating of Sorghum sudanense by endophytic Enterobacter sp. K3-2:Implications for Sorghum sudanense biomass production and phytostabilization[J]. Ecotoxicology and Environmental Safety, 2016, 124: 163-168. DOI:10.1016/j.ecoenv.2015.10.012 |
| [35] |
Babu A G, Kim J D, Oh B T. Enhancement of heavy metal phytoremediation by Alnus firma with endophytic Bacillus thuringiensis GDB-1[J]. Journal of Hazardous Materials, 2013, 250/251: 477-483. DOI:10.1016/j.jhazmat.2013.02.014 |
| [36] |
Zhang Z Z, Hou Z W, Yang C Y, et al. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8[J]. Bioresource Technology, 2011, 102(5): 4111-4116. DOI:10.1016/j.biortech.2010.12.064 |
| [37] |
Zhang X Y, Liu X Y, Wang Q, et al. Diesel degradation potential of endophytic bacteria isolated from Scirpus triqueter[J]. International Biodeterioration and Biodegradation, 2014, 87: 99-105. DOI:10.1016/j.ibiod.2013.11.007 |
| [38] |
Ontañon O M, González P S, Agostini E. Biochemical and molecular mechanisms involved in simultaneous phenol and Cr(Ⅵ) removal by Acinetobacter guillouiae SFC 500-1A[J]. Environmental Science and Pollution Research, 2015, 22(17): 13014-13023. DOI:10.1007/s11356-015-4571-y |
| [39] |
Sun K, Liu J, Jin L, et al. Utilizing pyrene-degrading endophytic bacteria to reduce the risk of plant pyrene contamination[J]. Plant and Soil, 2014, 374(1/2): 251-262. DOI:10.1007%2Fs11104-013-1875-x |
| [40] |
Afzal M, Khan Q M, Sessitsch A. Endophytic bacteria: Prospects and applications for the phytoremediation of organic pollutants[J]. Chemosphere, 2014, 117: 232-242. DOI:10.1016/j.chemosphere.2014.06.078 |
| [41] |
Glick B R. Using soil bacteria to facilitate phytoremediation[J]. Biotechnology Advances, 2010, 28(3): 367-374. DOI:10.1016/j.biotechadv.2010.02.001 |
| [42] |
Germaine K J, Keogh E, Ryan D, et al. Bacterial endophyte-mediated naphthalene phytoprotection and phytoremediation[J]. FEMS Microbiology Letters, 2009, 296(2): 226-234. DOI:10.1111/j.1574-6968.2009.01637.x |
| [43] |
Khan Z, Roman D, Kintz T, et al. Degradation, phytoprotection and phytoremediation of phenanthrene by endophyte Pseudomonas putida, PD1[J]. Environmental Science and Technology, 2014, 48(20): 12221-12228. DOI:10.1021/es503880t |
| [44] |
田林双. 内生真菌降解多环芳烃菲研究[D]. 南京: 南京师范大学, 2007. TIAN Lin-shuang. The study on the degradation of phenanthrene by endophytic fungus[D]. Nanjing: Nanjing Normal University, 2007. |
| [45] |
Mirzahossini Z, Shabani L, Sabzalian M R, et al. ABC transporter and metallothionein expression affected by Ni and Epichloe endophyte infection in tall fescue[J]. Ecotoxicology and Environmental Safety, 2015, 120: 13-19. DOI:10.1016/j.ecoenv.2015.05.025 |
| [46] |
Ma Y, Oliveira R S, Nai F, et al. The hyperaccumulator Sedum plumbizincicola harbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multi-metal contaminated soil[J]. Environmental Management, 2015, 156: 62-69. |
| [47] |
刘倩雯. 碱蓬内生菌EF0801对PEG胁迫下水稻幼苗的缓解作用[D]. 沈阳: 沈阳师范大学, 2017. LIU Qian-wen. Alleviation of endophyte EF0801 from S. salsato the damage of rice seedlings under PEG stress[D]. Shenyang: Shenyang Normal University, 2017. |
| [48] |
张国霞, 茅庆, 何忠义, 等. 陵水普通野生稻(Oryza rufipogon) 内生菌的固氮及溶磷特性[J]. 应用与环境生物学报, 2006, 12(4): 457-460. ZHANG Guo-xia, MAO Qing, HE Zhong-yi, et al. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates from Oryz rufipogon in Lingshui[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(4): 457-460. DOI:10.3321/j.issn:1006-687X.2006.04.003 |
| [49] |
Khan A R, Ullah I, Waqas M, et al. Host plant growth promotion and cadmium detoxification in Solanum nigrum, mediated by endophytic fungi[J]. Ecotoxicology and Environmental Safety, 2017, 136: 180-188. DOI:10.1016/j.ecoenv.2016.03.014 |
| [50] |
Guo J, Mcculley R L, Phillips T D, et al. Fungal endophyte and tall fescue cultivar interact to differentially affect bulk and rhizosphere soil processes governing C and N cycling[J]. Soil Biology and Biochemistry, 2016, 101: 165-174. DOI:10.1016/j.soilbio.2016.07.014 |
| [51] |
Oelmüller R, Sherameti I, Tripathi S, et al. Piriformospora indica, a cultivable root endophyte with multiple biotechnological applications[J]. Symbiosis, 2009, 49(1): 1-17. DOI:10.1007/s13199-009-0009-y |
| [52] |
Emami S, Alikhani H A, Pourbabaee A A, et al. Consortium of endophyte and rhizosphere phosphate solubilizing bacteria improves phosphorous use efficiency in wheat cultivars in phosphorus deficient soils[J]. Rhizosphere, 2020, 14: 100196. DOI:10.1016/j.rhisph.2020.100196 |
| [53] |
孙云珠, 吴晨洁, 李靖姝. 土壤中植物生长促进菌的研究进展[J]. 四川农业科技, 2019(7): 68-70. SUN Yun-zhu, WU Chen-jie, LI Jing-shu. Research progress of plant growth promoting bacteria in soil[J]. Science and Technology of Sichuan Agriculture, 2019(7): 68-70. DOI:10.3969/j.issn.1004-1028.2019.07.024 |
| [54] |
古添源, 余黄, 曾伟民, 等. 功能内生菌强化超积累植物修复重金属污染土壤的研究进展[J]. 生命科学, 2018, 30(11): 1228-1235. GU Tian-yuan, YU Huang, ZENG Wei-min, et al. Progress on the endophyte of hyperaccumulators and their beneficial role in heavy metal phytoremediation[J]. Chinese Bulletin of Life Sciences, 2018, 30(11): 1228-1235. |
| [55] |
Chen L, Luo S L, Xiao X B, et al. Application of plant growth-promoting endophytes(PGPE) isolated from Solanum nigrum L[J]. Applied Soil Ecology, 2010, 46(3): 383-389. DOI:10.1016/j.apsoil.2010.10.003 |
| [56] |
Wang L, Lin H, Dong Y B, et al. Isolation of vanadium-resistance endophytic bacterium PRE01 from Pteris vittata in stone coal smelting district and characterization for potential use in phytoremediation[J]. Journal of Hazardous Materials, 2018, 341: 1-9. DOI:10.1016/j.jhazmat.2017.07.036 |
| [57] |
Tiwari S, Sarangi B K, Thul S T. Identification of arsenic resistant endophytic bacteria from Pteris vittata roots and characterization for arsenic remediation application[J]. Journal of Environmental Management, 2016, 180: 359-365. DOI:10.1016/j.jenvman.2016.05.029 |
| [58] |
Gao Y, Miao C Y, Xia J, et al. Effect of citric acid on phytoextraction and antioxidative defense in Solanum nigrum L[J]. Environmental Earth Sciences, 2012, 65(7): 1923-1932. DOI:10.1007/s12665-011-1174-x |
| [59] |
Khan A R, Ullah I, Khan A L, et al. Phytostabilization and physicochemical responses of Korean ecotype Solanum nigrum L. to cadmium contamination[J]. Water, Air, and Soil Pollution, 2014, 225(10): 2147. DOI:10.1007/s11270-014-2147-y |
| [60] |
Yan Z, Zhang W, Chen J, et al. Methyl jasmonate alleviates cadmium toxicity in Solanum nigrum by regulating metal uptake and antioxidative capacity[J]. Biologia Plantarum, 2015, 59(2): 373-381. DOI:10.1007/s10535-015-0491-4 |
| [61] |
张萌萌, 曹立东, 王仁卿, 等. 植物内生细菌修复重金属污染土壤作用机制研究进展[J]. 生物技术通报, 2018, 34(11): 42-49. ZHANG Meng-meng, CAO Li-dong, WANG Ren-qing, et al. Mechanism of endophytic bacteria remediating heavy metal-contaminated soil[J]. Biotechnology Bulletin, 2018, 34(11): 42-49. |
| [62] |
Hamilton C E, Gundel P E, Helander M, et al. Endophytic mediation of reactive oxygen species and antioxidant activity in plants: A review[J]. Fungal Diversity, 2012, 54(1): 1-10. DOI:10.1007/s13225-012-0158-9 |
| [63] |
Pan F, Meng Q, Luo S, et al. Enhanced Cd extraction of oilseed rape (Brassica napus) by plant growth-promoting bacteria isolated from Cd hyperaccumulator Sedum alfredii Hance[J]. Phytoremediat, 2017, 19(3): 281-289. DOI:10.1080/15226514.2016.1225280 |
| [64] |
Ma Y, Zhang C, Oliveira R S, et al. Bioaugmentation with endophytic Bacterium E6S homologous to Achromobacter piechaudii enhances metal rhizoaccumulation in host Sedum plumbizincicola[J]. Frontiers in Plant Science, 2016, 7: 75. |
| [65] |
Long X X, Chen X M, Chen Y G, et al. Isolation and characterization endophytic bacteria from hyperaccumulator Sedum alfredii Hance and their potential to promote phytoextraction of zinc polluted soil[J]. World Journal of Microbiology and Biotechnology, 2011, 27(5): 1197-1207. DOI:10.1007/s11274-010-0568-3 |
| [66] |
石成春. 有机污染物微生物共代谢降解及其动力学研究[J]. 化学工程与装备, 2010(7): 164-167, 121. SHI Cheng-chun. Review of the biodegradation cometabolism and kinetics of the organic contaminant[J]. Chemical Engineering and Equipment, 2010(7): 164-167, 121. |
| [67] |
郭静波, 陈微, 马放, 等. 环境污染治理中难降解有机污染物的生物共代谢[J]. 安全与环境学报, 2014, 14(6): 223-227. GUO Jingbo, CHEN Wei, MA Fang, et al. Microbial co-metabolism of the refractory organic pollutants in the environmental pollution control[J]. Journal of Safety and Environment, 2014, 14(6): 223-227. |
| [68] |
Stumpe B, Marschner B. Factors controlling the biodegradation of 17β-estradiol, estrone and 17α-ethinylestradiol in different natural soils[J]. Chemosphere, 2009, 74(4): 556-562. DOI:10.1016/j.chemosphere.2008.09.072 |
| [69] |
Subramanyam R, Mishra I M. Biodegradation of catechol(2-hydroxy phenol) bearing waste water in an UASB reactor[J]. Chemosphere, 2007, 69(5): 816-824. DOI:10.1016/j.chemosphere.2007.04.064 |
| [70] |
Ning D L, Wang H, Ding C, et al. Novel evidence of cytochrome P450-catalyzed oxidation of phenanthrene in Phanerochaete chrysosporium under ligninolytic conditions[J]. Biodegradation, 2010, 21(6): 889-901. DOI:10.1007/s10532-010-9349-9 |
| [71] |
Corrêa R C G, Rhoden S A, Mota T R, et al. Endophytic fungi: Expanding the arsenal of industrial enzyme producers[J]. Journal of Industrial Microbiology and Biotechnology, 2014, 41(10): 1467-1478. DOI:10.1007/s10295-014-1496-2 |
| [72] |
Ambrose K V, Tian Z P, Wang Y F, et al. Functional characterization of salicylate hydroxylase from the fungal endophyte Epichloë festucae[J]. Scientific Reports, 2015, 5: 10939. DOI:10.1038/srep10939 |
| [73] |
刘世亮, 骆永明, 曹志洪, 等. 多环芳烃污染土壤的微生物与植物联合修复研究进展[J]. 土壤, 2002, 34(5): 257-265. LIU Shiliang, LUO Yong-ming, CAO Zhi-hong, et al. Progress in study on bioremediation of PAHs-contaminated soil using soil microorganisms combined with plant[J]. Soils, 2002, 34(5): 257-265. DOI:10.3321/j.issn:0253-9829.2002.05.002 |
| [74] |
傅婉秋, 谢星光, 戴传超, 等. 植物-微生物联合对环境有机污染物降解的研究进展[J]. 微生物学通报, 2017, 44(4): 929-939. FU Wan-qiu, XIE Xing-guang, DAI Chuan-chao, et al. Progress in the degradation of environmental organic pollutants by plant-microorganism combination[J]. Microbiology, 2017, 44(4): 929-939. |
 2021, Vol. 38
2021, Vol. 38



