植物根际微生态环境中,微生物显著影响着"土壤-植物"系统中矿质元素的生物有效性及植物生长环境的健康状况[1-3]。微生物群落的功能与群落的结构和多样性密切相关[4-5]。任何影响根际土壤微生物群落结构与多样性的因素,都会影响到群落的功能,进而影响到植物的健康生长。因此,研究根际微生物群落结构与多样性变化,有助于理解外界因素促进植物健康生长的根际过程。
硒是人体必需的微量元素,也是植物的有益元素。土壤中施用适量硒有助于植物生长,增强植物抗逆能力[6-8]。此外,土壤环境中,适量硒可直接或间接抑制白腐真菌(Phanerochaete chrysosporium)、青霉菌(Penicillium expansum)、核盘菌(Sclerotinia sclerotiorum)等多种病原微生物的生长[9-12]。有关硒与微生物生态的研究结果表明,硒可显著改变土壤微生物的群落结构及其多样性[13]。低浓度硒可提高土壤微生物的数量和多样性,高浓度硒则表现出抑制效果[14]。不同硒含量土壤的微生物群落特征及多样性与土壤性质等因素密切相关[15-16]。
前期研究发现:向土壤中施用适量硒显著提高了油菜体内矿质元素的含量,促进了油菜的生长;恩施地区油菜主产区土壤微生物群落与硒含量密切相关[17-18]。综合上述研究结果及其他研究报道推测,土壤施硒促进植物生长与硒改变根际微生物群落组成进而影响土壤微生态环境有关。为明确外源硒对根际土壤细菌及真菌群落的影响,进而评价其土壤生态安全性,本研究基于高通量测序技术,分析了土壤微生物群落的结构与多样性对外源硒的响应,以期从微生物生态调控的角度,研究硒与植物生长的关系,为进一步评价农田施硒对土壤微生态安全的影响提供新思路。
1 材料与方法 1.1 试验材料供试油菜品种为中国农业科学院油料作物研究所培育的中双9号。
1.2 试验设计与处理盆栽试验在华中农业大学微量元素中心盆栽场(30°28′26″N,114°02′15″E)完成。土壤类型为酸性黄棕壤,种植油菜前采样分析测定其基本理化性质如下:pH 4.8,有机质含量21.2 g·kg-1,碱解氮、有效磷、速效钾含量分别为69.73、29.87、47.64 mg·kg-1,土壤全硒含量12.37 μg·kg-1。试验以亚硒酸钠(Na2SeO3)作为硒源,共设置3个处理,土壤施硒浓度依次为0(CK)、0.5、1.0 mg·kg-1,分别记为Se0、Se0.5和Se1.0(土壤硒浓度参照本团队前期相关研究结果设定),每个处理3次重复。在油菜播种前,将所有营养元素配成溶液施入土壤,其中,N、P、K元素的施用量分别为N 0.2 g·kg-1、P2O5 0.15 g·kg-1、K2O 0.2 g·kg-1,营养元素来源分别为尿素、磷酸二氢铵和硫酸钾。微量元素以每千克土壤中加入1 mL阿农营养液(1 000倍)补充。先将硒配制成一定浓度的溶液,施入土壤后迅速拌匀。油菜按照当地播种时间于2017年9月16日播种。植物生长期间以去离子水作为水源。将盆栽放置于防雨棚下防止雨水中微量元素对试验的污染。
1.3 根际土壤样品采集根际土壤于2018年3月15日(油菜花期)采用抖根法收集,即从盆栽土壤的20~50 cm土层选取带完整根系的土块,然后轻轻抖落,紧附在根系表面且不易被抖落的土壤即为根际土壤。再去掉土壤中的根系和小石块,过2 mm筛后将土样装于无菌封口袋中,冰上放置带回实验室后保存在-80 ℃冰箱中。
1.4 根际土壤微生物总DNA提取和高通量测序取0.5 g根际土壤样品,采用土壤DNA试剂盒(MOBIO,美国)提取油菜根际土壤微生物总DNA。以紫外分光光度法测定提取的DNA纯度,1%琼脂糖凝胶电泳检测合格后用于构建文库。以提取的总DNA为模板,以细菌V4区特异性引物(338F 5′-GTGCCAGCMGCCGCGGTAA–3′;806R 5′-GGACTACHVGGGTWTCTAAT–3′)[19]和真菌ITS2区特异性引物(ITS2 F 5′ -GTGCCAGCMGCCGCGGTAA–3′;2043R 5′ - GACTACHVGGGTWTCTAAT – 3′)进行PCR扩增[20]。采用Illumina MiSeq测序平台对PCR扩增产物进行测序分析。土壤样品的微生物测序及数据分析由北京诺禾致源生物信息科技有限公司完成。
1.5 数据处理与分析原始测序数据经去除接头序列和低质量的碱基处理后,获得高质量序列。通过Flash软件对每个样品的Reads进行拼接,按照碱基数对Tags进行截断和过滤并与数据库进行比对,得到最终的有效数据。利用QIIME软件(V1.9.1)对序列进行识别,再利用USEARCH选出优质序列后,以97%的序列相似度将序列聚类成操作分类单元(Operational taxonomic unit,OTU),将选取出的OTU代表序列与16S rRNA数据库和ITS数据库进行物种注释后开展后续的测序数据分析。
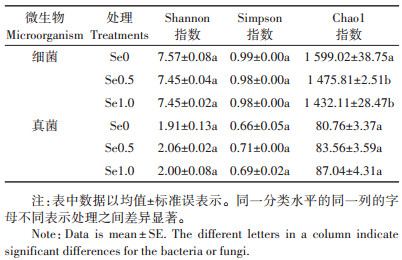
2 结果与分析 2.1 硒对油菜根际土壤微生物群落结构的影响通过计算不同硒处理土壤样品中细菌和真菌在门水平上的物种平均相对丰度,同时选取相对丰度在1%以上的物种,绘制了门水平上的物种相对丰度分布图(图 1)。由图 1A可知,油菜根际土壤中细菌相对丰度较大的门类为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)等。硒处理(0.5、1.0 mg·kg-1)增加了土壤酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)的丰度,降低了放线菌门(Actinobacteria)的丰度。由图 1B可知,土壤中真菌相对丰度最大的门类为子囊菌门(Ascomycota),硒处理(0.5、1.0 mg·kg-1)增加了土壤子囊菌门(Ascomycota)的相对丰度。
|
图 1 不同施硒浓度下油菜根际土壤细菌(A)和真菌(B)在门水平上的相对丰度 Figure 1 The relative abundances of bacterial(A)and fungal (B)phyla in the rhizosphere soil of oilseed rape under different selenium treatments |
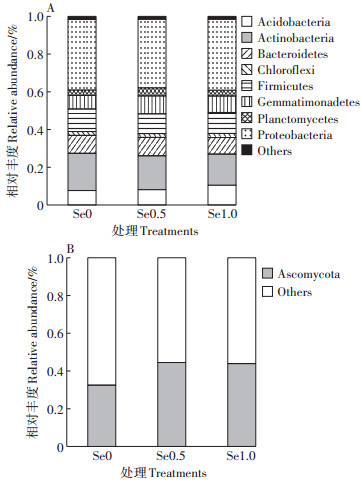
Venn图展示了不同浓度硒处理组土壤微生物群落共有或特有的OTU数,进而分析了各处理间微生物群落结构的相似性、重叠情况以及特异性(图 2)。由图 2A可知,硒处理土壤中细菌群落共有OTU个数为670,而Se0、Se0.5和Se1.0处理土壤细菌群落特有的OTU个数分别为213、117和113。由图 2B可知,硒处理土壤中真菌群落共有OTU个数为48,而Se0、Se0.5和Se1.0处理土壤真菌群落特有的OTU个数分别为5、8和14。结果表明,对照组(无外源硒处理组)根际土壤细菌群落结构最为复杂,特异性最高,硒处理降低了土壤细菌群落结构的特异性,增加了土壤真菌群落结构的特异性。
|
图 2 不同施硒浓度下油菜根际土壤细菌(A)和真菌(B)OTU Venn图 Figure 2 The Venn diagram of bacterial (A)and fungal (B)OTU in the rhizosphere soil of oilseed rape under different selenium treatments |
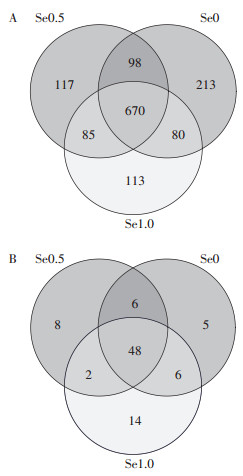
Alpha多样性是对单个样品中物种多样性的分析。本研究中,以Shannon指数和Simpson指数表示样本中微生物的多样性,前者数值越大或后者数值越小,表明群落多样性越大。Chao1指数可表征微生物群落丰富度,该指数的大小与微生物群落丰富度大小相对应。由表 1可知,土壤施硒对油菜根际土壤细菌和真菌群落Shannon指数和Simpson指数的影响均未达到显著水平,但显著降低了土壤细菌群落的Chao1指数,对土壤真菌群落的Chao1指数影响不显著。土壤微生物群落Alpha多样性分析结果表明:硒的施用未显著改变油菜根际土壤样品中微生物的多样性,降低了土壤细菌群落的丰富度。
|
|
表 1 不同施硒浓度下油菜根际土壤细菌和真菌多样性与丰富度 Table 1 The diversity and richness of bacteria and fungi in the rhizosphere soil of oilseed rape under different selenium treatments |
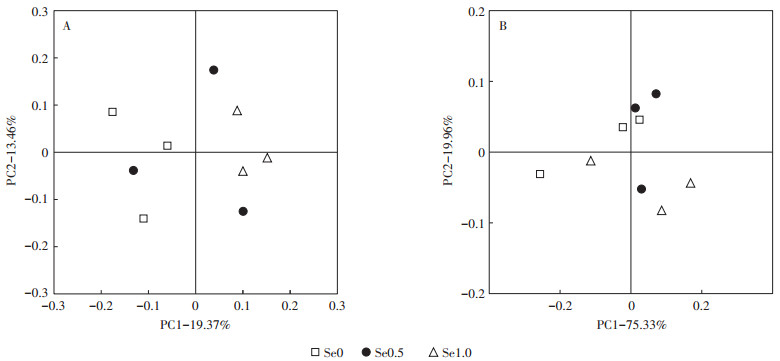
根据样本的OTU丰度信息计算Unweighted Unifrac距离,对土壤细菌和真菌群落进行主坐标分析(Principal coordinate analysis,PCoA),评价硒对油菜根际土壤微生物群落结构的影响(图 3)。由图 3可知,不同施硒浓度中的3个重复并不聚类于同一象限,表明组内变异较大。由图 3A可知,PC1轴上Se0.5、Se1.0处理集中分布在正方向,Se0处理分布在负方向,Se0与Se0.5、Se1.0之间差异显著,Se0.5和Se1.0之间差异不显著,说明影响土壤细菌群落结构的主导因子较为明显。由图 3B可知,PC1轴上Se0、Se0.5、Se1.0处理集中分布在正方向;Se0、Se0.5、Se1.0处理间的差异不显著,表明影响土壤真菌群落结构的主导因子并不明显。基于Bray-Curtis距离进行Adonis分析,结果表明:硒对土壤细菌群落结构影响显著(R2=0.346,P=0.044);硒对土壤真菌群落结构影响不显著(R2=0.294,P=0.324)。综合土壤微生物群落Beta多样性结果可知,硒对土壤细菌群落的影响比真菌群落更为明显。
|
图 3 不同施硒浓度下油菜根际土壤细菌(A)和真菌(B)PCoA分析 Figure 3 PCoA analysis of bacteria(A)and fungi (B)in the rhizosphere soil of oilseed rape under different selenium treatments |
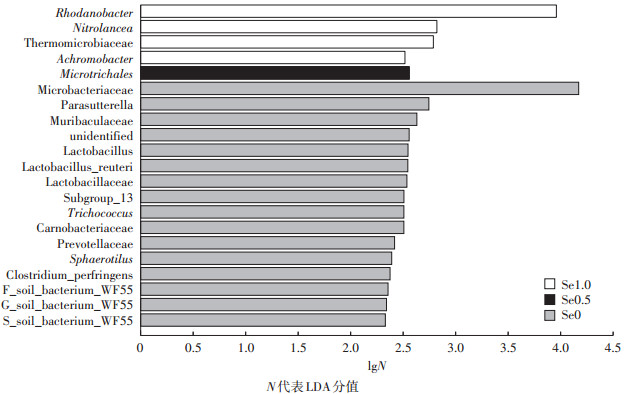
分析不同施硒浓度下土壤细菌和真菌群落的差异物种特征,对评价土壤硒与微生物多样性的关系十分重要。本研究对三个浓度硒处理土壤间的细菌群落采用线性判别分析(Linear discriminant analysis,LDA),估算了硒处理下物种丰度对差异效果影响的大小。分析结果见显著差异物种LDA值分布柱状图(图 4),该图反映了每个组内显著富集的物种及其差异影响。由图 4可知:未施硒的油菜根际土壤中显著富集乳杆菌目(Lactobacillaceae)、德库菌属(Trichococcus)、肉杆菌科(Carnobacteriaceae)、普雷沃氏菌科(Prevotellaceae)、红长命菌属(Sphaerotilus);Microtrichales显著富集于低浓度硒处理土壤中;而产黄杆菌(Rhodanobacter)、Nitrolancea、热微菌科(Thermomicrobiaceae)和无色杆菌属(Achromobacter)则显著富集于高浓度硒处理土壤中。
|
图 4 不同施硒浓度下油菜根际土壤细菌存在显著差异物种的LDA值分布柱图 Figure 4 Histogram of LDA value distribution of species with significant difference between bacteria in the rhizosphere soil of oilseed rape under different selenium treatments |
土壤微生物在土壤-植物生态系统中具有关键作用。植物在生长过程中与土壤微生物密切接触,其根系可塑造根际土壤微生物群落[21-23]。与此同时,根际微生物群落中的有益微生物如丛枝菌根真菌(AMF)和植物生长促生菌(PGPR),有助于增强植物对营养元素的吸收,促进植物生长,增强其对病原菌的抵抗能力[24]。根际微生物群落结构和多样性可通过"土壤-植物"互作系统直接影响到植物生长的微生态环境。任何影响土壤微生物生态的外源因素都可能间接影响植物的生长与安全。
本研究基于前期研究发现的"硒维护植物良好生长环境,促进植物对矿质养分的吸收"等相关结果,结合根际微生物生态功能,研究了硒作用下土壤微生物群落的结构与多样性的响应。研究发现,本试验油菜根际土壤中细菌相对丰度较大的门类为变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)等。于冰[25]研究表明,变形菌门对多种植物根际微环境(如:拟南芥、玉米、枸杞等)具有良好的适应能力,酸杆菌门能够降解复杂的木质素和纤维素,从而为土壤提供养分[26]。本研究中,硒处理下增加了根际土壤酸杆菌门(Acidobacteria)的丰度,表明土壤施硒可通过增加酸杆菌门细菌的丰度进而促进木质素和纤维素的分解,以增强油菜对养分的吸收。这与明佳佳等[17]研究结果一致。此外,有研究指出,外源条件增加土壤中酸杆菌门(Acidobacteria)和厚壁菌门(Firmicutes)的丰度,改变微生物种群的相互作用和平衡,从而促进作物生长,抑制土传病害的发生[27-28]。本研究数据验证了Liu等[18]土壤施硒降低了油菜菌核病的发病率相关研究结果。
Alpha多样性是有效评价土壤微生物群落多样性和物种丰富度的指标。本研究发现,土壤施硒未显著改变油菜根际土壤样品中细菌和真菌群落结构多样性。有研究报道,不同硒含量土壤微生物群落结构特征明显不同[15-16],低浓度硒提高了土壤微生物的数量和多样性,高浓度硒则表现出抑制效果[14]。本研究Beta多样性分析结果表明,相比硒对土壤真菌群落的影响,硒对细菌群落的影响更为明显。由此可见,油菜根际土壤中细菌群落对硒浓度响应表现更为敏感。
本研究中,差异物种分析结果表明,较高浓度硒(1.0 mg·kg-1)处理土壤中显著富集产黄杆菌(Rhodanobacter)、Nitrolancea和无色杆菌属(Achromobacter)。其中,产黄杆菌(Rhodanobacter)和Nitrolancea有助于降解土壤抗生素[29];无色杆菌属(Achromobacter)是一种对植物有益的菌属,能够促进植物生长,增强应激反应基因的表达量[30]。Jurado等[31]研究表明Microbacteriaceae可以产生某些生物活性物质,可用于防控植物病害。本实验发现Microbacteriaceae显著富集于低浓度硒(0.5 mg·kg-1)处理土壤中,由此推测,施硒有助于特异性富集一些利于植物生长的有益微生物。
尽管硒能够改变土壤微生物群落结构及其多样性[13],但不同硒含量的土壤微生物群落特征及多样性不尽相同,这与植物类别、土壤性质、养分含量、理化性质等密切相关[16, 32]。因此,后续研究有必要借助基因芯片技术,联合土壤理化因子冗余分析,进一步深入揭示土壤养分转化功能菌、植物生长促生菌、土传病害病原菌等丰度及其与硒含量的关系。此外,由于数据库物种注释的限制,本研究暂未确定种属的物种,未能对其在微生态环境中的功能进行解释,有待利用其他先进手段对这些物种进行更详细的物种注释。
4 结论本文在前期研究的基础上,借助高通量测序技术分析并明确了硒对油菜根际土壤微生物群落结构与多样性的影响。得到如下结论:
(1)硒对土壤细菌和真菌群落的多样性无显著影响,但影响了细菌和真菌群落中菌群的相对丰度,如增加了土壤酸杆菌门(Acidobacteria)和芽单胞菌门(Gemmatimonadetes)的丰度,但降低了放线菌门(Actinobacteria)的丰度;在真菌群落中,增加了土壤子囊菌门(Ascomycota)的相对丰度。
(2)硒对油菜根际土壤中细菌群落结构的影响显著,对真菌群落结构无显著影响。
(3)硒促进油菜根际土壤富集对植物生长有益的微生物。因此,本研究结果可为从根际微生态的角度解释"硒增强植物抗性,促进植物生长"提供数据参考。
| [1] |
Nacke H, Thürmer A, Wollherr C, et al. Pyrosequencing-based assessment of bacterial community structure along different management types in German forest and grassland soils[J]. PLoS ONE, 2011, 6(2): e17000. DOI:10.1371/journal.pone.0017000 |
| [2] |
Li R, Khafipour E, Krause D O, et al. Pyrosequencing reveals the influence of organic and conventional farming systems on bacterial communities[J]. PLoS ONE, 2012, 7(12): e51897. DOI:10.1371/journal.pone.0051897 |
| [3] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |
| [4] |
Bakker M G, Chaparro J M, Manter D K, et al. Impacts of bulk soil microbial community structure on rhizosphere microbiomes of Zea mays[J]. Plant and Soil, 2015, 392(2): 115-126. |
| [5] |
Shen W, Lin X, Shi W, et al. Higher rates of nitrogen fertilization decrease soil enzyme activities, microbial functional diversity and nitrification capacity in a Chinese polytunnel greenhouse vegetable land[J]. Plant and Soil, 2010, 337(1): 137-150. |
| [6] |
Lin L, Zhou W H, Dai H X, et al. Selenium reduces cadmium uptake and mitigates cadmium toxicity in rice[J]. Journal of Hazardous Materials, 2012, 235: 343-351. |
| [7] |
Mozafariyan M, Shekari L, Hawrylak-Nowak B, et al. Protective role of selenium on pepper exposed to cadmium stress during reproductive stage[J]. Biological Trace Element Research, 2014, 160(1): 97-107. DOI:10.1007/s12011-014-0028-2 |
| [8] |
Qing X J, Zhao X H, Hu C X, et al. Selenium alleviates chromium toxicity by preventing oxidative stress in cabbage(Brassica campestris L. ssp Pekinenisis)leaves[J]. Ecotoxicology and Environmental Safety, 2015, 114: 179-189. DOI:10.1016/j.ecoenv.2015.01.026 |
| [9] |
Wu Z L, Yin X B, Lin Z Q, et al. Inhibitory effect of selenium against Penicillium expansum and its possible mechanisms of action[J]. Current Microbiology, 2014, 69(2): 192-201. DOI:10.1007/s00284-014-0573-0 |
| [10] |
Jia W, Hu C X, Ming J J, et al. Action of selenium against Sclerotinia sclerotiorum:Damaging membrane system and interfering with metabolism[J]. Pesticide Biochemistry and Physiology, 2018, 150: 10-16. DOI:10.1016/j.pestbp.2018.06.003 |
| [11] |
Jia W, Hu C X, Xu J Y, et al. Dissolved organic matter derived from rape straw pretreated with selenium in soil improves the inhibition of Sclerotinia sclerotiorum growth[J]. Journal of Hazardous Materials, 2019, 369: 601-610. DOI:10.1016/j.jhazmat.2019.02.055 |
| [12] |
Cheng Q, Hu C X, Jia W, et al. Selenium reduces the pathogenicity of Sclerotinia sclerotiorum by inhibiting sclerotial formation and germination[J]. Ecotoxicology and Environmental Safety, 2019, 183: 1-9. |
| [13] |
雷磊, 朱建明, 王风平, 等. 湖北恩施渔塘坝富硒碳质泥岩中的微生物多样性初探[J]. 地球与环境, 2011, 39(4): 517-522. LEI Lei, ZHU Jian-ming, WANG Feng-ping, et al. Primarily investigating the diversity of microorganisms in selenium-rich carbonaceous mudstone of Yutangba, Enshi, Hubei[J]. Earth and Environment, 2011, 39(4): 517-522. |
| [14] |
樊俊.硒在土壤-植物中的转化及烟株对硒的富集和抗性机理研究[D].武汉: 华中农业大学, 2015. FAN Jun. Transformation of selenium in soil and plants, and the mechanisms for the accumulation and resistance to selenium in tobacco plant[D]. Wuhan: Huazhong Agricultural University, 2015. |
| [15] |
Knotek-Smith H M, Grawford D L, Moller G, et al. Microbial studies of a selenium-contaminated mine site and potential for on-site remediation[J]. Journal of Industrial Microbiology & Biotechnology, 2006, 33(11): 897-913. |
| [16] |
Rosenfeld C E, James B R, Santelli C M. Persistent bacterial and fungal community shifts exhibited in selenium-contaminated reclaimed mine soils[J]. Applied and Environmental Microbiology, 2018, 84(16): 1-18. |
| [17] |
明佳佳, 胡承孝, 赵小虎, 等. 硒对油菜各部位矿质元素含量及其迁移特征的影响[J]. 浙江农业学报, 2016, 28(9): 1564-1571. MING Jia-jia, HU Cheng-xiao, ZHAO Xiao-hu, et al. Content and migration characteristic of mineral element in rape with application of selenium[J]. Acta Agriculturae Zhejiangensis, 2016, 28(9): 1564-1571. DOI:10.3969/j.issn.1004-1524.2016.09.16 |
| [18] |
Liu K, Cai M M, Hu C X, et al. Selenium(Se)reduces Sclerotinia stem rot disease incidence of oilseed rape by increasing plant Se concentration and shifting soil microbial community and functional profiles[J]. Environmental Pollution, 2019, 254: 113051. DOI:10.1016/j.envpol.2019.113051 |
| [19] |
Xu N, Tan G C, Wang H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. DOI:10.1016/j.ejsobi.2016.02.004 |
| [20] |
Bokulich N A, Mills D A. Improved selection of internal transcribed spacer-specific primers enables quantitative, ultra-high-throughput profiling of fungal communities[J]. Applied and Environmental Microbiology, 2013, 79(8): 2519-2526. DOI:10.1128/AEM.03870-12 |
| [21] |
Steinkellner S, Lendzemo V, Langer I, et al. Flavonoids and strigolactones in root exudates as signals in symbiotic and pathogenic plantfungus interactions[J]. Molecules, 2007, 12(7): 1290-1306. DOI:10.3390/12071290 |
| [22] |
Zilber-Rosenberg I, Rosenberg E. Role of microorganisms in the evolution of animals and plants:The hologenome theory of evolution[J]. FEMS Microbiology Reviews, 2008, 32(5): 723-735. DOI:10.1111/j.1574-6976.2008.00123.x |
| [23] |
Turner T R, James E K, Poole P S. The plant microbiome[J]. Genome Biology, 2013, 14(6): 1-10. |
| [24] |
纳小凡, 郑国琦, 彭励, 等. 不同种植年限宁夏枸杞根际微生物多样性变化[J]. 土壤学报, 2016, 53(1): 241-252. NA Xiao-fan, ZHENG Guo-qi, PENG Li, et al. Microbial biodiversity in rhizosphere of Lycium bararum L. relative to cultivation history[J]. Acta Pedologica Sinica, 2016, 53(1): 241-252. |
| [25] |
于冰.长期不同施肥处理红壤对13C标记玉米秸秆降解及关联微生物的影响[D].北京: 中国农业科学院, 2017. YU Bing. Effects of long-term different fertilization treatments in red soil on degradation of 13C-labeled maize straw and related microbes[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. |
| [26] |
Bonanomi G, Antignani V, Capodilupo M, et al. Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases[J]. Soil Biology and Biochemistry, 2010, 42(2): 136-144. DOI:10.1016/j.soilbio.2009.10.012 |
| [27] |
Hartmann M, Frey B, Mayer J, et al. Distinct soil microbial diversity under long-term organic and conventional farming[J]. The ISME Journal, 2015, 9(5): 1177-1194. DOI:10.1038/ismej.2014.210 |
| [28] |
明佳佳.硒增强油菜对菌核病抗性及其生理机制[D].武汉: 华中农业大学, 2016. MING Jia-jia. The physiological mechanism of selenium enhanced resistance to Sclerotinia sclerotiorum in oilseed[D]. Wuhan: Huazhong Agricultural University, 2016. |
| [29] |
Lou J L, Liu M, Gu J L, et al. Metagenomic sequencing reveals microbial gene catalogue of phosphinothricin-utilized soils in south China[J]. Gene, 2019, 711: 143942. DOI:10.1016/j.gene.2019.143942 |
| [30] |
Joe M M, Islam M R, Karthikeyan B, et al. Resistance responses of rice to rice blast fungus after seed treatment with the endophytic Achromobacter xylosoxidans AUM54 strains[J]. Crop Protection, 2012, 42: 141-148. DOI:10.1016/j.cropro.2012.07.006 |
| [31] |
Jurado M M, Suárez-Estrella F, López M J, et al. Bioprospecting from plant waste composting:Actinobacteria against phytopathogens producing damping-off[J]. Biotechnology Reports, 2019, 23: e00354. DOI:10.1016/j.btre.2019.e00354 |
| [32] |
王悦, 杨贝贝, 王浩, 等. 不同种植模式下丹参根际土壤微生物群落结构的变化[J]. 生态学报, 2019, 39(13): 1-11. WANG Yue, YANG Bei-bei, WANG Hao, et al. Variation in microbial community structure in the rhizosphere soil of Salvia miltiorrhiza Bunge under three cropping modes[J]. Acta Ecologica Sinica, 2019, 39(13): 1-11. |
 2021, Vol. 38
2021, Vol. 38