2. 河北省农林科学院遗传生理研究所, 石家庄 050051
2. Institute of Genetics and Physiology, Hebei Academy of Agriculture and Forestry Sciences, Shijiazhuang 050051, China
土壤微生物是土壤生态系统的重要组成部分[1],不仅反映了土壤的生物性状,而且也是土壤有机质、养分转化与循环的动力[2-3],在土壤结构形成、土壤肥力和营养元素转化、土壤微生态平衡保持、土壤环境净化及生态修复等方面发挥着重要作用[4],其群落结构组成是衡量土壤肥力和质量的重要指标[5-6]。土壤微生物对所处环境的变化十分敏感[7],其群落结构和多样性可以较早地反映土壤环境质量的变化,已被认为是重要的生物学指标[8]。磷脂脂肪酸(Phospholipid fatty acid,PLFA)是活体微生物细胞膜的恒定组分[9],也是表示微生物量的指标之一,因此特定菌群PLFA数量变化可反映原位土壤真菌、细菌等活体的生物量与菌群结构[10]。PLFA技术是一种可定性和定量分析微生物群落多样性的方法,近年来被广泛应用并取得了大量成果[11-14]。
土壤微生物作为植物与土壤互作的重要纽带,其群落结构除了受气候和地理环境等因素的影响外,植被也是一个主要影响因素[15]。不同植物种类和种植年限均会对土壤微生物种群结构产生一定影响,李欣玫等[16]研究表明5种荒漠植物根际土壤微生物群落组成差异显著,并可用于检测不同荒漠植物根际微环境土壤退化状况。凃月等[17]研究了广西会仙湿地不同植物根际细菌群落结构及多样性,发现它们之间差异很大。王娟英等[18]对不同连作年限的怀牛膝根际土壤理化性质及微生物多样性进行了研究,结果发现连作使有效磷、碱解氮和速效钾等含量上升,而且随着连作年限增加,土壤中总PLFAs、细菌、革兰氏阴性菌、真菌含量明显上升,微生物多样性增加。刘顺等[19]研究表明,不同林龄的红心杉土壤微生物结构发生了明显改变。另外,土壤的盐碱度也直接影响土壤微生物的群落结构和组成,李新等[20]研究表明内蒙古河套灌区不同盐碱程度地区土壤微生物主要以细菌为主,但随着盐碱程度增加,细菌含量下降。张宁[21]研究了盐碱地起垄对土壤微生态的影响,发现起垄对细菌、放线菌影响效果显著。因此研究盐碱地不同植物种植下土壤微生物群落结构特征,对了解盐碱地土壤环境状况和质量变化具有重要意义。
滨海盐土是盐碱土的一种,盐分含量高,主要以NaCl为主,土壤结构单一,有机质含量低,一般植物难以在滨海盐土中正常生长。费菜(Sedum aizoon L.)是一种景天科的功能型植物,田菁(Sesbania cannabina(Retz.)Poir.)是一种豆科绿肥植物,蒲公英(Taraxacum mongolicum Hand.-Mazz.)是一种菊科的药食兼用植物,三者都具有较好的耐盐性,前期试验发现,它们在滨海盐土土壤种植可以降低土壤盐分[22-24],改善土壤结构,但是有关种植以上3种耐盐植物对滨海盐土微生物群落结构影响的研究还鲜有报道。本研究利用PLFA法研究3种耐盐植物种植下滨海盐土化学性质及微生物群落结构的变化,通过主成分分析揭示不同耐盐植物种植下土壤微生物群落结构特征,了解滨海盐土土壤质量变化,以期为滨海盐土通过种植耐盐植物实现生态恢复提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于河北省唐山市曹妃甸区天旭生态园(118°33′40.82″E,39°09′39.35″N),属于北温带大陆性季风气候,四季气候变化明显,具有明显的暖温带半湿润季风气候特征,年平均气温11.6 ℃,年平均降水量553.7 mm。土壤类型属于滨海盐土,主要盐分组成以NaCl为主。试验地土壤容重1.63 g·cm-3,0~ 20 cm土壤电导率为1.76 mS·cm-1,pH为7.58,有机质12.06 g·kg-1,有效氮82 mg·kg-1,有效磷57 mg·kg-1,速效钾220 mg·kg-1。
1.2 试验设计植物种子或种苗均由河北省农林科学院滨海农业研究所提供。为保证种植植物样地与裸地对照土壤背景一致,在植物生长过程中未施加任何形式的肥料和植物生长调节剂,且采用滴灌同时等量给水。
1.3 样品采集及主要指标测定 1.3.1 样品采集于植物生长旺盛期(2018年8月),按“S”形选取5个点,用土钻取0~20 cm土层土壤,去除石子、根系及动物残体,过2 mm筛后混合均匀,一份用无菌封口袋密封置于冰盒中带回实验室用于磷脂脂肪酸测定,一份用封口袋密封用于土壤化学性质测定。
1.3.2 土壤微生物PLFAs测定及命名土壤微生物PLFAs提取与测定主要参照Bligh等[25]的方法并稍作改进,取新鲜土壤8.0 g,用提取液(氯仿:甲醇:柠檬酸缓冲液体积比为1:2:0.8)提取,再分别用氯仿、丙酮和甲醇洗提,分离和萃取出磷脂,之后与甲醇进行酯化反应形成脂肪酸甲酯,然后用200 mL正己烷溶解,以C19脂肪酸甲酯作为内标物,利用美国安捷伦科技有限公司的Agilent 7890B型气相色谱仪进行分析,色谱柱为Agilent 19091B-102型,检测器为氢火焰离子(FID),载气为氢气,谱仪工作条件为:进样口温度250 ℃,检测器温度300 ℃,柱温箱初始温度190 ℃, 保持0 min, 以10 ℃·min-1升温至285 ℃保持0 min,以60 ℃·min-1升温至310 ℃保持2 min,进样量为2 μL。然后采用MIDI公司的Sherlock MIS6.2系统进行脂肪酸的鉴定。脂肪酸的命名参考Frostagard等[26]的命名方法。根据前人报道的磷脂脂肪酸的生物标记[19, 27],并结合MIDI软件系统自动识别参考划分微生物类群(表 1)。
|
|
表 1 土壤微生物种类的磷脂脂肪酸生物标记 Table 1 PLFA biomarker for soil microbes |
参照鲍士旦[28]的方法,土壤电导率测定时水土比为5:1,土壤有机质含量采用重铬酸钾加热法,土壤有效氮、有效磷和速效钾分别采用碱解扩散法、碳酸氢钠法和乙酸铵萃取法测定。
1.4 数据分析与处理 1.4.1 土壤微生物多样性分析土壤微生物多样性采用Shannon-Wiener多样性指数(H)、Margalef丰富度指数(SR)、Pielou均匀度指数(J)表示,计算公式[20, 29]如下:
Shannon-Wiener多样性指数(H):
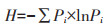
|
(1) |
其中Pi=Ni /N
Margalef丰富度指数(SR):
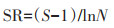
|
(2) |
Pielou均匀度指数(J):
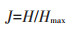
|
(3) |
其中Hmax=lnS
式中:Ni为第i种磷脂脂肪酸含量;N为每个样品所有磷脂脂肪酸的含量总和;S为每个样品磷脂脂肪酸种类数。
1.4.2 数据处理采用Excel 2010软件进行数据统计;采用SPSS 20.0软件进行单因素方差分析(One-way ANOVA),采用Canoco 4.5软件进行主成分分析并作图。
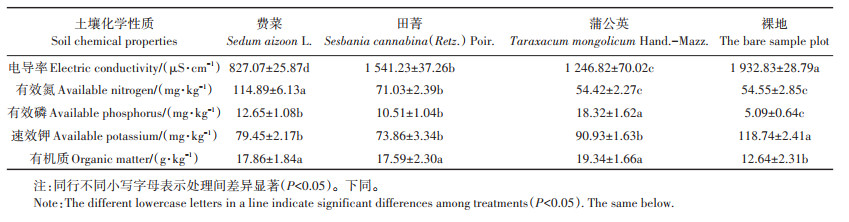
2 结果与分析 2.1 土壤化学性质由表 2可知,与裸地比较,种植植物样地土壤电导率和速效钾含量显著下降,电导率下降了20.26%~ 57.21%,有效钾含量下降了23.42%~37.80%;有效磷和有机质含量显著提高,有效磷提高了106.48%~259.92%,有机质含量提高了39.16%~53.01%;而有效氮含量变化规律性不明显。3种植物样地中,费菜样地的土壤电导率显著低于其余2种植物,有效氮含量显著高于其余2种植物;蒲公英样地土壤有效磷含量最高,3种植物样地的速效钾和有机质含量差异不显著。
|
|
表 2 不同处理样地土壤的化学性质 Table 2 Soil chemical properties under different treatments |
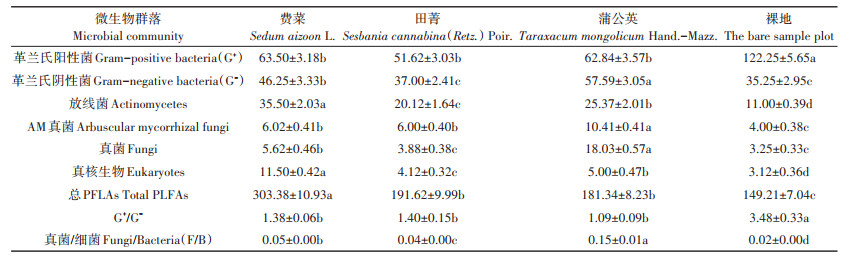
对种植耐盐植物及裸地处理下土壤微生物群落PLFAs含量进行分析(表 3),结果表明:与裸地比较,3个植物样地土壤中革兰氏阴性菌、放线菌、AM真菌、真核生物、真菌PFLA含量和总PFLAs含量显著升高,分别升高4.96%~63.37%、82.91%~222.72%、50.00%~ 160.25%、32.05%~268.59%、19.39%~454.77%、21.53%~ 103.32%;真菌/细菌(F / B)PFLA含量也显著升高1.00~6.50倍。其中,革兰氏阴性菌、真菌和AM真菌表现为蒲公英>费菜>田菁>裸地;放线菌和真核生物表现为费菜>蒲公英>田菁>裸地;总PFLAs大小依次为费菜>田菁>蒲公英>裸地;AM真菌、真菌和真菌/细菌PFLA含量在蒲公英样地中显著高于其余样地。而植物样地土壤的革兰氏阳性菌PFLA含量却大幅下降了48.06%~57.78%,大小顺序依次为裸地>费菜>蒲公英>田菁;革兰氏阳性菌/革兰氏阴性菌(G+/G-)PFLA含量也显著下降了59.77%~68.68%,但3个植物样地间差异不显著。
|
|
表 3 不同处理土壤微生物PLFA含量(nmol·g-1) Table 3 Soil microbial PLFA content under different treatments(nmol·g-1) |
对表征土壤微生物群落多样性的Shannon-Wiener多样性指数(H)、丰富度指数(SR)、均匀度指数(J)进行分析(表 4)可以看出,蒲公英样地多样性指数显著高于裸地(P < 0.05),增幅为22.26%;3个植物样地丰富度指数均显著高于裸地(P < 0.05),增幅为20.89%~ 36.31%。多样性指数表现为蒲公英>费菜≈田菁>裸地,丰富度指数表现为费菜>田菁>蒲公英>裸地,4个样地均匀度指数间没有显著差异。说明种植耐盐植物后,土壤微生物种类明显增加,群落结构复杂化。
|
|
表 4 不同处理土壤微生物群落多样性 Table 4 Diversity of soil microbial community under different treatments |
对4个样地处理土壤微生物PLFA进行主成分分析(图 1),结果表明:与土壤微生物PLFA组成相关的2个主成分累计贡献率达96.3%,其中第一主成分(PC1)和第二主成分(PC2)分别解释变量方差的82.9%和13.4%,对PC1起主要作用的微生物PLFA有32个,其中14个与其正相关,18个与其负相关;对PC2起主要作用的微生物PLFA有17个,1个与其正相关,16个与其负相关,有的磷脂脂肪酸之间相关性很大,几乎集中于一条射线。裸地与种植植物样地被明显区分开,裸地位于PC2轴的正向,种植植物样地均位于PC2轴的负向,费菜样地和田菁样地均位于PC1轴的负向,蒲公英样地位于PC1轴的正向,说明裸地与种植植物样地的土壤微生物PLFA组成存在较大差异,蒲公英样地与费菜样地、田菁样地的土壤微生物组成有一定差异,但费菜与田菁样地土壤微生物相似性较高。因此,主成分分析结果也证明了种植3种耐盐植物对土壤微生物群落有较大影响,不同植物品种覆盖的土壤微生物组成也略有不同。

|
LD、FC、TJ、PGY分别代表裸地、费菜、田菁和蒲公英样地 LD, FC, TJ, PGY represent the bare sample plot, the sample plots planted with Sedum aizoon L., Sesbania cannabina(Retz.)Poir., Taraxacum mongolicum Hand.-Mazz., respectively 图 1 不同处理土壤微生物PLFA主成分分析 Figure 1 PCA of soil microbial PLFA under different treatments |
植物、土壤和微生物是相互作用的有机整体。土壤微生物与地上植物息息相关,地上植物会直接或间接地影响土壤微生物量、活动和组成,而土壤微生物又会反过来影响地上植物生长。已有研究表明,植被的类型、数量及种植年限显著影响土壤理化性质和微生物群落结构[30-32]。本研究分析了种植3种耐盐植物对滨海盐土化学性质和微生物群落结构的影响,结果表明,种植植物样地土壤电导率和速效钾含量显著下降,有机质和有效磷含量却显著升高,微生物群落组成也发生改变。这可能是种植植物后,土壤覆盖度好,蒸发量小,而且耐盐植物的生长还可以有选择地吸收一些盐离子,尤其是通过吸收较多钾离子来抵御盐土环境胁迫,使得土壤电导率和速效钾含量下降;另外植物凋落物归还土壤中,可以增加土壤有机质含量,进而使土壤电导率降低,而有机质含量的增加又为土壤微生物生长提供了充足的碳源,更利于多种微生物的繁殖和活动,同时微生物的增加又可以促进土壤有机质的分解和养分释放,使得土壤有效磷含量也升高。因此种植耐盐植物能够对土壤性质改善、养分积累和循环起到调节作用。
土壤微生物作为植物与土壤环境之间沟通的桥梁,其必然受到植物和土壤性质的直接影响。与裸地比较,本研究中种植植物土壤中革兰氏阴性菌、放线菌、AM真菌及微生物总量均升高,这可能是植物根系分泌物介导下,植物根际促生菌在土壤中富集的原因。另外种植植物土壤中革兰氏阳性菌含量及G+/G-显著降低,即细菌趋于向革兰氏阴性菌转变。这与王娟英等[18]、余悦[33]的研究结果一致,可能由于8月份采样时为植物生长旺盛期,植物光合作用和生理代谢活动加强,根系分泌物使土壤有机质增加,而且土壤覆盖度好,环境湿润,更利于革兰氏阴性菌的生长。有学者认为[34-36]革兰氏阴性菌类群对环境变化较敏感,但在富营养条件下革兰氏阴性菌生长比革兰氏阳性菌迅速。邢肖毅[37]研究表明,土壤中G+/G-比值越小,F/B值越大,土壤肥力越高。而本研究中植物样地土壤G+/G-降低,F/B增加,也说明了种植耐盐植物后土壤养分逐渐增加,给微生物生长提供充足的碳源,更有利于微生物的繁殖,同时微生物的增加又可以促进土壤有机质的分解和养分释放,对土壤性质改善、养分积累和循环起调节作用。
PLFA技术已被广泛应用于土壤、堆肥样品、湖泊、海洋沉积物等环境微生物群落结构的研究中,但也存在不足之处,如对特异性微生物类群的鉴定不够准确[38],另外在磷脂脂肪酸鉴定过程中,尽管操作规范严格,但实际操作过程中仍会出现一些偏差,这些因素都会影响脂肪酸组成和含量的检测准确性[39]。为了更全面、更深入地了解耐盐植物种植对土壤微生物群落结构的影响,应结合高通量测序技术进行分析。
4 结论(1)在滨海盐土环境下,种植费菜、田菁和蒲公英3种耐盐植物,不仅可以降低滨海盐土土壤电导率,提高有机质和有效磷含量,还能够增加土壤中革兰氏阴性菌、放线菌、AM真菌、真核生物、真菌的数量,而且能提高土壤微生物多样性,改善土壤微生态环境。
(2)费菜在降低滨海盐土土壤电导率方面效果明显,蒲公英在提高土壤有机质、有效磷含量及微生物群落多样性方面占优势。因此通过种植费菜和蒲公英能够改良滨海盐土。
本研究结果为植物修复河北滨海盐土提供了理论依据。
| [1] |
Zhong W H, Gu T, Wang W, et al. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J]. Plant and Soil, 2010, 326(1/2): 511-522. |
| [2] |
Yanardag I H, Zornoza R, Bastida F, et al. Native soil organic matter conditions the response of microbial communities to organic inputs with different stability[J]. Geoderma, 2017, 295: 1-9. DOI:10.1016/j.geoderma.2017.02.008 |
| [3] |
Creamer C A, De Menezes A B, Krull E S, et al. Microbial community structure mediates response of soil C decomposition to litter addition and warming[J]. Soil Biology and Biochemistry, 2015, 80: 175-188. DOI:10.1016/j.soilbio.2014.10.008 |
| [4] |
Smith A P, Marn-Spiotta E, De Graaff M A, et al. Microbial community structure varies across soil organic matter aggregate pools during tropical land cover change[J]. Soil Biology and Biochemistry, 2014, 77: 292-303. DOI:10.1016/j.soilbio.2014.05.030 |
| [5] |
Kong A Y Y, Scow K M, Córdova-Kreylos A L, et al. Microbial community composition and carbon cycling within soil microenvironments of conventional, low-input, and organic cropping systems[J]. Soil Biol Biochem, 2011, 43: 20-30. DOI:10.1016/j.soilbio.2010.09.005 |
| [6] |
Santos V B, Araújo A S F, Leite L F C, et al. Soil microbial biomass and organic matter fractions during transition from conventional to organic farming systems[J]. Geoderma, 2012, 170: 227-231. DOI:10.1016/j.geoderma.2011.11.007 |
| [7] |
张莉, 党军, 刘伟, 等. 高寒草甸连续围封与施肥对土壤微生物群落结构的影响[J]. 应用生态学报, 2012, 23(11): 3072-3078. ZHANG Li, DANG Jun, LIU Wei, et al. Effects of continuous enclosure and fertilization on soil microbial community structure in alpine meadow[J]. Chinese Journal of Applied Ecology, 2012, 23(11): 3072-3078. |
| [8] |
Alexander K, Bryans T. Evaluation of the sterility test for detection of microbial contaminants of allografts[J]. Cell and Tissue Banking, 2006, 7(1): 23-28. DOI:10.1007/s10561-005-3393-4 |
| [9] |
姚晓东, 王娓, 曾辉. 磷脂脂肪酸法在土壤微生物群落分析中的应用[J]. 微生物学通报, 2016, 43(9): 2086-2095. YAO Xiao-dong, WANG Wei, ZENG Hui. Application of phospholipid fatty acid method in analyzing soil microbial community composition[J]. Microbiology China, 2016, 43(9): 2086-2095. |
| [10] |
李俊, 吴福忠, 杨万勤, 等. 高山草甸冬季凋落物分解过程中土壤动物对微生物群落结构的影响[J]. 应用与环境生物学报, 2016, 22(1): 27-34. LI Jun, WU Fu-zhong, YANG Wan-qin, et al. Effects of soil fauna on microbial community structure in foliar litter during winter decomposition in an alpine meadow[J]. Chinese Journal of Applied & Environmental Biology, 2016, 22(1): 27-34. |
| [11] |
郑雪芳, 刘波, 朱育菁, 等. 磷脂脂肪酸生物标记法分析养猪发酵床微生物群落结构的空间分布[J]. 农业环境科学学报, 2018, 37(4): 804-812. ZHENG Xue-fang, LIU Bo, ZHU Yu-jing, et al. Spatial distribution of microbial communities in a fermentation bed based on phospholipid fatty acid biomarkers[J]. Journal of Agro-Enviroment Science, 2018, 37(4): 804-812. |
| [12] |
王京文, 李丹, 柳俊, 等. 耐镉菌株对土壤镉形态及土壤微生物群落结构的影响[J]. 农业环境科学学报, 2015, 34(9): 1693-1699. WANG Jing-wen, LI Dan, LIU Jun, et al. Effects of cadmium tolerant bacteria on soil cadmium forms and microbial community structure[J]. Journal of Agro-Enviroment Science, 2015, 34(9): 1693-1699. |
| [13] |
兰木羚, 高明. 不同秸秆翻埋还田对旱地和水田土壤微生物群落结构的影响[J]. 环境科学, 2015, 36(11): 4252-4259. LAN Muling, GAO Ming. Influence of different straws returning with landfill on soil microbial community structure under dry and water farming[J]. Environmental Science, 2015, 36(11): 4252-4259. |
| [14] |
方圆, 王娓, 姚晓东, 等. 我国北方温带草地土壤微生物群落组成及其环境影响因素[J]. 北京大学学报, 2017, 53(1): 142-150. FANG Yuan, WANG Wei, YAO Xiao-dong, et al. Soil microbial community composition and environmental controls in northern temperate steppe of China[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2017, 53(1): 142-150. DOI:10.3969/j.issn.1671-167X.2017.01.026 |
| [15] |
李强, 周道玮, 陈笑莹. 地上枯落物的累积、分解及其在陆地生态系统中的作用[J]. 生态学报, 2014, 34(14): 3807-3819. LI Qiang, ZHOU Dao-wei, CHEN Xiao-ying, et al. The accumulation, decomposition and ecological effects above-ground litter in terrestrial ecosystem[J]. Acta Ecologica Sinica, 2014, 34(14): 3807-3819. |
| [16] |
李欣玫, 左易灵, 薛子可, 等. 不同荒漠植物根际土壤微生物群落结构特征[J]. 生态学报, 2018, 38(8): 2855-2863. LI Xin-mei, ZUO Yi-ling, XUE Zi-ke, et al. Characteristics of microbial community structure in rhizosphere soil of different desert plants[J]. Acta Ecologica Sinica, 2018, 38(8): 2855-2863. |
| [17] |
凃月, 李海翔, 姜磊, 等. 广西会仙湿地不同植物根际细菌群落结构及多样性研究[J]. 生态环境学报, 2019, 28(2): 252-261. TU Yue, LI Hai-xiang, JIANG Lei, et al. Bacterial communities structure and diversity in rhizosphere of different plants from Huixian wetland, Guangxi[J]. Ecol Environ Sci, 2019, 28(2): 252-261. |
| [18] |
王娟英, 许佳慧, 吴林坤, 等. 不同连作年限怀牛膝根际土壤理化性质及微生物多样性[J]. 生态学报, 2017, 37(17): 5621-5629. WANG Juan-ying, XU Jia-hui, WU Lin-kun, et al. Analysis of physicochemical properties and microbial diversity in rhizosphere soil of Achranthes bidentata under different cropping years[J]. Acta Ecologica Sinica, 2017, 37(17): 5621-5629. |
| [19] |
刘顺, 吴珍花, 郭晓敏, 等. 不同林龄陈山红心杉土壤微生物群落结构特征[J]. 应用与环境生物学报, 2016, 22(3): 510-517. LIU Shun, WU Zhen-hua, GUO Xiao-min, et al. Soil microbial community structure characteristics of Chenshan red-heart Chinese fir of different stand ages[J]. Chin J Appl Environ Biol, 2016, 22(3): 510-517. |
| [20] |
李新, 焦燕, 杨铭德. 用磷脂脂肪酸(PLFA)谱图技术分析内蒙古河套灌区不同盐碱程度土壤微生物群落多样性[J]. 生态科学, 2014, 33(3): 488-494. LI Xin, JIAO Yan, YANG Ming-de. Microbial diversity of different saline-alkaline soil analyzing by PLFA in the Hetao area of Inner Mongolia[J]. Ecological Science, 2014, 33(3): 488-494. |
| [21] |
张宁.滨海盐碱地起垄种植和地力提升技术结合对土壤生态系统的影响研究[D].济南: 齐鲁工业大学, 2016. ZHANG Ning. The research in effects of Binhai saline-alkali ridging planting and soil fertility level combined effects on soil ecosystem[D].Jinan: Qilu University of Technology, 2016. |
| [22] |
王秀萍, 张国新, 鲁雪林, 等. 费菜的耐盐性及其对滨海盐碱土的改良效果研究[J]. 安徽农业科学, 2010, 38(4): 1796-1799. WANG Xiu-ping, ZHANG Guo-xin, LU Xue-lin, et al. Research on the tolerance of Aizoon Stonecrop Herb to salt and its impact on improvement of coastal saline-alkali soil[J]. Journal of Anhui Agri Sci, 2010, 38(4): 1796-1799. DOI:10.3969/j.issn.0517-6611.2010.04.055 |
| [23] |
刘雅辉, 王秀萍, 刘广明, 等. 滨海盐土区4种典型耐盐植物盐分离子的积累特征[J]. 土壤, 2017, 49(4): 782-788. LIU Ya-hui, WANG Xiu-ping, LIU Guang-ming, et al. Ions absorption and accumulation in four typical salt-tolerant plants in coastal saline soil region[J]. Soils, 2017, 49(4): 782-788. |
| [24] |
刘雅辉, 王秀萍, 左永梅, 等. 蒲公英苗期盐胁迫反应及耐盐阈值的确定[J]. 西北农业学报, 2017, 26(8): 1223-1229. LIU Ya-hui, WANG Xiu-ping, ZUO Yong-mei, et al. Response of dandelion to saline stress and determination of salt-tolerance threshold at seeding stage[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(8): 1223-1229. |
| [25] |
Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry & Physiology, 1959, 37(8): 911. |
| [26] |
Frostegard A, Baath E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils, 1996, 22(1/2): 59-65. |
| [27] |
张秋芳, 刘波, 林营志, 等. 土壤微生物群落磷脂脂肪酸PLFA生物标记多样性[J]. 生态学报, 2009, 29(8): 4127-4136. ZHANG Qiufang, LIU Bo, LIN Ying-zhi, et al. The diversity of phospholipid fatty acid(PLFA)biomarker for the microbial community in soil[J]. Acta Ecologica Sinica, 2009, 29(8): 4127-4136. DOI:10.3321/j.issn:1000-0933.2009.08.014 |
| [28] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000: 30-34. BAO Shi-dan. Soil agrochemical analysis[M]. Beijing: China Agriculture Press, 2000: 30-34. |
| [29] |
朱小林, 梁辰飞, 蔡锡安, 等. 尾叶桉林下5种木本植物土壤微生物群落特征[J]. 生态环境学报, 2015, 24(4): 617-623. ZHU Xiao-lin, LIANG Chen-fei, CAI Xi-an, et al. Soil microbial community characteristics of 5 tree species in Eucalyptus urophylla plantation[J]. Ecol Environ Sci, 2015, 24(4): 617-623. |
| [30] |
Zhang C, Liu G B, Xue S, et al. Effect of different vegetation types on the rhizospheresoil microbial community structure in the Loess Plateau of China[J]. Journal of Integrative Agriculture, 2013, 12(11): 2103-2113. DOI:10.1016/S2095-3119(13)60396-2 |
| [31] |
马书琴, 王小丹, 王荷, 等. 藏北高寒草地土壤磷脂脂肪酸指纹特征及其与土壤化学性质的关系[J]. 生态环境学报, 2017, 26(9): 1480-1487. MA Shu-qin, WANG Xiao-dan, WANG He, et al. Phospholipid fatty acids fingerprint of different grassland soils in north Tibet and their relationship with chemical properties[J]. Ecology and Environmental Sciences, 2017, 26(9): 1480-1487. |
| [32] |
Santonja M, Rancon A, Fromin N, et al. Plant litter diversity increases microbial abundance, fungal diversity, and carbon and nitrogen cycling in a Mediterranean shrubland[J]. Soil Biology and Biochemistry, 2017, 111: 124-134. DOI:10.1016/j.soilbio.2017.04.006 |
| [33] |
余悦.黄河三角洲原生演替中土壤微生物多样性及其与土壤理化性质关系[D].济南: 山东大学, 2012. YU Yue. Relationships between soil microbial diversity and soil physieochemical properties along the primary succession of Yellow River Delta[D].Jinan: Shandong University, 2012. |
| [34] |
Byss M, Elhottová D, Tříska J, et al. Fungal bioremediation of the creosote-contaminated soil:Influence of Pleurotus ostreatus and Irpex lacteus on polycyclic aromatic hydrocarbons removal and soil microbial community composition in the laboratory-scale study[J]. Chemosphere, 2008, 73(9): 1518-1523. DOI:10.1016/j.chemosphere.2008.07.030 |
| [35] |
Huang H, Zhang S, Wu N, et al. Influence of Glomus etunicatum/Zea mays mycorrhiza on atrazine degradation, soil phosphatase and dehydrogenase activities, and soil microbial community structure[J]. Soil Biol Biochem, 2009, 41(4): 726-734. DOI:10.1016/j.soilbio.2009.01.009 |
| [36] |
Djukic I, Zehetner F, Watzinger A, et al. In situ carbon turnover dynamics and the role of soil microorganisms therein:A climate warming study in an Alpine ecosystem[J]. FEMS Microbiol Ecol, 2013, 83(1): 112-124. DOI:10.1111/j.1574-6941.2012.01449.x |
| [37] |
邢肖毅.黄土丘陵区侵蚀环境对土壤氮素及微生物群落结构的影响[D].杨凌: 西北农林科技大学, 2013. XING Xiao-yi. The effects of erosion environment on soil nitrogen and microbial community diversity on the hilly-gully area of Loess Plateau[D].Yangling: Northwest A&F University, 2013. |
| [38] |
高志远, 胡亚亚, 刘兰服, 等. 甘薯连作对根际土壤微生物群落结构的影响[J]. 核农学报, 2019, 33(6): 1248-1255. GAO Zhi-yuan, HU Ya-ya, LIU Lan-fu, et al. The effects of continuous cropping on the microbial community structure of rhizosphere soil of sweetpotato[J]. Journal of Nuclear Agricultural Sciences, 2019, 33(6): 1248-1255. |
| [39] |
王少杰, 左易灵, 薛子可, 等. 蒙古沙冬青深色有隔内生真菌磷脂脂肪酸生物标记[J]. 西北农业学报, 2017, 26(5): 781-789. WANG Shao-jie, ZUO Yi-ling, XUE Zi-ke, et al. Phospholipid fatty acid biomarker of dark septate endophytes in roots of Ammopiptanthus mongolicus [J]. Acta Agriculturae Borereali-occidentalis Sinica, 2017, 26(5): 781-789. |
 2021, Vol. 38
2021, Vol. 38