近年来,随着养殖业和加工产业的快速发展,我国每年产生38亿t以羽毛、蹄、角等为主要形式的畜禽废弃物,产生的畜禽废弃物大都被焚烧或填埋处理,未得到合理利用,不仅污染了环境,而且浪费了宝贵资源[1-2]。
我国的羽毛资源极其丰富,且动物的羽毛、角、蹄中不溶性纤维状的角蛋白含量超过90%,含有近10种氨基酸,且富含维生素、钙和磷等营养物质,在氨基酸饲料产业中应用价值极大[3]。但是这些畜禽废弃物角蛋白由于二硫键高度交联和分子间疏水作用及氢键等相互作用,使其结构极其稳定,很难被一般的蛋白酶制剂(胰蛋白酶、胃蛋白酶)降解[4]。根据X射线衍射分析,角蛋白的空间结构有α-螺旋结构(α-角蛋白)和β-折叠片层结构(β-角蛋白)两种类型。α-角蛋白,如毛发、角、甲、蹄等的蛋白,分子中胱氨酸含量丰富;β-角蛋白主要存在于鸟类及家禽的羽毛纤维中,又称羽毛角蛋白。猪毛角蛋白的二级结构主要为α-螺旋,二硫键多(半胱氨酸含量高),相比羽毛角蛋白(β-螺旋)结构更加稳定,更难降解[5]。角蛋白(畜禽废弃物:羽毛、毛发、角、蹄等)是一种抗降解性很强的蛋白质,大量堆积既造成严重的环境污染,又是极大的资源浪费。角蛋白是一种良好的可替代或部分替代鱼粉的饲料蛋白来源,对角蛋白资源的开发利用既有科学价值又有经济价值。机械法、化学法和生物降解法是最常用的降解角蛋白的方法,但传统的物理及化学处理方法均对反应设备和反应条件要求苛刻,能耗高,且产生三废污染,很难被应用,采用微生物降解角蛋白的方法不仅条件温和、环境污染小,而且可用于生产具有重要应用价值的多肽及氨基酸[5]。
自然环境中存在着大量能够有效利用畜禽废弃物作为自身营养物质生长的微生物,这些微生物能将角蛋白分解成多肽、氨基酸等动物可以消化利用的成分。因此,利用微生物对畜禽废弃物无害化处理是一种环保高效的转化方式,具有巨大发展潜力。目前与羽毛角蛋白相关的研究大都集中在角蛋白降解菌的分离鉴定、角蛋白酶活的研究等方面,已报道能降解畜禽废弃物的微生物包括细菌、真菌和放线菌[6-12],但以构建菌群的形式,集合多种酶促活性高效降解畜禽废弃物的研究鲜有报道。
本研究从某生猪屠宰场周边土壤中取样,筛选到3株猪毛角蛋白高效降解菌株,进行了猪毛角蛋白降解微生物菌群的构建及降解效果研究,并初步探讨其降解机理,以期为猪毛废弃物的无害化处理和资源化利用提供技术支持。
1 材料与方法 1.1 供试材料 1.1.1 样品采集及制备在湖南省某屠宰场长期堆积废弃猪毛的土壤及污泥中采取样品10份,迅速装入无菌袋,冷藏备用。
猪毛前处理:从湖南省某屠宰场采回的新鲜猪毛,在浓度为0.05%的NaOH溶液中浸泡并煮沸30 min,烘干至恒质量备用[5]。
猪毛粉制备:经烘干后的猪毛粉碎,过100目筛后即制成猪毛粉。
1.1.2 培养基酪蛋白固体培养基:酪蛋白10.0 g,牛肉膏3.0 g,NaCl 5.0 g,琼脂20.0 g,pH自然,蒸馏水定容至1 000 mL。
初筛固体培养基:猪毛粉10.0 g,MgSO4 0.1 g,KH2PO4 0.7 g,K2HPO4 1.4 g,NaCl 0.5 g,琼脂20.0,pH自然,蒸馏水定容至1 000 mL。
种子培养基(LB培养基):蛋白胨10.0 g,酵母粉5.0 g,NaCl 10.0 g,pH 7.5,蒸馏水定容至1 000 mL。
高氏1号:可溶性淀粉20.0 g,KNO3 1.0 g,K2HPO4 0.5 g,MgSO4 0.5 g,NaCl 0.5 g,FeSO4 · 7H2O 0.01 g,pH 7.4~7.6,蒸馏水定容至1 000 mL。
发酵培养基:完整猪毛10.0 g,MgSO4 0.1 g,KH2PO4 0.7 g,K2HPO4 1.4 g,NaCl 0.5 g,pH自然,蒸馏水定容至1 000 mL。
1.2 测定分析方法 1.2.1 猪毛降解菌株的分离及筛选产蛋白酶菌株初筛:称取采集的土壤样品10.0 g,添加到内含90 mL无菌水的锥形瓶中,充分振荡均匀,并于30 ℃、180 r·min-1驯化培养96 h,取驯化培养的土壤悬液稀释104、105、106倍后,分别涂布于酪蛋白固体培养基,30 ℃静置培养3~7 d,选取在酪蛋白固体培养基上生长良好且有透明圈的单菌落,利用四分区划线法进一步纯化,纯化后的菌株斜面低温保存备用。
高效猪毛降解菌株的初筛:将上述分离到的菌株活化培养后,接种在以猪毛为唯一碳氮源的初筛培养基上,30 ℃静置培养3~7 d,挑取生长良好、菌落较大且具有不同菌落形态的单菌落,斜面低温保存各菌株,作为复筛菌株备用。
高效猪毛降解菌株的摇瓶复筛:将上述分离到的菌株经活化培养后,按2%的接种量接种至含有完整猪毛的发酵培养基中(以猪毛为唯一碳氮源),并于30 ℃、180 r·min-1振荡培养,每日观察发酵液中完整猪毛的降解程度,每个处理重复3次。
1.2.2 高效猪毛降解菌株对α、β角蛋白的降解效果分析为验证高效猪毛降解菌株对α角蛋白、β角蛋白的降解情况,分别以猪毛、鸡毛、鹅毛和羊毛为底物进行降解试验。将复筛得到的高效猪毛降解菌株,接种至种子培养基中,获得活菌数为1×109 CFU·mL-1的种子液。将种子液以2%的接种量分别接种到以猪毛、鸡毛、鹅毛和羊毛为唯一碳氮源的发酵培养基中,猪毛、鸡毛、鹅毛和羊毛的底物浓度为10 g·L-1,于30 ℃、180 r·min-1振荡培养,发酵培养5~10 d,观察角蛋白降解菌株对猪毛、鸡毛、鹅毛和羊毛的降解效果,每个处理重复3次。
1.2.3 降解效果的测定(2)失重法测定猪毛或鸡毛降解率[5]:将新鲜猪毛、鸡毛、鹅毛和羊毛干燥至恒质量后,分别添加至发酵培养基中发酵。发酵完成后,滤去发酵液并将其发酵后的底物基质抽滤,收集残渣并干燥至恒质量,利用失重法分别测定猪毛、鸡毛、鹅毛和羊毛的降解率,每个处理重复3次。
1.2.4 猪毛降解菌群的构建(1)高效猪毛降解菌的拮抗实验:将复筛获得的3株猪毛降解效果良好的菌株活化培养,并通过平板对峙实验(培养3 d)检测不同猪毛降解菌株间是否具有拮抗作用[15]。
(2)组合菌群对猪毛降解效果的研究:将复筛获得的3株猪毛降解效果稳定且降解效果好的菌株进行菌群构建。分别将3株菌活化培养后制备一定浓度的菌悬液(1×109 CFU·mL-1),根据菌株生长特性和降解效果排列组合,构建出4组不同的组合菌群(C1:E-2-2,E-1-4;C2:E-2-2,E-3-2;C3:E-1-4,E-3-2;C4:E-2-2,E-3-2,E-1-4),每个组合菌群中的菌株均为等比例(体积比)混和,按2%的接种量接种于装有100 mL发酵培养基的500 mL的锥形瓶中,于30 ℃、180 r·min-1,振荡培养10 d。通过测定培养物的猪毛降解率和角蛋白酶活,筛选出最佳组合菌群,并比较其与单菌株猪毛降解率和角蛋白酶活的差异,每个处理重复3次。
1.2.5 高效猪毛降解菌的分子鉴定及其系统发育分析将复筛获得的3株高效猪毛降解菌株接种至初筛固体培养基上,待菌落形成后,分别观察各菌株的菌落形态,并通过油镜观察(简单染色)各菌株的菌体形态。采用Ezup柱式细菌基因组DNA抽提试剂盒(生工生物工程(上海)股份有限公司)提取各菌株的基因组DNA,以其为模板PCR扩增各个菌株的16S rDNA序列。采用16S rDNA通用引物27F:5′-AGAGTTT-GATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGT-TACGACTT-3′进行PCR扩增。PCR反应条件:95 ℃预变性3 min;95 ℃变性45 s,56 ℃退火45 s,72 ℃延伸90 s,反应进行30个循环;最后72 ℃延伸10 min,4 ℃终止。将PCR产物回收纯化后交由生工生物工程(上海)股份有限公司进行DNA测序,将测得的DNA序列通过NCBI的BLAST程序进行同源性分析。并选取一些亲缘关系相近的菌株利用DNAStar构建系统进化树。
1.2.6 高效猪毛降解菌株降解猪毛角蛋白产物分析活化培养3株高效猪毛降解菌株,分别制备浓度为1.0×109 CFU·mL-1的种子液,并将种子液以2%的接种量接种到发酵培养基中,于30 ℃、180 r·min-1振荡培养,分别在第10 d测定发酵上清液中可溶性蛋白含量、各种含硫化合物(巯基化合物、硫酸盐、亚硫酸盐)含量,每个处理重复3次。可溶性蛋白含量的测定参照齐志国等[16]研究中介绍的方法进行,发酵上清液中各种含硫化合物的含量测定参照黄林等[17]研究的方法进行。
1.2.7 数据分析试验数据利用Microsoft Excel 2003进行初步计算,以平均值±标准差表示,并绘图;利用软件SPSS 18.0对数据进行统计分析,数据间差异显著性采用ANOVA方法进行分析。
2 结果与分析 2.1 猪毛降解菌株的筛选通过产蛋白酶菌株的初筛,共获得18株能够在酪蛋白平板上产生较大透明圈的菌株。将其单菌落分别转接至以猪毛为唯一碳源的平板上,筛选出10株生长良好且菌落形态不同的菌株;将筛选到的10株菌株进一步接种至以猪毛为唯一碳源的锥形瓶中复筛(10 d),共获得3株(E-2-2,E-1-4,E-3-2)猪毛降解效果良好且稳定的菌株。3株菌株在酪蛋白平板上透明圈的直径(D)均在大于19 mm,菌落直径(d)均大于5 mm(图 1),其中E-2-2的D/d最大值为4.4(表 1)。

|
图 1 角蛋白降解菌株的筛选结果 Figure 1 Screening of keratin degradation strains |
|
|
表 1 角蛋白降解菌株的直径 Table 1 Diameters of keratin degradation strains |
经驯化筛选,共获得3株猪毛降解效果稳定且降解效果好的菌株,与对照相比,3株菌株发酵培养至第10 d,各锥形瓶中的猪毛、鸡毛、鹅毛、羊毛均明显得到降解,各个培养瓶中培养液明显变浑浊,菌体生长旺盛。单一菌株对猪毛和羊毛的降解率(10 d)均超过45%,其中对鸡毛和鹅毛的降解率(10 d)均超过87%,且角蛋白酶活与降解率呈正相关,各个菌株之间降解率和角蛋白酶活差异显著。在获得的3株高效降解菌株中,E-2-2菌株对猪毛、鸡毛、鹅毛和羊毛的降解率最高,降解效果显著强于其他菌株(表 2)。结果表明,驯化筛选到的3株菌株对不同来源的角蛋白均具有较好的降解效果,均为广谱高效的角蛋白降解菌,其中E-2-2的效果最佳。
|
|
表 2 单一菌株猪毛、鸡毛、鹅毛、羊毛的降解率及角蛋白酶活的测定 Table 2 The determination of pig hair, chicken feathers, goose feathers, and wool degradation rate and keratinase activity from the single strain |
平板对峙试验的结果表明,筛选获得的猪毛降解效果稳定且降解效果好的3株菌株,各个菌株间均无拮抗作用(图 2)。

|
图 2 猪毛降解菌株平板对峙试验 Figure 2 Plate confrontation experiment of pig hair degrading strain |
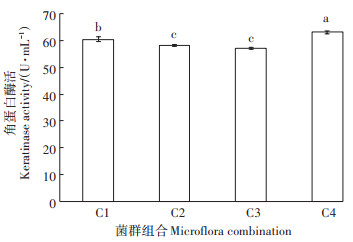
利用筛选获得的3株猪毛高效降解菌株,构建4个组合菌群(C1:E-2-2,E-1-4;C2:E-2-2,E-3-2;C3:E-1-4,E-3-2;C4:E-2-2,E-3-2,E-1-4),结果表明,在获得的4个组合菌群中,其猪毛降解率均高于单一菌株,其中C4效果最好,猪毛降解率(10 d)达到81.8%,C1、C2、C3的猪毛降解率(10 d)均超过69.0%,且不同菌株组合之间差异显著(图 3),其角蛋白酶活与降解率呈正相关,组合C4的角蛋白酶活最高,C4与其他菌群组合间差异显著(图 4)。

|
图 3 不同菌群组合的猪毛降解率 Figure 3 Degradation rate of pig hair of different microflora combination |
|
图 4 不同菌群组合的角蛋白酶活 Figure 4 Keratinase activity of different microflora combination |
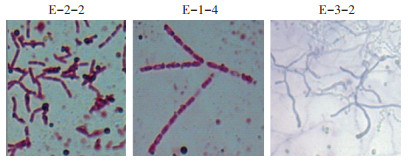
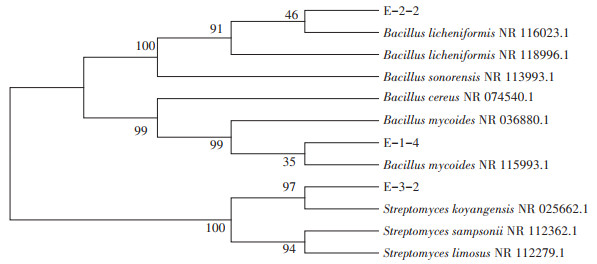
分别对3株高效猪毛降解菌株(E-2-2、E-1-4和E-3-2)的菌落及菌体形态进行了观察(图 5)。E-2-2菌落呈圆形,边缘呈锯齿状,表面非黏稠,菌体呈长杆状,产芽孢,革兰氏染色阳性。E-1-4菌落呈圆形,乳白色,粗糙,有皱折,不透明,菌体呈长杆状,具圆端,链状排列,革兰氏染色阳性。E-3-2菌落小而致密、干而不透明,边缘整齐,镜下形态菌丝细长,且有大量分枝,革兰氏染色阳性。将测序后的16S rDNA序列提交至GenBank数据库,并在NCBI通过BLAST分析,根据同源性的比对结果,利用DNAStar构建基于16S rDNA的系统发育树。结果表明,菌株E-2-2、E-1-4和E-3-2分别与地衣芽孢杆菌[Bacillus licheniformis(NR 116023.1)]、蕈状芽孢杆菌[Bacillus mycoides(NR 036880.1)]和链霉菌[Streptomyces koyangensis(NR 025662.1)]亲缘关系最近,其同源性均超过99%(图 6)。结合菌株形态特征、生理生化特征及系统发育分析,菌株E-2-2、E-1-4和E-3-2分别初步鉴定为地衣芽孢杆菌(Bacillus licheniformis)、蕈状芽孢杆菌(Bacillus mycoides)和链霉菌(Streptomyces koyangensis)。
|
图 5 猪毛降解菌株的菌体形态 Figure 5 The morphological examination of pig hair degrading strains |
|
图 6 猪毛降解菌株的16S rDNA序列系统发育树 Figure 6 Phylogenetic tree based on the 16S rDNA sequence of pig hair degrading strains |
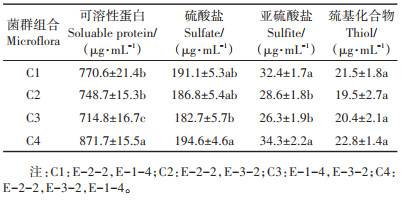
在以猪毛为唯一碳氮源的培养基中,组合菌群发酵培养10 d,各锥形瓶中的猪毛均明显得到降解,对其发酵产物进一步分析表明,发酵产物中产生了大量的可溶性蛋白,浓度高达871.7 μg·mL-1,同时含有大量的硫酸盐、亚硫酸盐和巯基化合物等含硫化合物,以硫酸盐居多,浓度高达194.6 μg·mL-1。组合C4可溶性蛋白及含硫化合物的浓度最高,可溶性蛋白含量高于与其他菌群组合,且差异显著(表 3)。
|
|
表 3 角蛋白降解过程中可溶性蛋白及含硫化合物的浓度 Table 3 Concentration of soluable protein and sulfur compounds during degradation of keratin |
角蛋白在分子内和分子间存在二硫键、氢键、配位键和范德华力等多种键能,三维构象高度交联,性质稳定,不容易被普通的蛋白酶(胃蛋白酶、胰蛋白酶)水解,因此给资源化利用带来了困难[5]。利用物理化学方法处理角蛋白具有能耗高、污染环境的缺点。利用微生物降解不同来源的畜禽废弃角蛋白不仅可以改善生态环境,而且可以增加氨基酸饲料的供给量,变废为宝。迄今为止,已有细菌、真菌和放线菌等多种降解角蛋白的微生物被分离纯化。
本研究筛选到的高效降解角蛋白的功能菌株对不同来源的角蛋白(α-角蛋白和β-角蛋白)均表现出了较好的降解效果,应用范围广泛[13]。目前有关角蛋白降解菌株的筛选和应用研究较少,而且多为单一菌株的降解研究,功能菌株降解菌群对角蛋白降解,特别是猪毛降解效果的研究鲜有报道。本研究利用筛选到的3株高效猪毛降解菌株(相互之间无拮抗),构建了4个微生物降解体系,通过与单一菌株降解猪毛的效果及角蛋白酶活比较,结果表明,组合菌群4(C4)的降解效果最好,猪毛降解率(10 d)高达81.8%,比单一菌株的猪毛降解率(10 d)最多提高了23.8个百分点。由此可见,构建的猪毛降解菌群对猪毛角蛋白的降解效果明显优于单一菌株,可能是由于参与猪毛角蛋白降解的多功能酶系在不同菌株中不同,如链霉菌的角蛋白酶为多酶复合体,而地衣芽孢杆菌的角蛋白酶为多功能酶[18]。角蛋白酶降解角蛋白的作用机制在不同菌株中也各不相同,其生成产物中,可溶性蛋白质和氨基酸的种类也存在差异[19]。因此,利用多种高活性的产角蛋白酶的菌株进行混菌协同发酵,不仅可以提高角蛋白的降解效果,缩短发酵周期,而且还能互补促进产物中氨基酸平衡,提高有效利用率。因此,在本研究的混合发酵中,不同菌株组合后,角蛋白酶活大大提高,主要是因为不同功能菌株之间降解作用相互促进,使得有效酶系协同增效,有效提高多酶体系或多功能酶的降解效果[13]。与单一菌株发酵相比,混菌发酵具有更为广阔的应用发展前景[12-15]。因此本研究不仅丰富了猪毛角蛋白降解的菌株资源,而且还拓展了废弃角蛋白综合利用的研究思路,具有较好的应用潜力。
微生物降解角蛋白过程中,首先破坏角蛋白结构中起稳定作用的二硫键,将角蛋白初步变性。然后在水解酶的作用下,将角蛋白进一步分解为多肽、氨基酸等小分子物质[20]。降解角蛋白的过程中,起关键作用的是二硫键的断裂,断裂后的二硫键以含硫化合物的形式存在于发酵产物中。角蛋白二硫键的断裂途径主要有三种,即二硫键还原酶裂解途径、真菌菌丝体机械穿透裂解途径、亚硫酸盐裂解途径等[5],本研究中猪毛降解菌群是否兼具三种裂解途径,它们是怎样起作用的,还需要对功能菌株菌群降解角蛋白的分子机理进一步研究。
4 结论(1)筛选到3株猪毛角蛋白高效降解菌株,分别鉴定为地衣芽孢杆菌(Bacillus licheniformis)、蕈状芽孢杆菌(Bacillus mycoides)和链霉菌(Streptomyces koyangensis)。
(2)3株菌株均为广谱高效的角蛋白降解菌,对α-角蛋白和β-角蛋白均表现出较好的降解效果。
(3)猪毛降解菌群对猪毛角蛋白的降解效果明显优于单一菌株,且在降解产物中发现大量的可溶性蛋白、含硫化合物等物质。
| [1] |
张晓玮.角蛋白降解菌的分离、鉴定及其角蛋白酶的性质和应用研究[D].济南: 山东大学, 2016. ZHANG Xiao-wei. Isolation and identification of keratinase-producing bacterium and properties and application of keralinase[D]. Jinan: Shandong University, 2016. |
| [2] |
Khosa M A, Ullah A. In-situ modification, regeneration, and application of keratin biopolymer for arsenic removal[J]. Journal of Hazardous Materials, 2014, 278: 360-371. DOI:10.1016/j.jhazmat.2014.06.023 |
| [3] |
贾如琰, 何玉凤, 王荣民, 等. 角蛋白的分子构成、提取及应用[J]. 化学通报, 2008, 71(4): 265-271. JIA Ru-yan, HE Yu-feng, WANG Rong-min, et al. Advanced in structure, extract and applications of keratins[J]. Chemistry Bulletin, 2008, 71(4): 265-271. |
| [4] |
周童娜, 杨文翰, 赵江婷, 等. 一株家禽羽毛角蛋白降解菌的分离与鉴定[J]. 家畜生态学报, 2015, 36(11): 37-41, 51. ZHOU Tong-na, YANG Wen-han, ZHAO Jiang-ting, et al. Isolation, identification and characterization of one strain of new feather-degrading bacteria[J]. Acta Ecologiae Animalis Domastici, 2015, 36(11): 37-41, 51. |
| [5] |
刘标, 尹红梅, 刘惠知. 猪毛角蛋白降解菌的分离筛选及其降解特性研究[J]. 农业工程学报, 2019, 35(7): 311-316. LIU Biao, YIN Hong-mei, LIU Hui-zhi. Isolation and identification of pig hair keratin-degrading strain and its degradation characteristic[J]. Transactions of the Chinese Society of Agricultural Engineering, 2019, 35(7): 311-316. |
| [6] |
Daroit D J, Corrêa A P F, Brandelli A. Keratinolytic potential of a novel Bacillus sp. P45 isolated from the Amazon basin fish Piaractus mesopotamicus[J]. International Biodeterioration & Biodegradation, 2009, 63(3): 358-363. |
| [7] |
Poopathi S, Thirugnanasambantham K, Mani C, et al. Purification and characterization of keratinase from feather degrading bacterium useful for mosquito control:A new report[J]. Tropical Biomedicine, 2014, 31(1): 97-109. |
| [8] |
岳寿松, 边斐, 贾嘉元, 等. 羽毛降解菌的分离及多样性分析[J]. 山东农业科学, 2014, 46(2): 68-71. YUE Shou-song, BIAN Fei, JIA Jia-yuan, et al. Isolation and phylogenetic diversity analysis of feather-degrading bacteria[J]. Shandong Agricultural Sciences, 2014, 46(2): 68-71. |
| [9] |
李金婷, 路福平, 李玉, 等. 高效降解羽毛角蛋白菌株的筛选与鉴定[J]. 天津科技大学学报, 2010, 25(6): 14-17, 29. LI Jin-ting, LU Fu-ping, LI Yu, et al. Screening and identification of a high efficient keratin degrading strain[J]. Journal of Tianjin University of Science & Technology, 2010, 25(6): 14-17, 29. |
| [10] |
Cedrola S M L, de Melo A C N, Mazotto A M, et al. Keratinases and sulfide from Bacillus subtilis SLC to recycle feather waste[J]. World Journal of Microbiology and Biotechnology, 2012, 28(3): 1259-1269. DOI:10.1007/s11274-011-0930-0 |
| [11] |
Wang L Y, Chen G Y, Ren Y X, et al. Degradation of intact chicken feathers by Thermo actinomyces sp. CDF and characterization of its keratinolytic protease[J]. Applied Microbiology and Biotechnology, 2015, 99(9): 3949-3959. DOI:10.1007/s00253-014-6207-4 |
| [12] |
Cavello I A, Chesini M, Hours R A, et al. Study of the production of alkaline keratinases in submerged cultures as an alternative for solid waste treatment generated in leather technology[J]. Journal of Microbiology and Biotechnology, 2013, 23(7): 1004-1014. DOI:10.4014/jmb.1211.11016 |
| [13] |
Ghaffar I, Imtiaz A, Hussain A, et al. Microbial production and industrial applications of keratinases:An overview[J]. Int Microbiol, 2018, 21(4): 163-174. DOI:10.1007/s10123-018-0022-1 |
| [14] |
杜永凯.解淀粉芽孢杆菌降解角蛋白机制的初步研究[D].北京: 中国农业科学院, 2017. DU Yong-kai. Preliminary study of keratin segradation mechanism of Bacillus amyloliquefaciens[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. |
| [15] |
秦涵淳, 杨腊英, 李松伟, 等. 香蕉镰刀菌枯萎病拮抗放线菌的分离筛选及其抑制效果的初步评价[J]. 中国生物防治, 2010, 26(2): 174-180. QIN Han-chun, YANG La-ying, LI Song-wei, et al. Isolation of antagonistic actinomyces against Banana Fusarium wilt disease and primary evaluation on their inhibition effects[J]. Chinese Journal of Biological Control, 2010, 26(2): 174-180. |
| [16] |
齐志国, 张铁鹰, 董杰丽, 等. 角蛋白降解菌分离、鉴定及其降解机制研究[J]. 饲料工业, 2012, 33(17): 19-24. QI Zhi-guo, ZHANG Tie-ying, DONG Jie-li, et al. Research on isolation and identification of keratin-degrading bacterial and its degradation mechanism[J]. Feed Industry, 2012, 33(17): 19-24. |
| [17] |
黄林, 熊智强, 蔡华静, 等. 链霉菌降解角蛋白的生化机制研究[J]. 微生物学通报, 2006, 33(4): 36-42. HUANG Lin, XIONG Zhi-qiang, CAI Hua-jing, et al. Study on the biochemical mechanism of degrading keratins by Streptomyces fradiae[J]. Microbiology China, 2006, 33(4): 36-42. |
| [18] |
朱晓飞, 张玲, 赵平芝, 等. 链霉菌B221的角蛋白降解机制初探[J]. 中国农学通报, 2007, 23(6): 18-22. ZHU Xiao-fei, ZHANG Ling, ZHAO Ping-zhi, et al. Mechanism of keratin degradation by Streptomycete sp. B221[J]. Chinese Agricultural Science Bulletin, 2007, 23(6): 18-22. |
| [19] |
葛梦娇, 尹军霞, 王李忻, 等. 高效协同降解羽毛复合菌系的筛选和鉴定[J]. 饲料研究, 2017(2): 44-47. GE Meng-jiao, YIN Jun-xia, WANG Li-xi, et al. The screening and identification of the highly effective synergistic biodegradable feather complex system[J]. Feed Research, 2017(2): 44-47. |
| [20] |
Mitola G, Escalona F, Salas R, et al. Morphological characterization of in-vitro human hair keratinolysis, produced by identified wild strains of Chrysosporium species[J]. Mycopathologia, 2003, 156(3): 163-169. DOI:10.1023/A:1023340826584 |
 2020, Vol. 37
2020, Vol. 37