随着我国工业化和城市化进程的加快,特别是矿山开采、金属冶炼、电镀等行业的蓬勃发展,导致大量金属元素被释放到土壤环境系统中[1]。金属含量的升高可能对土壤环境中的生物产生负面影响,并能通过食物链或直接摄取等方式对人体健康造成风险,因此,评价土壤金属的生物毒性,控制环境中金属风险尤为重要[2-5]。目前,针对土壤重金属污染物及其相关风险国内外都开展了大量研究,并在此基础上建立了土壤污染物生态风险基准/标准。近年来,美国能源部橡树岭实验室针对污染土壤的评估等相关问题做了大量基础性工作,制定了土壤生态受体毒性基准(SERTC),并得到了广泛的应用,该实验室针对不同土壤生态受体制定了10种金属元素的生态毒性基准,然而自然界中的金属种类很多,仍有50余种金属尚未颁布相关生态毒性基准值。但获得这些金属的生态毒性基准值需通过大量毒理学试验,会耗费大量的人力、物力和财力,并且在复杂的受体生物体系中,金属的形态难以准确分析测定,因此,掌握金属毒性与金属本身特性之间的关系,构建一种不依赖于毒理学试验的金属基准预测方法显得尤为重要。
定量构效关系(QSARs)是指定量表征有机污染物分子结构与其活性之间的数学模型[6],该模型通过理论计算方法和统计分析工具相结合的方式来建立有机物的理化性质与其生物活性之间的关系,从而实现对未知化合物生物活性预测的功能。QSARs通常应用在有机物领域。定量离子特征参数-活性关系(QICAR)模型是QSARs模型的发展延续,主要探索无机物的理化性质与其生物活性之间的关系,目前被成功应用于各种生物类群[7-8]。Walker等[9-10]对QICAR模型进行了大量研究,结果发现金属的物理化学结构参数与其毒性之间确实存在某种关系,利用这种关系可以预测金属离子的毒性;Khangarot等[11]测定23种金属离子对大型蚤的活动抑制作用,结果发现电负性(Xm)和软指数(σp)与金属离子毒性具有很好的相关性;近年来,Wu等[12]和Chen等[13-14]将QSAR模型和物种敏感度分布法相结合,预测了一系列淡水及海水中生物的金属水质基准浓度,为确定其他金属的水质基准提供了重要的参考价值。截至目前,已有30余种金属离子理化参数被提出,分别表征了金属离子的水解、电离、软硬度和几何特征[9-10]。总体而言,QICAR模型能够减少大量金属毒理学试验,为制定金属相关标准提供参考依据。然而,由于土壤中金属毒性较水体复杂,关于土壤生物毒性及基准的数据累积也相对较少,因此,QICAR模型用于土壤基准的研究还鲜见报道。
美国能源部橡树岭实验室制定的土壤生态受体毒性基准是被国际上普遍认可的污染土壤生态风险评估标准,本研究选择了美国能源部橡树岭实验室制定的土壤生态受体毒性基准浓度数据,探索金属离子特征参数与土壤生态受体毒性基准值之间的关系,在此基础上构建QICAR预测模型,以期为深入理解金属毒性机理、制定土壤生态金属毒性基准提供参考。
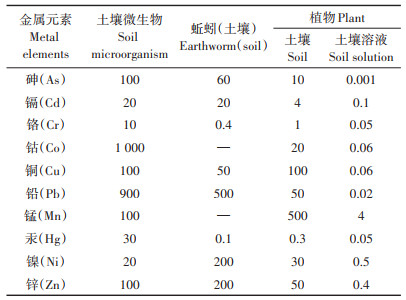
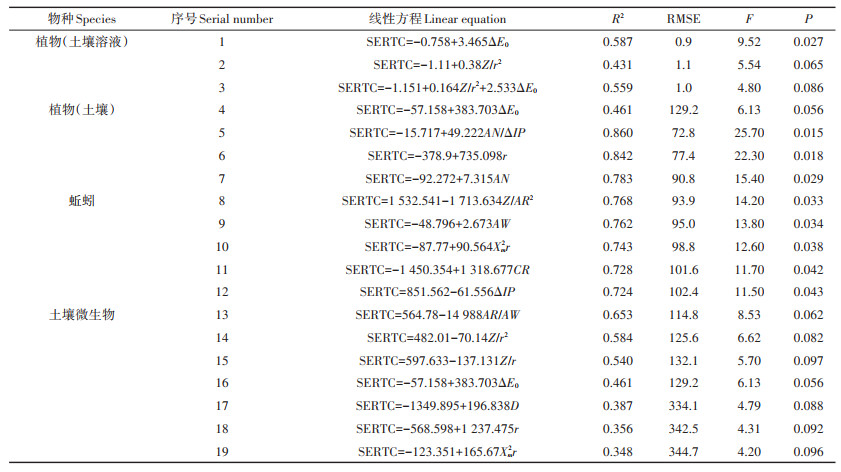
1 材料与方法 1.1 土壤金属毒性基准土壤毒性基准数据来自美国能源部橡树岭实验室制定的土壤生态受体毒性基准,其中包含了10种金属生态毒性基准值,即钴(Co)、铜(Cu)、铅(Pb)、镍(Ni)、锌(Zn)、铬(Cr)、锰(Mn)、砷(As)、镉(Cd)、汞(Hg),以这10种金属作为样本元素,建模物种包括:土壤微生物、土壤动物(蚯蚓)、土壤植物(基准值分别以植物在土壤和土壤溶液中的金属浓度表示),植物在土壤中的金属基准浓度记为植物(土壤),在土壤溶液中记为植物(土壤溶液),表 1是10种金属的土壤生态金属毒性基准浓度值[15]。
|
|
表 1 美国能源部橡树岭实验室制定的土壤生态受体毒性基准(SERTC)(mg·kg-1) Table 1 Soil metal toxicity concentration in SERTC(mg·kg-1) |
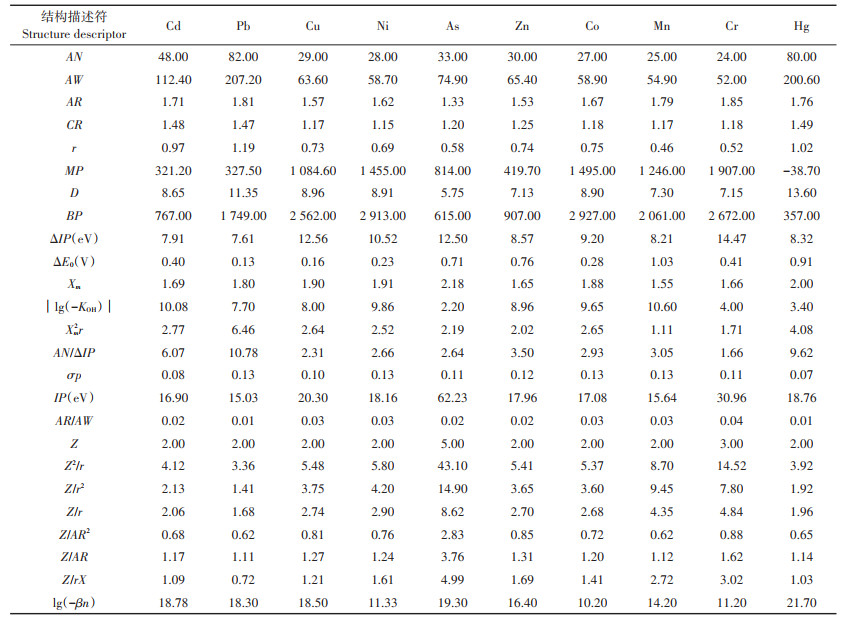
元素结构可以通过某些结构参数来描述,例如,亲水性参数、亲电性参数、拓扑结构参数、立体结构参数和量子化学参数等[9]。利用QICAR建立结构参数与生物活性之间的模型,需要把物质结构表示为数字的形式作为解释变量,这种用来反映物质结构的数字形式称为结构描述符。本研究选择与金属生态毒性效应有关的结构描述符建立QICAR模型,共包括25种结构描述符,分别为表征几何构型的原子序数AN、原子半径AR、共价半径CR、离子半径r、相对原子质量AW、电子密度AR/AW[16-18],表征热稳定性的熔点MP、沸点BP、300 K时的密度D,表征金属离子亲电性的离子价态Z、标准氧化还原电位ΔE0、电离势IP、电离势差ΔIP、原子电离势AN/ΔIP、电负性Xm、共价键指数Xm2r、极化力参数(Z/r、Z/r2、Z2/r)、类极化力参数(Z/AR、Z/AR2)、最大配合物稳定常数lg(-βn)[12, 19],表征亲水性的第一水解常数│lg(-KOH)|、软指数σp、离子相对柔软度Z/rx[20-22]。表 2是10种元素的25种物理化学结构参数。
|
|
表 2 10种金属元素的25种物理化学结构参数 Table 2 25 physicochemical properties structural parameters of 10 metals |
将25组金属离子结构描述符与10种土壤生态毒性基准值进行皮尔森相关性分析,得到相关系数(r)和显著性水平(P)等。在统计学角度,P < 0.1认为具有相关性。选取相关的理化性质参数(P < 0.1)作为最优结构描述符,以最优结构描述符为自变量,土壤基准值作为因变量,通过单变量线性回归构建金属毒性基准值与内在性质之间的关系。Pearson等[20]提出基于软硬离子分组的金属在性质上具有更大的相似性,为进一步揭示金属内在性质与其毒性机理,基于Pearson等[20]的软硬酸碱理论(HSAB)将金属离子分为硬离子、边界离子和软离子。其中,样本元素中Co、Cu、Pb、Ni、Zn为边界离子;Cr、Mn为硬离子;As、Cd、Hg为软离子。由于软硬离子的样本数量较少,不具有统计学意义,边界离子性质又介于软硬离子之间,因此,本研究将软硬离子分别与边界离子组合,从而将金属离子分为三组:边界离子、边界离子+硬离子及边界离子+软离子,然后分别探索每组金属离子内在结构参数与其毒性基准值间的关系。
为进一步探索金属不同理化性质参数在毒性中的作用,在单因素分析的基础上,建立了多变量线性回归方程。在构建多变量QICAR模型时,某些金属离子特征参数中存在大量的具有自相关性的参数,很难进行回归分析。主成分分析(PCA)是一种基于变量之间相关性的数据压缩方法,将多指标问题转化为较少的综合指标,是非常重要的多元数据分析方法。本研究采用PCA对存在相关性的参数进行降维,减少参数间的自相关性系数,获得准确的回归关系。基于调整后的决定系数(R2)、均方根误差(RMSE)、F统计量等,将单变量与多变量线性QICAR方程进行比较,最终得到能够较好地反映金属离子内在性质与其毒性基准值之间关系的QICAR模型。
1.4 数据统计与分析方法模型表征采用回归显著性和拟合效果检验,其中回归方程显著性检验通过方差分析(ANOVA)判定,得出相应的F值和P值;拟合效果通过拟合优度判断,相关统计学指标包括:调整后的决定系数、均方根误差,所有的统计分析均采用SPSS 24.0软件。
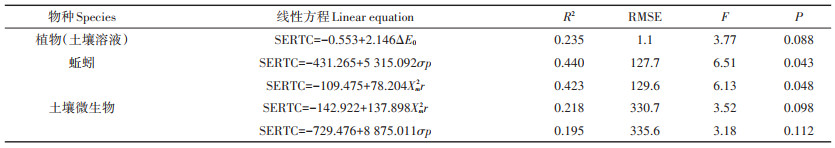
2 结果与讨论 2.1 基于SERTC所有金属离子的QICAR模型对所有金属离子(n=10)的金属毒性基准值与25种金属理化性质参数进行皮尔森相关分析,结果见表 3。由表 3可见,3个参数(ΔE0、Xm2r、σp)与土壤生态毒性基准值表现出线性关系,其中σp相关性最好(R2=0.440,F=6.51,P < 0.1),但总体拟合效果也较低,说明若建立全部金属离子与结构参数之间的关系,则效果较差。Chen等[13]研究表明,软离子和硬离子的生态毒性基准值与结构参数的关系相差较大,因此不同类型的金属离子产生毒性的决定因素不同。基于此,本研究基于软、硬离子的理化性质分别建立了边界离子、边界离子+硬离子及边界离子+软离子的结构参数与生态毒性基准值之间的关系。
|
|
表 3 元素理化性质与SERTC中10种金属离子推荐值的线性回归模型 Table 3 Linear regression models of physicochemical properties and soil ecological receptor toxicity criteria(SERTC)for 10 metal ions |
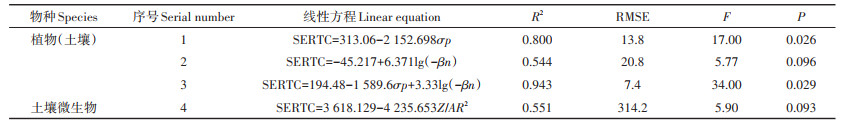
植物(土壤)和土壤微生物的毒性基准值与25种结构参数的分析结果及QICAR方程如表 4所示。由于蚯蚓的边界离子样本量小于5(n < 5),不具有统计意义,因此未分析蚯蚓的基准值与金属结构参数间的关系。由表 4可见,3种结构参数σp、lg(-βn)及Z/AR2与金属毒性基准值显著相关。Z/AR2与土壤微生物的毒性基准值R2为0.551(F=5.90,P < 0.1);对植物(土壤)而言,σp和lg(-βn)与毒性基准值显著相关,R2分别为0.800(F=17.0,P < 0.05)和0.544(F=5.77,P < 0.1)。Chen等[13]研究认为,很难只通过一种结构参数有效表征不同性质的金属。因此,本研究基于植物(土壤)的毒性基准值得到多变量QICAR方程,其拟合效果最好,R2高达0.943(F=34.0,P < 0.05),表明毒性基准值与σp和lg(-βn)均有线性关系。
|
|
表 4 元素理化性质与SERTC中边界离子推荐值的线性回归模型(n=5) Table 4 Linear regression model of physicochemical properties and recommended values of boundary ions in SERTC(n=5) |
软指数(σp)反映了不同金属离子供给电子的能力,一般软离子与不同原子配体的结合能力为S>N>O[23]。σp与金属毒性基准值相关可能是因为某些软离子进入生物体内能够与酶活性中心的巯基(-SH)相结合,导致酶活性降低,从而引起生物产生毒性效应。Chen等[13-14]在研究金属离子对水生生物Americamysis bahia的急性毒性时也发现了类似的规律。配合物稳定常数lg(-βn)表示金属离子与氰离子(CN-)、乙二胺四乙酸(EDTA)及硫氰根离子(SCN-)形成配合物的最大结合能,反映金属离子与含氧基团结合的倾向,其与土壤微生物的金属毒性基准值相关,表明羟基等官能团可能介导金属对生物的致毒过程。Wu等[12]研究发现lg(-βn)与Arthropoda的金属毒性具有显著的相关性,并利用lg(-βn)准确预测了其他未知毒性金属对Arthropoda的毒性效应。本研究得出能够较好地反映植物(土壤)和土壤微生物的金属离子内在性质与其毒性基准值之间关系的QICAR模型分别为方程3和方程4(表 4)
2.3 基于边界离子+硬离子的QICAR模型三种土壤生物的边界离子+硬离子的毒性基准值与25种结构参数的相关分析结果及单变量线性QICAR方程见表 5。结果发现,AN/ΔIP与植物(土壤)的毒性基准值拟合效果最好,R2为0.860(F=25.7,P < 0.05);ΔE0与植物(溶液)的基准值间的拟合效果最好,R2=0.587(F=9.52,P < 0.05);对蚯蚓来说,Z/AR2与其金属毒性基准值的相关性最显著,R2为0.768(F=14.2,P < 0.05);土壤微生物的基准值与AR/AW具有较好的线性相关,R2=0.653(F=8.53,P < 0.1),表明不同的土壤生物与其相关的金属结构参数的致毒机理可能不同。
|
|
表 5 元素理化性质与SERTC中边界离子+硬离子推荐值的线性回归方程(n=7) Table 5 Linear regression model of physicochemical properties and recommended values of boundary ions+hard ions in SERTC(n=7) |
原子电离势(AN/ΔIP)表征了金属离子形成共价键相对于离子键的难易程度,其中ΔIP反映了电子的亲和性,其机理可能是金属离子的轨道影响了细胞膜的流动性,导致生物细胞损伤。Chen等[13-14]在研究金属离子对微生物的吸附能力时也发现了硬金属离子的AN/ΔIP与生物吸附能力间具有显著相关性。Wang等[24]和Zamil等[25]也发现AR/AW、ΔE0、Z/AR2等参数与水体的连续基准浓度推荐值(CMCs)及微生物的吸附能力存在线性相关。
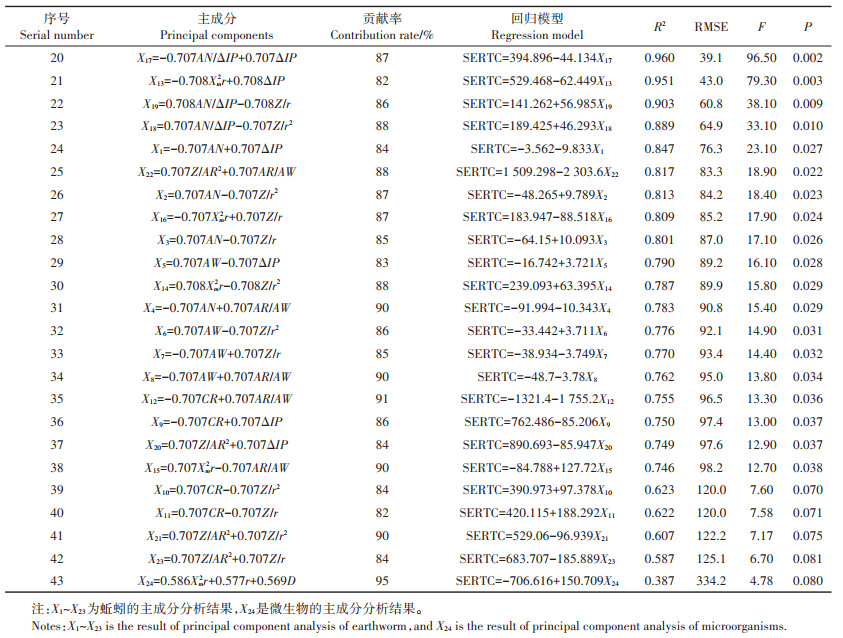
与边界离子的QICAR方程类似,本研究也建立了三种土壤生物的边界离子+硬离子的多变量线性方程。结果发现,AN、AW、CR、r、Xm2r、AN/ΔIP、Z/AR2之间存在着一定的自相关性,AR/AW、Z/r2、Z/r和ΔIP之间也存在自相关性,离子参数间的相关系数均大于0.85,AN与AW之间的相关性甚至达到了0.999,使离子参数反映的信息在一定程度上有所重叠,因此,采用主成分分析方法将这些结构参数之间的相关性压缩,获得更准确的回归关系,主成分分析结果见表 6。结果显示,所有多变量方程对蚯蚓毒性基准值的拟合效果都较好,其中AN/ΔIP与ΔIP组合相关性最显著,R2高达0.960(F=96.5,P < 0.01)。与Wu等[12]研究结果类似,其发现AN/ΔIP与其他离子参数组合成的多变量方程与Lymnaea acuminata的最大基准浓度值(CMCs)具有显著的相关性,能够更好地反映金属离子对其毒性效应。在边界+硬金属离子中,离子键参数-Z/r2、r、AR/AW、Z/r、lg(-βn)、Z/AR2和ΔE0与土壤毒性基准浓度值间存在较好的拟合效果,表明离子键作用在硬金属离子毒性方面发挥重要的作用。基于R2、RMSE、F统计量等,将3种生物的单变量以及多变量线性QICAR方程进行比较,得到能够较好地反映植物(土壤溶液)、植物(土壤)、土壤微生物的金属离子内在性质与其毒性浓度值之间关系的QICAR模型,分别为方程1、5、13及方程20(表 5和表 6)。
|
|
表 6 基于主成分分析的元素理化性质与SERTC中边界离子+硬离子推荐值的线性回归模型(n=7) Table 6 Linear regression model of physicochemical properties and recommended values of boundary ions+hard ions in SERTC based on principal component analysis |
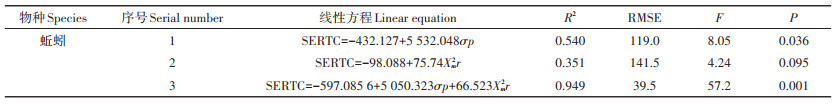
3种生物的边界离子+软离子的毒性基准值与金属内在性质参数相关分析结果见表 7。结果显示,植物及土壤微生物的基准值与25种结构参数的P值均大于0.1,相关系数r均小于0.20,因此,不再建立QICAR模型。对蚯蚓而言,Xm2r和σp与毒性基准值具有线性相关,R2分别为0.351(F=4.24,P < 0.1)和0.540(F=8.05,P < 0.05)。为改善模型的拟合效果,建立了多变量QICAR方程,拟合效果较好,R2高达0.949(F=57.2,P < 0.01),表明软金属离子对蚯蚓的毒性基准值与Xm2r和σp具有显著的相关性。
|
|
表 7 元素的理化性质与SERTC中边界离子+软离子推荐值的线性回归模型(n=8) Table 7 Linear regression models of physicochemical properties and recommended values of boundary ions+soft ions in SERTC(n=8) |
Xm2r表示共价键相互作用对离子键相互作用的重要性,Xm2r值越大,离子越软,越具有软离子的性质,离子越易与生物体表面含S、N的官能团结合,σp也反映了软金属离子的性质,两者结合表明共价键作用在软金属离子的毒性方面具有重要的作用。Wu等[12]发现Xm2r和σp组合能够很好地反映金属对Bufo melanostictus的毒性效应,本研究与该研究结果相似,在边界离子+软金属离子中,Xm2r和σp等共价键参数表征了金属离子共价键相对于离子键的难易程度,与土壤金属毒性基准浓度值具有很好的拟合效果,揭示共价键作用在软金属离子的毒性方面具有重要的作用。因此,最终建立蚯蚓QICAR线性回归模型为方程3(表 7)。
3 结论(1)硬金属离子理化性质参数AR/AW、Z/r、lg(-βn)、Z/AR2、ΔE0与土壤毒性基准值间具有较好的拟合效果,表明离子键作用在硬金属离子毒性方面发挥重要的作用。
(2)软金属离子的理化性质参数Xm2r和σp与土壤金属毒性基准浓度值具有很好的拟合效果,揭示共价键作用在软金属离子的毒性方面具有重要的作用。
(3)基于土壤生物的金属毒性基准值与其理化性质参数间的关系建立了QICAR模型,该模型对于建立其他未知毒性金属的生态基准值具有重要的参考价值。
| [1] |
杨志英, 张健珠, 李春苑, 等. 土壤重金属污染及修复技术研究现状[J]. 绿色科技, 2018, 22: 62-65. YANG Zhi-ying, ZHANG Jian-zhu, LI Chun-yuan, et al. Research status of soil heavy metal pollution and remediation technology[J]. Journal of Green Science and Technology, 2018, 22: 62-65. |
| [2] |
Yang Q Q, Li Z Y, Lu X N, et al. A review of soil heavy metal pollution from industrial and agricultural regions in China:Pollution and risk assessment[J]. Science of the Total Environment, 2018, 642(15): 690-700. |
| [3] |
王婷, 常高峰. 重金属污染土壤现状与修复技术研究进展[J]. 环境与发展, 2017, 29(1): 33-36. WANG Ting, CHANG Gao-feng. Present situation and remediation technology research progress for heavy metal contaminated soil[J]. Environment and Development, 2017, 29(1): 33-36. |
| [4] |
王祺鑫, 王学东, 李志涛, 等. 利用拓展生物配体模型预测Mg影响下的Cu-Ni、Zn-Ni对小麦的联合毒性[J]. 环境科学学报, 2018, 38(8): 3367-3374. WANG Qi-xin, WANG Xue-dong, LI Zhi-tao, et al. Extended biotic ligand model for prediction of mixture toxicity of Cu-Ni, Zn-Ni to wheat effected by Mg[J]. Acta Scientiae Circumstantiae, 2018, 38(8): 3367-3374. |
| [5] |
王颖.过渡金属水质基准阈值预测研究[D].北京: 北京师范大学, 2015: 1-3. WANG Ying. Study on prediction of transition metal water quality threshold[D]. Beijing: Beijing Normal University, 2015: 1-3. |
| [6] |
Hansch C, Fujita T. P-δ-π Analysis:A method for the correlation of biological activity and chemical structure[J]. Journal of the American Chemical Society, 1964, 86: 5710. |
| [7] |
Ownby D R, Newman M C. Advances in quantitative ion character-activity relationships(QICARs):Using metal-ligand binding characteristics to predict metal toxicity[J]. QSAR and Combinatorial Science, 2003, 22(2): 241-246. DOI:10.1002/qsar.200390018 |
| [8] |
Mccloskey J T, Newman M C. Predicting the relative toxicity of metal ions using ion characteristics:Microtox® bioluminescence assay[J]. Environmental Toxicology and Chemistry, 1996, 15(10): 1730-1737. DOI:10.1002/etc.5620151011 |
| [9] |
Walker J D, Newman M C, Enache M. Fundamental QSARs for metal ions[M]. Boca Raton: CRC Press, 2012.
|
| [10] |
Walker J D, Enache M, Dearden J C. Quantitative cationic-activity relationships for predicting toxicity of metals[J]. Environmental Toxicology and Chemistry, 2003, 22(8): 1916-1935. DOI:10.1897/02-568 |
| [11] |
Khangarot B S, Ray P K. Investigation of correlation between physicochemical properties of metals and their toxicity to the water flea Daphnia magna Straus[J]. Ecotoxicology and Environmental Safety, 1989, 18(2): 106-120. |
| [12] |
Wu F C, Mu Y S, Chang H, et al. Predicting water quality criteria for protecting aquatic life from physicochemical properties of metals or metalloids[J]. Environmental Science & Technology, 2013, 47(1): 446-453. |
| [13] |
Chen C, Wang J L. Correlating metal ionic characteristics with biosorption capacity using QSAR model[J]. Chemosphere, 2007, 69(10): 1610-1616. DOI:10.1016/j.chemosphere.2007.05.043 |
| [14] |
Chen C, Mu Y S, Wu F C, et al. Derivation of marine water quality criteria for metals based on a novel QICAR-SSD model[J]. Environmental Science Pollution Research, 2015, 22(6): 4297-4304. DOI:10.1007/s11356-014-3655-4 |
| [15] |
崔龙哲, 李社锋. 污染土壤修复技术与应用[M]. 北京: 化学工业出版社, 2016: 82-83. CUI Long-zhe, LI She-feng. Remediation technology and application of contaminated soil[M]. Beijing: Chemical Industry Press, 2016: 82-83. |
| [16] |
Wolterbeek H T, Verburg T G. Predicting metal toxicity revisited:General properties vs. specific effects[J]. Science of the Total Environment, 2001, 279: 87-115. DOI:10.1016/S0048-9697(01)00756-2 |
| [17] |
Shannon R D, Prewitt C T. Revised values of effective ionic radii[J]. Acta Crystallogr Sect B Struct Sci, 1970, B26: 1046-1048. |
| [18] |
Kaiser K L E. Correlation and prediction of metal toxicity to aquatic biota[J]. Can J Fish Aquatic Science, 1980, 37(2): 211-218. DOI:10.1139/f80-027 |
| [19] |
Newman M C, McCloskey J T. Predicting relative toxicity and interactions of divalent metal ions:Microtox® bioluminescence assay[J]. Environmental Toxicology Chemistry, 1996, 15(3): 275-281. |
| [20] |
Pearson R G, Mawby R J. The nature of metal-halogen bonds[M]//Gutmann V. Halogen chemistry. New York: Academic Press, 1967: 55-84.
|
| [21] |
Base C F, Mesmer R E. The hydrolysis of cations[M]. New York: John Wiley and Sons, 1976.
|
| [22] |
Qie Y, Chen C, Guo F, et al. Predicting criteria continuous concentrations of metals or metalloids for protecting marine life by use of quantitative ion characteristic-activity relationships-species sensitivity distributions(QICAR-SSD)[J]. Marine Pollution Bulletin, 2017, 124: 639-644. DOI:10.1016/j.marpolbul.2017.02.055 |
| [23] |
Jone M M, Vaughn W K. HASB theory and acute metal ion toxicity and detoxification processes[J]. Journal of Inorganic and Nuclear Chemistry, 1978, 40: 2081-2088. DOI:10.1016/0022-1902(78)80212-7 |
| [24] |
Wang Y, Wu F C, Liu Y D, et al. Effect doses for protection of human health predicted from physicochemical properties of meitals/metalloids[J]. Environmental Pollution, 2018, 232: 458-466. DOI:10.1016/j.envpol.2017.09.065 |
| [25] |
Zamil S S, Ahmad S, Chio M H, et al. Correlating metal ionic characteristics with biosorption capacity of Staphylococcus saprophyticus BMSZ711 using QICAR model[J]. Bioresource Technology, 2009, 100(6): 1895-1902. DOI:10.1016/j.biortech.2008.10.014 |
 2020, Vol. 37
2020, Vol. 37