2. 国家糖料改良中心, 哈尔滨 150080
2. National Sugar Crops Improvement Center, Harbin 150080, China
硼(B)是维管植物发育所必需的微量元素,对植物细胞膜和细胞壁的结构和功能、碳水化合物代谢和运输、蛋白质和核酸代谢及许多酶的活性等都具有重要作用。然而,硼毒害也是影响世界干旱和半干旱地区作物产量的主要问题[1]。近年来硼矿开采或高含量硼肥的施用导致土壤硼浓度异常升高[2],从而产生植物硼中毒现象。硼毒害问题已在小麦[3]、大麦[4]、柑橘[5]等作物中出现。叶片是甜菜植株中含硼量最高的部位,硼胁迫会直接影响植株光合作用,从而影响糖分积累,进而影响甜菜的产量和含糖量,因此研究高硼胁迫对甜菜的影响具有现实意义。
研究发现硼在植物体内运输主要受蒸腾作用调控,因而硼中毒现象常发生在叶片[6],出现叶片变小、边缘变黄、叶片坏死等现象,导致光合叶面积下降,叶绿素含量降低,影响光合作用[7-8];高硼胁迫增加叶片淀粉和可溶性糖含量,影响糖代谢[9];显著增加叶片中脯氨酸和丙二醛(MDA)含量,降低抗氧化酶活性,从而导致活性氧清除能力减弱,活性氧积累[10],影响植株正常发育。糖料作物的重要性在欧洲、非洲、澳大利亚等许多国家仅次于小麦[11]。糖除了能直接食用外,还可以作为许多化工、油漆材料及其他工业的原材料,是战略储备物资之一[12]。
甜菜(Beta vulgaris L.)为藜科,二年生草本植物,是世界上第二大糖料作物,也是对硼最敏感的作物之一。目前对甜菜受硼毒害的光合及逆境生理代谢响应研究较少。因此,本研究以大田主栽甜菜品种H004为材料,研究硼胁迫处理对甜菜苗期叶片光合性能、渗透物质调节及活性氧代谢的影响,以期为甜菜的抗硼毒害机理及高效栽培管理提供理论基础。
1 材料与方法 1.1 试验材料供试品种为甜菜遗传单粒种H004;主要药品与试剂:硼酸、95%乙醇、蒽酮、间苯二酚、硝基氮蓝四唑(NBT)、3,3-二氨基联苯胺(DAB)等。
1.2 试验设计试验于2018年11月6日—2018年12月14日在国家糖料改良中心(哈尔滨)生物培养室进行。试验用盆为聚乙烯培养箱(24 cm×17 cm×16 cm),使用前先用稀盐酸浸泡,然后用蒸馏水冲洗干净,外围粘上黑色贴纸避光。将甜菜种子播种于经过180 ℃高温消毒4.5 h的蛭石中,浇适量蒸馏水,待甜菜子叶完全展开后选择长势一致的幼苗移入装有1/4全量营养液的培养箱中培养,同时进行硼处理,每箱定苗2株。7 d后使用1/2全量营养液培养,营养液每周更换1次,最后使用全量营养液。设置5个硼浓度水平,分别为B1(0.05 mmol · L-1)、B2(0.25 mmol · L-1)、B3(0.50 mmol·L-1)、B4(2.50 mmol·L-1)、B5(5.00 mmol·L-1)。通过预试验对甜菜苗期硼浓度进行筛选,发现硼浓度0.05 mmol·L-1时最适宜幼苗生长,高于该浓度幼苗生长受到抑制,因而确定B1为对照处理,B2~B5为高硼胁迫处理。每处理8次重复,随机排列。光照强度300 μmol·m-2·s-1,昼夜时间和温度分别为16、8 h和28、20 ℃,每日更换位置确保光照均匀。营养液每日通气4 h,pH调节至6.50。
1.3 测定指标与方法 1.3.1 生长指标测定分别于处理后10、15、20、25 d取甜菜第3片真叶测定株高、叶片数、叶片长度、叶片宽度。株高、叶长、叶宽均用直尺测量。处理后25 d进行采样,称量鲜质量,将样品在105 ℃烘箱中杀青30 min后于65 ℃下烘干至恒质量,称量干质量。叶面积使用扫描仪扫描后采用Image J图像处理法分析测定;叶色值使用SPAD-502仪测定。
1.3.2 光合指标及渗透调节物质测定均选取植株第5片完全伸展叶片进行测定。叶绿素a和叶绿素b含量采用95%乙醇提取,分光光度计测定,二者比值即为叶绿素a/b;净光合速率(Pn)利用CI-340手持式光合作用测量系统(CID,美国)于上午9:00—11:00进行测定;可溶性糖与淀粉含量采用蒽酮比色法测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;游离脯氨酸含量采用酸性茚三酮法测定。
1.3.3 叶片超氧阴离子和过氧化氢组织化学染色取各处理甜菜幼苗第5片真叶,用打孔器(直径1.5 cm)打孔,将叶片原片分别放入0.1% NBT(50 mmol·L-1磷酸盐缓冲液,pH 7.5)和0.1% DAB染色液中,避光染色过夜,移除染液,将叶片放入含有95%乙醇中,置于80 ℃水浴锅煮至脱色,清水漂洗数次后,观察积累情况,拍照保存。
1.4 数据计算及统计分析试验数据采用Excel 2003和SPSS 23.0软件进行处理和统计分析及单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD)检验(P < 0.05)。采用Origin 23.0绘图。
2 结果与分析 2.1 高硼胁迫下不同时期幼苗生长进程硼处理后各阶段甜菜生长发育的影响如图 1所示。随着生育进程的推进,不同硼浓度处理下植株各生长指标数值均不断升高。处理第10 d,高硼胁迫对甜菜幼苗生长影响较小。处理第15 d,高硼胁迫出现明显抑制作用,植株株高和叶片数在B4、B5处理分别下降了19.3%、17.0%和21.7%、26.1%,B2、B3处理与对照相比差异较小;叶长和叶宽在高硼处理下分别下降了8.9%~42.9%、17.1%~57.1%,B4处理降幅最大。处理第20 d,株高与叶片数各处理与对照相比分别下降了6.5%~26.8%、0%~30.0%;叶长与叶宽分别下降了3.6%~18.1%、12.5%~33.9%。处理第25 d时,株高和叶片数各处理与对照相比差异较小;叶长、叶宽分别比对照降低了5.6%~10.9%、7.3%~27%。说明随着甜菜幼苗的生长,各指标受到的抑制作用有减缓趋势。
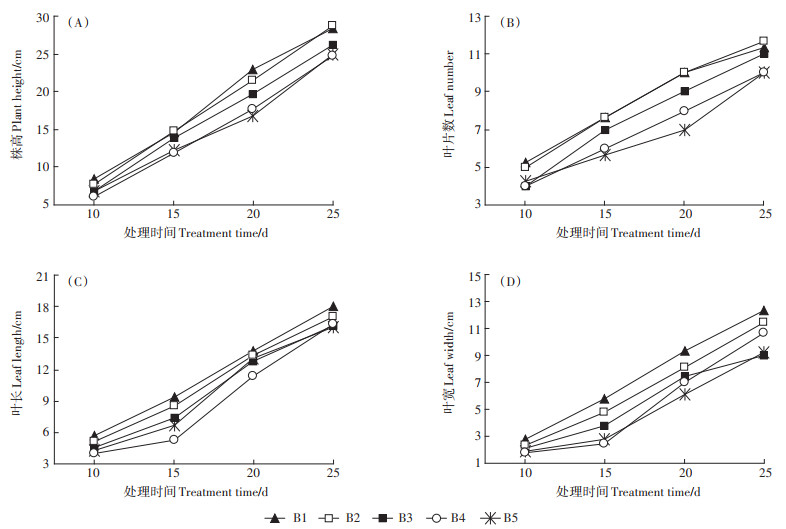
|
图 1 高硼胁迫下甜菜幼苗生长发育状况 Figure 1 Growth and development of sugar beet seedlings under high boron stress |
如图 2所示,甜菜叶面积随着硼浓度的增加而增加,与对照处理相比差异显著,而硼胁迫之间差异不显著。叶色值随着硼浓度的增加逐渐下降,分别比对照处理下降13.1%、17.6%、23.9%、24.4%。与对照处理相比,高硼胁迫对甜菜叶片生物量有显著抑制作用(P < 0.05),并且随着硼浓度的增加,其抑制作用更明显。当硼浓度在B4处理时,叶片的鲜质量和干质量均显著下降,表明B3(0.50 mmol·L-1)处理可能是甜菜幼苗高硼胁迫的临界值,超过该浓度,植株生物量积累受到严重抑制。B4、B5处理的叶色值、干质量、鲜质量无显著差异(P>0.05),说明当硼浓度大于2.50 mmol·L-1后,高浓度硼胁迫对植株生物量抑制作用有减弱趋势。
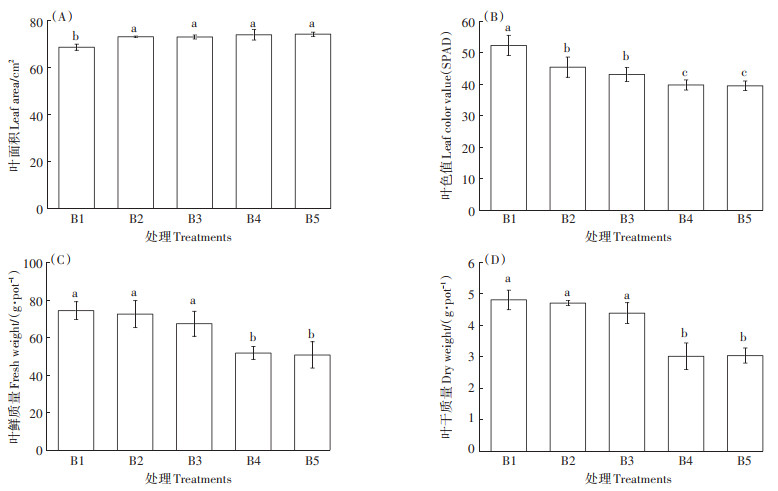
|
图 2 高硼胁迫处理第25 d叶片生长状况 Figure 2 Leaf growth of 25th day of high boron stress treatment |
由图 3可知,在不同浓度硼胁迫下,甜菜叶片叶绿素含量及光合速率变化趋势基本一致,即随着硼浓度的升高,叶绿素a、叶绿素b、净光合速率呈逐渐下降的趋势,与对照相比分别降低了25.7%~48.1%、28.8%~48.2%、7.5%~16.0%。叶绿素a/b在B5处理与对照相比无显著变化,但其他处理与对照差异显著,在B3处理下,叶绿素a/b最大,较对照增加了10.8%。
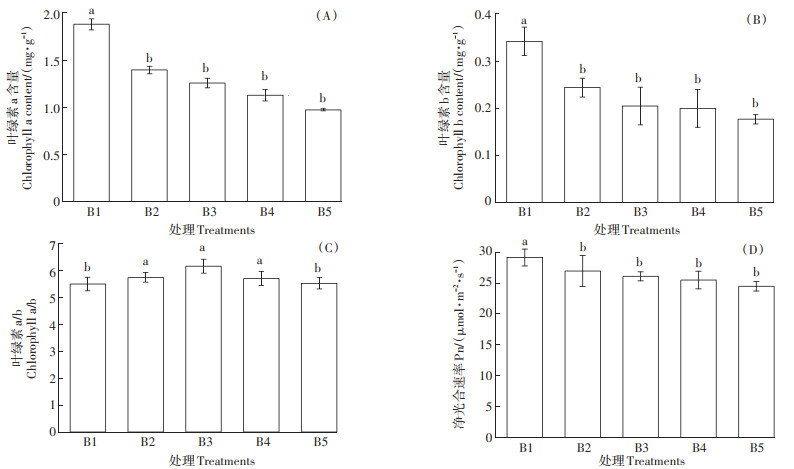
|
图 3 高硼胁迫对甜菜幼苗叶绿素及净光合速率的影响 Figure 3 Effect of high boron stress on chlorophyll and net photosynthetic rate of sugar beet seedlings |
图 4表明,甜菜叶片可溶性糖、淀粉、果糖含量随硼胁迫浓度增加而增加,在B5处理下含量最高,分别较对照增加35.6%、112.5%、137.1%。B2、B3处理可溶性糖、果糖含量与对照处理差异不显著(P>0.05),B5处理淀粉含量与对照差异显著(P < 0.05)。蔗糖含量规律相反,随硼胁迫浓度增加而下降,并且高硼处理与对照差异显著,分别较对照下降31.8%、41.4%、51.0%、54.1%。

|
图 4 高硼胁迫对甜菜幼苗叶片光合产物的影响 Figure 4 Effect of high boron stress on photosynthate of sugar beet seedling leaves |
丙二醛是膜脂过氧化最重要的产物之一,其含量的高低常可反映细胞膜脂过氧化的水平。从图 5可以看出,B2、B3、B4、B5的丙二醛含量均高于对照,分别增加了3.4%、12.2%、17.5%、20.1%。B3处理丙二醛含量显著高于B1、B2处理,说明叶片衰老进程加剧,细胞膜脂过氧化水平升高。B3、B4、B5处理丙二醛含量无显著差异。从图 5中可以看出,硼胁迫下甜菜叶片中的脯氨酸含量变化趋势呈单峰曲线,B3处理脯氨酸含量达到最大值,比对照增加23.0%。B4、B5处理脯氨酸含量稍有下降,但仍显著高于对照,分别比对照增加16.9%、21.3%。

|
图 5 高硼胁迫下叶片丙二醛和脯氨酸含量 Figure 5 Contents of malondialdehyde and proline in leaves under high boron stress |
逆境胁迫会导致植物大量产生超氧阴离子自由基、过氧化氢和羟基自由基等活性氧分子。通过NBT染色方法得到超氧阴离子在不同硼浓度处理下的积累程度。染色结果(图 6)显示,甜菜叶片对照处理染色面积最小,受到的胁迫程度最轻。B3、B4、B5处理蓝色斑点逐渐增多且面积扩大,B5处理染色面积最大,染色最深,受到的胁迫程度最强。通过DAB染色方法得到过氧化氢在不同硼浓度处理下的积累程度。染色结果(图 6)显示,随着硼浓度的升高,棕褐色面积逐渐加大,颜色也逐渐加深。表明高硼处理会导致甜菜体内过氧化氢累积。
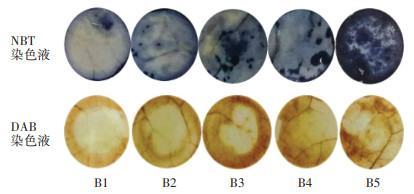
|
图 6 高硼胁迫下叶片细胞组织染色 Figure 6 Staining of leaf tissue under high boron stress |
Wang等[13]研究表明适量硼浓度能促进植物生长,但硼浓度过量时,植株许多生理过程会受到影响,生长受抑制,并且抑制程度会随着硼浓度的升高而加重[14]。本研究发现甜菜幼苗硼中毒时首先是老叶叶片会出现颜色变淡、变黄,产生斑点等症状,原因可能是硼在韧皮部不可转移,而在老叶边缘累积了更多的硼。刘术新等[15]研究了18种蔬菜对硼毒害敏感性,发现株高及地上部鲜质量都随硼浓度的升高而降低。本试验结果显示,高硼胁迫对甜菜植株形态及生物量均有显著影响,并且这些指标总体上均随硼浓度的增加呈逐渐下降趋势,这与谭小兵等[16]研究结果一致。另外本研究发现第25 d时高硼处理甜菜株高、叶片数以及叶长、叶宽与对照相比差异较小,尤其是株高和叶片数在B2处理下分别比对照增加了0.9%、2.9%,说明硼毒害对植株影响程度与生长发育时间有关,在生长后期影响程度减弱,这可能是因为随着植株的生长,需硼量增大,硼毒害对植株表观生长的影响逐渐降低。
叶绿素是植物进行光合作用的重要色素,其含量变化与光合作用密切相关[17]。Huang等[18]发现,硼毒害会使植株叶绿素含量及光合速率下降,抑制叶片光合性能。本试验中,高硼胁迫下叶绿素a、叶绿素b含量均显著下降,可能是因为高硼胁迫抑制了叶绿素前体的合成从而促使叶绿素分解,或者直接破坏了叶绿体结构,使叶绿素含量降低[7]。叶绿素a/b在5.00 mmol·L-1硼浓度处理时与对照相比差异并不显著,可能是当硼浓度超过一定量时,植株本身会产生适应机制,仍能维持其叶绿体光合作用。此外本试验发现在硼处理前期,叶面积受到的影响较大,与对照相比整体叶片偏小,但随着甜菜植株的生长,处理后期叶面积随着硼浓度的增加而增大,并未受到硼毒害影响。净光合速率与叶绿素含量规律一致,随硼浓度增加呈下降趋势,说明硼毒害使叶片出现黄化现象造成叶绿素含量显著下降,从而导致光合速率降低,抑制光合性能[19-20]。
硼能促进碳水化合物的运输,因为合成含氮碱基的尿嘧啶需要硼,而尿嘧啶二磷酸葡萄糖(UDPG)是蔗糖合成的前体,所以硼有利于蔗糖合成和糖的外运。本研究发现高硼胁迫使甜菜叶片可溶性糖、淀粉、果糖含量增加,而蔗糖规律相反,其含量随着硼浓度增加而降低,蔗糖含量下降可能是因为硼元素通过调控蔗糖代谢酶的活性来减慢蔗糖合成速率,而蔗糖含量的下降表示光合产物向外运输减少[21]。南丽丽等[22]研究发现苜蓿叶片中可溶性糖与淀粉含量呈显著负相关,而茎秆中可溶性糖与淀粉含量呈显著正相关,可溶性糖与淀粉含量的相关性因部位而异。而本研究甜菜叶片可溶性糖与淀粉含量均随着硼浓度的增加而增加,说明其相关性还因植物不同而异。Cervilla等[23]研究发现过量硼使叶片中的可溶性糖含量增加,而叶片中可溶性碳水化合物的积累也正是缓解高浓度硼中毒症状的重要因素[24]。
细胞膜是保障植物细胞内外物质交换运输的重要结构,硼对细胞膜的稳定性有直接作用[25]。丙二醛含量可反映膜脂过氧化作用的强弱[26]。本研究中随着硼浓度的增加,丙二醛含量随之升高,表明硼毒害能使植株体内丙二醛含量增加,并使质膜系统受到伤害[27]。本研究发现高硼胁迫下甜菜叶片中的脯氨酸含量在0.50 mmol·L-1处理时达到最大值,之后有下降趋势,说明在逆境条件下,植物会通过合成积累脯氨酸等有机物质来调节细胞内的渗透压,从而稳定细胞中酶分子的活性构象,增强适应环境的能力[28]。通过细胞组织染色的方法直观地发现甜菜叶片超氧阴离子、过氧化氢累积程度随着硼浓度的增加均呈上升趋势。Catav[29]等研究发现,随着有效硼浓度的增加,过氧化氢含量明显上升,同时叶片细胞膜的透性也会增大。过量硼会导致植物体内产生大量活性氧,过多的活性氧会引起膜质的脱脂化和过氧化,破坏生物膜的结构和功能,甚至会造成细胞死亡[30],从而影响植株正常发育。
4 结论(1)高硼胁迫显著影响甜菜叶片生长发育,导致叶绿素含量、净光合速率下降,叶片光合能力减弱,进而影响光合产物的运输,造成可溶性糖与淀粉含量增加,而蔗糖含量下降。
(2)随着硼浓度的增加,甜菜叶片丙二醛、脯氨酸含量显著增加,脯氨酸含量在硼浓度0.50 mmol·L-1时达到最大值;叶片中超氧阴离子与过氧化氢积累也逐渐增加,并在硼浓度5.00 mmol·L-1时累积最严重。
(3)本试验条件下,硼浓度为0.50 mmol·L-1可以作为甜菜幼苗高硼胁迫的临界值,超过该浓度,植株生长受到显著抑制。
| [1] |
Rivero M, Angel M, Cristóbal C, et al. Abscisic acid and transpiration rate are involved in the response to boron toxicity in Arabidopsis plants[J]. Physiologia Plantarum, 2017, 160(1): 21-32. DOI:10.1111/ppl.12534 |
| [2] |
Gunes A, Inal A, Bagci E, et al. Silicon increases boron tolerance and reduces oxidative damage of wheat grown in soil with excess boron[J]. Biologia Plantarum, 2007, 51: 571-574. DOI:10.1007/s10535-007-0125-6 |
| [3] |
Masood S, Saleh L, Witzel K, et al. Determination of oxidative stress in wheat leaves as influenced by boron toxicity and NaCl stress[J]. Plant Physiology and Biochemistry, 2012, 56: 56-61. DOI:10.1016/j.plaphy.2012.04.011 |
| [4] |
Schnurbusch T, Hayes J, Hrmova M, et al. Boron toxicity tolerance in barley through reduced expression of the multifunctional aquaporin HvNIP2;1[J]. Plant Physiology, 2010, 153(4): 1706-1715. DOI:10.1104/pp.110.158832 |
| [5] |
Sang W, Huang Z R, Qi Y P, et al. An investigation of boron-toxicity in leaves of two citrus species differing in boron-tolerance using comparative proteomics[J]. Journal of Proteomics, 2015, 123: 128-146. DOI:10.1016/j.jprot.2015.04.007 |
| [6] |
刘春光, 何小娇. 过量硼对植物的毒害及高硼土壤植物修复研究进展[J]. 农业环境科学学报, 2012, 31(2): 230-236. LIU Chun-guang, HE Xiao-jiao. Boron toxicity in plants and phytoremediation of boron-laden soils[J]. Journal of Agro-Environment Science, 2012, 31(2): 230-236. |
| [7] |
吴秀丽, 欧庸彬, 原改换, 等. 两种杨树对高硼胁迫的生理响应[J]. 植物生态学报, 2015, 39(4): 407-415. WU Xiu-li, OU Yong-bin, YUAN Gai-huan, et al. Physiological responses of two poplar species to high boron stress[J]. Chinese Journal of Plant Ecology, 2015, 39(4): 407-415. DOI:10.17521/cjpe.2015.0040 |
| [8] |
熊博, 叶霜, 邱霞, 等. 硼对黄果柑生理及抗氧化酶活性的影响[J]. 浙江农业学报, 2016, 28(7): 1171-1176. XIONG Bo, YE Shuang, QIU Xia, et al. Effect of boron on physiological and antioxidant enzymes activity of Huangguogan[J]. Acta Agriculturae Zhejiangensis, 2016, 28(7): 1171-1176. DOI:10.3969/j.issn.1004-1524.2016.07.12 |
| [9] |
方益华. 高硼胁迫对油菜光合作用的影响研究[J]. 植物营养与肥料学报, 2001, 7(1): 109-112. FANG Yi-hua. Study on effect of high boron stress on photosynthesis of oilseed rape[J]. Plant Nutrition and Fertilizer Science, 2001, 7(1): 109-112. DOI:10.3321/j.issn:1008-505X.2001.01.016 |
| [10] |
Hamurcu M, Aşkım H S, İsmail T, et al. Induced antioxidant activity in soybean alleviates oxidative stress under moderate boron toxicity[J]. Plant Growth Regulation, 2013, 70(3): 217-226. DOI:10.1007/s10725-013-9793-8 |
| [11] |
Mekdad A, El-Sherif A. Performance of two sugar beet varieties under fertilization with potassium and foliar spraying with micronutrients[J]. Egyptian Journal Agronomy, 2016, 38(2): 189-207. DOI:10.21608/agro.2016.601 |
| [12] |
余娟, 平秋婷, 余构彬, 等. 我国糖业国际标准化工作困境与展望[J]. 甘蔗糖业, 2019(1): 42-45. YU Juan, PING Qiu-ting, YU Gou-bin, et al. Predicament and prospect of China sugar industry international standardization[J]. Sugarcane and Canesugar, 2019(1): 42-45. DOI:10.3969/j.issn.1005-9695.2019.01.008 |
| [13] |
Wang B L, Shi L, Li Y X. Boron toxicity is alleviated by hydrogen sulfide in cucumber(Cucumis sativus L.)seedlings[J]. Planta, 2010, 231(6): 1301-1309. DOI:10.1007/s00425-010-1134-9 |
| [14] |
Archana P N. Antioxidant responses and water status in Brassica seedlings subjected to boron stress[J]. Acta Physiologiae Plantarum, 2012, 35(3): 697-706. |
| [15] |
刘术新, 郑海峰, 丁枫华, 等. 18种蔬菜品种对硼毒害敏感性的研究[J]. 农业环境科学学报, 2009, 28(10): 2017-2022. LIU Shu-xin, ZHENG Hai-feng, DING Feng-hua, et al. The sensibility of 18 vegetable species to boron toxicity[J]. Journal of Agro-Environment Science, 2009, 28(10): 2017-2022. DOI:10.3321/j.issn:1672-2043.2009.10.004 |
| [16] |
谭小兵, 杨焕文, 徐照丽, 等. 高硼植烟土壤对烤烟生长发育的影响及其钾肥调控措施[J]. 南方农业学报, 2017, 48(10): 1789-1794. TAN Xiao-bing, YANG Huan-wen, XU Zhao-li, et al. Effects of highboron soil planting tobacco on growth of fluecured tobacco and potassium fertilizer regulation measures[J]. Journal of Southern Agriculture, 2017, 48(10): 1789-1794. DOI:10.3969/j.issn.2095-1191.2017.10.10 |
| [17] |
苏明洁, 廖源林, 叶充, 等. 镉胁迫下苦楝(Melia azedarach L.)幼苗的生长及生理响应[J]. 农业环境科学学报, 2016, 35(11): 2086-2093. SU Ming-jie, LIAO Yuan-lin, YE Chong, et al. The growth and physiological responses of Melia azedarach L. seedlings to cadmium stress[J]. Journal of Agro-Environment Science, 2016, 35(11): 2086-2093. DOI:10.11654/jaes.2016-0929 |
| [18] |
Huang J H, Cai Z J, Wen S X, et al. Effects of boron toxicity on root and leaf anatomy in two citrus species differing in boron tolerance[J]. Trees, 2014, 28(6): 1653-1666. DOI:10.1007/s00468-014-1075-1 |
| [19] |
Macho-Rivero M A, Herrera-Rodríguez M B, Brejcha R, et al. Boron toxicity reduces water transport from root to shoot in Arabidopsis plants. Evidence for a reduced transpiration rate and expression of major PIP aquaporin genes[J]. Plant and Cell Physiology, 2018, 59(4): 836-844. |
| [20] |
Shah A, Wu X W, Ullah A, et al. Deficiency and toxicity of boron:Alterations in growth, oxidative damage and uptake by citrange orange plants[J]. Ecotoxicology and Environmental Safety, 2017, 145(6): 575-582. |
| [21] |
汪开拓, 郑永华. 硼处理对杨梅果实采后贮藏期间蔗糖代谢及花色苷合成的影响[J]. 食品与发酵工业, 2012, 38(9): 179-185. WANG Kai-tuo, ZHENG Yong-hua. Effects of boron treatment on sucrose metabolism and anthocyanin synthesis in postharvest Chinese bayberries[J]. Food and Fermentation Industries, 2012, 38(9): 179-185. |
| [22] |
南丽丽, 师尚礼, 陈建纲, 等. 硼锌配施对苜蓿矿质元素和碳水化合物含量的影响[J]. 中国草地学报, 2013, 35(1): 23-28. NAN Li-li, SHI Shang-li, CHEN Jian-gang, et al. Effects of B and Zn on mineral element and carbohydrate of alfalfa[J]. Chinese Journal of Grassland, 2013, 35(1): 23-28. DOI:10.3969/j.issn.1673-5021.2013.01.004 |
| [23] |
Cervilla L M, Blasco B, Rios J J, et al. Oxidative stress and antioxidants in tomato(Solanum lycopersicum)plants subjected to boron toxicity[J]. Annals of Botany, 2007, 100(4): 747-756. DOI:10.1093/aob/mcm156 |
| [24] |
Keles Y, Öncel I, Nilgün Y. Relationship between boron content and antioxidant compounds in citrus leaves taken from fields with different water source[J]. Plant and Soil, 2004, 265(1/2): 345-353. |
| [25] |
吕成群, 黄宝灵. 低温下硼对巨尾桉叶片膜脂过氧化及体内保护系统的影响[J]. 热带亚热带植物学报, 2003, 11(3): 217-222. LÜ Cheng-qun, HUANG Bao-ling. Effects of boron on membrane lipid peroxidation and endogenous protective systems in leaves of Eucalyptus grandis×Eucalyptus urophylla under low temperature[J]. Journal of Tropical and Subtropical Botany, 2003, 11(3): 217-222. DOI:10.3969/j.issn.1005-3395.2003.3.004 |
| [26] |
刘鹏, 杨玉爱. 钼、硼对大豆叶片膜脂过氧化及体内保护系统的影响[J]. 植物学报, 2000, 42(5): 461-466. LIU Peng, YANG Yu-Ai. Effects of molybdenum and boron on membrane lipid peroxidation and endogenous protective systems of soybean leaves[J]. Acta Botanica Sinica, 2000, 42(5): 461-466. DOI:10.3321/j.issn:1672-9072.2000.05.004 |
| [27] |
Song W, Huang Z R, Yang L T, et al. Effects of high toxic boron concentration on protein profiles in roots of two citrus species differing in boron-tolerance revealed by a 2-DE based MS approach[J]. Frontiers in Plant Science, 2017, 8: 180. |
| [28] |
覃光球, 严重玲, 韦莉莉. 秋茄幼苗叶片单宁、可溶性糖和脯氨酸含量对Cd胁迫的响应[J]. 生态学报, 2006, 26(10): 3366-3371. QIN Guang-qiu, YAN Chong-ling, WEI Li-li. Effect of cadmium stress on the contents of tannin, soluble sugar and proline in Kandelia candel(L.) Druce seedlings[J]. Acta Ecologica Sinica, 2006, 26(10): 3366-3371. DOI:10.3321/j.issn:1000-0933.2006.10.028 |
| [29] |
Catav S S, Genc T O, Oktay M K, et al. Effect of boron toxicity on oxidative stress and genotoxicity in wheat(Triticum aestivum L.)[J]. Bulletin of Environmental Contamination and Toxicology, 2018, 100: 502-508. DOI:10.1007/s00128-018-2292-x |
| [30] |
Ardıc M, Sekmen A H, Turkan I, et al. The effects of boron toxicity on root antioxidant systems of two chickpea(Cicer arietinum L.)cultivars[J]. Plant and Soil, 2009, 314(1/2): 99-108. |
 2020, Vol. 37
2020, Vol. 37


