盐渍土是陆地广泛分布的一种土壤类型,面积约占全球土地总面积的1/3。目前,全世界耕地面积约为1.5×109 hm2,其中23%为盐土,37%为碱性土[1]。我国各类盐渍土总面积已达到9 918.29万hm2,涉及我国23个省(市、自治区),其中面积较大、分布较集中的是黄淮海、新疆、内蒙古及黄河流域等地区。内蒙古作为我国盐渍化最严重的地区之一,其盐渍化土地面积已近3.33×106 hm2,且发生次生盐渍化的耕地面积正以每年1×104~1.3×104 hm2的速度增长[2]。盐碱胁迫不仅会导致植物生理性缺水,抑制植物对营养元素的吸收,过量的离子毒害还会减弱植物光合作用、呼吸作用和蛋白质合成作用,抑制酶活性[3]。因此,土壤盐渍化限制着作物产量以及地区可利用耕地面积,已经成为阻碍农业资源高效利用和造成土地退化的主要原因之一[4]。
丛枝菌根(Arbuscular mycorrhizal,AM)真菌是广泛存在于土壤中的一类有益微生物,它能够与自然界80%以上的陆生植物形成互惠共生关系[5]。已有研究发现,在盐胁迫下AM真菌可以改善植物生长的根际土壤环境,调节植物对水分和养分的吸收,有效缓解盐胁迫下的生理性干旱,促进植物生长,提高植物的耐盐性[6]。种植耐盐植物进行生态修复是改良盐渍土的主要生物措施之一[7]。向日葵是世界主要的油料经济作物,也是我国五大油料作物之一,具有突出的耐盐耐旱性,在内蒙古盐渍化地区种植向日葵可同时获得良好的经济效益和生态效益。杜善周等[8]研究表明,向日葵可与AM真菌形成共生关系,但国内外有关AM真菌对向日葵耐盐性和生长影响的研究鲜有报道,作用机制尚不清楚,因此其研究结果对于提高盐渍化土壤的生态修复效率具有十分重要的科学意义及实际应用价值。
本研究采用温室盆栽试验的方法,选取AM真菌作为试验菌种,模拟不同程度盐渍化土壤,研究接种AM真菌对不同盐度土壤中向日葵菌根侵染率、生物量、矿质营养吸收、盐分离子吸收、抗氧化酶活性和膜系统、渗透平衡物质含量、光合作用和水分利用率的影响,探讨AM真菌对向日葵耐盐性和生长的影响,旨在为今后促进盐渍土的生态修复,拓宽盐渍土的开发和利用,提供基础数据和技术支持。
1 材料与方法 1.1 供试植物和菌种供试植物为向日葵(Helianthus annuus L.),品种为美葵,产地山西,种子采购于内蒙古农牧科学研究院蔬菜研究所。供试AM真菌为摩西球囊霉Funneliformis mosseae(F. mosseae),BGC NM02A,1511C0001BGCAM0045,每10 g含282个孢子,菌种由北京市农林科学院植物营养与资源研究所微生物室提供。接种菌剂是以玉米(Zea mays L.)和白三叶草(Trifolium repens L.)为宿主植物进行扩大繁殖而获得的内含真菌孢子、菌丝以及宿主植物繁殖体的根际砂土混合物。
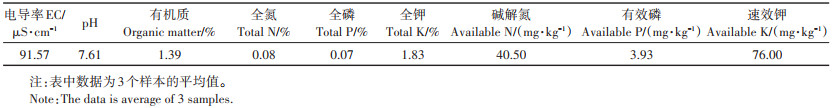
1.2 培养基质供试土壤采自内蒙古自治区呼和浩特市苗圃区非盐渍化土壤(水溶性盐含量为0.25 g·kg-1),自然风干后过2 mm筛,备用。于121 ℃的条件下高压蒸汽灭菌2 h,以杀灭土著AM真菌。土壤基本理化性质见表 1。
|
|
表 1 供试土壤基本理化性质 Table 1 Physical and chemical properties of the soil |
盆栽试验于内蒙古大学温室内进行。设置4种土壤盐度(外源添加NaCl)水平(0、0.5、1.0、1.5 g·kg-1)和2种接种处理(不接种处理CK、接种摩西球囊霉F. mosseae),每种处理设4个重复,共计32盆,随机排列。以圆形塑料花盆(上口径16.5 cm,下口径10.5 cm,高度13 cm)作为培养容器,内衬灭菌塑料自封袋。每盆装灭菌风干土壤2 kg,AM真菌接种处理采用混接法,每盆加菌剂50 g,与土壤基质充分混合均匀后装盆;不接种处理采用相同方法加入等量的灭菌菌剂。选择颗粒饱满的向日葵种子,每盆播种9颗,生长7 d后间苗,每盆保留3株长势相近的植株。试验期间自然采光,植物生长期间采用称质量法浇水,维持土壤基质含水量为田间最大持水量的80%,并记录每日浇水前后的质量用以计算向日葵生长期内的水分利用率。种植40 d后开始进行盐胁迫处理,盐分以NaCl溶液形式依次浇入土壤,每2 d浇盐一次,每盆加盐溶液100 mL,分6次完成。自出苗之日起,植物生长60 d后收获。
1.4 样品制备及分析测定收获前,将植物地上部分自茎基部剪下,先用自来水洗净向日葵地上部和根系的土壤,然后用蒸馏水冲洗3次,70 ℃烘干至恒质量后测定质量。随机选取0.5 g新鲜根段保存在50%乙醇中,用于测定菌根侵染率。测定时,将根系样品用0.05%台盼蓝于乳酸甘油溶液染色,保存、制片,利用根段频率法计算菌根侵染率。
植物样品烘干并测定质量后粉碎,每个样品称取20~40 mg,利用元素分析仪(CHNOS Elemental Analyzer,Vario MACRO cube,Elementar,德国)测定植物地上部和根部的C和N元素含量。称取0.5 g左右粉碎后的植物样品,加入5 mL BV(Ⅲ)级HNO3于120 ℃开放式消煮96 h,制备待测溶液。利用电感耦合等离子体发射光谱仪(ICP-OES,Optima 7000DV,Perkin Elmer,美国)测定消煮液中P、K、Ca、Mg和Na的含量。
使用便携式光合测定仪(GFS-3000,ZQ-WALZ009,WALZ,德国)测定净光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和叶片气孔导度(Gs)。盐胁迫结束5 d后进行相关生理指标测定。过氧化物酶(POD)和过氧化氢酶(CAT)活性采用可见光法测定;丙二醛(MDA)含量采用微板法测定;可溶性糖含量采用蒽酮比色法测定;可溶性蛋白质含量采用考马斯亮蓝法测定;脯氨酸(Pro)含量采用酸性茚三酮比色法测定。试剂盒来自南京建成生物工程研究所。
1.5 数据分析所有试验数据使用Excel 2003进行平均值及标准误差的计算,用SPSS 17.0进行统计分析,Duncan新复极差检验法(Duncan′ s multiple range test,DMRT)检验各处理平均值之间的差异显著性(α=0.05)。呈现非正态分布的数据(菌根侵染率)经过反正弦转换后再用同样的方法分析。采用双因子方差分析盐浓度和接种AM真菌的作用及二者交互作用对测定指标的影响。
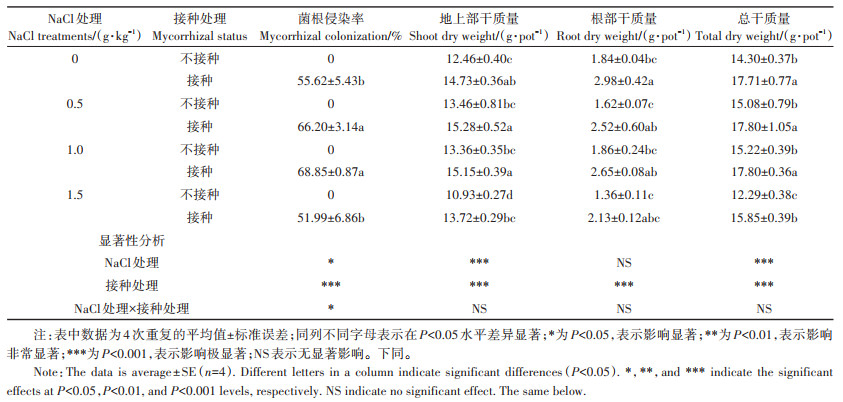
2 结果与分析 2.1 AM真菌对不同盐度土壤中向日葵菌根侵染率和生物量的影响AM真菌对向日葵菌根侵染率和生物量的影响如表 2所示。未接种处理向日葵根系中未观察到菌根真菌的侵染,而接种F. mosseae与向日葵建立了良好的共生关系。与对照相比,NaCl处理为0.5 g·kg-1和1.0 g·kg-1时菌根侵染率分别显著增加了10.58、13.23个百分点;而NaCl处理为1.5 g·kg-1时菌根侵染率显著低于0.5 g·kg-1和1.0 g·kg-1时的菌根侵染率(P < 0.05)。无论是否接种AM真菌,仅1.5 g·kg-1 NaCl处理显著降低了地上部干质量和总干质量(P < 0.05)。4种NaCl处理下,AM真菌显著增加了地上部干质量和总干质量;而仅在NaCl处理为0 g·kg-1和0.5 g·kg-1时,AM真菌显著增加了根部干质量(P < 0.05)。4种盐度下,AM真菌使得总生物量分别显著增加了23.85%、18.04%、16.95%和28.97%。
|
|
表 2 AM真菌对不同盐度土壤中向日葵菌根侵染率和生物量的影响 Table 2 Effects of AM fungi on mycorrhizal colonization and biomass of sunflower grown in soil with different salinity |
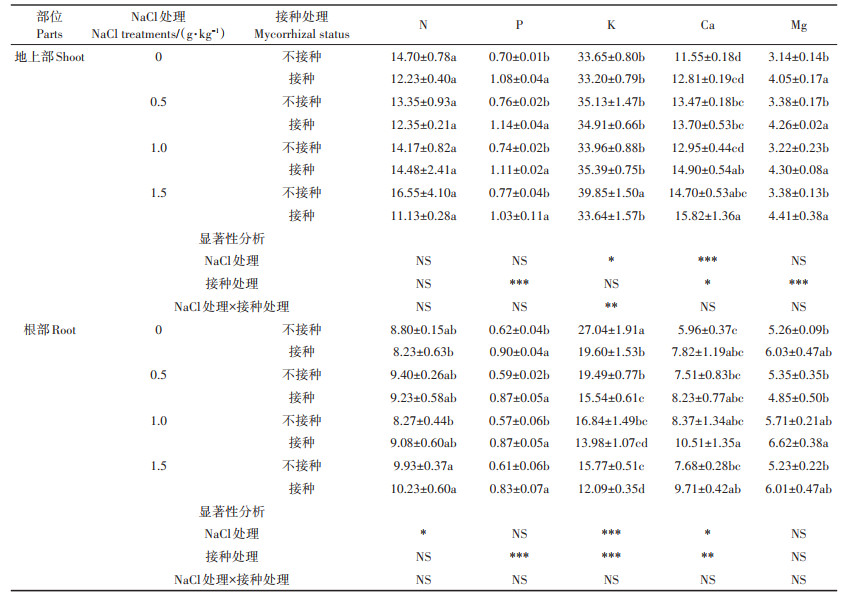
AM真菌对向日葵N、P、K、Ca和Mg含量的影响如表 3所示。无论是否接种AM真菌,NaCl处理均显著降低了根部K含量;不接种AM真菌时,1.5 g·kg-1 NaCl处理显著增加了地上部K含量,0.5 g·kg-1和1.5 g·kg-1 NaCl处理显著增加了地上部Ca含量;接种AM真菌时,1.0 g·kg-1和1.5 g·kg-1 NaCl处理显著增加了地上部Ca含量(P < 0.05)。4种NaCl处理下,AM真菌使得地上部和根部P含量分别显著增加了33.77%~ 54.29%和36.07%~52.63%(P < 0.05)。当NaCl处理为1.5 g·kg-1时,AM真菌显著降低了地上部和根部K含量,而当NaCl处理为0 g·kg-1和0.5 g·kg-1时,AM真菌仅显著降低了根部K含量(P < 0.05)。AM真菌显著提高了1.0 g·kg-1 NaCl处理下地上部Ca含量(P < 0.05)。相同NaCl处理下,AM真菌使得地上部Mg含量显著提高了26.04%~33.54%(P < 0.05)。
|
|
表 3 AM真菌对不同盐度土壤中向日葵地上部和根部N、P、K、Ca和Mg含量的影响(mg·g-1) Table 3 Effects of AM fungi on the content of N, P, K, Ca and Mg of shoot and root of sunflower grown in soil with different salinity(mg·g-1) |
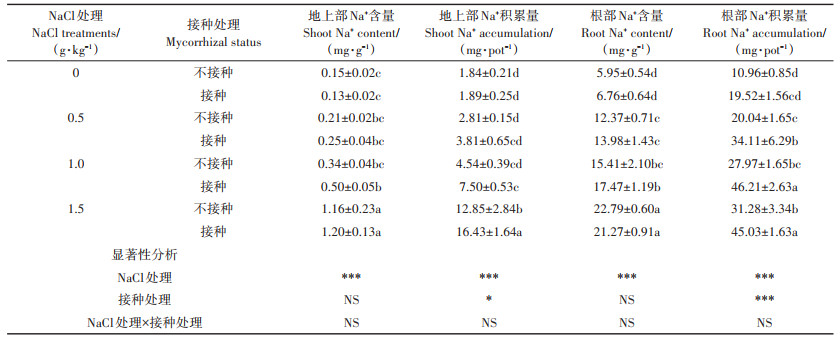
AM真菌对向日葵Na+吸收的影响如表 4所示。不接种AM真菌时,仅1.5 g·kg-1 NaCl处理地上部Na+含量和积累量显著增加;接种AM真菌时,1.0 g·kg-1和1.5 g·kg-1 NaCl处理地上部Na+含量和积累量显著增加;无论是否接种AM真菌,NaCl处理均使得根部Na+含量和积累量显著增加。在不同盐度土壤中,AM真菌处理没有显著影响地上部和根部Na+含量(P> 0.05)。仅当NaCl为1.5 g·kg-1时,AM真菌使得地上部Na+积累量显著增加27.86%(P < 0.05);NaCl为0.5、1.0、1.5 g·kg-1时,AM真菌使得根部Na+积累量分别显著增加了70.21%、65.21%和43.96%(P < 0.05)。
|
|
表 4 AM真菌对不同盐度土壤中向日葵Na+吸收的影响 Table 4 Effects of AM fungi on Na+ uptake of sunflower grown in soil with different salinity |
AM真菌对向日葵抗氧化酶活性和丙二醛含量的影响如表 5所示。不接种AM真菌时,仅1.5 g·kg-1 NaCl处理POD活性显著降低,MDA含量显著提高(P < 0.05)。当NaCl为1.0 g·kg-1和1.5 g·kg-1时,AM真菌使得叶片POD活性分别显著提高24.46%和19.81%(P < 0.05);当NaCl为0 g·kg-1时,AM真菌使得CAT活性显著提高85.58%(P < 0.05);仅在NaCl为1.5 g·kg-1时,AM真菌使得MDA含量显著降低31.91%(P < 0.05)。
|
|
表 5 AM真菌对不同盐度土壤中向日葵抗氧化酶活性和膜系统的影响 Table 5 Effects of AM fungi on membrane system and antioxidant enzyme activity of sunflower grown in soil with different salinity |
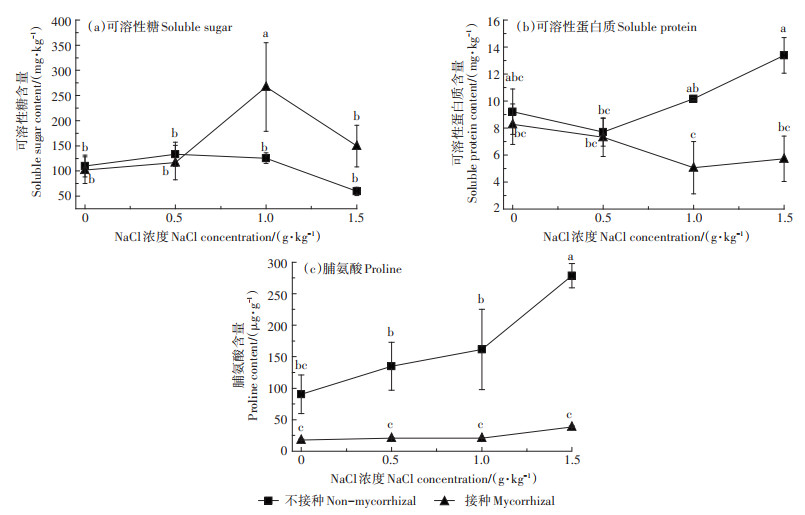
AM真菌对向日葵渗透平衡物质含量的影响见图 1。结果显示,当NaCl为1.0 g·kg-1时,AM真菌使得叶片可溶性糖含量显著提高了112.60%(P < 0.05)。当NaCl为1.0 g·kg-1和1.5 g·kg-1时,AM真菌使得可溶性蛋白质含量分别显著降低了50.10%和57.25%(P < 0.05)。4种NaCl处理下,AM真菌使得叶片脯氨酸含量分别显著降低了80.26%、84.74%、87.05%和86.11%(P < 0.05)。
|
不同字母表示在P < 0.05水平差异显著。下同 Different letters indicate significant differences(P < 0.05). The same below 图 1 AM真菌对不同盐度土壤中向日葵渗透平衡物质含量的影响 Figure 1 Effects of AM fungi on the content of osmotic balance substances of sunflower grown in soil with different salinity |
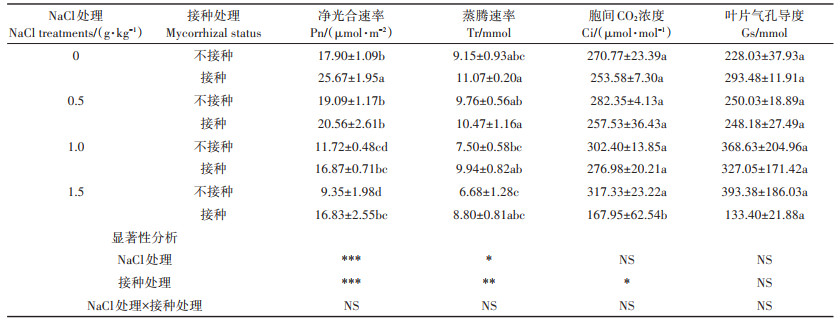
AM真菌对向日葵光合作用的影响如表 6所示,对向日葵水分利用率的影响如图 2所示。不接种AM真菌时,1.0 g·kg-1和1.5 g·kg-1 NaCl处理显著降低了净光合速率,接种AM真菌时,0.5、1.0 g·kg-1和1.5 g·kg-1 NaCl处理显著降低了净光合速率,1.5 g·kg-1 NaCl处理显著降低了叶片胞间CO2浓度。AM真菌使得0 g·kg-1和1.5 g·kg-1 NaCl处理净光合速率分别显著增加了43.41%和80.00%(P < 0.05)。仅在1.5 g·kg-1 NaCl处理时,AM真菌使得叶片胞间CO2浓度显著降低了47.07%(P < 0.05)。AM真菌对蒸腾速率和叶片气孔导度均无显著影响。4种NaCl处理下,AM真菌使得水分利用率分别显著提高了13.64%、13.66%、8.93%和14.97%(P < 0.05)。
|
|
表 6 AM真菌对不同盐度土壤中向日葵光合指标的影响 Table 6 Effects of AM fungi on photosynthesis index of sunflower grown in soil with different salinity |

|
图 2 AM真菌对不同盐度土壤中向日葵水分利用率的影响 Figure 2 Effects of AM fungi on the water use efficiency of sunflower grown in soil with different salinity |
菌根侵染率是表征AM真菌和宿主之间亲和力的重要指标,能够衡量其生态适应性[9]。本试验结果显示,当NaCl处理为0.5~1.0 g·kg-1时,显著增加了向日葵根系菌根侵染率;而当NaCl处理为1.5 g·kg-1时却又降低了菌根侵染率。Yano-Melo等[10]在研究菌根香蕉植物(Musa sp. cv. Pacovan)对盐胁迫的耐受性时发现,在土壤电导率为0.72~7.39 dS·m-1范围内,接种A. scrobiculata菌根侵染率与土壤盐分呈正相关,而接种G. clarum和G. etunicatum侵染率则随着土壤盐度的增加呈现先升高后降低趋势。土壤中较高的盐分可以抑制孢子的萌发、形成以及菌丝在宿主根系的生长,从而降低AM真菌对宿主根系的侵染[11]。研究表明,土壤盐度可显著影响向日葵根系的菌根侵染率,盐对菌根侵染率的影响可能与植物和AM真菌种类有关。
3.2 AM真菌对向日葵生长和矿质营养元素吸收的影响生物量是植物在逆境胁迫下生长状况的直接体现,也是反映逆境中植物耐受性的重要指标。研究已证明,AM真菌可显著地促进盐胁迫下植物的生长[12],其机制可能是根外菌丝数量增加,扩大了植物根系的吸收范围,增强了对营养元素和水分的吸收[13]。本研究结果显示,F. mosseae显著改善了不同盐度土壤向日葵的生长状况,可能是AM真菌的接种促进了盐胁迫下向日葵对磷的吸收、增加了POD活性、促进了脯氨酸积累、提高了光合速率和水分利用率。
矿质元素是植物正常生长发育所必需的,可通过改变植物的生长方式、生理机制等来增加植物对盐渍化土壤的抵抗能力。研究表明,AM真菌的根外菌丝能够促使植株从土壤中吸收养分磷,从而提供了植物生长所需磷量的80%。本研究中,在盐胁迫下接种F. mosseae显著提高了向日葵对磷的吸收,也使得向日葵地上部镁含量显著增加了26.04%~33.54%,与已有研究结果相同[12, 14]。盐胁迫下,AM真菌促进植物对镁的吸收,可缓解叶绿素的降解,保护叶绿体膜结构的完整性,提高植物的光合作用效率[15]。
3.3 AM真菌对向日葵Na+吸收的影响本研究显示,AM真菌没有显著影响植株中Na+的含量,但显著增加了1.5 g·kg-1 NaCl处理时向日葵地上部Na+积累量和0.5~1.5 g·kg-1 NaCl处理时根部Na+积累量。Mohammad等[16]研究发现,只有在较高盐分浓度(16.6 dS·m-1)时,接种混合菌种或接种G. intraradices可显著降低大麦地上部的Na+含量,中等盐分浓度(6.2 dS·m-1)和低盐分浓度(2.4 dS·m-1)时对Na+含量无显著影响。申连英等[17]研究显示,从枝菌根使酸枣(Zizyphus spinosus Hu)实生苗根部积累大量的Na+,含量显著高于不接种植株。然而,李涛等[18]研究表明,当NaCl浓度为100 mmol·L-1时,接种G. mosseae后大豆(Glycine max)地上部Na+含量显著降低,接种50 mmol·L-1和150 mmol·L-1时无显著差异。因此,AM真菌对植物Na+吸收和积累的影响可能与植物类型、AM真菌种类和土壤中盐分浓度相关。
3.4 AM真菌对向日葵抗氧化酶活性和膜系统的影响过氧化物酶POD是植物细胞体内清除活性氧自由基防御系统中一类重要的保护酶,可以消除植物细胞内的活性氧,防止膜脂过氧化。在本研究中,当NaCl处理为1.0~1.5 g·kg-1时,AM真菌显著提高了向日葵叶片POD活性。黄寿臣等[19]的研究显示,在盐含量为0.394%时,接种R. intraradice与C. etunicatum使白花三叶草(Trifolium repens L.)叶片POD活性增加了295.97~100.41 U·g-1。MDA含量是反映细胞膜脂过氧化作用强弱和质膜损伤程度的重要指标。在盐胁迫下,接种G. mosseae使芦笋(Asparagus officinalis L.)叶片MDA含量显著降低[20],与本研究结果相似。研究表明,AM真菌可以通过增加植物抗氧化酶活性和减轻膜脂过氧化程度,提高向日葵对盐胁迫的抵抗能力。
可溶性糖、可溶性蛋白质和脯氨酸是很多耐盐植物体内积累的渗透调节物质。本研究发现,仅1.0 g·kg-1 NaCl处理AM真菌显著提高了向日葵叶中可溶性糖含量。张爱娣等[21]研究发现,在0~15 mg·g-1 NaCl胁迫下,接种G. mosseae提高了大叶女贞(Ligustrum lucidum)可溶性糖含量,但仅在3~15 mg· g-1时有显著差异。4种NaCl处理下,AM真菌使得脯氨酸含量显著降低,与Echeverria等[22]的研究结果一致;但Oliveira等[23]的研究则表明,AM真菌显著提高了盐胁迫下植物的脯氨酸含量。盐胁迫下接种AM真菌对植物渗透调节系统的影响过程是复杂的,需进一步深入探索,可能与宿主植物类型、AM真菌种类、胁迫时间以及土壤生态环境等多重因素有关。
3.5 AM真菌对向日葵光合作用和水分利用率的影响光合作用为植物生长发育提供能量和物质,盐胁迫可通过抑制植物的光合作用来间接地影响植物的生长[24]。本研究显示,AM真菌显著增加了0~1.5 g· kg-1 NaCl处理下的净光合速率。王志刚等[25]认为AM真菌提高盐渍化土壤上植物光合作用的原因可能是外生菌丝不断延伸并产生庞大的菌丝网,促进养分吸收供地上部生长,从而提高光合速率。
盐胁迫与水分胁迫常相伴而生,因此提高植物的水分利用率是增加植物耐盐碱性的重要机制。贺忠群[26]对番茄的研究表明,在0~1% NaCl处理下接种G.mosseae的植株叶片水分利用率提高了19.1%~ 65.1%。与上述研究结果相同,本研究显示AM真菌显著提高了向日葵的水分利用率,增强了抵抗盐胁迫的能力。目前,对于AM真菌改善植物水分利用状况的解释主要认为菌丝比植物根系更细,可吸收非菌根植物不能利用的水分,扩大根系的吸收范围,并且AM真菌菌丝具有无横隔结构的特点,水分在菌丝中的流动速度远大于在根系中的速度,从而提高了植物对水分的吸收利用率[27]。植物在抵抗盐碱胁迫过程中,菌根改善植物水分状况可能起到了重要作用。
4 结论(1)盐胁迫显著抑制了向日葵的生长,促进其对Na+的吸收和积累,使得叶片POD活性、净光合速率、蒸腾速率和水分利用率显著降低,MDA和脯氨酸含量显著增加。
(2)接种AM真菌显著改善了不同盐度土壤中向日葵的生长,促进了向日葵对Na+的积累。
(3)AM真菌可通过促进向日葵对磷的吸收,提高POD活性,增加渗透调节物质可溶性糖含量,提高净光合速率、蒸腾速率和水分利用率等,增强向日葵对盐胁迫的抵抗能力。
| [1] |
Lin J X, Li Z L, Shuai S, et al. Effects of various mixed salt-alkaline stress conditions on seed germination and early seedling growth of Leymus chinensis from Songnen grassland of China[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca, 2014, 42(1): 154-159. |
| [2] |
韩剑宏, 李艳伟, 张连科, 等. 生物炭和脱硫石膏对盐碱土壤基本理化性质及玉米生长的影响[J]. 环境工程学报, 2017, 11(9): 5291-5297. HAN Jian-hong, LI Yan-wei, ZHANG Lian-ke, et al. Effect of biochar and FGD-gypsum application on soil basic physical and chemical properties and maize growth of saline soil[J]. Chinese Journal of Environmental Engineering, 2017, 11(9): 5291-5297. |
| [3] |
Selvakumar G, Kim K Y, Hu S J, et al. Effect of salinity on plants and the role of arbuscular mycorrhizal fungi and plant growth-promoting rhizobacteria in alleviation of salt stress[M]//Ahmad P, Wanim R. Volume 1: Physiological mechanisms and adaptation strategies in plants under changing environment. New York: Springer Science, 2014: 115-144.
|
| [4] |
张晓光, 黄标, 梁正伟, 等. 松嫩平原西部土壤盐碱化特征研究[J]. 土壤, 2013, 45(2): 332-338. ZHANG Xiao -guang, HUANG Biao, LIANG Zheng -wei, et al. Study on salinization characteristics of surface soil in western Songnen Plain[J]. Soils, 2013, 45(2): 332-338. |
| [5] |
Santander C, Aroca R, Ruiz-Lozano J M, et al. Arbuscular mycorrhiza effects on plant performance under osmotic stress[J]. Mycorrhiza, 2017, 27(3): 1-19. |
| [6] |
Wu N, Li Z, Liu H G, et al. Influence of arbuscular mycorrhiza on photosynthesis and water status of Populus cathayana Rehder males and females under salt stress[J]. Acta Physiologiae Plantarum, 2015, 37(9): 183. DOI:10.1007/s11738-015-1932-6 |
| [7] |
Jia T T, Wang J, Chang W, et al. Proteomics analysis of E. angustifolia seedlings inoculated with arbuscular mycorrhizal fungi under salt stress[J]. Int J Mol Sci, 2019, 20(3): 788. DOI:10.3390/ijms20030788 |
| [8] |
杜善周, 毕银丽, 王义, 等. 丛枝菌根对神东煤矿区塌陷地的修复作用与生态效应[J]. 科技导报, 2010, 28(7): 41-44. DU Shan-zhou, BI Yin-li, WANG Yi, et al. The reclamation and ecological effects of arbuscular mycorrhiza on subsided land in Shendong coal mine areas[J]. Science & Technology Review, 2010, 28(7): 41-44. |
| [9] |
王晓英, 王冬梅, 陈保冬, 等. 丛枝菌根真菌群落对白三叶草生长的影响[J]. 生态学报, 2010, 30(6): 1456-1462. WANG Xiao-ying, WANG Dong-mei, CHEN Bao-dong, et al. Growth response of white clover to inoculation with different arbuscular mycorrhizal fungi communities[J]. Acta Ecologica Sinica, 2010, 30(6): 1456-1462. |
| [10] |
Yano-Melo A M, Saggin O J, J r, et al. Tolerance of mycorrhized banana(Musa sp. cv. Pacovan)plantlets to saline stress[J]. Agriculture Ecosystems & Environment, 2003, 95(1): 343-348. |
| [11] |
Chen J, Zhang H Q, Zhang X L, et al. Arbuscular mycorrhizal symbiosis alleviates salt stress in black locust through improved photosynthesis, water status, and K+/Na+ homeostasis[J]. Frontiers in Plant Science, 2017, 8: 1739. DOI:10.3389/fpls.2017.01739 |
| [12] |
Wang Y, Wang M, Li Y, et al. Effects of arbuscular mycorrhizal fungi on growth and nitrogen uptake of Chrysanthemum morifolium under salt stress[J]. PLoS ONE, 2018, 13(4): 1-14. |
| [13] |
刘欢, 姚拓, 李建宏, 等. 丛枝菌根真菌对番茄生长的影响[J]. 甘肃农业大学学报, 2017, 52(4): 75-81. LIU Huan, YAO Tuo, LI Jian-hong, et al. Effect of various arbuscular mycorrhizal fungi on growth of tomato[J]. Journal of Gansu Agricultural University, 2017, 52(4): 75-81. |
| [14] |
Asrar A A, Abdel-Fattah G M, Elhindi K M. Improving growth, flower yield, and water relations of snapdragon(Antirhinum majus L.)plants grown under well-watered and water-stress conditions using arbuscular mycorrhizal fungi[J]. Photosynthetica, 2012, 50(2): 305-316. |
| [15] |
徐瑶, 樊艳, 俞云鹤, 等. 丛枝菌根真菌对盐胁迫下红花幼苗生长及耐盐生理指标的影响[J]. 生态学杂志, 2014, 33(12): 3395-3402. XU Yao, FAN Yan, YU Yun-he, et al. Effects of arbuscular mycorrhizal fungus on the growth and physiological salt tolerance parameters of Carthamus tinctorius seedlings under salt stress[J]. Chinese Journal of Ecology, 2014, 33(12): 3395-3402. |
| [16] |
Mohammad M J, Malkawi H I, Shibli R. Effects of arbuscular mycorrhizal fungi and phosphorus fertilization on growth and nutrient uptake of barley grown on soils with different levels of salts[J]. Journal of Plant Nutrition, 2003, 26(1): 125-137. DOI:10.1081/PLN-120016500 |
| [17] |
申连英, 毛永民, 鹿金颖, 等. 丛枝菌根对酸枣实生苗耐盐性的影响[J]. 土壤学报, 2004, 41(3): 426-433. SHEN Lian-ying, MAO Yong-min, LU Jin-ying, et al. Effect of arbuscular mycorrhizae on salt tolerance of wild jujube(Zizyphus spinosus Hu)seedlings[J]. Acta Pedologica Sinica, 2004, 41(3): 426-433. |
| [18] |
李涛, 刘润进, 陈敏, 等. 盐渍条件下AM真菌对大豆生长和离子含量的影响[J]. 菌物学报, 2009, 28(3): 410-414. LI Tao, LIU Run-jin, CHEN Min, et al. Effects of arbuscular mycorrhizal fungi on growth and ionic content of Glycine max seedlings under saline conditions[J]. Mycosystema, 2009, 28(3): 410-414. |
| [19] |
黄寿臣, 陈飞, 李丽丽, 等. 松嫩平原盐碱土AM真菌对白花三叶草生长及生理生化的影响[J]. 贵州农业科学, 2017, 45(7): 61-67. HUANG Shou-chen, CHEN Fei, LI Li-li, et al. Effect of AMF on growth and physio-biochemistry of Trifolium repens under stress of salt alkaline soil in Songnen Plain[J]. Guizhou Agricultural Sciences, 2017, 45(7): 61-67. |
| [20] |
曹岩坡, 代鹏, 戴素英. 丛枝菌根真菌(AMF)对盐胁迫下芦笋植株渗透调节物质及抗氧化酶活性的影响[J]. 西南大学学报(自然科学版), 2017, 39(5): 43-48. CAO Yan-po, DAI Peng, DAI Su-ying. Effects of arbuscular mycorrhiza fungi(AMF)on osmoregulation substances and antioxidant enzyme activities of asparagus officinalis L.under salt stress[J]. Journal of Southwest University(Natural Science Edition), 2017, 39(5): 43-48. |
| [21] |
张爱娣, 郑仰雄, 黄东兵. 丛枝菌根真菌对大叶女贞耐盐性的影响[J]. 江苏农业科学, 2018, 46(19): 129-133. ZHANG Ai-di, ZHENG Yang-xiong, HUANG Dong-bing. Effects of arbuscular mycorrhizal fungi on salt tolerance of Ligustrum lucidum[J]. Jiangsu Agricultural Sciences, 2018, 46(19): 129-133. |
| [22] |
Echeverria M, Sannazzaro A I, Ruiz O A, et al. Modulatory effects of Mesorhizobium tianshanense and Glomus intraradices on plant proline and polyamine levels during early plant response of Lotus tenuis to salinity[J]. Plant and Soil, 2012, 364(1/2): 69-79. |
| [23] |
Oliveira D F B, Endres L, Silva J V, et al. Pre-colonized seedlings with arbuscular mycorrhizal fungi:An alternative for the cultivation of Jatropha curcas L. in salinized soils[J]. Theoretical and Experimental Plant Physiology, 2017, 29(3): 129-142. DOI:10.1007/s40626-017-0089-7 |
| [24] |
Zhang T, Hu Y J, Zhang K, et al. Arbuscular mycorrhizal fungi improve plant growth of Ricinus communis by altering photosynthetic properties and increasing pigments under drought and salt stress[J]. Industrial Crops and Products, 2018, 117: 13-19. DOI:10.1016/j.indcrop.2018.02.087 |
| [25] |
王志刚, 毕银丽, 李强, 等. 接种AM真菌对采煤沉陷地复垦植物光合作用和抗逆性的影响[J]. 南方农业学报, 2017, 48(5): 800-805. WANG Zhi-gang, BI Yin-li, LI Qiang, et al. Effects of arbuscular mycorrhizal fungus on photosynthesis and stress resistance of reclamation plants in coal mining subsidence areas[J]. Journal of Southern Agriculture, 2017, 48(5): 800-805. |
| [26] |
贺忠群.丛枝菌根真菌(AMF)提高番茄耐盐性机制的研究[D].杨凌: 西北农林科技大学, 2007. HE Zhong-qun. Studies on mechanisms of salt tolerance improved by arbuscular mycorrhizal fungi(AMF)in tomato[D]. Yangling: Northwest A&F University, 2007. |
| [27] |
Allen M F. Influence of vesicular-arbuscular mycorrhizae on water movement through Bouteloua gracilis(H.B.K.)Lag Ex Steud[J]. New Phytologist, 1982, 91(2): 191-196. DOI:10.1111/j.1469-8137.1982.tb03305.x |
 2020, Vol. 37
2020, Vol. 37