2. 沈阳农业大学植物保护学院, 沈阳 100161
2. Plant Protection College, Shenyang Agricultural University, Shenyang 100161, China
生物入侵和重金属污染均是全球变化背景下存在的普遍且严重的环境问题,近年来入侵植物适生生境出现重金属污染现象,研究入侵植物对重金属的耐受性对该入侵种的防控意义重大[1]。入侵种在逆境下可以通过调节其形态特征和内在生理机制适应新生境,生理生态适应性的获得是入侵性形成的基础之一[2]。表型可塑性是指同一基因型个体由于环境条件的改变而发生表型变化的能力[3],即生物可以在不同的环境中表现出不同的行为、形态或生理特征,从而在不同空间和时间的环境中提高其耐受性[4],是环境适应性获得的一种方式。表型可塑性与植物的入侵性密切相关,能影响外来植物的形态和地理分布特征,是其蔓延扩张的重要机制。面对同样的资源条件,表型可塑性强的物种对胁迫生境的耐受性强,资源可获得性也强,因此更具入侵性[5-6]。重金属污染生境对植物的生长、保护酶活性及脂膜过氧化作用均有影响,有些会直接表现在植物的各组织器官等表型特征上,且在不同植物间影响差异较大[7-8],而入侵植物往往表现出较强的耐受性,所以其在重金属污染生境中生态适应性的获得机制在近几年颇受关注[9]。
黄顶菊(Flaveria bidentis)为一年生草本,菊科,堆心菊族,黄菊属[10]。原产地为南美洲,2001年在天津市与河北衡水湖首次被发现,其具有较强的适生能力,能够迅速占据新生境的生态位并向周边地区扩散。黄顶菊具有喜光、喜湿、耐盐等生态习性,生境范围非常广,尤其偏爱干扰后的生境[11],且农田是黄顶菊在天津地区主要发生生境之一,黄顶菊的入侵对我国的粮食生产造成了巨大的损失[12]。近年来,天津地区农田土壤Cd污染严重,Cd含量相当于土壤背景值(0.090 mg·kg-1)的4倍[13]。然而,关于Cd污染生境对黄顶菊入侵性影响的报道还非常少。因此,本研究通过网室试验,人工模拟不同浓度Cd污染农田,对黄顶菊生长、生物量、保护酶活性等指标进行测定与分析,计算黄顶菊对Cd的富集参数,研究其生长及生理生态特性对Cd胁迫的可塑性响应,并进一步探讨其对重金属环境的生态适应性,为黄顶菊入侵的研究和防控措施的选择提供理论依据。
1 材料与方法 1.1 试验材料黄顶菊种子采自天津静海团泊水库,为2016年收获的新鲜种子。供试土壤采集于农业农村部环境保护科研监测所网室(39°05′ N,117°08′ E),土壤类型为潮土,装盆前统一过筛确保盆中土壤粒径均匀。土壤的基本理化性质:pH 7.78,全磷含量0.542 g· kg-1,速效磷含量3.708 mg·kg-1,全氮含量0.486 g· kg-1,有机质含量11.530 g·kg-1,土壤中镉的本底含量0.086 mg·kg-1。试验添加的Cd源为CdCl2·2.5H2O粉末,与土拌匀后平衡2个月后备用。
1.2 试验设计2017年4—9月开展网室盆栽试验,试验容器为25 cm×35 cm的塑料花盆,每盆装土7.5 kg。2017年4月15日,选择健康饱满的黄顶菊种子播种于育苗盘,培养至2~3片真叶,选择长势一致的幼苗进行移栽,每个处理移栽10盆,每盆定苗2株,共移栽40盆。设置CK(0 mg·kg-1 Cd)、Cd1(2 mg·kg-1 Cd)、Cd2(4 mg·kg-1 Cd)和Cd3(8 mg·kg-1 Cd)共4个Cd胁迫处理。基肥中N含量为175 mg·kg-1,P2O5含量为120 mg·kg-1,K2O含量为50 mg·kg-1,移苗后以水溶液的形式施肥一次。各处理每2 d浇水一次,每15 d随机转盆一次以消除局部环境条件差异的影响。
1.3 测定指标与方法 1.3.1 生长指标的测定于2017年9月20日(胁迫处理92 d),即黄顶菊生长后期,采集整株植株,进行生长指标的测定。用卷尺测定黄顶菊的株高与根长,株高为黄顶菊植株根颈部到主茎顶部之间的距离,根长测定植株主根系。
1.3.2 生物量测定随机选取三盆完整植株,将黄顶菊植株以及花盆中的泥全部挖出,将其用清水冲洗干净,将水中残留的根系用镊子挑选出来,然后将根、茎和叶分开,于105 ℃杀青2 h,75 ℃烘72 h后测定质量,总生物量为根、茎和叶生物量之和。
1.3.3 保护酶活性测定于2017年8月20日(胁迫处理61 d),即黄顶菊生长盛期,采集从植株顶端开始第4~6对叶龄、叶位和长势一致的新鲜叶片,锡纸包裹且液氮速冻后,存放于-70 ℃冰箱中,用于保护酶活性的测定。采用氮蓝四唑光化还原法测定黄顶菊叶片的超氧化物歧化酶(SOD)活性,紫外吸收法测定黄顶菊叶片的过氧化氢酶(CAT)活性,愈创木酚法测定黄顶菊叶片的过氧化物酶(POD)活性,硫代巴比妥酸法测定黄顶菊叶片的丙二醛(MDA)含量[14]。
1.3.4 植物和土壤样品测定于2017年9月20日(胁迫处理92 d),即黄顶菊生长成熟期,每个处理随机采集3个植物样品,烘干后称取根、茎和叶各组织植物样品0.25 g,用HNO3法消化,电感耦合等离子体质谱仪(ICP-MS)测定Cd含量。
植物样品采集后,收集植物样品所在盆栽的土壤,风干后过2 mm尼龙筛,称取0.25 g土壤样品用HNO3法消化,电感耦合等离子体质谱仪(ICP-MS)测定Cd含量。
1.3.5 黄顶菊富集和耐性指数计算[15]地上部和根部Cd生物富集系数(Bio-concentration factor,BCF)的计算公式:

|
转移系数(Translocation factor,TF)的计算公式:

|
植株地上部耐性指数(Tolerance index,TI)的计算公式:

|
各指标表型可塑性指数(PPI)计算方法为不同处理下某一指标的最大值减去其最小值再除以最大值[16]。
1.4 数据分析试验结果用Origin 9.1整理,用SPSS 17.0统计软件对不同浓度Cd胁迫下各指标进行单因素方差分析,并利用Tukey test法进行差异显著性检验(α=0.05)。
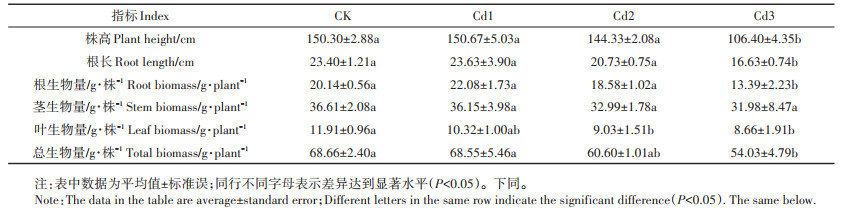
2 结果与讨论 2.1 不同浓度Cd处理对黄顶菊生长及生物量的影响由表 1可知,低(2 mg·kg-1)、中浓度(4 mg·kg-1)Cd胁迫下黄顶菊株高和根长与对照组相比无显著变化,而在高浓度(8 mg·kg-1)Cd胁迫处理下黄顶菊的株高和根长分别较对照组显著降低了29.21%和28.93%(P < 0.05);各浓度Cd处理下黄顶菊茎生物量变化不显著,且低、中浓度Cd处理对其根生物量和总生物量影响不显著,但高浓度Cd胁迫处理显著降低了植株的根生物量、叶生物量和总生物量,分别较对照组显著降低了33.52%、27.29%和21.31%,在中浓度Cd处理下黄顶菊根生物量、叶生物量和总生物量分别较对照组降低了7.75%、24.18%和11.74%。
|
|
表 1 Cd胁迫对黄顶菊生长特性的影响 Table 1 Effects of Cd treatments on growth characteristics of Flaveria bidentis |
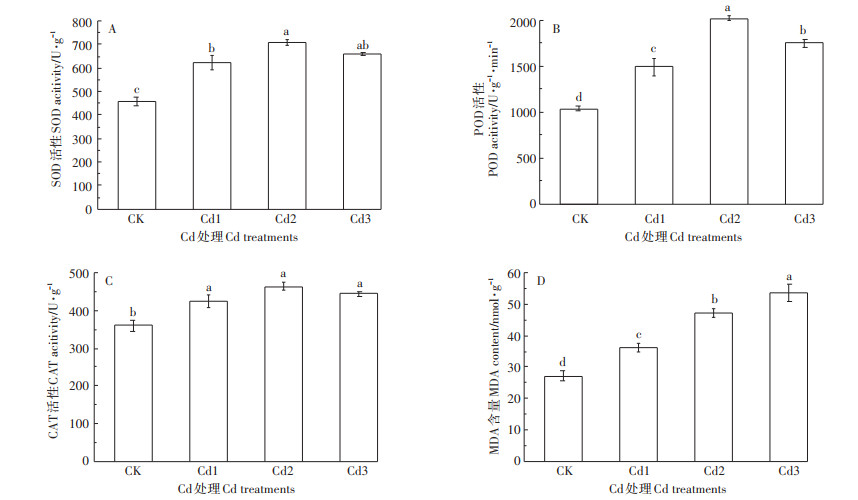
醛含量的影响黄顶菊的SOD活性(图 1A)、POD活性(图 1B)和CAT活性(图 1C)在Cd胁迫处理下均随着胁迫浓度的增加呈现先升高后降低的趋势,且各处理下酶活性均显著高于对照组,并在Cd2处理下达到最大值,其中Cd2处理下黄顶菊SOD活性、POD活性和CAT活性分别较对照组显著升高了53.70%、94.22%和29.08%(P < 0.05);MDA含量随着Cd浓度的升高呈现逐渐增加的趋势(图 1D),Cd1、Cd2和Cd3处理下黄顶菊叶片MDA含量分别较对照组显著增加了32.71%、73.44%和97.28%(P < 0.05)。
|
图 1 不同浓度Cd胁迫下黄顶菊植物保护酶活性 Figure 1 Effects of Cd treatments on plant protective enzyme activity of Flaveria bidentis |
对黄顶菊的根部进行DCFH-DA染色(图 2),植物细胞内的活性氧可以将无荧光的DCFH氧化成有荧光的DCF,因此可以通过观察黄顶菊根部DCF的荧光强度来检测细胞内活性氧的水平。CK、Cd1和Cd2处理下DCF荧光强度差异不明显,Cd3处理下荧光强度增强,绿色程度显著加深,表明Cd3胁迫处理下黄顶菊根部细胞活性氧增多。
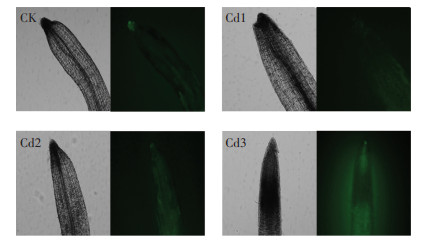
|
图 2 Cd胁迫对黄顶菊根部活性氧的影响 Figure 2 Effects of Cd treatments on active oxygen in roots of Flaveria bidentis |
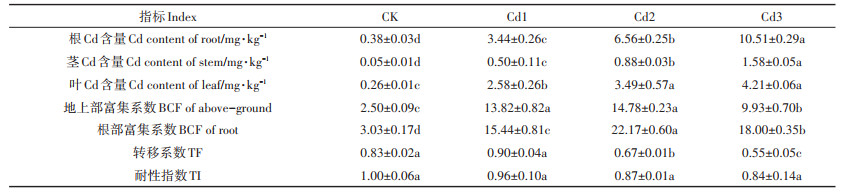
由表 2可知,在重金属Cd处理下,Cd含量在黄顶菊植株中整体呈现出根 > 叶 > 茎的规律,且黄顶菊各组织中Cd含量随着胁迫浓度的升高也呈现显著增加的趋势。其中,Cd3、Cd2和Cd1处理下黄顶菊根组织中Cd含量分别较对照组显著升高了26.66、16.26和8.05倍(P < 0.05);对各处理下黄顶菊Cd的富集系数、转移系数和耐性指数进行分析,可知黄顶菊的地上部富集系数、根部富集系数和转移系数均随着Cd浓度的升高呈现先升高后降低的趋势,说明在高浓度Cd胁迫下黄顶菊对重金属Cd的吸收与转移能力变弱,黄顶菊对Cd的耐性指数随着重金属浓度的升高呈现逐渐降低的趋势,但其变化不显著(P > 0.05)。
|
|
表 2 Cd处理下黄顶菊Cd富集系数、转移系数和耐性指数 Table 2 Cd bio-concentration factor(BCF), translocation factor (TF) and tolerance index(TI) of Flaveria bidentis under Cd treatments |
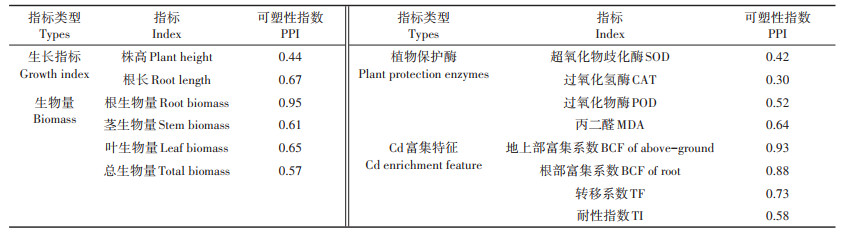
由表 3可知,在不同浓度Cd处理下,黄顶菊的生物量和Cd富集特征指标的表型可塑性指数整体较高,其中根生物量和叶生物量的表型可塑性指数分别为0.95和0.65,地上部富集系数、根部富集系数和转移系数的表型可塑性指数分别为0.93、0.88和0.73,说明黄顶菊在受到重金属胁迫时,可能主要通过维持根和叶生物量积累营养物质,并通过调节Cd在体内的积累量适应污染生境。
|
|
表 3 Cd处理对黄顶菊可塑性指数的影响 Table 3 Effects of Cd treatments on phenotypic plasticity index(PPI) of Flaveria bidentis |
研究表明,重金属超过一定浓度会对植物生长和生物量产生影响[17],主要表现出植株矮小、根生长受抑制和生物量下降等症状[18]。外来入侵植物或许对重金属具有较高耐受性。本研究中,黄顶菊的株高和根长在低、中浓度Cd处理下无显著变化,可能是其根系细胞中的谷胱甘肽和含硫化合物与Cd2+形成稳定的螯合物,对Cd2+起到截留作用,从而降低Cd对其的毒害作用[19-20],说明黄顶菊对重金属Cd具有一定的耐受性;而在高浓度Cd处理下黄顶菊株高与根长较对照组显著降低,这与简敏菲等[21]的研究结果一致,可能因Cd是植物体内非必需元素,不参与植物的代谢与物质合成,因此过量积累会对植物产生毒害作用[22]。生物量是判定植物耐性大小的指标之一,且生物量减少20%是植物耐性的上限标准[15]。本研究中,高浓度Cd胁迫处理下黄顶菊根生物量、叶生物量和总生物量降幅均大于20%,而在中浓度处理下只有叶生物量的降幅大于20%,说明黄顶菊在低、中浓度Cd生境下有较高的耐受性,而高浓度Cd胁迫才显著限制其生长。植物能够对Cd产生抗逆性,而达到一定的浓度才会影响其生长发育[23],可能是由于一定程度的逆境胁迫可开启植物保护系统[24]。入侵植物互花米草在高浓度重金属Cd污染下生物量和光合指标受到大幅抑制,但是在低、中浓度污染下变化不显著,这是其蔓延扩张的机制之一[25],这与本研究中黄顶菊生长及生物量指标变化趋势一致,说明黄顶菊在Cd污染生境下适应性较强。
当植物的生长环境受到逆境胁迫时会产生活性氧,导致脂膜过氧化和离子外渗等情况出现[26-28]。植物体内存在的酶促防御系统在遭受逆境胁迫后启动其保护机制,防止脂膜过氧化发生[29]。丙二醛是植物体内活性氧增加后导致细胞膜不饱和脂肪酸氧化的产物,其含量可以直接反映脂膜过氧化程度[30],本研究中黄顶菊叶片的丙二醛含量在Cd胁迫下较对照组显著升高,说明黄顶菊保护酶系统调节能力下降,细胞膜受损严重。DCFH-DA染色显示中、高浓度Cd胁迫下黄顶菊根尖活性氧积累较多,而SOD的主要功能是清除超氧阴离子自由基,POD和CAT的主要作用是分解H2O2,SOD、POD和CAT活性均随Cd浓度的升高呈现先升后降的趋势,但均显著高于对照组,这可能是由于环境胁迫能够一定程度促进抗氧化酶活性的升高[31],随着胁迫剂量的增加,抗氧化酶活性反而会受到抑制[32]。入侵植物喜旱莲子草幼苗在低温胁迫处理12 h后SOD、POD和CAT活性显著升高,随后活性逐渐下降[33]。黄顶菊在Cd胁迫下抗氧化酶活性的变化趋势与以上研究一致,可见两种入侵植物在逆境生境下具有相似的适应机制。
本研究中,Cd在黄顶菊植株体内的含量表现为根 > 叶 > 茎的规律,说明Cd主要积累在黄顶菊的根部,根部富集系数大于地上部,且转移系数均小于1,这可能是由于根系是植物与土壤直接接触的器官,根部大量的微生物有利于吸收并固定重金属离子,从而增强根部对重金属的富集能力[34-35],这也是黄顶菊适应重金属生境的一种表现形式,将大部分Cd积累在根部,阻止Cd2+向地上部运输,从而降低对地上部光合作用以及代谢酶活性的影响[36],也说明黄顶菊对Cd的转移能力较差。入侵植物假苍耳地上部与地下部富集系数分别达11.39和4.18,且转移系数分别为4.43和11.71,属于超富集植物,可用于重金属污染废弃地的修复与治理,而黄顶菊对Cd的富集与转移系数均小于1,说明黄顶菊不是对Cd吸收较强的超富集植物[37],但黄顶菊对Cd的耐性指数在各处理下变化不显著,也表明其对Cd有一定的耐受性。
环境条件复杂的新生境下,入侵物种强大的适应能力是其入侵成功的关键,大量研究表明表型可塑性在植物成功入侵新生境过程中发挥了重要作用。对庄稼地、林缘、弃耕地和公路边四种小生境下银胶菊的形态特征与生殖配置进行可塑性分析,发现生殖配置方面显示的可塑性更为突出,是其成功入侵的重要机制[38]。王宁等[39]研究发现入侵植物节节麦通过改变生物量分配模式对土壤水分变化有一定的适应性。本研究中,在Cd胁迫下黄顶菊根生物量、叶生物量和Cd富集特征的可塑性指数均较高,其他指标表型可塑性指数较低,说明在适应Cd污染环境的过程中,黄顶菊通过维持根生物量与叶生物量积累营养物质供自身生长发育,并调节根部与地上部对Cd的富集与转移以适应Cd污染生境。Wang等[40]研究也认为入侵植物的根生物量在入侵过程中起重要作用。也有研究认为逆境条件下植物生长指标较高的可塑性水平可能对生理指标可塑性起补偿作用[41],这也可能是黄顶菊在低、中浓度Cd胁迫下可以正常生长的原因。
4 结论(1)黄顶菊对Cd污染的耐受性受多因素的共同调节,且各生理生态指标的响应规律与胁迫强度有关。黄顶菊在低、中浓度Cd污染下有较强的耐受性,且抗氧化酶活性增强,而高浓度Cd污染下植物的调节能力减弱。
(2)黄顶菊植株体内Cd含量表现为根 > 叶 > 茎的规律,且高浓度Cd胁迫下其富集与转移能力降低。
(3)表型可塑性分析表明黄顶菊主要通过维持根和叶生物量过程积累营养物质,重新分配Cd在体内的富集与转移来适应Cd污染生境。
| [1] |
蔡红红, 黄凯, 宋由页, 等. 全球变化下的重金属污染与外来植物入侵[J]. 江苏农业科学, 2016, 44(12): 49-53. CAI Hong-hong, HUANG Kai, SONG You-ye, et al. Heavy metal pollution and alien plant invasion under global changes[J]. Jiangsu Agricultural Science, 2016, 44(12): 49-53. |
| [2] |
Byers J E. Physical habitat attribute mediates biotic resistance to nonindigenous species invasion[J]. Oecologia, 2002, 130(1): 146-156. |
| [3] |
Pichancourt J B, Klinken R D. Phenotypic plasticity influences the size, shape and dynamics of the geographic distribution of an invasive plant[J]. PLoS ONE, 2012, 7(2): e0032323. |
| [4] |
Esmaeilzadeh M, Karbassi A, Bastami K D. Antioxidant response to metal pollution in Phragmites australis from Anzali wetland[J]. Marine Pollution Bulletin, 2017, 119(1): 376-380. |
| [5] |
Huang Q Q, Pan X Y, Fan Z W, et al. Stress relief may promote the evolution of greater phenotypic plasticity in exotic invasive species:A hypothesis[J]. Ecology & Evolution, 2015(6): 1169-1177. |
| [6] |
Lamarque L J, Porté A J, Eymeric C, et al. A test for pre-adapted phenotypic plasticity in the invasive tree Acer negundo L[J]. PLoS ONE, 2013, 8(9): e0074239. |
| [7] |
陈良华, 赖娟, 胡相伟, 等. 接种丛枝菌根真菌对受镉胁迫美洲黑杨雌、雄株光合生理的影响[J]. 植物生态学报, 2017, 41(4): 480-488. CHEN Liang-hua, LAI Juan, HU Xiang-wei, et al. Effects of inoculation with arbuscular mycorrhizal fungi on photosynthetic physiology in females and males of Populus deltoides exposed to cadmium pollution[J]. Chinese Journal of Plant Ecology, 2017, 41(4): 480-488. |
| [8] |
Hu G T, Yang X, Chen X M, et al. Physiological responses of bamboowillow plants to heavy metal stress[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3870-3875. |
| [9] |
陈权, 马克明. 互花米草入侵对红树林湿地沉积物重金属累积的效应与潜在机制[J]. 植物生态学报, 2017, 41(4): 409-417. CHEN Quan, MA Ke-ming. Effects of Spartina alterniflora invasion on enrichment of sedimental heavy metals in a mangrove wetland and the underlying mechanisms[J]. Chinese Journal of Plant Ecology, 2017, 41(4): 409-417. |
| [10] |
李香菊, 王贵启, 张朝贤, 等. 外来植物黄顶菊的分布、特征特性及化学防除[J]. 杂草科学, 2006, 24(4): 58-61. LI Xiang-ju, WANG Gui-qi, ZHANG Chao-xian, et al. Distribution, characteristics and chemical control of exotic plant Flaveria bidentis[J]. Weed Science, 2006, 24(4): 58-61. |
| [11] |
张秀红, 李跃, 韩会智, 等. 黄顶菊生物学特性及防治对策[J]. 河北林业科技, 2006, 32(1): 48-49. ZHANG Xiu-hong, LI Yue, HAN Hui-zhi, et al. Biological characteristics and control strategies of Flaveria bidentis[J]. Hebei Forestry Science and Technology, 2006, 32(1): 48-49. |
| [12] |
韩建华. 天津市农业外来入侵植物黄顶菊疫情分析及防治对策[J]. 天津农林科技, 2017(6): 13-15. HAN Jian-hua. Analysis on the epidemic situation of the alien invasive plant Flaveria bidentis in Tianjin and its prevention and control measures[J]. Tianjin Agriculture and Forestry Science and Technology, 2017(6): 13-15. |
| [13] |
许萌萌, 刘爱风, 师荣光, 等. 天津农田重金属污染特征分析及降雨沥浸探究[J]. 环境科学, 2018, 39(3): 1-11. XU Meng-meng, LIU Ai-feng, SHI Rong-guang, et al. Characteristics of heavy metals pollution of farmland and the leaching effect of rainfall in Tianjin[J]. Environmental Science, 2018, 39(3): 1-11. |
| [14] |
张蜀秋. 植物生理学实验技术教程[M]. 北京: 科学出版社, 2011: 191-194. ZHANG Shu-qiu. Plant physiology experiment technology tutorial[M]. Beijing: Science Press, 2011: 191-194. |
| [15] |
李云, 张世熔, 张少卿, 等. 野茼蒿对镉的富集及其镉耐性[J]. 农业环境科学学报, 2012, 31(7): 1296-1302. LI Yun, ZHANG Shi-rong, ZHANG Shao-qing, et al. Cadmium tolerance and accumulation characteristics of Crassocephalum crepidioides[J]. Journal of Agro-Environment Science, 2012, 31(7): 1296-1302. |
| [16] |
Valladares F, Wright S J, Lasso E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest[J]. Ecology, 2000, 81(7): 1925-1936. |
| [17] |
Appenroth K. Definition of "heavy metals" and their role in biological systems[M]//Sherameti I, Varma A. Soil heavy metals. Springer Nature, 2010: 19-29.
|
| [18] |
Maathuis F J. Physiological functions of mineral macronutrients[J]. Current Opinion in Plant Biology, 2009, 12(3): 250-258. |
| [19] |
Benavides M P, Gallego S M, Tomaro M L. Cadmium toxicity in plants[J]. Braz J Plant Physiol, 2005, 17(1): 21-34. |
| [20] |
刘柿良, 石新生, 潘远智, 等. 镉胁迫对长春花生长、生物量及养分积累与分配的影响[J]. 草业学报, 2013, 22(3): 154-161. LIU Shi-liang, SHI Xin-sheng, PAN Yuan-zhi, et al. Effects of cadmium stress on growth, accumulation and distribution of biomass and nutrient in Catharanthus roseus[J]. Acta Prataculturae Sinica, 2013, 22(3): 154-161. |
| [21] |
简敏菲, 张乖乖, 史雅甜, 等. 土壤镉、铅及其复合污染胁迫对丁香蓼(Ludwigia prostrata)生长和光合荧光特性的影响[J]. 应用与环境生物学报, 2017, 23(5): 837-844. JIAN Min-fei, ZHANG Guai-guai, SHI Ya-tian, et al. Effects of single and combined pollution stress of cadmium and lead in soil on the growth and photosynthetic fluorescence characteristics of Ludwigia prostrate[J]. Chin J Appl Environ Biol, 2017, 23(5): 837-844. |
| [22] |
杨雪艳, 蒋代华, 史进纳, 等. "双耐"细菌-香根草对铅镉复合污染土壤的修复机理[J]. 应用与环境生物学报, 2016, 22(5): 884-890. YANG Xue-yan, JIANG Dai-hua, SHI Jin-na, et al. Remediation mechanism of "double-resistant" bacteria-Vetiveria zizanioides on Cd and Pb contaminated soil[J]. Chin J Appl Environ Biol, 2016, 22(5): 884-890. |
| [23] |
Liu J N, Zhou Q X, Sun T, et al. Growth responses of three ornamental plants to Cd and Cd-Pb stress and their metal accumulation characteristics[J]. Journal of Hazardous Materials, 2008, 151(1): 261-267. |
| [24] |
王晓娟, 王文斌, 杨龙, 等. 重金属镉(Cd)在植物体内的转运途径及其调控机制[J]. 生态学报, 2015, 35(23): 7921-7929. WANG Xiao-juan, WANG Wen-bin, YANG Long, et al. Transport pathways of cadmium(Cd) and its regulatory mechanisms in plant[J]. Acta Ecologica Sinica, 2015, 35(23): 7921-7929. |
| [25] |
王天弘.铅镉污染对互花米草生长的影响[D].南京: 南京大学, 2013. WANG Tian-hong. The effect of lead and cadmium pollution on growth of Spartina alterniflora[D]. Nanjing: Nanjing University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10284-1015575753.htm |
| [26] |
Rocca N L, Andreoli C, Giacometti G M, et al. Responses of the antarctic microalga Koliella antarctica(Trebouxiophyceae, Chlorophyta) to cadmium contamination[J]. Photosynthetica, 2009, 47(3): 471-479. |
| [27] |
Schieber M, Chandel N. ROS function in redox signaling and oxidative stress[J]. Current Biology, 2014, 24(10): 453-462. |
| [28] |
Sebastian A, Prasad M N. Iron-and manganese-assisted cadmium tolerance in Oryza sativa L.:Lowering of rhizotoxicity next to functional photosynthesis[J]. Planta, 2015, 241(6): 1519-1528. |
| [29] |
Rahoui S, Chaoui A, Elferjani E. Membrane damage and solute leakage from germinating pea seed under cadmium stress[J]. Journal of Hazardous Materials, 2010, 178(1): 1128-1131. |
| [30] |
黄运湘, 廖柏寒, 王志坤. 超积累植物的富集特征及耐性机理[J]. 湖南农业大学学报(自然科学版), 2005, 31(6): 693-697. HUANG Yun-xiang, LIAO Bo-han, WANG Zhi-kun. The characteristics of bioaccumulation and tolerance mechanism of hyperaccumulator[J]. Journal of Hunan Agricultural University(Natural Sciences), 2005, 31(6): 693-697. |
| [31] |
Wu F F, Zheng Y F, Wu R J, et al. Concentration of O3 at the atmospheric surface affects the changes characters of antioxidant enzyme activities in Triticum aestivum[J]. Acta Ecologica Sinica, 2011, 31(14): 4019-4026. |
| [32] |
黄亚萍, 俎丽红, 沈广爽, 等. 铅胁迫对蜀葵重金属积累及抗氧化酶活性的影响[J]. 农业环境科学学报, 2017, 36(9): 1746-1752. HUANG Ya-ping, ZU Li-hong, SHEN Guang-shuang, et al. Effects of lead stress on accumulation ability and antioxidant enzyme activities of Althaea rosea Cavan[J]. Journal of Agro-Environment Science, 2017, 36(9): 1746-1752. |
| [33] |
许凯扬, 叶万辉, 沈浩, 等. 低温胁迫下喜旱莲子草幼苗膜脂过氧化及保护酶活性的变化[J]. 生态科学, 2006, 25(2): 139-142. XU Kai-yang, YE Wan-hui, SHEN Hao, et al. Changes in membrane lipid peroxidation and activities of cell protective enzyme in leaves of Alternanthera philoxeroides seedling under low temperature stress[J]. Ecologic Science, 2006, 25(2): 139-142. |
| [34] |
李铭红, 李侠, 宋瑞生, 等. 受污农田中农作物对重金属Pb的富集特征研究[J]. 农业环境科学学报, 2006, 25(S1): 109-113. LI Ming-hong, LI Xia, SONG Rui-sheng, et al. Accumulation of lead (Pb) in crops grown in polluted farmland[J]. Journal of Agro-Environment Science, 2006, 25(S1): 109-113. |
| [35] |
Zurayk R, Sukkariyah B, Baalbaki R. Common hydrophytes as bioindicators of nickel, chromium and cadmium pollution[J]. Water, Air, & Soil Pollution, 2001, 127(1/2/3/4): 373-388. |
| [36] |
黄白飞, 辛俊亮. 植物积累重金属的机理研究进展[J]. 草业学报, 2013, 22(1): 300-307. HUANG Bai-fei, XIN Jun-liang. Advances in research on the mechanism of plant accumulation of heavy metals[J]. Acta Prataculturae Sinica, 2013, 22(1): 300-307. |
| [37] |
祖元刚, 张晓楠, 任之光, 等. 入侵植物假苍耳对土壤中铜、铅重金属污染的富集特征[J]. 植物研究, 2010, 30(5): 612-616. ZU Yuan-gang, ZHANG Xiao-nan, REN Zhi-guang, et al. Cu, Pb accumulation of invasive plant Iva xanthifolia[J]. Bulletin of Botanical Research, 2010, 30(5): 612-616. |
| [38] |
蒲高忠, 唐赛春, 潘玉梅, 等. 入侵植物银胶菊在不同生境下表型可塑性和构件生物量[J]. 广西植物, 2010, 30(5): 641-646. PU Gao-zhong, TANG Sai-chun, PAN Yu-mei, et al. Phenotypic plasticity and modular biomass of invasive Parthenium hysterophorus in different habitats in south China[J]. Guihaia, 2010, 30(5): 641-646. |
| [39] |
王宁, 袁美丽, 王磊, 等. 入侵植物节节麦表型可塑性及竞争能力对模拟氮沉降的响应[J]. 草地学报, 2018, 26(6): 1428-1434. WANG Ning, YUAN Mei-li, WANG Lei, et al. The response of phenotypic plasticity and competitive ability of Aegilops tauschii Coss. to simulated nitrogen diposition[J]. Acta Agrestia Sinica, 2018, 26(6): 1428-1434. |
| [40] |
Wang C Y, Zhou J W, Liu J, et al. Differences in functional traits and reproductive allocations between native and invasive plants[J]. Journal of Central South University, 2018, 25(3): 516-525. |
| [41] |
Delagrange S, Messier C, Lechowicz M J, et al. Physiological, morphological and allocational plasticity in understory deciduous trees:Importance of plant size and light availability[J]. Tree Physiology, 2004, 24(7): 775-784. |
 2020, Vol. 37
2020, Vol. 37