重金属一般指密度大于5.0 g·cm-3的金属,如Cu、Pb、Zn、Cd、Hg、Cr等,其中大部分重金属并非生命活动所必需[1]。由于一般重金属在微量水平即可产生显著毒性效应,不能被微生物降解,且被生物体摄取后能在较高级的生物体内富集,能与生物高分子(如蛋白质、酶等)发生强烈相互作用而使其失去活性,同时也可累积在某些器官中造成累积性中毒[2-3],因此,重金属污染的治理已经成为环境保护领域中亟待解决的重大问题之一。重金属废水是重金属迁移并造成污染的一种主要形式,是对环境污染最严重、对人类危害最大的工业废水之一[4]。处理重金属废水的方法有很多种,包括化学沉淀、离子交换、膜分离、电化学去除和吸附等[5]。
吸附法是一种较为高效、经济的重金属废水处理方法。目前应用最多的吸附剂是活性炭,但其价格昂贵、再生率低,限制了其大规模应用。近年来,研究者开始利用农林废弃植物吸附剂吸附、分离和提取废水中重金属离子,该方法因具有吸附速度快、成本低、操作简单、环境友好等特点而独具优势[6]。目前,国内外学者研究较广的农林废弃植物吸附剂主要为花生壳、椰子壳、稻壳、锯末、麦秸、蔗渣等[7-9],而利用黄麻制备吸附剂处理重金属废水的研究甚少。
黄麻(Corchorus capsularis L)为椴树科(Tiliaceae)黄麻属(Corchorus)一年生草本植物,是一种来源丰富、价格低廉的天然可再生资源。前期研究发现,黄麻对重金属Cr、Cd、Cu、Pb等具有很强的吸附性能[10-12]。同时发现,黄麻叶片中含有果胶等多糖类物质,而这些物质又富含-OH和-NH2等基团,对重金属具有更强的吸附能力。因此利用黄麻叶去除污水中的重金属具有低成本、高效且环境友好的现实意义。但黄麻种质繁多,且不同种质叶片的产量、多糖物质种类和含量等存在较大差异,影响其对重金属的吸附性能及应用。因此,为挖掘叶片产量高且对重金属吸附能力强的黄麻种质,本研究以国内外不同黄麻种质为原料,比较了不同黄麻种质的干叶产量及其对重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)和络阴离子Cr(Ⅵ)的去除效果,为筛选、开发适合重金属吸附的黄麻种质提供理论依据。
1 材料与方法 1.1 试验设计与方法参试黄麻种质材料包括栽培种、野生种、长果种和圆果种,共36份。田间试验于2017年5—9月在中国农业科学院麻类研究所白箬铺基地进行。试验田内土质为黄壤,肥力中等,常年种植黄麻,冬季闲置。试验采取随机区组设计,3次重复,小区面积1.2 m2,每小区种植2行,行距30 cm,每行采用随机撒播的形式。整地、施肥、田间管理等按一般大田生产进行。待黄麻苗长至成熟期(即开花后、结果前),于9月5日收获全部新鲜黄麻叶,自然晾晒至恒质量后,测定质量、记录各黄麻种质的干叶产量。将黄麻干叶经粉碎机粉碎后,得到尺寸为30~250 μm的实验用黄麻叶粉末样品,置于密封袋中储存备用。
1.2 重金属吸附实验用去离子水将一定量的Cu(NO3)2·3H2O、Pb(NO3)2、Cd(NO3)2·4H2O和K2Cr2O7溶解,配制成100 mg·L-1的Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)、Cr(Ⅵ)溶液,备用。每个样品按如下步骤处理:取100 mL重金属溶液置于250 mL锥形瓶中,用0.5 mol·L-1的HCl和NaOH调节溶液pH值为6,加入0.1 g不同种质黄麻叶粉末,置于25 ℃恒温振荡器上,以150 r·min-1转速反应24 h,达到平衡后,取出2 mL混合液,以8000 r·min-1转速离心分离5 min,取0.5 mL上清液,定容到50 mL。用原子吸收分光光度法测定上清液中Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)的浓度,并用二苯基碳酰二肼分光光度法,于540 nm波长下,测定上清液中Cr(Ⅵ)的浓度。并按以下公式计算黄麻干叶对各重金属离子的吸附容量。
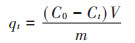
|
(1) |
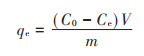
|
(2) |
式中:qt和qe分别为t时刻和平衡时的吸附容量,mg· g-1;C0、Ct和Ce分别为重金属离子的初始浓度、t时刻浓度和平衡浓度,mg·L-1;V为重金属溶液的体积,L;m为黄麻干叶的投加量,g。
1.3 数据处理实验数据用Excel 2007软件进行初步处理后,采用SPSS 19.0统计软件进行单因素方差分析(Oneway ANOVA),若组间差异显著,则采用Duncan法进行多重比较,显著水平为P < 0.05。实验结果以平均值±标准差表示。
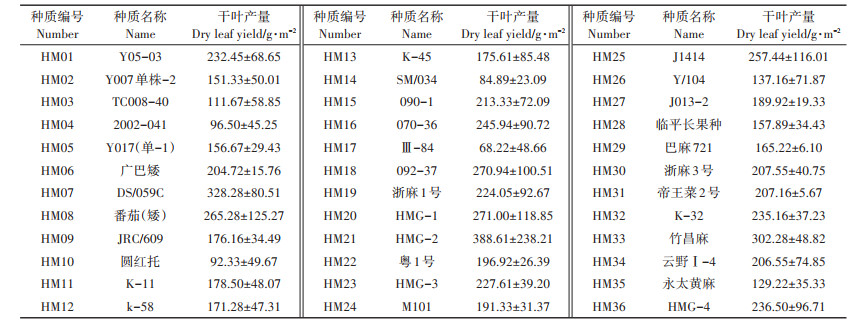
2 结果与讨论 2.1 黄麻种质干叶产量不同种质间相关功能基因的差异,导致种质间具有较大表型差异。本研究测定了36份黄麻种质的干叶产量,结果(表 1)发现不同黄麻种质的干叶产量差异很大,其中,干叶产量较高的种质编号是HM07、HM21和HM33,而干叶产量较低的种质编号是HM10、HM14和HM17,且干叶产量最大值(HM21)是最小值(HM17)的5.70倍。
|
|
表 1 36份黄麻种质的干叶产量 Table 1 The dry leaf yield of 36 jute germplasm |
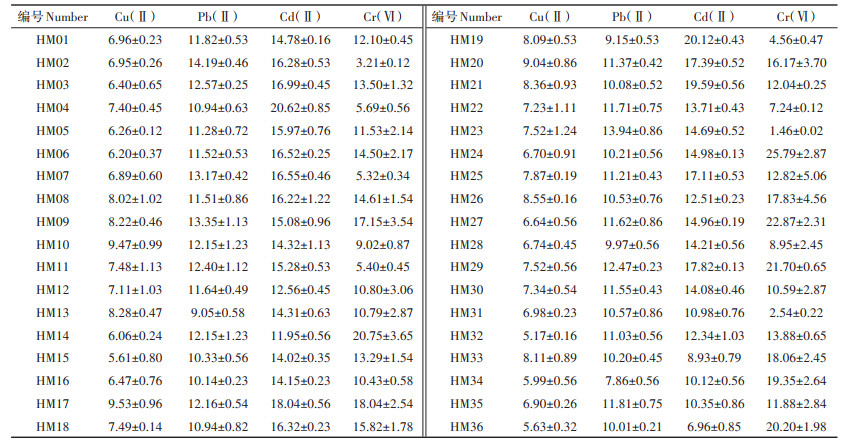
不同种质叶片中吸附重金属的有效成分的种类及含量,影响其对重金属的吸附性能。本实验考察了36个黄麻种质的干叶对重金属离子Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)和Cr(Ⅵ)的去除效果,结果见表 2。由表 2可知,不同黄麻种质的干叶对同种重金属的去除效果各异,且同一种质对不同重金属的去除效果也不同。其中部分种质,如HM02、HM23、HM31等,对重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的去除效果明显优于络阴离子Cr(Ⅵ),这可能是因为黄麻叶中含有较多纤维素、半纤维素等多糖物质,其分子结构中富含羟基、羧基等带负电的含氧活性官能团,能与带正电的金属离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)发生静电作用或离子交换,有利于其在黄麻叶表面的吸附[10]。由表 2可知,大部分黄麻种质干叶,如HM01、HM04、HM24等,对重金属阳离子具有一定的选择吸附特性,且选择性吸附顺序为Cu(Ⅱ) < Pb(Ⅱ) < Cd(Ⅱ)。36份黄麻种质中,干叶对Cd(Ⅱ)和Pb(Ⅱ)的最高吸附容量分别可达20.62、14.19 mg·g-1,而对Cu(Ⅱ)的吸附容量最高则仅为9.53 mg·g-1,这种差异性吸附可能与重金属的电负性、离子半径大小和核质比差异等相关,使其与吸附位点具有不同的配位能力[13]。而干叶对Cr(Ⅵ)的去除效果受种质的影响较大,其中HM24对Cr(Ⅵ)的吸附容量最大,为25.79 mg· g-1,而HM23对Cr(Ⅵ)几乎没有吸附效果,其吸附容量仅为1.46 mg·g-1。
|
|
表 2 36份黄麻种质干叶对重金属Cu(Ⅱ)、Pb(Ⅱ)、Cd(Ⅱ)和Cr(Ⅵ)的吸附容量(mg·g-1) Table 2 The adsorption capacity of Cu(Ⅱ), Pb(Ⅱ), Cd(Ⅱ) and Cr (Ⅵ) by dry leaves of 36 jute germplasms(mg·g-1) |
因不同黄麻种质的干叶产量及其对重金属的去除效果不同,且两者分别影响叶用黄麻在重金属污水处理中的成本和吸附性能,因此,本研究依据干叶产量和吸附容量两方面进行综合评定,筛选出可用于重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)吸附的优势黄麻种质为HMG-1和HMG-2(编号为HM20和HM21),可用于络阴离子Cr(Ⅵ)吸附的优势黄麻种质为竹昌麻和HMG-4(编号为HM33和HM36),这些种质可作为吸附重金属叶用黄麻种质在生产上使用。
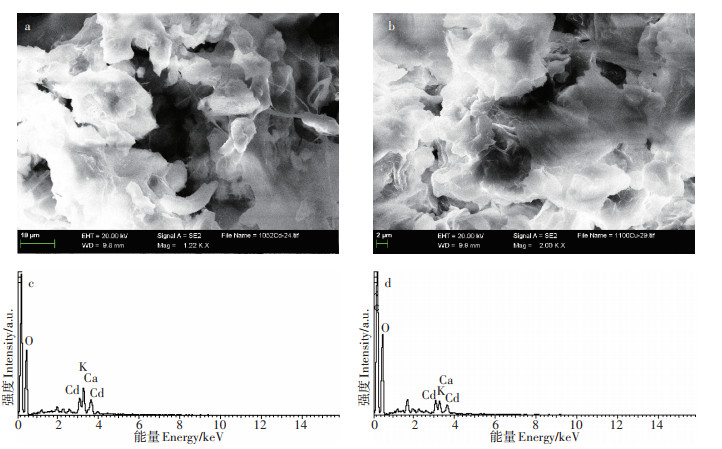
2.3 黄麻种质干叶差异性吸附机理研究基于以上研究结果,本实验以常见重金属污染物Cd(Ⅱ)为例,进一步分析比较高Cd(Ⅱ)吸附性叶用黄麻种质HM21(吸附容量为19.59 mg·g-1)和低Cd(Ⅱ)吸附性叶用黄麻种质HM36(吸附容量为6.96 mg·g-1)对Cd(Ⅱ)的差异性吸附。图 1a和1b分别为HM21和HM36叶片吸附Cd(Ⅱ)后的SEM图,图 1c和1d分别为HM21和HM36叶片吸附Cd(Ⅱ)后的EDS图。由SEM图可知,种质HM21和种质HM36的叶表形貌相似,叶片表面有孔洞,较粗糙;由EDS图可知,吸附在种质HM21叶表面的Cd(Ⅱ)的量高于HM36叶表面。
|
图 1 HM21(a,c)和HM36(b,d)叶片吸附Cd(Ⅱ)后的SEM图和EDS图 Figure 1 SEM images of HM21(a) and HM36(b) after Cd(Ⅱ) adsorption; EDS of HM21(c) and HM36(d) after Cd(Ⅱ) adsorption |
为了更进一步分析两种黄麻种质干叶对重金属Cd(Ⅱ)吸附的差异机制,本实验分别测定了HM21和HM36叶片的化学成分,结果(表 3)发现两种黄麻叶具有相似的有机组分,但组分含量不同。由表 3可知,HM21叶片中的纤维素、半纤维素和木质素都高于HM36,而HM21和HM36叶片中果胶的含量差异不明显,HM21叶片中可溶性糖含量则低于HM36,说明两种黄麻种质干叶对重金属Cd(Ⅱ)吸附的差异与叶片中纤维素、半纤维素和木质素的含量差异相关。纤维素是直链结构,每个聚合物链由7000~15 000个葡萄糖分子组成[14]。半纤维素由500~3000个糖单元组成的低分子量直链构成[15]。纤维素和半纤维素链中的官能团是脂肪族羟基(-OH)和醚(C-O-C)基团,而木质素是一种交联的外消旋大分子,分子量超过10 000 U[16]。它本身具有疏水性和芳香族特性,有三种香豆醇、松柏醇和芥子醇等甲氧基化程度不同的木质醇单体,这些单体以苯丙酸衍生物的形式存在于木质素中。木质素分子中广泛存在的官能团包括脂肪族和芳香族羟基、双键和苯基。
|
|
表 3 黄麻HM21和HM36叶的化学组成(g·kg-1) Table 3 Chemical composition of jute leaf in HM21 and HM36(g·kg-1) |
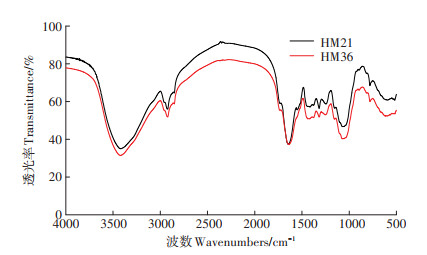
用傅里叶变换红外光谱仪(FTIR)分析了两个黄麻种质叶的红外光谱,发现两种黄麻叶的FTIR图谱中的特征峰基本相似,而峰强度的差异比较大(图 2),这是由于黄麻叶中活性官能团的含量不同。波数以3422 cm-1为中心的特征峰是由O-H键振动引起的,2924 cm-1特征峰是烷基C-H键振动引起的,而1644 cm-1峰则是由芳香族C=C键振动引起的,1240、1072 cm-1和776 cm-1特征峰则分别归因于C-O醇、C-O醚和芳香族C-H键的弯曲振动。由此可见,两种黄麻叶生物质中存在纤维素、半纤维素和木质素中富含的官能团,且官能团的含量差异因黄麻种质中多糖物质含量不同而不同。这些多糖物质的含量差异是影响黄麻种质间Cd(Ⅱ)吸附差异的主要原因。除此以外,植物叶片中还有一些其他物质,比如单宁酸、儿茶酸等也富含羟基(-OH)等利于重金属吸附的官能基团[17],其含量差异也可能影响黄麻叶对Cd(Ⅱ)的吸附。
|
图 2 HM21和HM36叶片的FTIR图 Figure 2 FTIR of HM21and HM36 |
吸附等温线是指在一定温度下溶质分子在两相界面上进行的吸附过程达到平衡时它们在两相中浓度之间的关系曲线。本实验中,用Langmuir吸附等温线模型和Freundlich吸附等温线模型来模拟黄麻叶粉末对重金属Cd(Ⅱ)的吸附。Langmuir模型和Freundlich模型的方程式如下:
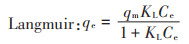
|
(3) |
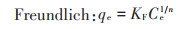
|
(4) |
式中:qe为吸附平衡时的吸附容量,mg·g-1;qm为最大吸附容量,mg·g-1;KL为Langmuir常数,L·mg-1;KF和1/n为Freundlich经验常数。KF和n值可以从lgqe和lgCe的线性函数的截距和斜率中得到。
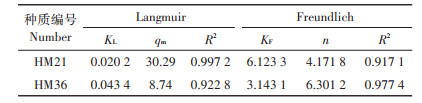
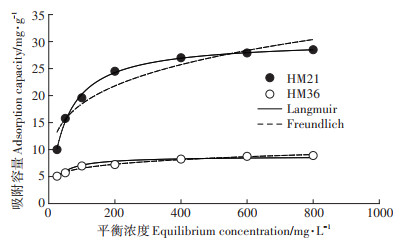
两个模型中的相应参数列于表 4。黄麻HM21和HM36干叶粉末吸附Cd(Ⅱ)的实验数据以及与Langmuir等温线和Freundlich等温线的拟合曲线见图 3。
|
|
表 4 黄麻HM21和HM36干叶粉末吸附重金属Cd(Ⅱ)的Langmuir和Freundlich参数 Table 4 Langmuir and Freundlich parameters of Cd(Ⅱ) adsorption by dried leaves of HM21 and HM36 |
|
图 3 HM21和HM36叶片吸附Cd(Ⅱ)的Langmuir和Freundlich等温线的拟合 Figure 3 Curves of Cd(Ⅱ) adsorption on HM21 and HM36 leaves fitted with Langmuir and Freundlich isotherms |
从表 4和图 3中可以看出,Langmuir等温线模型对黄麻HM21叶片吸附Cd(Ⅱ)的实验数据的拟合程度较好,有更高的决定系数(R2=0.997 2),因此,本研究可以假设吸附剂的表面形成了一个单纯的Cd(Ⅱ)覆盖层,所有的吸附位点都有相同的吸附能力,被吸附的吸附质之间没有任何相互作用和影响。为了确定HM21叶片是否对Cd(Ⅱ)的吸附过程有利,本实验用一个分离系数或平衡参数的无量纲常数RL[18]进行评估:
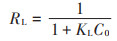
|
(5) |
不同RL值表示不同的意义:RL > 1代表不利于吸附,RL= 1代表吸附等温线呈线性,0 < RL < 1表示有利于吸附,而RL=0表示吸附不可逆。黄麻HM21叶片吸附Cd(Ⅱ)的实验过程中,所有RL值都在0和1之间,表示HM21叶片有利于对Cd(Ⅱ)的吸附。此外,随着Cd(Ⅱ)初始浓度的增加,RL的值减小,说明更高的Cd(Ⅱ)初始浓度更有利于吸附过程。而黄麻HM36叶片对Cd(Ⅱ)吸附的实验数据与Freundlich等温线模型的拟合程度较好,说明Cd(Ⅱ)在HM36叶片表面的吸附状态与其在HM21叶片表面的吸附状态有所不同。
3 结论(1)不同黄麻种质的干叶对同种重金属的去除效果各异,同一种质对不同重金属的去除效果也不同。其中大部分种质对重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)的去除效果明显优于络阴离子Cr(Ⅵ)。
(2)本研究对36个黄麻种质的干叶产量和吸附容量两个指标进行综合评定,筛选出可用于重金属阳离子Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)吸附的优势黄麻种质为HMG-1和HMG-2,可用于络阴离子Cr(Ⅵ)吸附的优势黄麻种质为竹昌麻和HMG-4。
(3)黄麻种质HMG-2对Cd(Ⅱ)的吸附等温线符合Langmuir模型,最大理论吸附容量可达30.29 mg·g-1。
(4)差异性吸附研究发现,不同黄麻种质干叶对同种重金属的吸附容量不同,主要与黄麻叶片中的富含活性官能团的多糖物质,如纤维素、半纤维素和木质素等的含量有关。
| [1] |
Srivastava N K, Majumder C B. Novel biofiltration methods for the treatment of heavy metals from industrial wastewater[J]. Journal of Hazardous Materials, 2008, 151(1): 1-8. |
| [2] |
Liu L H, Li Y H, Liu X, et al. Chelating stability of an amphoteric chelating polymer flocculant with Cu(Ⅱ), Pb(Ⅱ), Cd(Ⅱ), and Ni(Ⅱ)[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2014, 118: 765-775. |
| [3] |
O'Connell D W, Birkinshaw C, O'Dwyer T F. Heavy metal adsorbents prepared from the modification of cellulose:A review[J]. Bioresource Technology, 2008, 99(15): 6709-6724. |
| [4] |
Liu L H, Wu J, Li X, et al. Synthesis of poly(dimethyldiallylammonium chloride-co-acrylamide)-graft-triethylenetetramine-dithiocarbamate and its removal performance and mechanism of action towards heavy metal ions[J]. Separation and Purification Technology, 2013, 103: 92-100. |
| [5] |
Barrera-Diaz C E, Lugo-Lugo V, Bilyeu B. A review of chemical, electrochemical and biological methods for aqueous Cr(Ⅵ) reduction[J]. Journal of Hazardous Materials, 2012, 223/224: 1-12. |
| [6] |
Sud D, Mahajan G, Kaur M P. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions:A review[J]. Bioresource Technology, 2008, 99(14): 6017-6027. |
| [7] |
Yang Z, Wang Y G, Jing Y J, et al. Preparation and modification of peanut shells and their application for heavy metals adsorption[J]. Bulgarian Chemical Communications, 2016, 48(3): 535-542. |
| [8] |
Olayinka K O, Alo B I, Adu T. Sorption of heavy metals from electroplating effluents by low-cost adsorbents Ⅱ:Use of waste tea, coconut shell and coconut husk[J]. Journal of Applied Sciences, 2007, 7(16): 2307-2313. |
| [9] |
Xu X Z, Geng W D, Song J, et al. Adsorption of Cd(Ⅱ) and Cu(Ⅱ) by epichlorohydrin and cysteine modified bagasse[J]. Asian Journal of Chemistry, 2011, 23(3): 1377-1380. |
| [10] |
邓灿辉, 粟建光, 陈基权, 等. 黄麻吸附材料的研究及应用前景[J]. 中国麻业科学, 2017, 39(6): 306-311. DENG Can-hui, SU Jian-guang, CHEN Ji-quan, et al. Research progress on removal of pollutant in wastewater with jute-based materials[J]. Plant Fiber Sciences in China, 2017, 39(6): 306-311. |
| [11] |
粟建光, 戴志刚, 杨泽茂, 等. 麻类作物特色资源的创新与利用[J]. 植物遗传资源学报, 2019, 20(1): 11-19. SU Jian-guang, DAI Zhi-gang, YANG Ze-mao, et al. Innovation and utilization of characteristic germplasm for bast fiber crops[J]. Journal of Plant Genetic Resources, 2019, 20(1): 11-19. |
| [12] |
李楠, 龚友才, 陈基权, 等. 黄麻对溶液中Cr(Ⅵ)的生物吸附效果及机理研究[J]. 工业水处理, 2015, 35(2): 79-83. LI Nan, GONG You-cai, CHEN Ji-quan, et al. Research on the biological adsorption effect of jute powder on Cr(Ⅵ) in aqueous solution and its mechanisms[J]. Industrial Water Treatment, 2015, 35(2): 79-83. |
| [13] |
Zhou G Y, Luo J L, Liu C B, et al. Efficient heavy metal removal from industrial melting effluent using fixed-bed process based on porous hydrogel adsorbents[J]. Water Research, 2018, 131: 246-254. |
| [14] |
Motawie A M, Mahmoud K F, El-Sawy A A, et al. Preparation of chitosan from the shrimp shells and its application for pre-concentration of uranium after cross-linking with epichlorohydrin[J]. Egyptian Journal of Petroleum, 2014, 23: 221-228. |
| [15] |
Balat M. Production of bioethanol from lignocellulosic materials via the biochemical pathway:A review[J]. Energy Conversion Management, 2011, 52: 858-875. |
| [16] |
Sadeek S A, Negm N A, Hefni H H H, et al. Metal adsorption by agricultural biosorbents:Adsorption isotherm, kinetic and biosorbents chemical structures[J]. International Journal of Biological Macromolecules, 2015, 81: 400-409. |
| [17] |
Bacelo H A M, Santos S C R, Botelho C M S. Tannin-based biosorbents for environmental applications:A review[J]. Chemical Engineering Journal, 2016, 303: 575-587. |
| [18] |
Anirudhan T S, Radhakrishnan P G. Thermodynamics and kinetics of adsorption of Cu(Ⅱ) from aqueous solutions onto a new cation exchanger derived from tamarind fruit shell[J]. The Journal of Chemical Thermodynamics, 2008, 40(4): 702-709. |
 2020, Vol. 37
2020, Vol. 37