农药是农业生产中不可或缺的生产资料,可以有效地保护作物免于病、虫、草害,从而增加作物的产量,提高品质[1-2]。然而,农药的大量使用也会污染土壤和水源,进而对包括人类在内的非靶标生物造成不利影响。Hao等[3]研究发现,有机氯农药禁用25年后,还可以在田间检测到其残留物,并且有机氯残留从最初的水稻田转移到了蔬菜田。Fenoll等[4]报道,三嗪类除草剂在土壤中具有较长的残留期,可以通过土壤淋溶污染地表水和地下水。美国环境保护署(USEPA)曾报道,常规农业施药已经导致至少46种农药进入地下水,76种农药进入地表水[5-6]。土壤和水环境中的农药残留可以通过食物链富集,最终影响人类健康[7-12]。因此开展土壤环境中的农药残留监测是保障土培作物安全的必要举措。
氯噻啉和呋喃虫酰肼是我国自主创制的杀虫剂品种,分别属于新烟碱类和昆虫生长调节剂类,它们都属于高效低毒的农药品种,是高毒有机磷类农药禁用后的有效替代品[13-14]。啶菌噁唑、丁吡吗啉和丁香菌酯是创制的杀菌剂品种,分别属于异噁唑啉类、肉桂酰胺类和嘧啶水杨酸类化合物[15],它们作用方式新颖、药效高,可以与市售的杀菌剂轮换使用,有效减轻植物病原菌的抗性问题。毒氟磷是创制的抗病毒剂,属于氟氨基膦酸酯类化合物[16],它的创制和应用,为我国植物病毒病的防控,提供了新的手段。目前,关于这几种农药残留检测的研究主要集中在番茄、苹果、水稻等作物,涉及到土壤中残留检测的报道较少,且主要是为了研究母体的降解半衰期,检出限较高[17-19]。因此缺少灵敏、高效的多残留分析方法来检测这些化合物在土壤中的实际残留水平及其对非靶标生物的风险。本研究旨在建立氯噻啉等6种农药在土壤中的多残留分析方法,并为其他种类的农药在土壤环境中的检测提供方法借鉴。
1 材料与方法 1.1 药剂与试剂氯噻啉(Imidaclothiz)标准品(含量≥95.0%)、呋喃虫酰肼(Fufenozide)标准品(含量≥95.0%),购自Dr. Ehrenstorfer公司(德国);啶菌噁唑(Pyrisoxazole)标准品(含量≥99.3%)、丁香菌酯(Coumoxystrobin)标准品(含量≥98.0%),购自沈阳化工研究院;丁吡吗啉(Pyrimorph)标准品(含量≥99.5%),由江苏耕耘化学有限公司提供;毒氟磷(Dufulin)标准品(含量≥99.0%),购自广西田园生化股份有限公司。色谱纯乙腈,购自德国默克公司;残留分析过程中的分析纯乙腈、甲酸、氯化钠、无水硫酸镁均购自北京试剂公司;弗罗里硅土、GCB(石墨化炭黑)、PSA(N-丙基乙二胺)、0.22 μm滤膜,购于天津博纳艾杰尔科技有限公司。
1.2 仪器与设备超高效液相色谱-串联四极杆液质联用仪(Acquity UPLC-TQS,美国Waters公司);PL203/01电子天平(瑞士梅特勒-托利多仪器有限公司);CK-2000振荡器(Thmorgan公司);TG16-WS台式离心机(长沙湘仪离心机有限公司);Milli-Q Reference超纯水系统(德国Merk公司)。
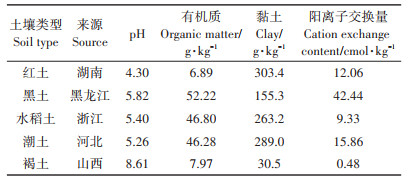
1.3 试验方法 1.3.1 土壤样品采集供试空白土壤样品为5种我国典型土壤:黑土、红土、潮土、褐土和水稻土,分别采集自黑龙江省、湖南省、河北省、山西省和浙江省。每个采样地随机选取15个采样点,采集0~30 cm土层土样,置于聚乙烯袋中。将土壤样品自然晾干,过1 mm筛,检测土壤理化性质。所有土壤样品于4 ℃保存,备用。
1.3.2 样品提取与净化称取5 g(精确至±0.01 g)土壤样品于50 mL离心管,加入5 mL超纯水浸润土壤样品,再加入10 mL乙腈,振荡提取10 min;再依次加入2.5 g无水硫酸镁和2.5 g氯化钠,振荡5 min,盐析,于4000 r·min-1下离心5 min;取1.5 mL红土及褐土上清液,过0.22 μm滤膜直接进样;取1.5 mL黑土、潮土和水稻土上清液,转移至含有50 mg弗罗里硅土、5 mg GCB和150 mg无水硫酸镁的2 mL离心管,涡旋1 min,10 000 r·min-1离心5 min,取上清过0.22 μm滤膜,进样。
1.3.3 色谱和质谱检测条件色谱条件:HSS色谱柱(2.1 mm×100 mm×1.7 mm);柱温40 ℃;样品室温度5 ℃;进样体积5 μL;流速0.3 mL·min-1;采用梯度洗脱,流动相A为0.2%甲酸水,B为乙腈,0 min,90% A;2 min,10% A;3.5 min,10% A;3.6 min,90% A;5 min,90% A。
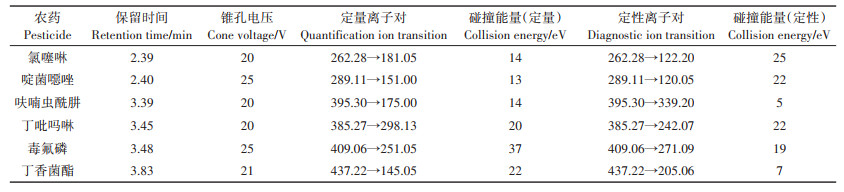
质谱条件:电喷雾电离源(ESI);正离子模式;离子喷雾电压3.5 kV;离子源温度150 ℃;锥孔气为氮气,流速150 L·h-1;干燥气为氮气,流速800 L·h-1,温度550 ℃;碰撞气为氩气,2×10-4 kPa;多反应监测(MRM)模式下,目标化合物的质谱参数见表 1。
|
|
表 1 质谱多反应监测参数 Table 1 The parameters of multiple reaction monitoring |
分别称取各目标化合物标准品适量,用乙腈溶解;配成1000 mg·L-1标准品母液,置于100 mL棕色容量瓶中,备用。使用时将6种母液等比例混合后分别用乙腈、空白基质提取液稀释,得到0.000 5、0.001、0.01、0.025、0.05 mg·L-1的溶剂标准溶液及基质匹配标准溶液。溶剂标准溶液及基质匹配标准溶液均用锡箔纸包裹,于-18 ℃避光保存。按照1.3.3节的条件测定。以峰面积为纵坐标,以质量浓度为横坐标绘制标准曲线。
1.3.5 加标回收实验在每种空白土壤样品中添加适量标准储备液,配成三个不同的添加水平即1、10、100 mg·kg-1,每种基质每个水平重复5次。按1.3.2节的方法处理,按1.3.3节的条件测定,计算平均回收率及相对标准偏差(RSD)。
2 结果与讨论 2.1 检测条件的优化在优化流动相条件时,分别采用甲醇-超纯水、乙腈-超纯水、乙腈-0.2%甲酸、甲醇-0.2%水溶液作为流动相,并采用梯度洗脱法对标准溶液进行进样分析。结果发现加入微量甲酸不仅有助于改善峰型,而且有助于使待测物离子化,从而提高待测化合物的响应;甲醇相较于乙腈虽然响应值更高但是峰型较差。因此,最终选择以乙腈-0.2%甲酸水溶液作为流动相。
在优化质谱条件时,依次以流动注射方式注入浓度为100 μg·L-1的目标化合物乙腈溶液。分别在正、负离子模式下进行母离子全扫描,发现正离子模式下的响应相对较高,因此选择正离子模式检测。在正离子模式下,发现所有目标化合物都容易加合H质子,在[M+H]处有基峰,因此选择[M+H]作为母离子。调节锥孔电压使每种化合物母离子峰响应达到最高值,然后开启碰撞能量、碰撞气,将母离子打碎。每个母离子打碎后挑选稳定存在且响应较高的两个碎片离子作为子离子,每个子离子单独调节碰撞能量,将其响应调节至最高值。具体优化参数见表 1。
2.2 提取溶剂的优化乙腈由于其与水分层效果好,提取效率高,被广泛应用于QuEChERS前处理方法[20-22]。在多残留分析中,由于大部分农药都呈弱酸性,在乙腈中加入适量的甲酸通常能改善回收率。因此,本研究将纯乙腈提取与甲酸乙腈提取进行了比较。结果发现,对于红土和褐土,纯乙腈提取及甲酸乙腈提取并没有明显的差异,两种提取方式的回收率均满足残留分析要求。然而对于黑土、潮土和水稻土,相比甲酸乙腈,纯乙腈提取的颜色更浅,回收率也更好。各种土壤的理化性质见表 2,从表中可以看出,红土和褐土的有机质含量非常低,这使得无论用纯乙腈还是甲酸乙腈提取,提取液都比较干净,对回收率影响不大。而黑土、潮土和水稻土的有机质含量很高,甲酸的加入可能增加了部分有机质的溶解度,这些有机质又作为共流出物,影响目标化合物的响应。因此,选择了纯乙腈作为提取溶剂,对于有机质含量高的三种土壤如果不经过净化,目标化合物的峰型差,尤其响应值低的两种农药(呋喃虫酰肼和丁香菌酯)峰型极差,使得积分变动性较大,回收率不稳定,因此,对于黑土、潮土和水稻土,需要进行进一步的净化处理。
|
|
表 2 5种典型土壤的理化性质 Table 2 The properties of five kinds of typical soil types |
在农药残留分析中常用的净化剂有N-丙基乙二胺、C18、弗罗里硅土及石墨化炭黑。N-丙基乙二胺可以有效去除脂肪酸、有机酸和一些极性色素及糖类物质;C18主要去除一些非极性组分;弗罗里硅土主要去除一些极性干扰物及油脂;石墨化炭黑主要用来去除色素。考虑到黑土、潮土和水稻土有机质含量较高,提取物中的色素较深,本研究采用了50 mg弗罗里硅土+5 mg石墨化炭黑、50 mg C18+5 mg石墨化炭黑和N-丙基乙二胺三种净化方式进行净化。净化后,上清液均变澄清,说明三种净化方式都能很好地去除色素。
净化方式对回收率的影响见图 1。从图中可以看出,三种净化方式净化后,回收率均在70%~120%之间,说明三种方式均满足回收率要求,且回收率之间差异不明显。峰型好坏可以影响积分的准确度,色谱峰两侧基线的信噪比可以半定量地反映峰型好坏,因此又进一步比较了三种净化方式对信噪比的影响。从图 2中可以看出,50 mg弗罗里硅土+5 mg石墨化炭黑的净化组合信噪比最高,峰型相对较好,并且弗罗里硅土成本较低,比较经济,因此最终选择弗罗里硅土和石墨化炭黑作为净化剂。
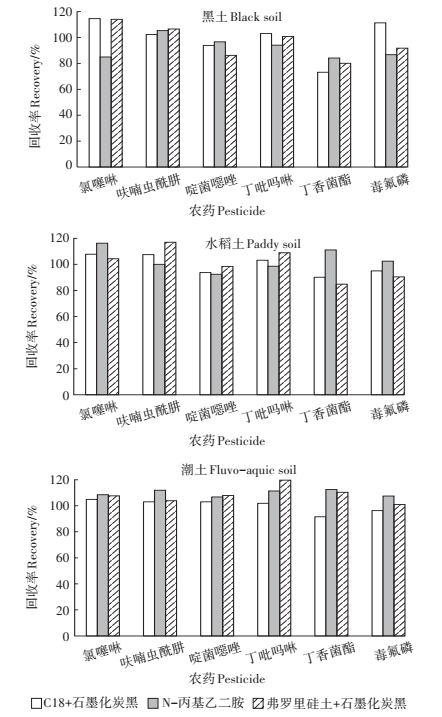
|
图 1 不同净化方式对化合物在黑土、水稻土和潮土中回收率的影响 Figure 1 Effect of different types of adsorbents on recoveries in black soil, paddy soil and fluvo-aquic soil |
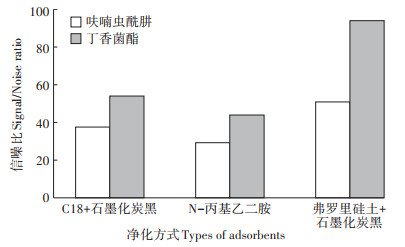
|
图 2 不同净化方式对化合物在水稻土中信噪比的影响 Figure 2 Effect of different types of adsorbents on signal/noise ratio in paddy soil(n=3) |
用溶剂标准溶液及基质匹配标准溶液进样得到的标准曲线来评估方法的线性范围及其相关性。不同标准曲线的线性回归参数见表 3。从表中可以看出,在0.5~50 μg·L-1范围内,本方法线性回归决定系数R2均大于0.990 0,线性关系良好。基质效应的存在会影响残留农药的定量分析,通过基质标准曲线斜率与溶剂标准曲线斜率的比值,可以判断基质效应的大小[23]。即当基质效应在±20%之间时,被认为基质效应较低;当基质效应在±50%之间时,被认为基质效应中等;当基质效应超出±50%时,被认为基质效应较强[24]。由表 3可以看出,5种土壤对氯噻啉和啶菌噁唑均有不同程度的基质增强效应,而对丁吡吗啉、呋喃虫酰肼、毒氟磷和丁香菌酯均有不同程度的基质减弱效应。影响基质效应的因素有很多,基质类型、化合物的理化性质以及样品前处理的过程均可对基质效应造成影响[25]。在本试验中,5种不同类型的土壤对单种目标化合物的基质增强及减弱效应具有一致性,因此可以推断,目标化合物的理化性质是基质效应主要影响因素之一。同时研究发现,农药的响应值也是基质效应的主要影响因素,本研究中毒氟磷和丁吡吗啉的响应值最高,高出其他农药一个数量级,而它们的基质效应是最低的;呋喃虫酰肼、啶菌噁唑和丁香菌酯的响应值处于中间,它们的基质效应也处于中间值;氯噻啉的响应值最低,基质效应也最大。农药的响应值取决于目标化合物本身的性质以及农药的添加水平。目标化合物的理化性质影响了其在离子源处的雾化效率,导致不同的响应;本试验中最低添加水平为1 μg·L-1,标准曲线最低点为0.5 μg· L-1,添加水平很低,从而使得总体基质效应较高。基质效应的存在会对方法的精确度及准确度造成很大影响[26]。因此,本研究采用基质匹配标准溶液校正法对基质效应进行了补偿,以提高定量准确性。以最低添加水平确定定量限(LOQ),6种农药的定量限均为1 μg·kg-1。
|
|
表 3 6种农药的线性回归方程、决定系数和定量限 Table 3 Linear regression equations, determination coefficients and detection limits of the 6 pesticides |
6种目标化合物均在5 min内出峰,出峰时间分别为2.39 min(氯噻啉)、2.40 min(啶菌噁唑)、3.45 min(丁吡吗啉)、3.39 min(呋喃虫酰肼)、3.48 min(毒氟磷)和3.83 min(丁香菌酯)。从空白色谱图中可以看出,相应出峰时间内目标化合物没有干扰(图 3)。
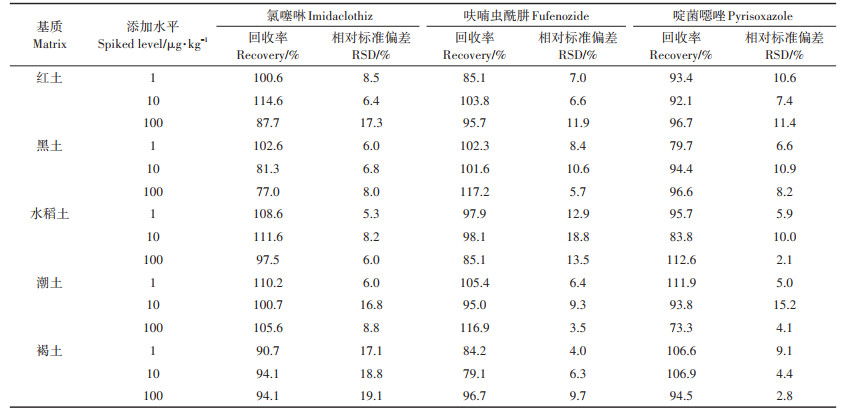
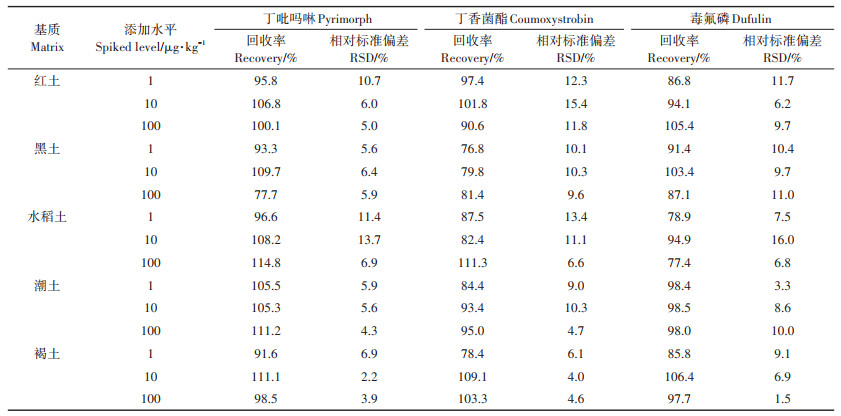
加标回收试验的回收率用来评估方法的准确度和精确度。准确度指的是实际检测浓度与添加浓度的比值,也就是回收率本身。精确度指的是方法的重现性,由不同重复之间回收率的相对标准偏差(RSD)来评估。我国农药残留实验准则对不同添加浓度(C)有不同的回收率和相对标准偏差范围要求[27]。当0.01 mg·kg-1 < C≤0.1 mg·kg-1时,回收率要求为70%~ 120%,相对标准偏差RSD≤20%;当0.001 mg·kg-1 < C≤ 0.01 mg·kg-1时,回收率要求为60%~120%,相对标准偏差RSD≤20%。6种农药在5种基质中的回收率及相对标准偏差见表 4、表 5,从表中可以看出,目标化合物在不同基质中的回收率范围在73.3%~117.2%(n=15)之间,相对标准偏差为1.5%~17.3%,均满足残留分析的要求。
|
|
表 4 氯噻啉、呋喃虫酰肼和啶菌噁唑在不同基质中的回收率和相对标准偏差 Table 4 Recoveries and RSD for imidaclothiz, fufenozide and pyrisoxazole in different matrices |
|
|
表 5 丁吡吗啉、丁香菌酯和毒氟磷在不同基质中的回收率和相对标准偏差 Table 5 Recoveries and RSD for pyrimorph, coumoxystrobin and dufulin in different matrices |
从湖南省、东北地区、浙江省、河北省和山西省采集土壤实际样品20份进行氯噻啉、呋喃虫酰肼、啶菌噁唑、丁吡吗啉、丁香菌酯和毒氟磷的残留检测,结果显示6种农药残留值均低于检出限(0.5 μg·L-1)。
3 结论本研究建立的方法具有良好的特异性、回收率、精确度、准确度和线性关系。6种目标农药在不同基质中的平均回收率范围在73.3%~117.2%之间,相对标准偏差为1.5%~17.3%,定量限为1 μg·kg-1。本方法操作简便,经济环保,灵敏度高,可以用来检测土壤环境中氯噻啉、呋喃虫酰肼、啶菌噁唑、丁吡吗啉、丁香菌酯和毒氟磷的残留,也可以为土壤中其他种类农药的检测提供参考。
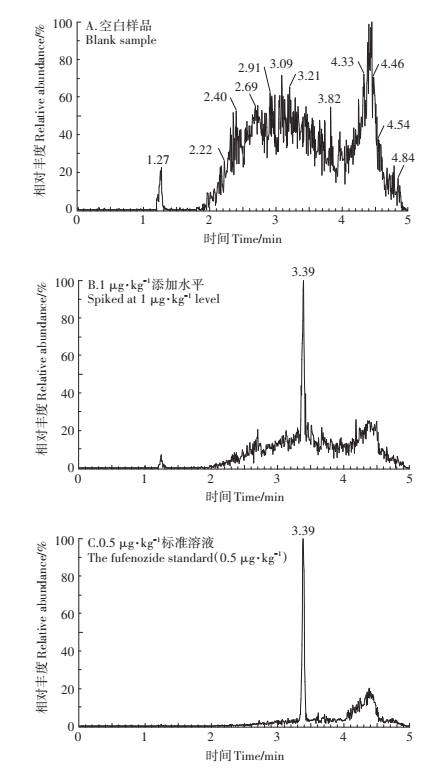
|
图 3 呋喃虫酰肼在水稻土中的典型色谱图 Figure 3 Typical chromatograms of fufenozide in paddy soil |
| [1] |
Sparks T C, Hahn D R, Garizi N V. Natural products, their derivatives, mimics and synthetic equivalents:Role in agrochemical discovery[J]. Pest Management Science, 2016, 73(4): 700-715. |
| [2] |
Oerke E C, Dehne H W. Safeguarding production:Losses in major crops and the role of crop protection[J]. Crop Protection, 2004, 23(4): 275-285. |
| [3] |
Hao H, Bo S, Zhao Z. Effect of land use change from paddy to vegetable field on the residues of organochlorine pesticides in soils[J]. Environmental Pollution, 2008, 156(3): 1046-1052. |
| [4] |
Fenoll J, Vela N, Navarro G, et al. Assessment of agro-industrial and composted organic wastes for reducing the potential leaching of triazine herbicide residues through the soil[J]. Science of the Total Environment, 2014, 493: 124-132. |
| [5] |
Larson S J. Pesticides in surface waters:Distribution, trends and governing factors[M]. Boca Raton: CRC Press, 1997.
|
| [6] |
USEPA. Research program description: Groundwater research[R]. Washington D C: US Environmental Protection Agency, 1998.
|
| [7] |
Franke C, Studinger G, Berger G, et al. The assessment of bioaccumulation[J]. Chemosphere, 1994, 29(7): 1501-1514. |
| [8] |
Burton G A. Sediment toxicity assessment[J]. Freshwater Science, 1992, 33(3): 708-717. |
| [9] |
Kannan K. Global organochlorine contamination trends:An overview[J]. AMBIO, 1994, 23(3): 187-191. |
| [10] |
Ellgehausen H, Guth J A, Esser H O. Factors determining the bioaccumulation potential of pesticides in the individual compartments of aquatic food chains[J]. Ecotoxicology & Environmental Safety, 1980, 4(2): 134-157. |
| [11] |
Cerrillo I, Granada A, López-Espinosa M J, et al. Endosulfan and its metabolites in fertile women, placenta, cord blood, and human milk[J]. Environmental Research, 2005, 98(2): 233-239. |
| [12] |
Yan Y, Zhang S, Tao G J, et al. Acetonitrile extraction coupled with UHPLC-MS/MS for the accurate quantification of 17 heterocyclic aromatic amines in meat products[J]. Journal of Chromatography B, 2017, 1068/1069: 173-179. |
| [13] |
戴宝江. 新颖杀虫剂——氯噻啉[J]. 世界农药, 2005, 27(6): 46-47. DAI Bao-jiang. Imidaclothiz:An innovative pesticide[J]. World Pesticide, 2005, 27(6): 46-47. |
| [14] |
张湘宁. 新型昆虫生长调节剂——呋喃虫酰肼[J]. 世界农药, 2005, 27(4): 48-49. ZHANG Xiang-ning. Fufenozide:A new kind of insect growth regulator[J]. World Pesticide, 2005, 27(4): 48-49. |
| [15] |
陈小霞, 袁会珠, 覃兆海, 等. 新型杀菌剂丁吡吗啉的生物活性及作用方式初探[J]. 农药学学报, 2007, 9(3): 229-234. CHEN Xiao-xia, YUAN Hui-zhu, QIN Zhao-hai, et al. Preliminary studies on antifungal ativity of pyrimorph[J]. Chinese Journal of Pesticide Science, 2007, 9(3): 229-234. |
| [16] |
陈卓, 杨松. 自主创制抗植物病毒新药:毒氟磷[J]. 世界农药, 2009, 31(2): 52-53. CHEN Zhuo, YANG Song. Dufulin:A new pant antivirus pesticide created by China[J]. World Pesticide, 2009, 31(2): 52-53. |
| [17] |
Zhu H J, Shi M M, Hu D Y, et al. Dissipation rate and residue distribution of dufulin in tomato and soil under field conditions[J]. Bull Environ Contam Toxicol, 2014, 92(1): 752-757. |
| [18] |
丁琦, 贾福艳, 陈光, 等. 苹果与土壤中丁香菌酯的残留分析[J]. 农药, 2012, 51(1): 53-54. DING Qi, JIA Fu-yan, CHEN Guang, et al. Residue analysis of coumoxystrobin in apple and soil[J]. Agrochemicals, 2012, 51(1): 53-54. |
| [19] |
Wu M, Cai J G, Yao J Y, et al. Study of imidaclothiz residues in cabbage and soil by HPLC with UV detection[J]. Bull Environ Contam Toxicol, 2010, 84(1): 289-293. |
| [20] |
Schenck F J, Callery P, Gannett P M, et al. Comparison of magnesium sulfate and sodium sulfate for removal of water from pesticide extracts of foods[J]. Journal of AOAC International, 2002, 85(5): 1177-1180. |
| [21] |
Cairns T, Sherma J. Emerging strategies for pesticide analysis[M]. Boca Raton: CRC Press, 1992.
|
| [22] |
Lehotay S J, Lightfield A R, Harman-Fetcho J A. Analysis of pesticide residues in eggs by direct sample introduction/gas chromatography/tandem mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2001, 49(10): 4589-4596. |
| [23] |
Economou A, Botitsi H, Antoniou S, et al. Determination of multiclass pesticides in wines by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(31): 5856-5867. |
| [24] |
Li M M, Liu X G, Dong F S, et al. Simultaneous determination of cyflumetofen and its main metabolite residues in samples of plant and animal origin using multi-walled carbon nanotubes in dispersive solid-phase extraction and ultra high performance liquid chromatography-tandem mass spectrometry[J]. J Chromatography A, 2013, 1300: 95-103. |
| [25] |
Li Y, Liu X G, Wu X H, et al. Simultaneous determination of flupyradifurone and its two metabolites in fruits, vegetables, and grains by a modified quick, easy, cheap, effective, rugged, and safe method using ultra high performance liquid chromatography with tandem mass spectrometry[J]. Journal of Separation Science, 2016, 39(6): 1090-1098. |
| [26] |
Payá P, Anastassiades M, Mack D, et al. Analysis of pesticide residues using the quick easy cheap effective rugged and safe(QuEChERS) pesticide multiresidue method in combination with gas and liquid chromatography and tandem mass spectrometric detection[J]. Analytical & Bioanalytical Chemistry, 2007, 389(6): 1697-1714. |
| [27] |
农业农村部.农作物中农药残留试验准则: NY/T 788-2018[S].北京: 中国农业出版社, 2018. Ministry of Agriculture and Rural Affairs. Guideline for the testing of pesticide residues trials in crops: NY/T 788-2018[S]. Beijing: China Agriculture Press, 2018. |
 2020, Vol. 37
2020, Vol. 37