2. 湖南农业大学植物保护学院, 长沙 410128;
3. 广西民族大学, 南宁 530006;
4. 缅甸生物技术研究中心创新技术研究所, 皎施 05152
2. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China;
3. Guangxi University for Nationalities, Nanning 530006, China;
4. Biotechnology Research Center, Department of Research and Innovation, Kyaukse 05152, Myanmar
根际微生物,是指能够影响作物根系营养成分、土壤理化指标和土壤根系微生态的一类微生物。在植物生长过程中,凋亡的根系、脱落物(根毛、表皮细胞、根冠等)及其分泌物是根际微生物重要的营养和能量来源。根际具有良好的通气性和充足的的水分,因而形成了有利于微生物生长繁殖的根际微环境[1-2]。根际有益微生物通过产生激素类物质、促进植物养分吸收、诱导植株增强抗性等直接作用方式,以及抑制病原菌生长的间接作用方式促进植物生长[3-6]。促生效应是根际有益微生物研究最初所关注的问题之一。同时,根际有益微生物还可以应用于植物病害的生物防治。复杂及特殊的环境条件会对土壤微生物产生一定的影响,植物根际特异性是微生物群落建成的重要原因之一[7]。红树林是一种典型的生长于热带、亚热带隐蔽海岸潮间带的植物群落,其特化的环境适应特征为众多微生物提供了良好的生存环境[8-9],一些特殊的微生物具有过滤污染、净化水源、促进植物生长等功能,且其代谢产物具有药用价值[10-12]。因此,利用红树林根际土壤筛选具有促进植物生长作用的菌株,对于开发新型、高效的微生物源植物生长调节剂具有重要意义。
1 材料与方法 1.1 试验材料试验土样采自广西北海一处海沙周围,为红树林根际土壤沉积物,土壤深度为2~40 cm。将采集的土壤放置无菌袋中,标注好采样地点和时间,置于冰箱4 ℃保存。
试验所用番茄品种为改良毛粉802,购自天津市宏程芹菜研究所。
生长素产出菌筛选培养基(R2A):酵母粉0.5 g,葡萄糖2 g,胰蛋白胨0.5 g,酪蛋白氨基酸0.5 g,可溶性淀粉0.5 g,K2HPO4 0.3 g,MgSO4·7H2O 0.05 g,丙酮酸钠0.3 g,溶于1000 mL水,pH值调至7.2,121 ℃灭菌20 min。
蒙金娜无机磷培养基:Ca3(PO4)2 1%,葡萄糖1%,MgSO4·7H2O 0.03%,KCl 0.03%,MnSO4·4H2O 0.003%,FeSO4·7H2O 0.003%,(NH4)2SO4 0.05%,NaCl 0.03%。固体培养基在液体培养基的基础上加2%的琼脂,配制该培养基时,Ca3(PO4)2与培养基其他成分分开组装,121 ℃灭菌20 min。
LB(Luria Bertain)固体培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,琼脂15 g,蒸馏水1000 mL,pH 7.0。
LB液体培养基(LB肉汤):酵母粉5 g,胰蛋白胨10 g,NaCl 10 g,蒸馏水1000 mL,pH 7.0。
Salksowski比色液配方:50 mL 35% HClO4+1 mL 0.5 mol·L-1 FeCl3。
50 mg·mL-1色氨酸溶液:50 mg色氨酸溶于100 mL蒸馏水中,由于色氨酸微溶于水,所以用1 g的NaOH助溶。
1.2 试验方法 1.2.1 菌种的富集、筛选及纯化(1)菌种的富集:称取5 g土样加入装有20 mL无菌水的小摇瓶内,将小摇瓶放入30 ℃、200 r·min-1摇床避光振荡培养30 min,使土样与无菌水充分混匀。形成悬浊液后,静置使悬浊液分层,取5 mL上清液于30 mL LB液体培养基中,在30 ℃、200 r·min-1摇床避光振荡培养24 h。
(2)菌种的分离:从LB液体培养基中取1 mL细菌悬液使其浓度为1×10-2 cfu·mL-1,按10倍稀释法依次制备成1×10-4、1×10-5、1×10-6、1×10-7 cfu·mL-1悬浮液,用稀释涂布平板法在ACC筛选培养基上分离细胞悬液中的细菌,每个浓度设置三组平行。倒置平板于34 ℃恒温培养箱中避光培养48~72 h,待平板上有很多单菌落长出后,挑取形态不同的单菌落。
(3)菌株的初筛:将形态不同的单菌落挑选至2 mL含色氨酸的R2A液体培养基(100 mL R2A液体培养基+100 μL 50 mg·L-1色氨酸溶液)的离心管中,分别作好对应菌种的标记。将带有菌种的2 mL离心管置于30 ℃、200 r·min-1摇床避光振荡培养24 h。
① 细菌溶磷能力的筛选:从对应不同菌株的2 mL离心管中转移1 μL菌悬液置于蒙金娜无机磷固体培养基中,并将带有不同菌种的蒙金娜无机磷固体培养基倒置放于34 ℃恒温培养箱中避光培养24 h,筛选有溶磷效果的菌种,若单菌落周围出现溶磷圈,则说明细菌具有溶磷效果,溶磷圈与单菌落直径比值越大代表同等条件下该菌株的溶磷效果越强。
② 细菌产IAA(吲哚乙酸)能力的筛选:将对应不同菌种的2 mL离心管在12 000 r·min-1的高速离心机中离心10 min,离心后分别取100 μL上清液,与100 μL的Salksowski比色液(0.1 mL 0.5 mol·L-1 FeCl3+5 mL 35% HClO4)在96孔板上1:1混合进行显色反应,并用100 μL 5 mg·L-1的IAA与100 μL Salksowski比色液1:1混合作为阳性对照。将96孔板置于38 ℃条件下避光保温40 min,若颜色变红,则说明菌株具有产IAA的能力,颜色越深说明同等条件下该菌株产IAA的量越多。将既具有溶磷效果又有产IAA能力的菌株筛选出来,采用五线平板划线法分别将这些菌株进行纯化,为了确保该菌种的纯度,平板划线重复2~3次。将纯化的单菌落转移至20 mL的LB液体培养基中,放入30 ℃、200 r·min-1摇床避光振荡培养24 h。用500 μL 40%的甘油与500 μL LB液体培养基的菌悬液1:1混合至2 μL的离心管中,并将作好相应标记的2 μL离心管冷藏在-20 ℃冰箱。
1.2.2 菌株16S rRNA鉴定使用细菌全基因组提取试剂盒提取细菌DNA,采用16S rRNA鉴定技术对细菌进行种属鉴定,通用引物由深圳华大基因科技有限公司负责合成(正向引物:5′ -AGAGTTTGATCCTGGCTCAG-3′;反向引物:5′ -GGTTACTTGTTACGCACTT-3′)。PCR扩增反应体系(25 μL):2×Taq PCR Master mix 12.5 μL、正向引物1 μL和反向引物1 μL,模板DNA 2 μL,用ddH2O补足至25 μL。PCR反应程序:94 ℃预变性5 min,94 ℃变性30 s,55~62 ℃退火30 s,72 ℃延伸90 s,32个循环,最后72 ℃延伸10 min。
1.2.3 菌株发酵液的制备及计数将细菌菌株接种至LB固体培养基,并放置于28 ℃的恒温培养箱中遮光培养1 d。在无菌条件下接种1 cm2大小的菌饼至LB液体培养基,并放置于温度为28 ℃、转速为220 r·min-1的摇床中振荡培养24 h,用50 mL离心瓶在27 ℃、6000 r·min-1条件下离心6 min后取上清即得到发酵液。
取9支无菌离心管,将细菌发酵液稀释至1×10-9 cfu·mL-1到离心管,每个离心管菌液吸取100 μL于LB固体培养皿上均匀涂布,做3组平行试验,28 ℃恒温培养箱中培养24 h,对菌落数在10~100之间的培养皿进行计数,求平均值,并将四株原菌发酵液稀释为1×106 cfu·mL-1备用。将该菌株的发酵稀释液用孔径为0.22 μL细菌过滤器过滤后备用。
1.2.4 菌株发酵液对室内番茄种子萌发的影响在超净工作台上洗净并浸泡同一袋番茄种子4 h,除去漂浮的瘪粒种子,控干水分后,先用0.2%次氯酸钠溶液浸泡5 min,再用70%酒精浸泡5 min,最后用无菌水冲洗3~5次,沥干。用无菌镊子挑取大小和饱满程度一致的种子50粒,播种在放有无菌滤纸的培养皿(Φ90 mm)中,再分别倒入5 mL浓度分别为1× 106、1×105、2×104、1×104、5×103 cfu·mL-1的发酵过滤液,盖上皿盖,作好标记,对照组添加相同体积、相同浓度的LB液体培养基,再设置一组无菌水对照,每处理3次重复。置于25 ℃、相对湿度为90%的光照培养箱中培养,每日光照时间为12 h。每日定时打开培养皿,喷洒少量无菌水以确保种子湿润,待幼苗生长至与培养皿盖齐平时打开皿盖。
种子发芽以胚根探出种皮1 mm为基准。发芽势是指在试验前期指定的日期内,发芽种子数占总测试种子数的百分比;发芽率指在试验结束时正常种子发芽数占测试种子总数的百分比[13]。本研究以发芽试验开始日记作0 d,8 d后统计发芽势,10 d后计算发芽率。每个处理组选取5株有代表性幼苗,测量幼苗根长、株高、植株鲜质量,并计算番茄种子的发芽指数和活力指数。
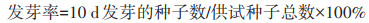
|
(1) |

|
(2) |
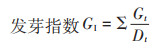
|
(3) |
式中:Gt为发芽试验期内每日发芽数;Dt为发芽日数;∑为总和。

|
(4) |
式中:GP为幼苗的生长势,本试验中以幼苗平均根质量计。
1.2.5 菌株发酵液对番茄幼苗促生效果的测定试验所用营养基质由蛭石、珍珠岩以及营养土混合而成,配制比例为1:1:3,将混拌均匀后的营养基质置于育苗盘中,并用蒸馏水使之浸润通透。在育苗盘的每个孔中播撒3~5粒番茄种子,并在种子上面撒一层薄薄的细沙,最后用保鲜膜密封育苗盘。将处理后的育苗盘放置于温度为25 ℃、相对湿度为60%的温室中培养。待幼苗长出2~3片真叶时,揭去保鲜膜并间苗,使每个孔穴中仅保留长势较好的番茄幼苗用于后续试验。
试验共设10组,分别施用浓度为2×104、1×104 cfu·mL-1的四株菌株发酵液和相同浓度的LB液体培养基,对照组施用等量清水,每个处理组20株幼苗,并设3个重复。当番茄幼苗长出两片真叶时进行灌根处理,每隔7 d灌根一次。在灌根5次后,将幼苗挖出,用蒸馏水冲洗根部泥土并晾干,测量各组幼苗的农艺指标,如根长、株高、鲜质量等。将幼苗烘干测量幼苗干质量。株高为子叶至生长点的长度,根长为根茎结合处至根尖的长度。
1.3 数据处理系统发育树采用MEGA 5.0软件中的最大似然法构建,自展检验均为1000次;番茄农艺指标运用SPSS 22.0软件进行数据处理。
2 结果与分析 2.1 菌株的鉴定通过提取细菌DNA、设计引物以及扩增细菌16S rRNA片段,得到了长度为1300 bp的扩增序列(图 1),经过产物测序获得序列提交至GenBank,登录序列号为MN857720,经过NCBI检索和比较,得到同源性较高的菌株,并构建系统发育树(图 2),结果表明,该分离物与软腐果胶杆菌、肠沙门菌、拉氏西地西菌、嗜线虫沙雷氏菌、柠檬酸杆菌及塔特姆氏菌同属于一个分组,与烟草肠杆菌株Enterobacter tabaci strain YIM Hb-3同属于一个分支,因此,该菌株暂鉴定为烟草肠杆菌。

|
M:DL 5000 DNA梯带;1~5:细菌扩增片段;目标条带均为1300 bp左右 M:DL 5000 DNA ladder; 1~5:Amplification fragment of bacterial strain, the target band is about 1300 bp 图 1 细菌通用引物筛选 Figure 1 Universal primer screening for bacterial strain |

|
图 2 基于菌株及相关细菌16S rRNA序列的系统发育树 Figure 2 The phylogenetic tree based on 16S rRNA sequences of bacterial strains and related bacteria strains |
利用菌株发酵液对番茄种子进行发芽势、发芽率、发芽指数和活力指数的测定,结果(表 1)表明,清水浸泡(CK)处理可以达到71.33%的发芽率,5×103 cfu·mL-1发酵培养基和菌株发酵液浸泡处理,发芽率均超过80%,分别为80.67%和88.67%,说明菌株发酵液促生效果较好,浓度在1×104 cfu·mL-1时促生效果达到最大值,发芽率为92.00%,发芽势为84.67%,发芽指数为36.01,活力指数为241.21,之后随着浓度的升高,菌株发酵液对番茄种子萌发表现出一定的抑制作用。
|
|
表 1 菌株发酵液对番茄种子萌发的影响 Table 1 Effects of fermentation broth of bacteria on germination of tomato seeds |
基于菌株发酵液浓度2×104、1×104 cfu·mL-1能够促进种子萌发的结果,比较发酵液浓度2×104、1×104 cfu·mL-1对温室中番茄幼苗的生长影响,结果(表 2)表明,其根长、株高、鲜质量、干质量均存在显著差异。菌株发酵液浓度为1×104 cfu·mL-1时对番茄的促生作用更为显著,其中浇灌发酵液的番茄与对照相比,干质量、鲜质量均明显增加,分别增加了150.00%、144.83%;根长、株高较对照也均有不同程度的增加,分别增加了63.42%、75.83%。
|
|
表 2 菌株发酵液对番茄生长的影响 Table 2 The effect of fermentation broth of bacteria on tomato growth |
近年来,植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)因具有防病、促生、增产的效果成为科技工作者的研究热点,而且越来越多的PGPR制剂在农业生产中发挥着重要作用[14]。PGPR通过改善植物生长微生态、提高植物的固氮能力、分泌各种活性物质等促进植物生长[15-17];通过产生抗生素和胞外溶解酶等抑制病原菌的生长,减轻其对植物的危害[18-19]。利用环保、高效的根际促生菌创制微生物肥料及植物生长调节剂已成为研究的热点及发展趋势[20-21]。目前,已报道的植物根际促生菌大多属于芽孢杆菌属和假单胞菌属,此外,还包括黄杆菌属、固氮菌属、沙雷氏菌属及克雷伯氏菌属等。本研究从红树林特殊生境中分离获得一株烟草肠杆菌,该菌的新种于2015年首次被报道,属于革兰氏阴性菌,是可运动的杆状细菌,命名为YIM Hb-3T。相关报道指出其基因组DNA G+C含量测定为54.8% mol,基于16S rRNA基因序列的系统发育树和多位点序列分析,YIM Hb-3T与莫里肠杆菌LMG 25706T的系统发育关系最为密切,根据表型和化学分类学资料、系统发育分析和DNA-DNA亲缘关系,认为YIM Hb-3T(=KACC 17832T=KCTC 42694T)是肠杆菌属的一个新物种[22]。后续关于该菌株的报道较少,本研究发现烟草肠杆菌具有较好的促生效果。同时,本研究也验证该菌株对于真菌病害的防治效果,发现其对病原真菌并没有显著的抑制效果。综上所述,本研究可丰富植物促生菌的种类,为进一步研究开发微生物源植物生长剂及微生物菌肥提供了理论依据。
4 结论通过平板涂布法以及16S rRNA技术筛选得到一株具有促生作用的细菌,经鉴定该菌株为烟草肠杆菌(Enterobacter tabaci)。该菌株对番茄种子的萌发和幼苗的生长有显著的促进作用,研究为该菌株开发为安全、高效的微生物肥料或微生物源植物生长调节剂提供了理论基础。
| [1] |
Lu Y H, Zhang F S. The advances in rhizosphere microbiology[J]. Soil, 2006, 38(2): 113-121. |
| [2] |
布凤琴, 闫方仪, 燕坤蛟. 土壤微生物生态学研究方法进展[J]. 山东林业科技, 2012, 42(6): 113-116. BU Feng-qin, YAN Fang-yi, YAN Kun-jiao. Soil microbial ecology progress[J]. Journal of Shandong Forestry Science and Technology, 2012, 42(6): 113-116. |
| [3] |
周文杰, 吕德国, 杨丹丹, 等. 根际优势细菌对甜樱桃幼树光合及根系活力的影响[J]. 吉林农业大学学报, 2015, 37(5): 555-561, 567. ZHOU Wen-jie, LÜ De-guo, YANG Dan-dan, et al. Effects of plant growth-promoting rhizobacteria on photosynthesis and root vitality of sweet cherry saplings[J]. Journal of Jilin Agricultural University, 2015, 37(5): 555-561, 567. |
| [4] |
Mendes R, Garbeva P, Raaijmakers J M. The rhizosphere microbiome:Significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms[J]. FEMS Microbiology Reviews, 2013, 37(5): 634-663. |
| [5] |
Gaby J C, Buckley D H. A global census of nitrogenase diversity[J]. Environmental Microbiology, 2011, 13: 1790-1799. |
| [6] |
Liu J, Jung J H, Liu Y. Antimicrobial compounds from marine invertebrates-derived microorganisms[J]. Current Medicinal Chemistry, 2016, 23(25): 2892-2905. |
| [7] |
杨智仙, 汤利, 郑毅, 等. 不同品种小麦与蚕豆间作对蚕豆枯萎病发生、根系分泌物和根际微生物群落功能多样性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 570-579. YANG Zhi-xian, TANG Li, ZHENG Yi, et al. Effects of different wheat cultivars intercropped with faba bean on faba bean Fusarium wilt, root exudates and rhizosphere microbial community functional diversity[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(3): 570-579. |
| [8] |
Lee S. Mangrove outwelling:A review[J]. Hydrobiologia, 1995, 295(1/2/3): 203-212. |
| [9] |
Kuenzer C, Bluemel A, Gebhardt S, et al. Remote sensing of mangrove ecosystems:A review[J]. Remote Sensing, 2011, 3(5): 878-928. |
| [10] |
Thatoi H, Behera B C, Mishra R R, et al. Biodiversity and biotechnological potential of microorganisms from mangrove ecosystems:A review[J]. Annals of Microbiology, 2013, 63(1): 1-19. |
| [11] |
Gong B, Chen Y P, Zhang H, et al. Isolation, characterization and anti-multiple drug resistant(MDR) bacterial activity of endophytic fungi isolated from the mangrove plant, Aegiceras corniculatum[J]. Tropical Journal of Pharmaceutical Research, 2014, 13(4): 593-599. |
| [12] |
Yompakdee C, Thunyaharn S, Phaechamud T. Bactericidal activity of methanol extracts of crabapple mangrove tree(Sonneratia caseolaris Linn.) against multi-drug resistant pathogens[J]. Indian Journal of Pharmaceutical Sciences, 2012, 74(3): 230-235. |
| [13] |
任艳芳, 何俊瑜, 杨军, 等. 外源H2O2对盐胁迫下小白菜种子萌发和幼苗生理特性的影响[J]. 生态学报, 2019, 39(20): 1-12. REN Yan-fang, HE Jun-yu, YANG Jun, et al. Effects of exogenous hydrogen peroxide on seed germination and physiological characteristics of pakchoi seedling(Brassica chinensis L.) under salt stress[J]. Acta Ecologica Sinca, 2019, 39(20): 1-12. |
| [14] |
Choi O, Kim J, Kim J G, et al. Pyrroloquinoline quinone is a plant growth promotion factor produced by Pseudomonas fluorescens B16[J]. Plant Physiology, 2008, 146(2): 657-668. |
| [15] |
Zou C, Li Z, Yu D. Bacillus megaterium strain XTBG34 promotes plant growth by producing 2-pentylfuran[J]. Journal of Microbiology, 2010, 48(4): 460-466. |
| [16] |
Bloemberg G V, Lugtenberg B J. Molecular basis of plant growth promotion and biocontrol by rhizobacteria[J]. Currrent Opinion in Plant Biology, 2001, 4(4): 343-350. |
| [17] |
Koumoutsi A, Chen X H, Henne A, et al. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefacies strain FZB42[J]. Journal of Bacteriology, 2004, 186: 1084-1096. |
| [18] |
Ge B B, Liu B H, Nwet T T, et al. Bacillus methylotrophicus strain NKG-1, isolated from Changbai Mountain, China, has potential applications as a biofertilizer or biocontrol agent[J]. PLoS ONE, 2016, 11(11): e0166079. |
| [19] |
Zhang Y, Wang X J, Chen S Y, et al. Bacillus methylotrophicus isolated from the cucumber rhizosphere degradesferulic acid in soil and affects antioxidant and rhizosphere enzyme activities[J]. Plant and Soil, 2015, 392: 309-321. |
| [20] |
Myo E M, Ge B B, Ma J J, et al. Indole-3-acetic acid production by Streptomyces fradiae NKZ-259 and its formulation to enhance plant growth[J]. BMC Micriobiology, 2019, 19: 155. |
| [21] |
Myo E M, Liu B H, Ma J J, et al. Evaluation of Bacillus velezensis NKG-2 for bio-control activities against fungal disease and potential plant growth promotion[J]. Biological Control, 2019, 134: 23-31. |
| [22] |
Duan Y Q, Zhou X K, Li D Y, et al. Enterobacter tabaci sp. nov., a novel member of the genus Enterobacter isolated from a tobacco stem[J]. Antonie van Leeuwenhoek, 2015, 108(5): 1161-1169. |
 2020, Vol. 37
2020, Vol. 37