2. 河北北方学院, 河北 张家口 075000
2. Hebei North University, Zhangjiakou 075000, China
水分是植物赖以生存的基本条件。土壤水分含量、运行状况以及分布特性不仅直接影响植物的生长,也影响根际微生物的生存以及微生物与植物的互作[1]。近年来,不少学者研究了不同农作物的需水规律及其对作物生长的影响。马建辉等[2]研究表明,在保证设施番茄产量和节约用水的条件下,将土壤水势-30 kPa作为膜下滴灌控制下限,有利于土壤结构的稳定。蒋树芳等[3]研究了不同水势对茄子生长与水分利用的影响,结果表明水势为-10~-50 kPa时,不同生育期茄子平均株高无明显差异,但灌溉水利用效率随着土壤水势的降低明显升高,建议将土壤水势控制在-30 kPa和-40 kPa较为适宜。土壤水分影响植物根系的分布、形态特征以及吸水能力。土壤水分过高或过低均会对茄子生长产生抑制作用[4]。茄子植株对水分状况反应敏感,其生长量不随土壤含水量增加而增大[5]。弓萌萌等[6]研究发现红树莓“秋福”在苗期经历短期适度干旱可促进根系活力,干旱胁迫后再复水并不影响其生理指标的恢复,提示可在植物生长苗期适当少浇水。当表层土壤水分亏缺时,根向深土层延伸,更有利于根系发育和对深层土壤水分的利用[7-8]。
土壤含水量不仅影响植物根系发育和分布,还可以改变植物-土壤-微生物间相互作用并调控微生物群落的构成,其中一些厚壁细菌可以更好地存活于干旱胁迫的土壤中[9-10]。如放线菌门和芽孢杆菌属丰度明显高于其他菌,这些菌群可能发挥重要的生态功能[11]。有关芽孢杆菌和放线菌等菌株的促生作用报道较多[12-14]。Grover等[15]从高粱根际分离得到四株芽孢杆菌,其可促进植物生长并具有耐盐、耐高温和耐水分胁迫等特性。在缺水的情况下,一些根际促生细菌(PGPR)可通过产生胞外多糖(EPS)和挥发性物质[16-18]提高植物抗逆性能。周冬梅[19]报道有益菌产生的挥发性有机化合物刺激了植物胆碱的合成,植物利用胆碱防止水分流失和维持细胞膨压而抵御逆境胁迫。
水肥一体化灌溉技术已经成为设施蔬菜生产中的重要灌溉方式之一,但是菜农缺乏节水节肥观念,化肥用量高,肥料利用率低(< 30%)[20]。有关水肥一体化灌溉技术模式下微生物与土壤水势、植物生长以及产量之间的关系尚不明确。贝莱斯芽孢杆菌B006是一株高效生防菌株[21-22],该菌生长迅速,具有防病促生功能,但在不同土壤水势条件下该菌株对植物根系发育、生长状况及土壤养分利用的影响尚不清楚。本研究通过盆栽试验进一步明确了芽孢杆菌B006菌剂抗缺水胁迫功能;在此基础上研究水肥一体化技术条件下,芽孢杆菌B006菌剂应用与土壤水势、植物对土壤中养分利用及植物生长之间的关系,明确少水灌溉时应用芽孢杆菌菌剂促生增产效果,以达到蔬菜优质高产同时减少不合理水肥投入的目标,为芽孢杆菌制剂的合理应用及科学浇水施肥提供技术指导。
1 材料与方法田间小区试验于北京市海淀区昌宁农庄日光温室进行;盆栽土壤取自北京市海淀区昌宁农庄日光温室大棚自然土,前茬作物为玉米。
1.1 试验材料供试菌剂:贝莱斯芽孢杆菌(Bacillus velezensis)B006粉剂,参考王军强[23]的方法,在500 L发酵罐中发酵培养,管式离心机离心收集菌体,阴干后,得到干菌粉。活菌含量为1.5×1011 CFU·g-1。
供试茄子品种:京茄黑霸,北京市昌宁农庄提供。
1.2 试验设计 1.2.1 盆栽试验在上口宽×高为15 cm×15 cm的花盆中进行盆栽试验,测定芽孢杆菌B006菌剂对茄子的促生作用。试验中设置施用和不施用芽孢杆菌菌剂两个处理。每盆装土1000 g,每处理36盆。将1.5×1011 CFU·g-1的芽孢杆菌B006菌剂稀释至1×107 CFU·mL-1[24],于茄子移栽时,每株幼苗根部浇灌5 mL B006菌剂稀释液,以不施用芽孢杆菌菌剂作为对照(CK)。每2 d浇一次水,每盆浇水量150 mL,使土壤含水量保持在20%~30%之间。35 d后,将两处理盆栽苗平分成两组,每组18盆。一组正常浇水,一组停止浇水,进行7 d缺水处理。
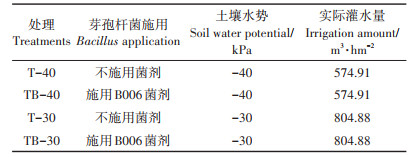
1.2.2 日光温室试验参照文献[2-3],设置土壤水势为-30 kPa(正常灌溉)和-40 kPa(少水灌溉),研究两种土壤水势条件下施用和不施用B006菌剂处理对茄子生长和产量的影响。试验采用单因素随机区组交互试验设计,共4个处理(表 1)。分别在移栽时和定植后30 d,每株苗浇灌250 mL浓度为1×107 CFU·mL-1[21]的B006菌剂稀释液。每处理重复3次,共12个小区。移栽前,施用生物有机肥16 667.67 kg·hm–2作为基肥。分别在幼苗期、开花坐果期和盛果期追施水溶肥(N/P/K为17:9:34),每个处理苗期追肥量为39.82 kg·hm–2;开花坐果期和盛果期追肥量合计为238.95 kg·hm–2,全生长期共追施4次。4个处理施用同等量的水溶肥。
|
|
表 1 日光温室试验设计 Table 1 Experimental design of the field trial |
试验共设12个小区,每小区面积为8.3 m×4.0 m,温室两端设置宽2.5 m的保护区。茄子苗于2019年4月24日移栽定植。每小区11行,每行9株,行距50 cm,株距35 cm。每行使用1条滴灌带,滴头间距为35 cm。根据茄子的生长特性,整个生育期分为幼苗期(2019年4月13日—6月1日)、开花坐果期(2019年6月1日—7月1日)、盛果期(2019年7月1日—8月24日),共132 d。
移栽时,选取长势茁壮且一致的茄子幼苗进行定植栽培。采用电子张力计和水肥一体化自动灌溉系统分别进行土壤水势的监测和日常灌溉。茄子定植后于每处理25 cm深处土层埋设电子张力计,与茄子植株水平距离为10 cm。每次根据张力计读数指导灌溉,当土壤水势达到设定值时开始灌溉,土壤水势为-40 kPa的两个处理中每次灌水时间约为25 min,土壤水势为-30 kPa的两个处理中每次灌水时间约为30 min。
1.3 测试指标 1.3.1 盆栽试验测试指标土壤含水量的测定:烘干法[25]测定土壤含水量。用取土器在茄子植株周围挖取长×宽为2 cm×2 cm的上层5 cm土壤样品,从每处理随机选取3盆盆栽土,每盆作为一个样品,每个样品取3 g土壤放入105 ℃恒温烘箱中烘干至恒质量,测定土壤含水量(%)。
植株生长指标测定:于移栽后35 d,短期缺水处理前测定施用B006菌剂和对照处理中所有盆栽茄子苗的株高和茎粗。7 d后测定正常浇水的两处理茄子根长和根干质量,停止浇水的两处理用于观察缺水时植株生长情况。
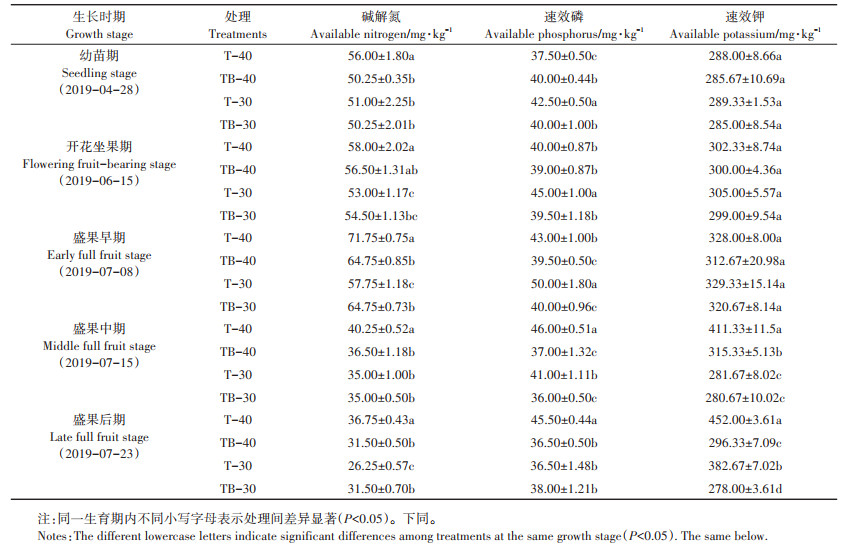
1.3.2 日光温室试验测试指标土壤理化性质检测:土壤含水量采用电子张力计(北京市霖雷科技有限公司)实时监测。分别于2019年5月23日、6月16日、7月9日和7月16日采集各处理土壤样品,进行土壤中营养元素的测定[26]:碱解扩散法测定土壤碱解氮含量;钼锑抗显色法测定土壤速效磷含量;NH4OAC浸提、火焰光度计法测定土壤速效钾含量。
植株生长和产量测定:定植后35 d观察到各处理间植株生长存在差异,从每小区四角和中间五个方位各选取2行,每行随机挖取4株茄子幼苗,共20株苗进行生长指标的测定。用直尺测量植株的株高和茎粗,用SPAD-502PLUS便携式叶绿素测定仪(柯尼卡美能达控股公司)测量叶片的叶绿素含量(SPAD),烘干法测定地上部干质量。于定植后50 d,每小区随机抽取30株,调查不同处理茄子的开花数。收获时,测定不同小区茄子质量,计算每个处理的平均产量,并计算每公顷产量。拉秧后,从每个小区约30 cm深度的耕层土壤内挖取30株茄子植株的根系,测量茄子根长和根干质量。
1.4 分析方法采用Excel软件作图,采用IBM SPSS Statistics 20对实验数据进行统计分析。
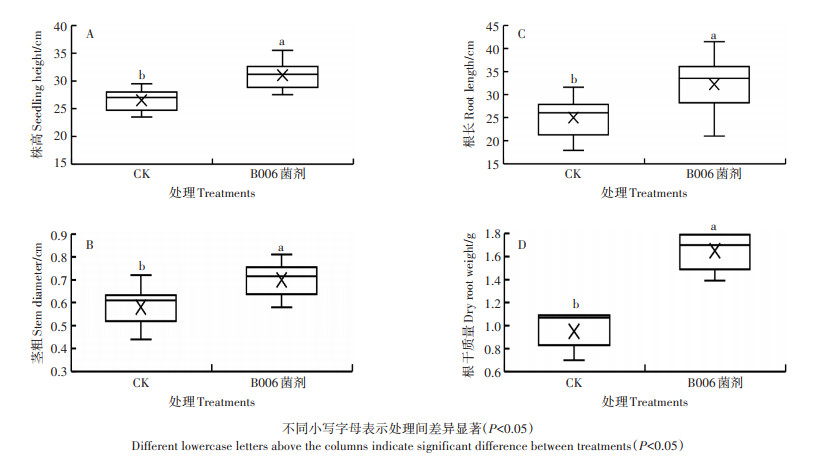
2 结果与分析 2.1 芽孢杆菌B006菌剂对盆栽茄子生长的影响对施用和未施用B006菌剂的盆栽茄子幼苗的生长指标进行统计分析,结果见图 1。芽孢杆菌B006菌剂对茄子苗期生长具有促进作用。施用B006菌剂后,茄子幼苗株高、茎粗、根长、根干质量比对照分别提高了16.7%、20.7%、28.7%和67.0%,与对照差异显著(P < 0.05)。
|
不同小写字母表示处理间差异显著(P < 0.05) Different lowercase letters above the columns indicate significant difference between treatments(P < 0.05) 图 1 芽孢杆菌B006菌剂对茄子幼苗的促生作用 Figure 1 Growth promotion of eggplant seedlings by Bacillus B006 agent |
正常浇水处理组中,空白对照和B006菌剂处理的茄子植株周围5 cm土层的土壤含水率分别为30.1%±0.7%和28.0%±1.1%,两处理之间差异不显著(P > 0.05)。缺水处理组中,空白对照和B006菌剂处理的土壤含水率分别为3.1%±0.3%和3.2%±0.7%,两处理之间土壤含水量差异也不显著(P > 0.05)。缺水处理后,对照中茄子萎蔫程度比施用B006菌剂处理更为严重(图 2),说明在土壤缺水时,施用芽孢杆菌B006菌剂可以提高茄子幼苗对缺水胁迫的耐受能力。

|
CK-I:正常浇水;TB-I:正常浇水+芽孢杆菌;CK-NI:缺水胁迫;TB-NI:缺水胁迫+芽孢杆菌 CK-I:Normal irrigation; TB-I:Normal irrigation with Bacillus B006 agent; CK-NI:Water shortage treatment; TB-NI:Water shortage treatment after application with Bacillus B006 agent 图 2 芽孢杆菌B006菌剂对茄子幼苗缺水耐受能力的提升作用 Figure 2 Improvement of Bacillus B006 agent on the tolerance of eggplant seedlings under 7 day water deficit |
在茄子不同生育期,各处理的土壤养分变化见表 2。从不同时期的土壤碱解氮含量来看,两个未施用菌剂的对照处理中,少水灌溉T-40处理比正常灌溉T-30处理土壤中碱解氮含量高,且均存在显著差异(P < 0.05),表明少水灌溉不利于植株对土壤中氮的吸收。少水灌溉条件下,施用B006菌剂TB-40处理比对照T-40土壤中碱解氮含量降低,在幼苗期和盛果早、中、后期差异均显著(P < 0.05);但在正常灌溉条件下,施用B006菌剂TB-30与对照T-30土壤中碱解氮含量总体上差异不显著。该结果说明芽孢杆菌在土壤水势较低的情况下,可帮助植物吸收土壤中的氮元素。从不同时期土壤速效磷含量和土壤速效钾含量来看,施用芽孢杆菌菌剂两处理中土壤速效磷的含量较为稳定,在盛果早期和中期与对照差异显著(P < 0.05);施用芽孢杆菌菌剂处理中土壤速效钾含量在茄子幼苗期到盛果早期与对照无显著差异,但在盛果中、后期TB-40处理的土壤速效钾含量与对照相比分别显著下降了23.3%和34.4%(P < 0.05),而且比TB-30处理中土壤速效钾含量降幅明显,说明施用芽孢杆菌菌剂利于茄子对磷、钾元素的吸收。总之,在少水灌溉条件下,芽孢杆菌B006菌剂有助于植物对土壤中氮、磷、钾营养元素的吸收。
|
|
表 2 芽孢杆菌B006菌剂对茄子不同生长期土壤养分的影响 Table 2 Effect of Bacillus B006 agent on the available soil nutrients at different growth stages of eggplants |
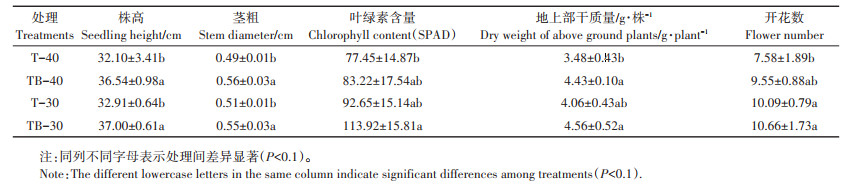
在定植后35 d测定了茄子的株高、茎粗、叶绿素含量和地上部干质量等生物量指标(表 3)。施用芽孢杆菌B006菌剂的两个处理中茄子株高和茎粗比对照分别增加了13.8%、12.4%和14.3%、7.8%,差异显著(P < 0.1);正常灌溉且施用菌剂的TB-30处理中茄子叶绿素含量、地上部干质量和开花数与对照T-30差异不显著,与少水灌溉且施用菌剂的处理TB-40相比差异也不显著,但与少水灌溉对照T-40相比差异显著(P < 0.1)。TB-30处理的叶绿素含量、地上部干质量和开花数比T-40处理分别增加47.1%、31.0%和40.6%。上述结果说明在少水灌溉条件下,芽孢杆菌B006菌剂可缓解缺水所造成的植株生长受限,促进其生长,使其达到甚至超过正常浇水施肥时植株的生长水平。正常灌水条件可使芽孢杆菌的促生作用得到更好的发挥。
|
|
表 3 不同浇水条件下芽孢杆菌B006菌剂对茄子生长发育的影响 Table 3 Effect of Bacillus B006 agent on the growth and development of eggplant under different water conditions |
在茄子拉秧时对根系生长情况的调查结果(图 3)表明,少水灌溉处理T-40与正常灌溉处理T-30相比,茄子根长、根干质量差异不显著。施用B006菌剂可促进茄子根系生长,TB-40和TB-30两处理的茄子根长和根干质量均显著高于其对照(P < 0.1),但两者之间差异不显著。
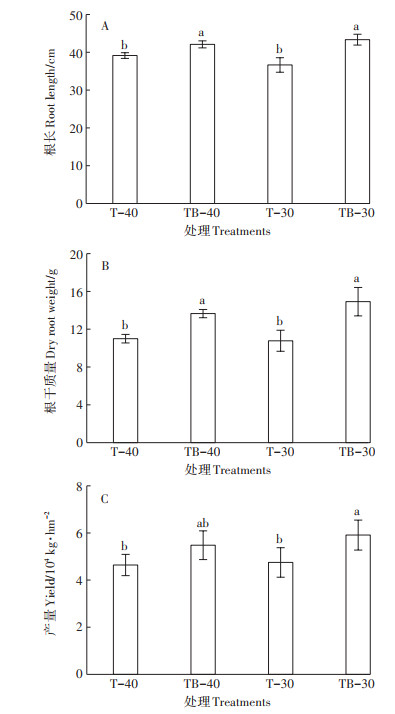
|
图 3 芽孢杆菌B006菌剂对茄子根长、根干质量及产量的影响 Figure 3 Effect of Bacillus B006 agent on root length, dry root weight and yield of eggplants |
对不同处理茄子产量的调查结果(图 3)表明,正常灌溉并施用B006菌剂的TB-30处理产量最高,平均产量为59 091.2 kg·hm–2,比对照T-30产量增加24.5%,差异显著(P < 0.1);少水灌溉并施用B006菌剂处理TB-40的平均产量为54 790.9 kg·hm–2,比对照T-40增产18.1%;施用B006菌剂两处理的灌溉量从804.88 m3·hm–2减少到574.91 m3·hm–2,但产量差异不显著(P > 0.1)。上述结果表明少水灌溉条件下施用芽孢杆菌B006菌剂仍可促进植株生长,且不降低产量,在土壤水势为-30 kPa时进行灌溉并施用芽孢杆菌B006菌剂可进一步促进茄子生长并提高产量。
3 讨论蔬菜在生长过程中对水分和营养的需求并不是恒定的,如何科学管理水、肥用量并提高作物产量对设施蔬菜生产具有重要意义。邢英英等[27]研究表明不合理的灌溉与氮肥施用不仅不能增加产量,反而会增加土壤剖面硝态氮累积、降低作物品质,而减水减肥能有效提高肥料利用率[28-29]。有益微生物不仅能通过与植物互作促进肥料的使用效率[30],而且其所制成的微生物肥与化肥减量配施还可提高土壤微生物数量并改善土壤肥力[31]。本研究将水肥一体化技术与有益微生物制剂应用相结合,以土壤水势指导浇水时间和浇水量,发现芽孢杆菌B006菌剂能够促进茄子的根系生长并具增产效果,使少水条件下产量达到正常浇水的产量水平,为水肥一体化条件下合理灌溉和应用芽孢杆菌提供了指导。为了减少肥料投入,在茄子不同生育期使用了不同的追肥量,开花坐果期和盛果期追肥量是苗期追肥量的6倍,然而花果期土壤中的养分含量远远低于苗期,说明茄子在苗期需要的肥料量很少,与前人研究结果一致[32],提示在作物苗期应减少追肥用量。
灌水量不仅影响植物根系在土壤中的分布,还与土壤中营养元素相互作用,最终影响产量。赵俊芳等[33]研究发现较少灌水更利于旱稻根系向中下层土壤分布,根冠比增加,利于旱稻对土壤深层水的利用,从而减少灌溉水的投入。Zhang等[34]研究表明,不同作物或同种作物的不同品种对水分和氮素的营养需求不同,低土壤含水量(土壤水势-20 kPa)和中等水平施氮量适于旱稻,而高土壤含水量(土壤水势0kPa)和低水平施氮量更适合水稻生长和根系发育,这与旱稻和水稻根系在土壤中的分布有关。旱稻根系主要分布于10~20 cm耕作层,而水稻根系主要分布于0~5 cm耕作层。因此确定适宜的土壤水势和施肥量,既可避免水分和氮素营养的过多投入又可增产,在生产中具有重要的意义。本研究采用的土壤水势-30 kPa和-40 kPa是比较适合茄子生长的用水量[2-3],在这两种土壤水势条件下,茄子根系生长差异不显著,但使用B006菌剂可明显促进茄子根系发育,根长和根干质量增加,说明根系向土壤深层伸展可帮助茄子更好地利用深层土壤的养分和水分[33, 35]。虽然本研究中所有处理的土壤施肥量和追肥量相同,但应用芽孢杆菌的土壤中可溶性磷、钾含量减少,氮含量略高于对照,而植株生长并未受到影响,其生长和开花、结实还有明显的提升(表 3),因此认为,芽孢杆菌的应用首先促进了根系的生长及其对土壤深层养分的利用,是芽孢杆菌促进植物生长的重要原因。土壤中氮元素增多可能是由于土壤中氮素营养供应过多,远远超出茄子本身需求量,而造成土壤中碱解氮略有升高。芽孢杆菌B006菌剂应用与植物对土壤中营养元素利用效率之间的相关性还需要进一步研究。
植物耐受缺水胁迫的能力可以通过叶片水势、光合作用、气孔导度、蒸腾速率和叶面积指数等生理指标来反映[36],本研究盆栽试验验证了芽孢杆菌B006菌剂能够提高茄子对短期缺水的耐受能力。在田间小区试验中,监测土壤灌水量所采用的土壤水势-30 kPa和-40 kPa,是比较适合茄子生长的土壤水势,其是否影响上述生理指标,尚需进一步研究。B006菌剂的应用提高了茄子叶片中叶绿素含量,可能增加了叶片的光合作用效率,进而影响植株生长及产量。此外,前人研究认为芽孢杆菌或其他微生物产生的代谢物是有益菌的重要促生机理[37-38]。芽孢杆菌B006具有编码IAA(吲哚乙酸)产生的基因簇[22],并可产生IAA(待发表),IAA的产生可能直接促进茄子的根系发育,使其可以从深层土壤吸收更多的水分和养分;IAA也可能促进植株的光合效率,或通过影响根系水压、调节植物根系水分运输[39]来促进植物的生长。有关B006菌剂对茄子的促生机理还需要深入研究。
综上所述,芽孢杆菌B006菌剂在不同土壤水势下均能促进茄子根系生长,并能增强根系对土壤中营养元素的吸收利用,未来将进一步明确土壤水势、肥料用量与芽孢杆菌用量之间是否存在互作或协同作用,以及通过何种途径调控植物生长,为水、肥及有益微生物的利用提供理论基础。
4 结论(1)施用芽孢杆菌B006菌剂可以促进茄子对氮、磷、钾的吸收,提高肥料利用率。
(2)芽孢杆菌B006菌剂对茄子苗期生长有明显的促生作用,并能提高茄子幼苗对短期缺水的耐受能力。
(3)正常浇水并施用芽孢杆菌B006菌剂可显著促进茄子生长并提高产量。少水灌溉并增施芽孢杆菌B006菌剂可以缓解因缺水所造成的植株生长受限。
| [1] |
姚小英, 王澄海, 蒲金涌, 等. 甘肃黄土高原地区土壤水热特征分析研究[J]. 土壤通报, 2006, 37(4): 666-670. YAO Xiao-ying, WANG Cheng-hai, PU Jin-yong, et al. Hydro-thermal feature of soil in the Loess Plateau, Gansu[J]. Chinese Journal of Soil Science, 2006, 37(4): 666-670. |
| [2] |
马建辉, 叶旭红, 韩冰, 等. 膜下滴灌不同灌水控制下限对设施土壤团聚体分布特征的影响[J]. 中国农业科学, 2017, 50(18): 3561-3571. MA Jian-hui, YE Xu-hong, HAN Bing, et al. Effects of different controlled irrigation low limits on the size distribution of soil aggregates with drip irrigation under film mulching in a greenhouse soil[J]. Scientia Agricultura Sinica, 2017, 50(18): 3561-3571. |
| [3] |
蒋树芳, 万书勤, 康跃虎. 滴灌条件下不同土壤基质势对圆茄子生长与水分利用的影响[J]. 灌溉排水学报, 2009, 28(4): 66-69. JIANG Shu-fang, WAN Shu-qin, KANG Yue-hu. Effects of soil matric potential on eggplant growth and water use efficiency under drip irrigation[J]. Journal of Irrigation and Drainage, 2009, 28(4): 66-69. |
| [4] |
仝国栋, 刘洪禄, 吴文勇, 等. 不同水分处理对茄子生长与产量品质的影响[J]. 排灌机械工程学报, 2013, 31(6): 540-545. TONG Guo-dong, LIU Hong-lu, WU Wen-yong, et al. Effects of different water treatments on growth, yield and quality of greenhouse eggplant[J]. Journal of Drainage and Irrigation Machinery Engineering, 2013, 31(6): 540-545. |
| [5] |
陈修斌, 杨彬, 闫芳, 等. 不同土壤含水量对日光温室茄子生长及生理特性影响[J]. 土壤通报, 2009, 40(2): 231-234. CHEN Xiu-bin, YANG Bin, YAN Fang, et al. Effect of different soil moistures on growth and physiological characteristics of solar greenhouse spring eggplant during fruit stage[J]. Chinese Journal of Soil Science, 2009, 40(2): 231-234. |
| [6] |
弓萌萌, 张培雁, 张瑞禹, 等. 干旱胁迫及复水处理对'秋福'红树莓苗期生理特性的影响[J]. 经济林研究, 2019, 37(1): 94-99. GONG Meng-meng, ZHANG Pei-yan, ZHANG Rui-yu, et al. Effects of drought stress and re-watering treatment on physiological characteristics in 'Autumn Bliss' Rubus idaeus seedlings[J]. Nonwood Forest Research, 2019, 37(1): 94-99. |
| [7] |
Potters G, Pasternak T P, Guisez Y, et al. Stress-induced morphogenic responses:Growing out of trouble?[J]. Trends in Plant Science, 2007, 12(3): 98-105. |
| [8] |
Pasternak T, Rudas V, Potters G, et al. Morphogenic effects of abiotic stress:Reorientation of growth in Arabidopsis thaliana seedlings[J]. Environmental and Experimental Botany, 2005, 53(3): 299-314. |
| [9] |
Na X F, Yu H L, Wang P, et al. Vegetation biomass and soil moisture co-regulate bacterial community succession under altered precipitation regimes in a desert steppe in northwestern China[J]. Soil Biology and Biochemistry, 2019, 136: 107520. |
| [10] |
Santos-Medellín C, Edwards J, Liechty Z, et al. Drought stress results in a compartment-specific restructuring of the rice root-associated microbiomes[J]. mBio, 2017, 8(4): e00764-17. |
| [11] |
Nessner K V, Taketani R G, Lanconi M D, et al. Water regime influences bulk soil and rhizosphere of Cereus jamacaru bacterial communities in the Brazilian Caatinga biome[J]. PLoS ONE, 2013, 8(9): e0073606. |
| [12] |
Ahemad M, Kibret M. Mechanisms and applications of plant growth promoting rhizobacteria:Current perspective[J]. Journal of King Saud University:Science, 2014, 26(1): 1-20. |
| [13] |
Fahad S, Hussan S, Bano A, et al. Potential role of phytohormones and plant growth-promoting rhizobacteria in abiotic stresses:Consequences for changing environment[J]. Environmental Science and Pollution Research, 2015, 22(7): 4907-4921. |
| [14] |
Vejan P, Abdullah R, Khadiran T, et al. Role of plant growth promoting rhizobacteria in agricultural sustainability:A review[J]. Molecules, 2016, 21(5): e573. |
| [15] |
Grover M, Madhubala R, Ali S Z, et al. Influence of Bacillus spp. strains on seedling growth and physiological parameters of sorghum under moisture stress conditions[J]. Journal of Basic Microbiology, 2014, 54(9): 951-961. |
| [16] |
García J E, Maroniche G, Creus C, et al. In vitro PGPR properties and osmotic tolerance of different Azospirillum native strains and their effects on growth of maize under drought stress[J]. Microbiological Research, 2017, 202: 21-29. |
| [17] |
Sandhya V, Ali S Z, Grover M, et al. Alleviation of drought stress effects in sunflower seedlings by the exopolysaccharides producing Pseudomonas putida strain GAP-P45[J]. Biology and Fertility of Soils, 2009, 46(1): 17-26. |
| [18] |
Cho S M, Kang B R, Han S H, et al. 2R, 3R-butanediol, a bacterial volatile produced by Pseudomonas chlororaphis O6, is involved in induction of systemic tolerance to drought in Arabidopsis thaliana[J]. Molecular Plant-Microbe Interactions, 2008, 21(8): 1067-1075. |
| [19] |
周冬梅.植物-微生物互作提高植物抗生物和非生物胁迫能力的机理研究及应用[D].南京: 南京农业大学, 2015: 16-18. ZHOU Dong-mei. Plant-microbe interactions to improve plant resistance to biotic and abiotic stresses[D]. Nanjing: Nanjing Agricultural University, 2015: 16-18. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017044235.htm |
| [20] |
王俊霞. 水肥一体化在日光温室中的应用[J]. 农业技术与装备, 2011(13): 68-70. WANG Jun-xia. Application of water and fertilizer integration in solar greenhouse[J]. Agricultural Technology and Equipment, 2011(13): 68-70. |
| [21] |
贾珂, 李世东, 刘桂君, 等. 枯草芽孢杆菌B006产surfactin突变株特性及其对黄瓜枯萎病的抑制能力[J]. 中国生物防治学报, 2013, 29(4): 538-546. JIA Ke, LI Shi-dong, LIU Gui-jun, et al. Characteristics of surfactin mutants of Bacillus subtilis B006 and their suppressing ability against cucumber Fusarium wilt[J]. Chinese Journal of Biological Control, 2013, 29(4): 538-546. |
| [22] |
Gao Y H, Guo R J, Li S D. Draft genome sequence of Bacillus velezensis B6, a rhizobacterium that can control plant diseases[J]. Genome Announcements, 2018, 6(12): e00182-18. |
| [23] |
王军强.枯草芽孢杆菌B006的发酵工艺优化及其代谢组学研究[D].连云港: 江苏海洋大学, 2017: 10-12. WANG Jun-qiang. Optimization of fermentation process and metabolomics of Bacillus subtilis B006[D]. Lianyungang: Jiangsu Ocean University, 2017: 10-12. |
| [24] |
马海莲, 刘会清, 郭荣军, 等. 芽孢杆菌在棚室黄瓜育苗上的应用研究[J]. 北方园艺, 2011(23): 33-34. MA Hai-lian, LIU Hui-qing, GUO Rong-jun, et al. Study on applications of bio-control Bacillus on cucumber seeding in greenhouse[J]. Northern Horticulture, 2011(23): 33-34. |
| [25] |
郭焘, 于红博. 土壤含水量测定方法综述[J]. 内蒙古科技与经济, 2018(3): 66-67. GUO Tao, YU Hong-bo. Review of methods for measuring soil water content[J]. Inner Mongolia Science Technology & Economy, 2018(3): 66-67. |
| [26] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000: 127-136. LU Ru-kun. Chemical analysis method of soil agriculture[M]. Beijing: China Agricultural Science and Technology Press, 2000: 127-136. |
| [27] |
邢英英, 张富仓, 张燕, 等. 滴灌施肥水肥耦合对温室番茄产量、品质和水氮利用的影响[J]. 中国农业科学, 2015, 48(4): 713-726. XING Ying-ying, ZHANG Fu-cang, ZHANG Yan, et al. Effect of irrigation and fertilizer coupling on greenhouse tomato yield, quality, water and nitrogen utilization under fertigation[J]. Scientia Agricultura Sinica, 2015, 48(4): 713-726. |
| [28] |
邹慧芳, 李丽君, 刘平, 等. 减水减肥条件下温室黄瓜产量、养分吸收情况[J]. 山西农业科学, 2019, 47(3): 393-397. ZOU Hui-fang, LI Li-jun, LIU Ping, et al. Study on cucumber yield and nutrient uptake under reduced irrigation and fertilization[J]. Journal of Shanxi Agricultural Sciences, 2019, 47(3): 393-397. |
| [29] |
罗勤, 陈竹君, 闫波, 等. 水肥减量对日光温室土壤水分状况及番茄产量和品质的影响[J]. 植物营养与肥料学报, 2015, 21(2): 449-457. LUO Qin, CHEN Zhu-jun, YAN Bo, et al. Effects of reducing water and fertilizer rates on soil moisture and yield and quality of tomato in solar greenhouse[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(2): 449-457. |
| [30] |
Adesemoye A O, Kloepper J W. Plant-microbes interactions in enhanced fertilizer-use efficiency[J]. Applied Microbiology and Biotechnology, 2009, 85(1): 1-12. |
| [31] |
赵政, 陈巍, 王欢, 等. 木霉微生物肥与减量化肥配施对番茄产量、品质及土壤肥力的影响[J]. 土壤学报, 2018, 55(5): 1243-1253. ZHAO Zheng, CHEN Wei, WANG Huan, et al. Effects of bio-manure combined with chemical fertilizer reduced in application rate on soil fertility and yield and quality of tomato[J]. Acta Pedologica Sinica, 2018, 55(5): 1243-1253. |
| [32] |
杜健宇, 夏春婷, 左秀丽. 茄子需肥特点及施肥[J]. 河北农业科技, 2007(7): 47. DU Jian-yu, XIA Chun-ting, ZUO Xiu-li. Characteristics and fertilization of eggplant[J]. Hebei Agricultural Science and Technology, 2007(7): 47. |
| [33] |
赵俊芳, 杨晓光, 陈斌, 等. 不同灌溉处理对旱稻根系生长及水分利用效率的影响[J]. 中国农业气象, 2004, 25(4): 44-48. ZHAO Jun-fang, YANG Xiao-guang, CHEN Bin, et al. Effects of different irrigation treatments on root growth and water use efficiency of upland rice[J]. Chinese Journal of Agrometeorology, 2004, 25(4): 44-48. |
| [34] |
Zhang Y J, Xu J N, Cheng Y D, et al. The effects of water and nitrogen on the roots and yield of upland and paddy rice[J]. Journal of Integrative Agriculture, 2020, 19(5): 1363-1374. |
| [35] |
Wang X B, Zhou B Y, Sun X F, et al. Soil tillage management affects maize grain yield by regulating spatial distribution coordination of roots, soil moisture and nitrogen status[J]. PLoS ONE, 2015, 10(6): e0129231. |
| [36] |
饶玲.不同外源硒对干旱胁迫下黄瓜生长的影响[D].重庆: 西南大学, 2017: 1-6. RAO Ling. Effects of exogenous selenium on the growth of cucumber under drought stress[D]. Chongqing: Southwest University, 2017: 1-6. http://cdmd.cnki.com.cn/Article/CDMD-10635-1017847222.htm |
| [37] |
Liu Y P, Chen L, Wu G W, et al. Identification of root-secreted compounds involved in the communication between cucumber, the beneficial Bacillus amyloliquefaciens, and the soil-borne pathogen Fusarium oxysporum[J]. Mol Plant Microbe Interact, 2017, 30(1): 53-62. |
| [38] |
Kokalis-Burelle N, Kloepper J W, Reddy M S. Plant growth-promoting rhizobacteria as transplant amendments and their effects on indigenous rhizosphere microorganisms[J]. Applied Soil Ecology, 2005, 31(1): 91-100. |
| [39] |
Quiroga G, Erice G, Aroca R, et al. Radial water transport in arbuscular mycorrhizal maize plants under drought stress conditions is affected by indole-acetic acid(IAA) application[J]. Journal of Plant Physiology, 2020, 246/247-e153115. |
 2020, Vol. 37
2020, Vol. 37