2. 长春职业技术学院食品与生物技术分院, 长春 130033
2. College of Food Production Technology and Biotechnology, Changchun Vocational Institute of Technology, Changchun 130033, China
雌激素是目前环境中的一类主要污染源,其主要来源是化工、制药、农业、林业和畜牧业的集约化生产。在过去的半个世纪,畜牧业已成为环境中雌激素污染的主要来源[1]。有关饲料和禽畜粪便中雌性激素残留的检测受到越来越多学者的关注,高效液相色谱法、气相色谱法、色谱-质谱联用法、高效薄层色谱法、毛细管电泳分析法、免疫分析法等得以广泛使用[2]。其中高效液相色谱检测技术较为成熟,最低检测限达到310 ng·mL-1,加标回收率71%~95%,因此该方法广泛应用于雌激素污染物的检验[3]。过量的雌激素可以使女性肿瘤的发病率增高,如乳腺癌和子宫癌等;也导致男性精液的体积减少25%,精子浓度降低50%,因此雌激素污染问题已经受到许多发达国家的普遍重视[4]。当雌激素浓度达到1.0ng·L-1时即可干扰生物内分泌系统[5]。然而就我国而言,松花江、长江中游等水源中的雌激素浓度远远高于该水平[6-7]。因此,对于雌激素污染的治理是十分必要的。
近些年来,越来越多的学者关注雌激素污染物降解方法的研究。自然光催化法、光催化耦合膜滤技术、湿式氧化催化降解法等方法应运而生[8-10]。然而上述方法中无论光催化剂制备还是高压反应釜催化和过滤膜耦合,都存在生产成本高、雌激素污染物降解率低、工业应用困难、造成二次污染等一系列问题。目前,微生物降解法是环境中雌激素污染物降解最有效且环境友好的方法[11]。现已报道的雌激素降解菌有近百株,它们在一定条件下对雌激素降解率超过90%。雌激素降解菌中变形菌门占的比重最大,有44株,放线菌门有16株,厚壁菌门12株。其他菌门菌株数量较少,如拟杆菌门只有3株。这些菌株可产生促进雌激素污染物降解的酶类[12]。如亚硝化单胞菌属(Nitrosomonas sp.)可产生单加氧酶(Monooxygenase);诺卡氏菌属(Nocardia sp.)及不动杆菌属(Acinetobacter sp.)可产生双加氧酶(Dioxygenase);红球菌属(Rhodococcus sp.)及鞘氨醇单胞菌属(Sphingomonas sp.)可产生单加氧酶、双加氧酶、羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase,HSD)等[13-14]。微生物法降解雌激素的过程中,选择合适的降解菌株成为雌激素污染物能否高效降解的重要因素。
1951年,德国学者在西班牙巴塞罗那首次分离了能够水解雌激素的革兰氏阴性菌——睾丸酮丛毛单胞菌(CT1,Comamonas testosteroni ATCC11996) [15]。这种细菌以雌激素为碳源[13],通过约20种酶来降解雌激素[16-17]。基因诱导机理研究,发现一些调节雌激素代谢酶基因表达的特异操纵子、抑制子和激活子,通过基因工程的方法敲除某些抑制子,或将强启动子插入激活子基因的上游都可能提高CT1水解雌激素的能力[18-19]。将CT1中抑制子RepA基因敲除后得到变异株Ca3;将CT1中敲除抑制子RepB基因后得到变异株Cb7。3α-羟基类固醇脱氢酶(3α-HSD) /羰基还原酶(CR)是CT1在雌激素降解过程中的一种关键酶。这种酶在变异株Ca3和Cb7的基因中表达量增加了10倍[20-21]。M6变异株是通过敲除CT1中抑制子PhaR基因得到的[22]。在DNA依赖的RNA聚合酶中,σ因子负责识别转录起始点。在CT1中敲除一个σ因子合成的抑制子RseA基因得到变异株M2[23]。M2同样提高了菌株的3α-HSD和3, 17β-羟基类固醇脱氢酶(3, 17β-HSD)表达和水解底物的能力。
在3α-HSD/CR基因的上游发现了一种活化基因,它的活化剂是一种蛋白质,可以与启动子结构结合并增加CT1中3α-HSD/CR和3, 17β-HSD基因的表达。因此可以将强启动子“tac”插入激活基因的上游,得到变异株Mact1,Mact1对雌激素表现出极高的降解活性[24]。通常来说,CT1中雌激素的降解发生在低于30 ℃的温度条件下。当温度高于35 ℃时,雌激素不能被CT1降解。然而,由于变异株A3是强启动子“tac”插入CT1中3α-HSD/CR基因的上游,从而使得A3能够在37 ℃的条件下降解雌激素[25]。由美国分离得到的另外一种睾丸酮丛毛单胞菌菌株KF-1 (Comamonas testosteroni ATCC49202),具有降解雌激素的作用[26]。弧菌(Vibrio,H5)和布丘氏菌(Buttiauxella,S19-1)从德国的波罗的海分离得到。这两种细菌可以在高盐浓度(5% NaCl)的培养基中降解雌激素[27-28]。由于鸡粪中的盐浓度高于1.7%,因此H5和S19-1可能更适合用于粪便中雌激素的降解。恶臭假单胞菌(Pseudomonas putida,LN12)是一种新分离得到的菌株。这种菌株在雌激素降解的过程中,可以产生高双加氧酶,能够高效降解多种雌激素,包括雌二醇(E2)。
本研究利用高效液相色谱法检测蛋鸡饲料和鸡粪中的雌激素。通过对以上11种菌株(CT1、Ca3、Cb7、M2、M6、Mact1、A3、KF-1、H5、S19-1和LN12)和上述菌株等体积混合得到的菌群的降解实验,研究其对雌激素的降解能力和降解的影响因素。
1 材料与方法 1.1 试验材料和仪器色谱纯E2购于美国Sigma-Aldrich公司;硫酸卡那霉素购于Sigma-Aldrich公司;提取溶剂使用分析纯氯仿;色谱纯乙腈购于Fisher Scientific公司;超纯水(18.2 MΩ·cm-1)用于HPLC分析。选择海兰褐蛋鸡为研究对象;蛋鸡饲料购于吉林省双阳饲料厂。
11种雌激素降解菌株均由德国基尔大学提供。试验仪器:BZF-30型真空干燥箱;B3024型离心机;MS3002分析天平;MX-F可调式混匀仪;Waters e2695高效液相色谱仪。
1.2 饲养和鸡粪采集选用鸡龄50周的成熟、健康海兰褐蛋鸡80只,平均分为四组(4次重复),每组20只,每日每组饲喂蛋鸡饲料2.5 kg,分早晚两次饲喂。鸡粪样品为采食后1 h的新鲜粪便,用一次性无菌袋收集并混合,立即进行样品处理和提取。
1.3 雌激素的提取在无菌试管中加入1 g鸡粪或鸡饲料和4 mL LB培养基,或者经微生物降解后的样品,加入1 mL氯仿,转移至10 mL离心管中,振摇20 min,氯仿相与水相在4000 r·min-1离心10 min后分层,雌激素溶于氯仿相中。然后取氯仿相500 µL放置于1.5 mL Eppendorf试管中。样品于13 000 r·min-1离心10 min,取氯仿相300 µL放置于新的试管中,室温真空干燥30 min。取40 µL HPLC的流动相溶解,待测。
1.4 雌激素的检测利用高效液相色谱仪(Waters e2695)检测雌激素。检测器为UV(2988 Water Detector)。色谱柱为C18柱(5 μm,4.6 mm×150 mm,Waters),液相色谱条件:以乙腈:水=50:50(V:V)作为流动相,流速为1 mL·min-1;λ=225 nm;进样量为5 μL;柱温为25 ℃[29],每个实验对照均重复4次。方法的质量控制和保证如下:设置8组E2标准溶液,摩尔浓度为0.1、0.5、1.0、5.0、10.0、50.0、100.0 μmol·L-1和200.0 μmol·L-1,其线性方程的R2>0.99;在实际样品分析过程中,每10个样品设置一个空白样,用于测定分析过程中的背景干扰;根据3倍信噪比(S/N=3) E2的检测限(LOD)为8.2 ng·mL-1,定量限(QOD)为27.2 ng·mL-1;每10个样品添加一个质量控制(QC)标准,用于检测仪器的稳定性,校正保留时间,验证响应;同一样品设置4个平行样品。平行样品相对标准偏差(RSD) ≤5%。
1.5 单一菌株和菌群对雌激素的降解将-80 ℃保存的11种菌株(CT1、Ca3、Cb7、M2、M6、Mact1、A3、KF-1、H5、S19-1和LN12)室温融化。吸取200 μL CT1、KF1和LN12的菌液分别接种在2 mL LB培养基。吸取200 μL H5和S19-1菌液分别接种至2 mL 2%(质量分数) NaCl的LB培养基中。吸取200 μL Ca3、Cb7、M6、M2、Mact1和A3菌液分别在含有40 μg·mL-1硫酸卡那霉素(用于工程菌筛选)的2 mL LB培养基中培养。将上述菌液在180 r·min-1、27 ℃下振荡,恒温培养过夜。分别将11种菌株的浓度调节至OD600nm=1.0(细菌含量为3.5×109个·mL-1)。将上述11种菌株分别取0.1 mL混合制备成微生物菌群。然后分别将1 mL 11种菌株和菌群分别接种到3 mL培养基中,再加入0.5 mmol·L-1 E2,置于恒温摇床(180 r·min-1)中在27 ℃条件下培养10 d。比较11种菌株和混合菌群对E2标准样品的降解率。
1.6 菌株降解雌激素条件的优化按照1.5节所述方法制备混合菌群种子液(OD600nm=1.0),将种子液接种到含有0.5 mmol·L-1 E2的3 mL LB培养基中,单因素分析菌群在不同培养时间(2、5、10、20 d)、培养温度(10、20、27、37 ℃)和发酵液pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0)下对E2的降解率,其他培养条件同1.5。利用HPLC分析对比不同培养条件下降解前后发酵液中的E2浓度,计算降解率。
1.7 混合菌群在鸡粪雌激素降解中的效果按照1.5节所述方法制备混合菌群种子液(OD600nm=1.0),并将其分别稀释10倍和100倍,即得到OD600nm=0.1和OD600nm=0.01的菌群。OD600nm=0即为直接加入LB,不进行接种。将1 g鸡粪加入至0.5 mmol·L-1 E2和3 mL LB培养基中,再分别加入1 mL不同浓度的菌群,菌群浓度分别为OD600nm=0(不加菌的对照组)、0.01、0.1、1.0,置于恒温摇床(180 r·min-1)中在27 ℃条件下培养10 d,利用HPLC法分析比较不同菌群浓度对E2的降解率。
1.8 雌激素降解率的计算
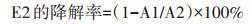
|
式中:A1为经过微生物降解后经HPLC检测的剩余E2的面积;A2为微生物降解前经HPLC检测的E2的面积。
2 结果与分析 2.1 鸡粪和鸡饲料中E2的检测利用HPLC对0.5 mmol·L-1 E2的标准品进行检测。结果(图 1)表明E2在4.1 min被洗脱。

|
图 1 E2标准品的HPLC谱图(225 nm) Figure 1 The standards of E2 detected by HPLC(225 nm) |
如图 2所示,标准曲线用于检测鸡粪提取物中的E2含量。使用10、20、30、40、50 μmol·L-1 E2的标准品来绘制标准曲线,相应的峰面积与E2浓度线性相关。
|
图 2 鸡粪提取物的HPLC谱图(225 nm) Figure 2 The extract isolated from chicken feces, detected by HPLC(225 nm) |
从1 g鸡粪和1 g鸡饲料中分离得到了雌激素污染物。在鸡粪中能够检测到E2吸收峰(4.1 min)(图 2),而鸡饲料的HPLC谱图中没有发现E2吸收峰(图 3)。通过E2的标准曲线,计算得出鸡粪中E2的含量为230 ng·g-1。因此利用微生物降解对其进行生物修复是非常有必要的。

|
图 3 鸡饲料提取物的HPLC谱图(225 nm) Figure 3 The extract isolated from chicken feed, detected by HPLC(225 nm) |
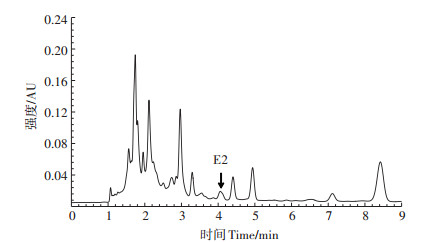
如图 4所示,在相同培养条件下,混合菌群对E2降解率最高,为76%,Ca3和Mact1的降解能力显著高于其他菌株,降解率为70%,与菌群相比不存在显著差异。而H5、S19 - 1和LN12的降解能力较差(约9%),其他6种单一菌株对E2的降解率为42%~61%,与菌群相比具有显著差异(P < 0.05)。因此,选用微生物菌群研究不同培养条件对E2降解率的影响。
|
不同小写字母表示差异显著(P < 0.05)。下同 Different lowercase letters indicate significant difference(P < 0.05). The same below 图 4 11种单菌和菌群(OD600nm=1.0)对E2的降解率 Figure 4 The degradation rate of E2 degraded by 11 bacterial strains and the bacterial group(OD600nm=1.0) |
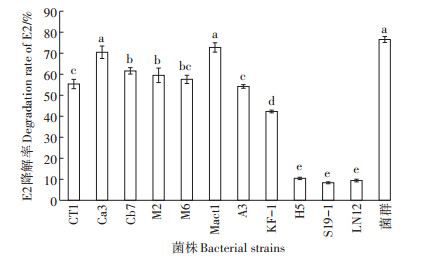
如图 5所示,在培养10 d时,菌群对E2降解率最大,约有76.6%的E2被降解,20 d时E2的降解率略有降低。因此,菌群降解0.5 mmol·L-1 E2的适宜降解时间为10 d。
|
图 5 不同培养时间下菌群(OD600nm=1.0)对E2的降解率 Figure 5 The E2 degradation rate of the bacterial group (OD600nm=1.0)at different time |
如图 6所示,在27 ℃时,E2降解率最高,为76.3%,这也是菌株生长的最适温度。当温度升高时,E2降解率大幅下降。这与以往报道的当温度高于35 ℃时,雌激素不能被CT1等菌株降解的结论相符[25]。当温度降低时,E2的降解率有所下降,但要高于高温条件,这可能是由于在低温条件下微生物生长代谢变得缓慢。说明菌群更适于在温度相对偏低的条件下进行降解。
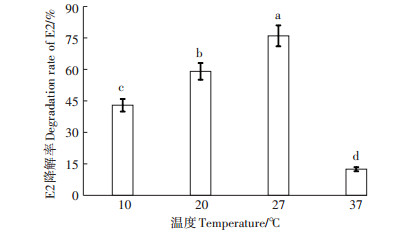
|
图 6 不同温度下菌群(OD600nm=1.0)对E2的降解率 Figure 6 The E2 degradation rate of the bacterial group (OD600nm=1.0)at different temperature |
如图 7所示,在pH值为8.0时,E2降解率达到最大,为78.6%。随着pH值的增加,E2的降解率明显下降,pH为6.0、7.0和8.0时,E2的降解率相近,均在75%~80%之间。考虑到样品本身pH为6.0,因此选用的降解条件为pH 6.0、27 ℃条件下培养10 d。
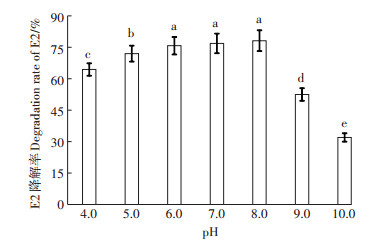
|
图 7 不同pH值下菌群(OD600nm=1.0)对E2的降解率 Figure 7 The E2 degradation rate of the bacterial group (OD600nm=1.0)with different pH values |
雌激素污染物的微生物降解主要是通过酶促反应来完成,是单加氧酶、双加氧酶、羟基类固醇脱氢酶等多种酶系协同作用的结果。单一菌株产生酶系往往也较为单一,如假单胞菌属以产生羟基类固醇脱氢酶为主,不动杆菌属以产生双加氧酶为主[12]。本研究通过单一菌株和混合菌群的雌激素污染物降解实验,证明混合菌株的降解率高于单一菌株,菌群对E2降解率高的原因可能是多种微生物共同参与雌激素的代谢,是多种酶系的共同参与和协同作用的结果。在后续的工作中,将开展组学分析,以期进一步研究雌激素降解酶的协同作用和调控机制。
2.4 微生物菌群对鸡粪中E2的降解由于鸡粪中E2的含量较低,为了研究菌群浓度对降解率的影响,将0.5 mmol·L-1 E2标准品添加到1 g鸡粪中,再加入不同浓度的微生物菌群,降解10 d。结果如图 8所示,E2的降解率随菌体浓度的增加而提高。当OD600nm增加至1.0时,E2降解率达到最大,约有70%的E2被菌群降解。由于添加的E2 (0.5 mmol· L-1)比天然条件下的浓度高出很多倍,所以经过微生物菌群培养10 d后的鸡粪中的E2依然有部分残留。

|
图 8 不同浓度下菌群对E2的降解率 Figure 8 The E2 degradation rate of the bacterial group under different concentrations |
(1) 利用HPLC法在鸡粪中检测出E2,含量为230 ng·g-1。
(2) 通过对比11个单一菌株和混合菌群对雌激素的降解率,证明菌群对雌激素降解率最高。通过研究菌群降解E2的影响因素,结果表明在pH值为8.0、降解温度为27 ℃、降解10 d时,菌群对E2的降解率达到最大,为78.6%。
| [1] |
李依韦, 银玲, 薛兰兰. 土壤中异黄酮植物雌激素降解体系的研究[J]. 环境污染与防治, 2012, 34(3): 55-58. LI Yi-wei, YIN Ling, XUE Lan-lan. Research on the degradation system of isoflavionic phytoestrogren in soil[J]. Environmental Pollution and Prevention, 2012, 34(3): 55-58. DOI:10.3969/j.issn.1001-3865.2012.03.012 |
| [2] |
达剑森. 饲料及畜产品中雌激素检测方法的研究进展[J]. 草业与畜牧, 2016, 226(3): 51-55. DA Jian-sen. Progress of detection methods for estrogens in feeds and animal products[J]. Grass and Livestock, 2016, 226(3): 51-55. DOI:10.3969/j.issn.1673-8403.2016.03.011 |
| [3] |
Ciofi L, Fibbi D, Chiuninatto U, et al. Fully-automated on-line solid phase extraction coupled to high-performance liquid chromatographytandem mass spectrometric analysis at sub-ng/L levels of selected estrogens in surface water and wastewater[J]. Journal of Chromatography A, 2013(1283): 53-61. |
| [4] |
屈海娜. P2X受体在雌激素促进乳腺癌细胞系MCF-7增殖中的作用[D].上海: 第二军医大学, 2010. QU Hai -na. The effect of P2X receptor on modulation of estrogen on the MCF-7 human brest cancer cells proliferation[D]. Shanghai: Second Military Medical University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-90024-2010150835.htm |
| [5] |
Ying G, Kookana R, Ru Y. Occurrence and fate of hormone steroids in the environment[J]. Environment International, 2002, 28: 545-551. DOI:10.1016/S0160-4120(02)00075-2 |
| [6] |
温馨.雌激素和孕激素在松花江水体及给水处理单元的分布规律[D].哈尔滨: 哈尔滨工业大学, 2014. WEN Xin. Reserach on the distribution of hormones in Songhua River and drinking water treatment processes[D]. Harbin: Harbin Institute of Technology, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10213-1014083234.htm |
| [7] |
Yang Y, Cao X, Zhang M, et al. Occurrence and distribution of endocrine-disrupting compounds in the Honghu Lake and east Dongting Lake along the central Yangtze River, China[J]. Environmental Science and Pollution Research, 2015, 22: 17644-17652. DOI:10.1007/s11356-015-4980-y |
| [8] |
王明泉.水源调蓄供水雌激素污染特征及光催化耦合膜滤技术[D].哈尔滨: 哈尔滨工业大学, 2017. WANG Ming-quan. Pollution of estrogen in water supply and the photocatalytic removed technology coupled with ultrafiltration[D]. Harbin: Harbin Institute of Technology, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10213-1017862091.htm |
| [9] |
中国科学院大连化学物理研究所.一种模拟自然光催化降解雌激素类污染物的方法: CN200610134016.7[P]. 2008-04-30. Dalian Institute of Chemical Physics, Chinese Academy of Sciences. A method for simulating natural photocatalytic degradation of estrogen pollutants: CN200610134016.7[P]. 2008-04-30. |
| [10] |
中国科学院大连化学物理研究所.一种催化湿式氧化降解雌激素污染物的方法: CN200610134022.2[P]. 2008-04-30. Dalian Institute of Chemical Physics, Chinese Academy of Sciences. A method for catalyzing wet oxidation degradation of estrogen pollutants: CN200610134022.2[P]. 2008-04-30. |
| [11] |
林泳墨, 秦玉莹, 李明堂. 雌激素类污染物的微生物降解研究进展[J]. 广州化工, 2016, 44(11): 3-4. LIN Yong-mo, QIN Yu-ying, LI Ming-tang. Review on estrogens microbial degradation of pollutants[J]. Guangzhou Chemical, 2016, 44(11): 3-4. DOI:10.3969/j.issn.1001-9677.2016.11.002 |
| [12] |
田克俭, 孟繁星, 霍洪亮. 环境雌激素的微生物降解[J]. 微生物学报, 2019, 59(3): 442-453. TIAN Ke-jian, MENG Fan-xing, HUO Hong-liang. Microbial degradation of environmental estrogens[J]. Acta Microbiologica Sinica, 2019, 59(3): 442-453. |
| [13] |
Chen Y L, Yu C P, Lee T H, et al. Biochemical mechanisms and catabolic enzymes involved in bacterial estrogen degradation pathways[J]. Cell Chemical Biology, 2017, 24(6): 1-13. |
| [14] |
Talalay P, Dobson M M, Tapley D F. Oxidative degradation of testosterone by adaptive enzymes[J]. Nature, 1952, 170(4328): 620-621. DOI:10.1038/170620a0 |
| [15] |
Xiong G M, Luo Y, Jin S, et al. Cis-and trans-regulatory elements of 3alpha-hydroxysteroid dehydrogenase/carbonyl reductase as biosensor system for steroid determination in the environment[J]. ChemicoBiological Interactions, 2009, 178(1): 215-220. |
| [16] |
Maser E, Mobus E, Xiong G M. Functional expression, purification and characterization 3α-hydroxysteroid dehydrogenase/carbonyl reductase Comamonas testosterone[J]. Biochemical Biophysical Research Communications, 2000, 272(2): 622-628. DOI:10.1006/bbrc.2000.2813 |
| [17] |
Maqbool F, Mostafalou S, Bahadar H, et al. Review of endocrine disorders associated with environmental toxicants and possible involved mechanisms[J]. Life Sciences, 2016, 145: 265-273. DOI:10.1016/j.lfs.2015.10.022 |
| [18] |
Eric M, Maseer E. Molecular cloning, overexpression, and characterization of steroid-inducible 3alpha-hydroxysteroid dehydrogenase/carbonyl reductase from Comamonas testosteroni. A novel member of the short-chain dehydrogenase/reductase superfamily[J]. Journal of Biological Chemistry, 1998, 273(47): 30888-30896. DOI:10.1074/jbc.273.47.30888 |
| [19] |
Möbus E, Jahn M, Schmid R, et al. Testosterone-regulated expression of enzymes involved in steroid and aromatic hydrocarbon catabolism in Comamonas testosterone[J]. Journal of Bacteriology, 1997, 179(18): 5951-5955. DOI:10.1128/JB.179.18.5951-5955.1997 |
| [20] |
Xiong G M, Maser E. Regulation of the steroid-inducible 3α-hydroxysteroid dehydrogenase/carbonyl reductase gene in Comamonas testosterone[J]. Journal of Biological Chemistry, 2001, 276(13): 9961-9970. DOI:10.1074/jbc.M010962200 |
| [21] |
Xiong G M, Martin H J, Maser E. Identification and characterization of a novel translational repressor RepB of the steroid-inducible 3α-hydroxysteroid dehydrogenase/carbonyl reductase gene in Comamonas testosterone[J]. Journal of Biological Chemistry, 2003, 278(48): 47400-47407. DOI:10.1074/jbc.M309210200 |
| [22] |
Li M T, Xiong G M, Maser E. A novel transcriptional repressor PhaR for the steroid-inducible expression of the 3, 17β-hydroxysteroid dehydrogenase gene in Comamonas testosteroni ATCC11996[J]. Chemico-Biological Interactions, 2003, 202(1/2/3): 116-125. |
| [23] |
Gong W J, Xiong G M, Maser E. Oligomerization and negative autoregulation of the LysR-type transcriptional regulator HsdR from Comamonas testosteroni[J]. Journal of Steroid Biochemistry and Molecular Biology, 2012, 132(3/4/5): 203-211. |
| [24] |
戴艺民, 周以飞, 吴明霞, 等. 不同-10区保守序列的tac启动子表达睾丸酮丛毛单胞菌中的活化因子[J]. 农业生物技术学报, 2005, 13(6): 747-753. DAI Yi-min, ZHOU Yi-fei, WU Ming-xia, et al. Expression of activator form Comamonas testeroni with tac poromter containing different-10 consensus sequences[J]. Journal of Agricultural Biotechnology, 2005, 13(6): 747-753. DOI:10.3969/j.issn.1674-7968.2005.06.012 |
| [25] |
Chen J Q, Ai Y F, Zhou Y F, et al. Characterization and heterologous expression of testosterone-inducible regulator from Comamonas testosteroni in Escherichia coli[J]. Chinese Journal of Agricultural Biotechnology, 2009, 6(1): 41-47. DOI:10.1017/S147923620900254X |
| [26] |
Schleheck D, Knepper T P, Fischer K, et al. Mineralization of individual congeners of linear alkylbenzenesulfonate by defined pairs of heterotrophic bacteria[J]. Applied and Environmental Microbiology, 2004, 70(7): 4053-4063. DOI:10.1128/AEM.70.7.4053-4063.2004 |
| [27] |
Xiong G M, Draus G, Luo E, et al. 3alpha-Hydroxysteroid dehydrogenase/carbonyl reductase as a tool for isolation and characterization of a new marine steroid degrading bacterial strain[J]. Chemico-Biological Interactions, 2009, 178(1): 206-210. |
| [28] |
Zhang T, Xiong G M, Master E. Characterization of the steroid degrading bacterium S19-1 from the Baltic Sea at Kiel, Germany[J]. Chemico-Biological Interactions, 2011, 191(1): 83-88. |
| [29] |
孙岩, 刘慧慧, 徐英江, 等. 不同海洋介质中环境激素类物质的分析测定和生态风险评价研究进展[J]. 中国渔业质量与标准, 2015, 5(1): 11-18. SUN Yan, LIU Hui-hui, XU Ying-jiang, et al. Progress in determination and ecological risk assessment of environmental hormones in different marine mediums[J]. Chinese Fisheries Quality and Standards, 2015, 5(1): 11-18. |
 2020, Vol. 37
2020, Vol. 37


