抗生素作为兽药以及饲料的添加剂,广泛应用于畜禽和畜牧养殖业,可以预防和治疗多种疾病,加快畜禽生长[1-2]。据资料统计,我国每年生产抗生素21万t,其中48%用于农业和畜牧业,但是在饲料中添加的抗生素无法被动物完全吸收及代谢,75%的抗生素会以母体药物或代谢物的形式排泄进入环境,并在环境中积累[1, 3-4]。此外,长期使用含有抗生素的饲料还将导致抗生素残留以及耐药基因的产生,加速耐药基因的扩散,威胁人类健康和微生态环境[5-6]。Cu在畜禽的生长发育过程中具有重要作用,可以促进畜禽生长并提高畜禽抗病性,所以在畜禽饲料中会人为添加一定量的Cu,但是若Cu添加过量,则不能被畜禽完全吸收,多余的Cu会随粪便排出体外[7]。据调查发现,仔猪和牲猪饲料中添加硫酸铜可达100~250 mg∙kg-1,规模化养殖场畜禽粪便重金属(包括Cu)超标率达63.1%[8]。
随着畜禽粪便长期、大量的农用,抗生素和Cu会共同在土壤中积累,造成复合污染[9-11]。很多抗生素结构中含有大量的羟基和氨基,可以与重金属形成复合物,从而对土壤生物过程产生潜在的危害[12]。土壤酶活性可表征土壤环境质量状况,且与土壤重金属含量存在相关性,可作为土壤污染的综合性指标[13]。土壤过氧化氢酶(CAT)是微生物或植物产生的一类氧化还原酶,是土壤中的重要酶类,能催化很多反应,以过氧化氢为底物可快速把土壤代谢产生的废物转化为无害或毒性较小的物质,同时释放出氧气[14-16]。本研究以恩诺沙星(ENR)、土霉素(OTC)、磺胺二甲嘧啶(SM2)和Cu为目标污染物,土壤中CAT为表征指标,采用室内培养试验法,研究这三种抗生素与Cu的单一及复合污染对土壤CAT活性的影响,为今后探索抗生素与重金属复合污染环境风险评价和污染治理提供一定参考。
1 材料与方法 1.1 试验材料 1.1.1 试验土壤土样采自山东农业大学南校区试验田,采用五点取样法,去除表层的枯枝、树叶和表面1 cm左右的表层土后,采集耕作层土壤,采样深度约为20 cm。采集后剔除石砾、杂草等杂物,过1 mm筛,于4 ℃储存备用。土壤类型为棕壤,有机质为13.91 g ∙ kg-1,有效氮为132.3 mg∙kg-1,有效磷为16.5 mg∙kg-1,速效钾为125.7 mg∙kg-1;黏粒(< 0.002 mm)占10.4%,砂粒(>0.05 mm)占32.4%,粉粒(0.05~0.002 mm)占57.2%;pH值6.5,田间最大持水量为18.9%。抗生素浓度为0.036~0.252 mmol·kg-1,全Cu浓度为0.315 mmol·kg-1,可提取态Cu浓度为0.018 3~0.018 9 mmol·kg-1。
1.1.2 实验药品盐酸恩诺沙星,盐酸土霉素,磺胺二甲嘧啶钠,硫酸铜,纯度99%。
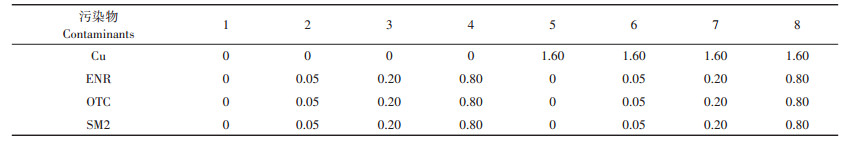
1.2 试验方法依据前期预实验结果,参考文献[17-19],通过实验分析,设定本试验采用二因素(ENR/OTC/SM2和Cu),分别为4水平(ENR、OTC、SM2均设4个浓度:0、0.05、0.20、0.80 mmol∙kg-1)和2水平(Cu设2个浓度:0、1.60 mmol∙kg-1),按照摩尔比1:2、1:8、1:32设计试验方案(表 1),共24个处理。
|
|
表 1 实验浓度设计(mmol∙kg-1) Table 1 Experimental factors and levels(mmol∙kg-1) |
染毒时每个浓度处理设置3个重复,染毒前,每个广口棕色瓶装有50 g土(预先置于25 ℃生化培养箱避光培养24 h),每个小瓶分别染毒。将ENR、OTC和SM2这三种抗生素的储备液(预先配制,即取3.219 7 g盐酸恩诺沙星、3.709 9 g盐酸土霉素、2.151 6 g磺胺二甲嘧啶钠分别定容至100 mL,配制成70.93 mmol∙L-1储备液,取3.582 2 g硫酸铜定容至100 mL,并稀释至70.93 mmol∙L-1,于4 ℃避光保存),按浓度比例添加至土壤中,添加量分别为0.035 mL(0.05 mmol ∙ kg-1)、0.141 mL(0.20 mmol ∙ kg-1)、0.564 mL (0.80 mmol∙kg-1)、1.128 mL(1.60 mmol∙kg-1)。染毒时保证每份土中加入的溶液体积为5 mL,剩余体积用去离子水补充,对照组用去离子水代替抗生素和铜溶液,充分混合后,用纱布将棕色瓶封口,置于25 ℃生化培养箱避光培养,并在7、14、21 d和28 d测定土壤中CAT的活性,期间使土壤湿度保持在最大持水量的50%~60%。
土壤CAT活性采用高锰酸钾滴定法检测[16],酶活性以1 g土壤消耗的0.02 mol∙L-1高锰酸钾的毫升数表示,单位为U∙g-1。
1.3 数据处理运用Excel 2010计算各组实验中3次重复所得数据的平均值及标准差,并绘制柱状图;采用SPSS 17.0软件对数据进行双因素方差分析,差异显著性水平为P < 0.05;使用Canoco for Windows 4.5(Microcomputer Power,Ithaca,NY)分析软件分析环境因子与酶活性之间的相关性。
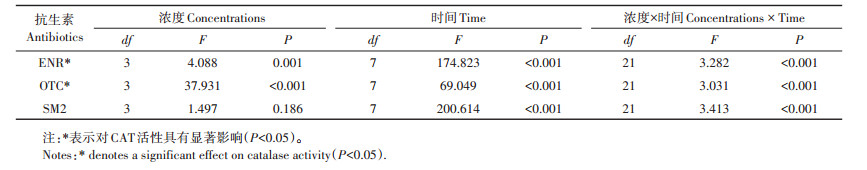
2 结果与分析由表 2可以发现,三种抗生素暴露浓度与处理时间对CAT的活性的影响存在着明显的交互作用,污染物浓度和时间既可以单独影响酶的活性,又可以相互作用共同影响酶的活性。
|
|
表 2 以浓度和时间为主效应的双因素方差分析 Table 2 Results of two-factor ANOVA based on concentration and time |
从图 1可知,ENR单一污染下,整个试验周期各处理组的CAT活性相比对照组总体上呈现为升高趋势,即被激活,其中,ENR中浓度(0.20 mmol∙kg-1)组的酶活性与对照差异相对显著,在第21 d,达到最高激活率5.52%。第28 d,随ENR浓度增高,对CAT活性的激活作用不断增强,ENR高浓度(0.80 mmol∙kg-1)组的酶活性激活率为6.04%。第7、14、21 d时,1.6 mmol∙kg-1 Cu单一处理酶活性与对照组无显著差异。
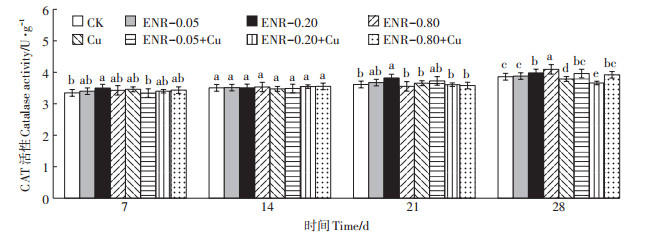
|
同一时间不同字母表示处理组之间差异显著(P < 0.05)。下同 Different letters in columns at the same time are significantly different at P < 0.05. The same below 图 1 不同取样时间ENR和Cu单一及复合污染对土壤CAT活性的影响 Figure 1 Effects of single and joint toxicity of ENR and Cu on soil catalase activity in different sampling times |
在ENR和Cu复合处理下,低浓度ENR (0.05 mmol∙ kg-1)和Cu复合处理组在整个试验周期内CAT活性与对照组差异均不显著;中浓度ENR和Cu复合处理组在第28 d酶活性被抑制,抑制率为5.18%;而高浓度ENR和Cu复合处理组的酶活性在整个周期内与对照组相比无显著差异。
复合处理与单一处理相比,第21 d后,各个浓度的复合处理组较单一处理组酶活性变化更为显著,低浓度ENR和Cu复合处理组在第28 d酶活性显著高于Cu单一处理组。在第21 d和第28 d,中浓度ENR和Cu复合处理组酶活性显著低于ENR中浓度单一处理组和Cu单一处理组。高浓度ENR和Cu复合处理组酶活性在第28 d显著低于ENR高浓度单一处理组。正如表 3中所得,ENR与Cu的单一及复合处理下,暴露时间对CAT活性的影响有显著差异。
|
|
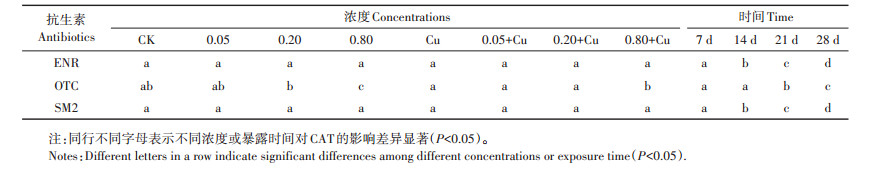
表 3 LSD多重比较的单因素方差分析 Table 3 Results of single-factor ANOVA and LSD multiple comparisons |
从图 2可知,第7 d Cu单一处理组与对照组相比,酶活性被激活,激活率为5.34%,之后的培养时间内,与对照差异不显著。OTC单一处理CAT活性随OTC浓度升高而降低,抑制率最高达6.12%;在整个周期,OTC高浓度组酶活性表现出较强的抑制作用,最高抑制率为8.36%。OTC中低浓度组与对照组无显著差异。
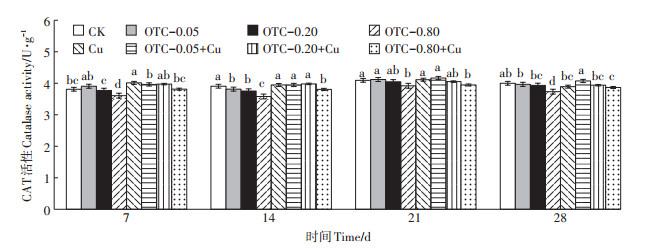
|
图 2 不同取样时间OTC和Cu单一及复合污染对土壤CAT活性的影响 Figure 2 Effects of single and joint toxicity of OTC and Cu on soil catalase activity in different sampling times |
在OTC和Cu复合处理下,低浓度OTC和Cu复合处理组酶活性与对照无显著差异;中浓度OTC和Cu复合处理组酶活性与对照处理比,差异也不显著;第14 d后,高浓度OTC和Cu复合处理组酶活性与对照比,抑制作用较为明显,抑制率最高为3.58%。第7 d和第14 d,中浓度OTC和Cu复合处理组酶活性与OTC单一污染处理比,酶活性显著增加,激活率最大为4.29%;高浓度OTC和Cu复合处理组酶活性低于Cu单一处理组,但高于OTC高浓度单一处理组。在OTC与Cu的单一及复合处理下,暴露浓度对CAT活性的影响有显著差异(表 3)。
2.3 SM2与Cu单一及复合污染对土壤CAT活性的影响从图 3可知,Cu单一处理组CAT活性与对照无显著差异。第7 d和第21 d,SM2中低浓度处理组与对照相比均表现为显著激活作用,激活率最高为7.46%。SM2高浓度组在第21 d酶活性显著高于对照组,激活率为1.71%。
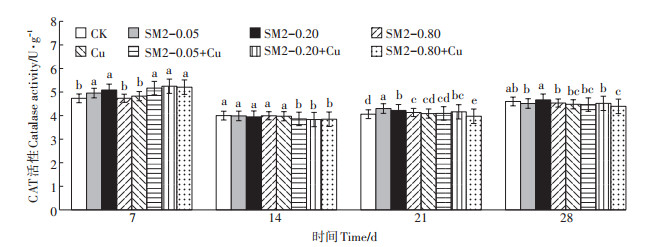
|
图 3 不同取样时间SM2和Cu单一及复合污染对土壤CAT活性的影响 Figure 3 Effects of single and joint toxicity of SM2 and Cu on soil catalase activity in different sampling times |
三个复合处理组中,低浓度SM2和Cu复合处理组与对照组比,在第7 d表现出激活作用,激活率为9.15%,第14 d酶活性被抑制,第21、28 d酶活性与对照无显著差异;高浓度SM2和Cu复合处理组与对照组比,在第7 d有显著激活作用,激活率高达10.00%,14 d后转为抑制作用,抑制率最高为4.49%。
复合污染与单一污染处理组相比,第7 d,复合污染各浓度处理组对酶活性的激活作用总体上高于各单一处理组;第14 d,复合污染各浓度处理组酶活性均低于各单一处理组;第21 d,低浓度SM2和Cu复合处理组酶活性显著低于低浓度SM2单一处理组;第28 d,高浓度SM2和Cu复合处理组对酶活性抑制作用显著强于单一处理。由表 3可知,SM2与Cu的单一及复合污染试验中,污染时间对CAT活性的影响有显著差异。
2.4 抗生素与Cu单一及复合污染对CAT活性影响的冗余分析如图 4所示,对于ENR来说,第21 d与第7、14、28 d之间夹角较大,说明呈负相关,即第21 d变化较为显著。对于OTC来说,第7 d和14 d之间夹角很小,第21 d和28 d之间夹角也很小,说明两者的变化趋势比较接近。对于SM2来说,第21 d和28 d之间夹角很小,说明两者的变化趋势比较接近,第7 d与第14、21、28 d之间夹角较大,说明第7 d变化较为显著。7dENR和14dENR的线比较短,说明ENR处理在第7、14 d对酶活性的影响比其他时间、其他抗生素处理对酶活性的影响要小。
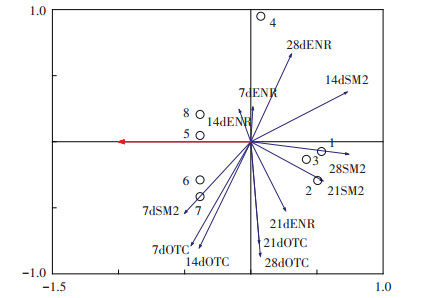
|
7dENR、14dENR、21dENR、28dENR分别表示ENR与Cu单一及复合污染在第7、14、21、28 d时对酶活性的影响,OTC、SM2同理。1~8分别表示抗生素与Cu单一及复合污染的8个浓度 7dENR, 14dENR, 21dENR and 28dENR indicate the effect of single and joint toxicity of ENR and Cu on catalase activity on day 7th, 14th, 21st and 28th, respectively. OTC and SM2 are the same as above. 1~8 represents eight concentration levels of single and complex pollution of antibiotics and Cu 图 4 三种抗生素与Cu单一及复合污染与CAT活性的RDA分析 Figure 4 Redundance analysis (RDA)of the effects of single and joint toxicity of three antibiotics and Cu on catalase activity |
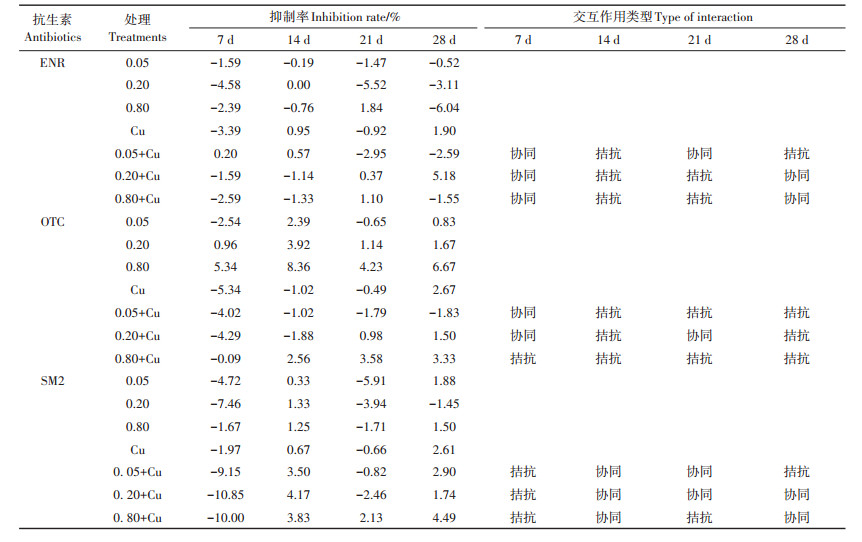
由表 4可知,在ENR与Cu复合污染的各处理组中,第7 d各浓度下的处理组都表现为协同作用,第14 d各浓度复合处理组均表现为拮抗作用;到第21 d,低浓度ENR和Cu复合污染表现为协同作用,而中高浓度ENR和Cu复合污染表现为拮抗作用;第28 d,低浓度ENR和Cu复合污染表现为拮抗作用,其他复合处理组表现为协同作用。
|
|
表 4 不同取样时间ENR、OTC、SM2和Cu对CAT的交互作用类型 Table 4 Type of interaction of ENR, OTC, SM2, and Cu on catalase at different sampling times in soil |
在OTC与Cu复合污染的各处理组中,低浓度OTC和Cu复合污染在第7 d表现为协同作用,而后的时间一直表现为拮抗作用;而高浓度OTC和Cu复合污染则在整个试验周期均表现为拮抗作用。
在SM2与Cu复合污染的各处理组中,在第7 d时,各浓度处理组的交互类型均表现为拮抗,第14 d均表现为协同作用;在第21 d时,中低浓度SM2和Cu复合污染表现为协同作用,而高浓度SM2和Cu复合污染则表现为拮抗作用;在第28 d时,中高浓度SM2和Cu复合污染表现为协同作用,而低浓度SM2和Cu复合污染则表现为拮抗作用。
3 讨论本研究中,抗生素对土壤CAT影响与抗生素的类型、暴露浓度以及暴露时间都有密切关系。已有资料表明,抗生素的类型、浓度以及暴露时间均会影响土壤酶的活性[20]。本研究中,ENR单一污染下,整个试验周期内各浓度处理组的CAT活性相比对照组总体上表现为升高趋势,而OTC高浓度组的酶活性则呈现强烈的抑制作用。此外有研究表明,不同类型抗生素对土壤微生物的毒性影响也不同,ENR单一污染对蔗糖酶在第14 d激活,第7、21、28 d表现为抑制作用,而OTC毒害作用会随着暴露时间的延长显现,部分微生物被杀死,因此导致染毒的土壤中脲酶活性降低[21]。同种抗生素不同暴露浓度下对土壤CAT活性影响也有差异,低浓度OTC对酶活性的影响小于高浓度,且低浓度OTC会对微生物有一定促进作用[22],本实验也发现低中浓度OTC污染对酶活性影响不大,而高浓度OTC污染对酶活性有显著抑制作用,可能是微生物可以通过提高酶活性来抵抗不利因素,但是不能抵抗所有不利因素[23]。随着时间变化,同种抗生素对土壤CAT活性的影响也会不同,SM2污染组酶活性在前期(第7 d)激活作用明显,之后无显著变化;而ENR污染组酶活性则在后期(第28 d)被显著激活。
本研究发现,单一污染处理组中,Cu在染毒前期对CAT的活性影响并不明显,只存在轻微的激活或抑制作用。有研究表明,低浓度的Cu对CAT活性有轻微的激活作用[24]。本实验土壤有机质含量为13.91 g∙kg-1,相对于其他种类土壤有机质含量较高,另有资料表明,土壤有机质对土壤酶的保护作用和对重金属的缓冲作用,导致污染物对土壤酶的毒害作用降低,表现为激活作用[25]。而且土壤微生物适应性很强,对重金属的适应也会随时间增加而增强[26]。本研究中,随着时间的增长,Cu单一处理组在后期(第28 d)对CAT活性抑制作用更明显,这一结果与汤波等[27]研究结果相似,CAT活性与Cu呈负相关,由此可见,CAT在Cu影响下较敏感,这可能是由于Cu与CAT的中心活性基团结合,生成稳定的络合物质,与底物产生竞争性抑制作用;也可能是Cu对土壤微生物生长产生抑制作用,阻碍了其体内酶的分泌[28]。
三种抗生素与Cu之间存在复杂的相互作用,抗生素和Cu复合处理下表现为两种关系:拮抗作用和协同作用。本研究中,高浓度SM2和Cu复合污染对CAT活性的抑制作用强于单一处理。但并不是所有抗生素都存在这种情况,OTC与Cu复合污染中,在试验周期内大多表现为拮抗作用,但第7、14 d的酶活性大多高于对照组,酶活性被激活,其原因可能是OTC与重金属相互作用,会降低重金属对土壤酶的影响[29-30]。本实验还发现,同一Cu浓度下,复合污染对酶活性的抑制作用不会简单地随污染浓度增加而加强,可能是因为抗生素会与Cu相结合,不同抗生素与Cu结合后所表现出的毒性有可能增加也有可能降低,对CAT活性的影响也不同;另外根据分子式可知不同抗生素自由基个数不同,可以结合的Cu数量不同,对CAT的毒性也不同。四环素类具有O、N、OH官能团,Cu2+和其他金属离子可能与这些位点上的分子结合,改变它们的形状,并影响其在环境中的行为、生物吸收和毒性[31]。这与相关报道类似,两种不同的化合物交互作用时,其自身的基团会发生作用从而改变其化学性质[32]。本研究还发现,ENR、OTC、SM2和Cu的相互作用可能与暴露时间和复合污染浓度比例有显著的关系。第28 d,低浓度ENR和Cu复合污染表现为拮抗作用,而高浓度SM2和Cu复合污染表现为协同抑制作用,低剂量的复合污染可能会诱导土壤微生物对二者产生交互抗性,从而影响土壤微生物基础呼吸、微生物量碳、氮以及CAT活性,而高剂量协同污染对土壤微生物生态功能产生较为严重的协同抑制作用[33]。另有研究表明,污染物进入土壤后在光照、化学和生物因素作用下被降解,在代谢过程中产生的代谢产物毒性更大,会对微生物以及酶活性产生严重影响[34]。
不同的微生物指标可以从不同的角度反映污染物对微生物功能和土壤质量的影响。本文仅用CAT活性作为供试污染物的测试终点,存在一定局限性,因此,后续的研究工作将增加其他指标来全面反映污染物,特别是复合污染物对土壤微生物群落结构、微生物活性及土壤肥力等的影响。
4 结论(1) 单一污染下,抗生素对土壤CAT活性的影响与抗生素的类型、浓度以及暴露时间都有密切关系。中低浓度的ENR对CAT活性激活作用相对明显,OTC污染组随着浓度的增加,对CAT活性的抑制作用增强,SM2污染组处理初期,低浓度处理对酶活性具有激活作用,处理后期,高浓度处理起抑制作用。Cu单一处理下,在染毒前期对CAT的活性影响并不明显,只存在轻微的激活或抑制作用,随着时间的延长,Cu对CAT活性呈现抑制作用。
(2) 抗生素和Cu复合污染时,其交互作用存在差异,表现为拮抗和协同两种作用,这不仅与抗生素种类结构、复合污染浓度比例、暴露时间有关,还与抗生素和Cu配位反应产生复合物的比例有关。总体上ENR与Cu复合污染组对CAT活性的影响呈现随污染浓度增加先抑制后激活的趋势,OTC和Cu复合污染组对CAT活性呈现前期激活后期抑制的趋势,SM2和Cu复合污染组整个周期内对CAT活性呈现初期激活后期抑制的趋势。从整个试验周期来看,ENR与Cu处理组、SM2与Cu处理组受浓度和暴露时间影响较明显;OTC与Cu复合污染总体上以拮抗作用为主。
| [1] |
Wang L J, Wang J H, Zhu L S, et al. Toxic effects of oxytetracycline and copper, separately or combined, on soil microbial biomasses[J]. Environmental Geochemistry and Health, 2018, 40: 763-776. DOI:10.1007/s10653-017-0022-7 |
| [2] |
郑佳伦, 刘超翔, 刘琳, 等. 畜禽养殖业主要废弃物处理工艺消除抗生素研究进展[J]. 环境化学, 2017, 36(1): 37-47. ZHENG Jia-lun, LIU Chao-xiang, LIU Lin, et al. Removal of antibiotics in waste and wastewater treatment facilities of animal breeding industry:A review[J]. Environmental Chemistry, 2017, 36(1): 37-47. |
| [3] |
Li C, Chen J Y, Wang J H, et al. Occurrence of antibiotics in soils and manures from greenhouse vegetable production bases of Beijing, China and an associated risk assessment[J]. Science of the Total Environment, 2015, 521/522: 101-107. DOI:10.1016/j.scitotenv.2015.03.070 |
| [4] |
Leston S, Nunes M, Viegas I, et al. The influence of sulfathiazole on the macroalgae Ulva lactuca[J]. Chemosphere, 2014, 100: 105-110. DOI:10.1016/j.chemosphere.2013.12.038 |
| [5] |
Hu J L, Zhao F Z, Zhang X X, et al. Metagenomic profiling of ARGs in airborne particulate matters during a severe smog event[J]. Science of the Total Environment, 2018, 615: 1332-1340. DOI:10.1016/j.scitotenv.2017.09.222 |
| [6] |
Gao Q X, Li Y L, Qi Z H, et al. Diverse and abundant antibiotic resistance genes from mariculture sites of China' s coastline[J]. Science of the Total Environment, 2018, 630: 117-125. DOI:10.1016/j.scitotenv.2018.02.122 |
| [7] |
Kumar R R, Park B J, Cho J Y. Application and environmental risks of livestock manure[J]. Journal of the Korean Society for Applied Biological Chemistry, 2013, 56: 497-503. DOI:10.1007/s13765-013-3184-8 |
| [8] |
朱恩, 王寓群, 林天杰, 等. 上海地区畜禽粪便重金属污染特征研究[J]. 农业环境与发展, 2013, 30(1): 90-93. ZHU En, WANG Yu-qun, LIN Tian-jie, et al. Study on heavy metal pollution characteristics of livestock and poultry feces in Shanghai[J]. Agro-Environment & Development, 2013, 30(1): 90-93. DOI:10.3969/j.issn.1005-4944.2013.01.025 |
| [9] |
Wu G H, Shang J M, Pan L, et al. Heavy metals in surface sediments from nine estuaries along the coast of Bohai Bay, northern China[J]. Marine Pollution Bulletin, 2014, 82: 194-200. DOI:10.1016/j.marpolbul.2014.02.033 |
| [10] |
Saeedi M, Li L Y, Salmanzadeh M. Heavy metals and polycyclic aromatic hydrocarbons:Pollution and ecological risk assessment in street dust of Tehran[J]. Journal of Hazardous Materials, 2012, 227/228: 9-17. DOI:10.1016/j.jhazmat.2012.04.047 |
| [11] |
Gagneten A M, Paggi J C. Effects of heavy metal contamination(Cr, Cu, Pb, Cd)and eutrophication on zooplankton in the lower basin of the Salado River(Argentina)[J]. Water, Air, and Soil Pollution, 2009, 198: 317-334. DOI:10.1007/s11270-008-9848-z |
| [12] |
Wang J H, Wang L J, Zhu L S, et al. Individual and combined effects of enrofloxacin and cadmium on soil microbial biomass and the ammonia-oxidizing functional gene[J]. Science of the Total Environment, 2018, 624: 900-907. DOI:10.1016/j.scitotenv.2017.12.096 |
| [13] |
王秀梅, 安毅, 秦莉, 等. 镉胁迫下土壤理化因子与过氧化氢酶活性的通径分析[J]. 中国农学通报, 2018, 34(11): 59-65. WANG Xiu-mei, AN Yi, QIN Li, et al. Path analysis of soil physicochemical factors and catalase activities under cadmium stress[J]. Chinese Agricultural Science Bulletin, 2018, 34(11): 59-65. DOI:10.11924/j.issn.1000-6850.casb17040022 |
| [14] |
Hu X F, Jiang Y, Shu Y, et al. Effects of mining wastewater discharges on heavy metal pollution and soil enzyme activity of the paddy fields[J]. Journal of Geochemical Exploration, 2014, 147: 139-150. DOI:10.1016/j.gexplo.2014.08.001 |
| [15] |
魏子艳, 王金花, 夏晓明, 等. 三种抗生素对蔬菜种子芽与根伸长的生态毒性效应[J]. 农业环境科学学报, 2014, 33(2): 237-242. WEI Zi-yan, WANG Jin-hua, XIA Xiao-ming, et al. Ecotoxicity of three antibiotics to shoots and root elongation of cucumber, rape and Chinese cabbage[J]. Journal of Agro-Environment Science, 2014, 33(2): 237-242. |
| [16] |
Yu Y J, Li L Z, Yu L H, et al. Effect of exposure to decabromodiphenyl ether and tetrabromobisphenol A in combination with lead and cadmium on soil enzyme activity[J]. International Biodeterioration & Biodegradation, 2017, 117: 45-51. |
| [17] |
Su Y H, Zhu Y G, Lin A J, et al. Interaction between cadmium and atrazine during uptake by rice seedlings[J]. Chemosphere, 2005, 60: 802-809. DOI:10.1016/j.chemosphere.2005.04.022 |
| [18] |
魏子艳.土霉素、恩诺沙星、磺胺二甲嘧啶与铜单一及复合污染对土壤微生物的影响[D].泰安: 山东农业大学, 2014. WEI Zi-yan. Single and joint toxicity of oxytetracycline, enrofloxacin, sulfadimidine and Cu on soil microorganism[D]. Tai'an: Shandong Agricultural University, 2014. |
| [19] |
Ahmed M B M, Rajapaksha A U, Lim J E, et al. Distribution and accumulative pattern of tetracyclines and sulfonamides in edible vegetables of cucumber, tomato, and lettuce[J]. Journal of Agricultural and Food Chemistry, 2015, 63: 398-405. DOI:10.1021/jf5034637 |
| [20] |
Zhang Y P, Snow D D, Parker D, et al. Intracellular and extracellular antimicrobial resistance genes in the sludge of livestock waste management structures[J]. Environmental Science and Technology, 2013, 47: 10206-10213. DOI:10.1021/es401964s |
| [21] |
陈智学, 谷洁, 高华, 等. 土霉素对堆肥过程中酶活性和微生物群落代谢的影响[J]. 生态学报, 2013, 33(21): 6957-6966. CHEN Zhi-xue, GU Jie, GAO Hua, et al. Effect of oxytetraeyeline (OTC)on the activities of enzyme and microbial community metabolic profiles in composting[J]. Acta Ecologica Sinica, 2013, 33(21): 6957-6966. |
| [22] |
张健, 关连珠, 颜丽. 鸡粪与猪粪所含土霉素在土壤中降解的动态变化及原因分析[J]. 环境科学, 2012, 33(1): 323-328. ZHANG Jian, GUAN Lian-zhu, YAN Li. Dynamics of degradation of oxytetracycline of pig and chicken manures in soil and mechanism investigation[J]. Environmental Science, 2012, 33(1): 323-328. |
| [23] |
张自坤, 张宇, 黄治军, 等. 嫁接对铜胁迫下黄瓜根际土壤微生物特性和酶活性的影响[J]. 应用生态学报, 2010, 21(9): 2317-2322. ZHANG Zi-kun, ZHANG Yu, HUANG Zhi-jun, et al. Effects of grafting on cucumber rhizospheric soil microbial characteristics and enzyme activities under copper stress[J]. Chinese Journal of Applied Ecology, 2010, 21(9): 2317-2322. |
| [24] |
程凤侠, 司友斌, 刘小红. 铜与草甘膦单一污染和复合污染对水稻土酶活性的影响[J]. 农业环境科学学报, 2009, 28(1): 84-88. CHENG Feng-xia, SI You-bin, LIU Xiao-hong. Effects of both single and combined pollution of copper and glyphosate on enzyme activity in paddy soil[J]. Journal of Agro-Environment Science, 2009, 28(1): 84-88. DOI:10.3321/j.issn:1672-2043.2009.01.016 |
| [25] |
汪杏, 沈根祥, 胡双庆, 等. 铬(Ⅵ)和菲单一及复合污染对土壤微生物酶活性的影响[J]. 农业环境科学学报, 2016, 35(7): 1300-1307. WANG Xing, SHEN Gen-xiang, HU Shuang-qing, et al. Effects of single and joint pollution of chromium(Ⅵ)and phenanthrene on microbiological enzyme activities in soil[J]. Journal of Agro-Environment Science, 2016, 35(7): 1300-1307. |
| [26] |
李盼盼, 宋雯, 谷洁, 等. 含四环素沼肥对蔬菜品质及抗性基因的影响[J]. 环境科学研究, 2016, 29(6): 907-915. LI Pan-pan, SONG Wen, GU Jie, et al. Effects of biogas fertilizers containing tetracycline on vegetable quality and resistance genes[J]. Research of Environmental Sciences, 2016, 29(6): 907-915. |
| [27] |
汤波, 赵佐平, 宋凤敏, 等. 汉江上游铅锌尾矿区土壤环境效应[J]. 江苏农业科学, 2016, 44(8): 470-473. TANG Bo, ZHAO Zuo-ping, SONG Feng-min, et al. Effect of soil environment on Pb-Zn tail mining area in the upper reaches of Hanjiang River[J]. Jiangsu Agricultural Sciences, 2016, 44(8): 470-473. |
| [28] |
郭伟, 赵仁鑫, 张君, 等. 内蒙古包头铁矿区土壤重金属污染特征及其评价[J]. 环境科学, 2011, 32(10): 3099-3105. GUO Wei, ZHAO Ren-xin, ZHANG Jun, et al. Distribution characteristic and assessment of soil heavy metal pollution in the iron mining of Baotou in Inner Mongolia[J]. Environmental Science, 2011, 32(10): 3099-3105. |
| [29] |
陈苏, 陈宁, 晁雷, 等. 土霉素和镉复合污染土壤的植物-微生物联合修复实验研究[J]. 生态环境学报, 2015, 24(9): 1554-1559. CHEN Su, CHEN Ning, CHAO Lei, et al. The experimental study of polluted soils with oxytetracycline and cadmium by plant microbial remediation[J]. Ecology and Environmental Sciences, 2015, 24(9): 1554-1559. |
| [30] |
Yan S H, Wang J H, Zhu L S, et al. Toxic effects of nitenpyram on antioxidant enzyme system and DNA in zebrafish(Danio rerio)livers[J]. Ecotoxicology and Environmental Safety, 2015, 122: 54-60. DOI:10.1016/j.ecoenv.2015.06.030 |
| [31] |
Chen W R, Huang C H. Transformation of tetracyclines mediated by Mn(Ⅱ)and Cu(Ⅱ)ions in the presence of oxygen[J]. Environmental Science and Technology, 2009, 43(2): 401-407. DOI:10.1021/es802295r |
| [32] |
Inaba S, Takenaka C. Effects of dissolved organic matter on toxicity and bioavailability of copper for lettuce sprouts[J]. Environment International, 2005, 31: 603-608. DOI:10.1016/j.envint.2004.10.017 |
| [33] |
刘爱菊, 刘敏, 李梦红, 等. Cu、抗生素协同污染对土壤微生物活性的影响[J]. 生态环境学报, 2013, 22(11): 1825-1829. LIU Ai-ju, LIU Min, LI Meng-hong, et al. Collaborative effects of Cu and antibiotic on soil microbial activities[J]. Ecology and Environmental Sciences, 2013, 22(11): 1825-1829. DOI:10.3969/j.issn.1674-5906.2013.11.014 |
| [34] |
He J Z, Kristin R R, Alvarez-Cohen L. Microbial reductive debromination of polybrominated diphenyl ethers(PBDEs)[J]. Environmental Science and Technology, 2006, 40(14): 4429-4424. DOI:10.1021/es052508d |
 2020, Vol. 37
2020, Vol. 37