2. 云南农业大学资源与环境学院, 昆明 650201
2. College of Resources and Environment, Yunnan Agricultural University, Kunming 650201, China
玉米是我国南方矿粮复合区最主要的作物。相关研究报道,由于矿区和周边农田土壤受到铅(Pb)等重金属的严重污染,矿区农田生产的玉米籽粒Pb含量偏高,给当地居民的健康带来严重威胁[1-2]。同时,玉米吸收和累积Pb等重金属存在明显的种内差异[3-4]。根是玉米吸收累积Pb最主要的器官,在玉米根系吸收Pb的过程中,细胞壁是Pb进入细胞质的第一道屏障。本课题组前期研究结果显示玉米各部位的Pb含量分配规律为根>叶>茎>籽粒[5],采用亚细胞分离发现玉米根细胞壁累积的Pb含量占细胞总Pb含量的48.9%~55.8%[6]。
植物细胞壁由多糖、蛋白质等组成,其中多糖含量占初生壁总量的90%[7]。研究表明植物细胞壁对重金属具有吸附固定作用,其中,在重金属胁迫条件下,植物依靠增加细胞壁多糖含量,以及改变多糖组分比例,使其与重金属结合的位点增多,吸附阻碍重金属进入原生质体[8-9],这是一种重要的适应机制。在重金属胁迫下,细胞中细胞壁多糖合成酶以及相关蛋白大量表达,使果胶、纤维素、半纤维素等含量增加,对重金属固定能力增强[10]。特别是细胞壁果胶等多糖解离后形成大量带负电荷的羧基、羟基、氨基、醛基和巯基等,带正电荷的Pb2+容易通过静电被吸附在细胞壁上,故多糖解离所形成的负电基团越多,其吸附Pb2+的容量就越大,植物对Pb的抗性就可能越强[11-12]。因此,细胞壁结合Pb的能力可能主要取决于羧基、羟基和氨基等负电基团含量的多少。
目前关于植物根细胞壁对重金属吸附方面的研究工作大部分集中于同一种植物的吸附特征,包括一些农作物,茶树、红树等木本植物,以及商陆等超积累植物[13-14],王梦等[14]分析了同一个茶树品种的细胞壁不同组分对Pb的吸附性能及其不同官能团的作用大小,但是针对同种作物的不同品种之间的吸附累积差异及细胞壁上各官能团所起作用的研究还鲜见报道。而不同品种的玉米,其根细胞壁上的多糖成分及含量,以及参与吸附作用的官能团数量存在的差异,可能是其对Pb吸附能力不同的主要原因。
因此,本研究选择两个玉米品种为研究对象,分别通过吸附动力学和FTIR(傅立叶变换红外光谱)表征,探讨了两个玉米品种根细胞壁中不同多糖组分及主要官能团在吸附Pb过程中的作用差异,揭示两个玉米品种根系细胞壁组分吸收累积Pb的种内差异机制,从而为阐明不同玉米品种对Pb的吸收累积差异提供一定的科学依据。
1 材料与方法 1.1 试验材料供试玉米品种为“会单4号”和“路单8号”,本课题组早期研究[6]发现,在外源添加Pb胁迫条件下,两个品种表现出对Pb的不同累积特性(表 1),“路单8号”籽粒Pb的质量分数为1.89 mg·kg-1,“会单4号”籽粒Pb质量分数为0.50 mg·kg-1;而根中Pb的质量分数为“会单4号” 237 mg·kg-1、“路单8号” 162 mg·kg-1。因此,将“会单4号”确定为根高累积玉米品种,“路单8号”为根低累积玉米品种。
1.2 试验方法 1.2.1 玉米的培养取经消毒处理、颗粒饱满均匀的玉米种子,在培养箱中28 ℃条件下催芽后,置于云南农业大学温室大棚中培养。挑选生长强壮的玉米苗转移至改良Hoagland营养液中培养,营养液每周更换一次,14 d后取出,将植株根用去离子水洗净,晾干,4 ℃冰箱密封保存,备用。
1.2.2 玉米根细胞壁的提取参考武贝[15]的方法。取新鲜根系于研钵中加入液氮研磨成粉末,转移到50 mL离心管中,加入75%的乙醇完全浸没混匀,冰浴20 min后离心10 min,去上清液,加入丙酮,冰浴提取20 min后再离心20 min,去上清液再加入甲醇:氯仿=1:1 (V/V)的溶液,冰浴提取20 min后离心20 min,去上清液,加入甲醇,冰浴提取20 min后离心20 min,去上清液,冷冻干燥后得到的固体即细胞壁。干燥的细胞壁放入4 ℃的冰箱密封保存。试剂用量均为10 mL·g-1(以根鲜质量计), 离心转速均为5000×g。
1.2.3 细胞壁的化学改性参考徐劼[16]和Zheng等[17]的方法进行细胞壁改性处理。共设置对照(CW)、酯化改性(CW1)、氨基甲基化改性(CW2)、果胶酶改性(CW3)、半纤维素酶改性(CW4)、纤维素酶改性(CW5) 6个处理。
(1) 细胞壁酯化改性
称取0.100 g根细胞壁粉末于离心管中,加入7 mL无水甲醇、1.2 mL浓HCl混匀。悬浮液在125 r· min-1下旋转振荡12 h;经5000×g离心10 min后弃去上清液,沉淀物用去离子水洗涤3次,冷冻干燥后4 ℃保存备用。
(2) 细胞壁氨基甲基化改性
称取0.100 g根细胞壁粉末于离心管中,加入4 mL甲酸、2 mL甲醛混匀。悬浮液在125 r·min-1下旋转振荡6 h;离心、洗涤、保存方法同(1)。
(3) 细胞壁果胶酶改性
取0.100 g根细胞壁粉末于离心管中,加入6 mL 1%果胶酶及0.1% BSA(牛血清白蛋白),混合液在30 ℃水浴中消解30 min;离心、洗涤、保存方法同(1)。
(4) 细胞壁半纤维素酶改性
取0.100 g根细胞壁粉末于离心管中,加入2 mL乙酸-乙酸钠缓冲液(0.2 mol·L-1,pH 5.5)和0.2 g半纤维素酶,50 ℃水解2 h;离心、洗涤、保存方法同(1)。
(5) 细胞壁纤维素酶改性
取0.100 g根细胞壁粉末于离心管中,加入2 mL乙酸-乙酸钠缓冲液(0.2 mol·L-1,pH 4.8)和0.2 g纤维素酶,50 ℃水解24 h;离心、洗涤、保存方法同(1)。
1.2.4 吸附解吸动力学实验方法吸附解吸动力学实验方法参照王梦等[14]的方法并加以改进。取0.100 g上述未经处理或经化学改性后的根细胞壁装入交换柱,交换柱上下均用导管连接,用于注入吸附液和收集流出液。吸附液为5 mg· L-1 Pb (NO3) 2+0.01 mol·L-1 NaNO3溶液,溶液用蠕动泵以0.5 mL·min-1流速泵入交换柱,每15 min收集一管。用原子吸收分光光度法测定流出液中Pb含量,设3次重复。吸附试验结束后,先用0.01 mol·L-1 NaNO3溶液(pH 4.5)以0.5 mL·min-1的流速进行清洗操作(1 h),再用0.05 mol·L-1 NaNO3溶液(pH 4.5)对根细胞壁吸附的Pb进行解吸试验,解吸条件与吸附试验条件相一致,每15 min收集一管。用原子吸收分光光度法测定溶液中的Pb含量。
1.2.5 Pb吸附前后根细胞壁FTIR测定通过红外光谱对玉米根细胞壁的化学官能团进行表征[14]。按照1:150比例分别称取干细胞壁2 mg与300 mg KBr充分混匀(其中KBr在150 ℃条件下烘干6 h,在干燥器中冷却),在红外灯下的玛瑙研钵中充分研磨,压片,放入样品室,在相同条件下进行红外光谱图测定。用傅立叶变换红外光谱仪记录样品在4000~500 cm-1范围内的红外光谱信号,光谱分辨率为4 cm-1。
1.3 数据分析采用Excel计算和制表、SPSS数据分析、Origin 9.1作图。吸附动力学和解吸动力学曲线采用最小二乘法进行拟合。
2 结果与分析 2.1 根细胞壁对Pb的吸附解吸动力学分析图 1a是玉米“会单4号”和“路单8号”的根细胞壁对Pb的吸附曲线,线性相关系数分别为0.96、0.97。从图 1中可以看出,“会单4号”对Pb的吸附在0~100 min内速率很快,之后逐渐放缓,在400 min左右达到吸附平衡,总吸附量为7.05 mg·g-1;“路单8号”对Pb的快速吸附期为0~165 min,在400 min左右达到吸附平衡,总吸附量为6.36 mg·g-1。“会单4号”的根细胞壁对Pb的最终吸附量明显高于“路单8号”,说明“会单4号”对Pb的吸附能力强于“路单8号”。图 1b是“会单4号”和“路单8号”的根细胞壁对Pb解吸曲线,线性相关系数分别为0.86、0.92。“会单4号”和“路单8号”前45 min解吸速率均较快,之后速率放缓,但“会单4号”在125 min左右解吸达到平衡,解吸率为67.41%,“路单8号”在150 min左右达到平衡,解吸率为76.95%,“会单4号”达到解吸平衡的时间较早,解吸率低于“路单8号”,说明“会单4号”对Pb的吸附更加牢固,不易解吸。

|
图 1 玉米根细胞壁对Pb的吸附解吸动力学曲线 Figure 1 Kinetic curves of Pb adsorption and desorption by the root cell wall of maize |
图 2a和图 2b分别是“会单4号”和“路单8号”化学改性前后根细胞壁对Pb的吸附曲线,从图 2中可以看出,与对照相比,化学改性后的“会单4号”和“路单8号”根细胞壁对Pb的吸附量均有不同程度的降低,其中“会单4号” CW1、CW2、CW3、CW4、CW5处理的Pb吸附量分别下降了44.59%、28.60%、15.79%、20.01%、27.13%。“路单8号” CW1、CW2、CW3、CW4、CW5处理的Pb吸附量分别下降了47.41%、24.86%、21.75%、23.92%、26.11%。“会单4号”和“路单8号”化学改性后的根细胞壁使Pb的吸附量降低最多的处理均是酯化改性(CW1)处理。

|
图 2 化学改性对玉米根细胞壁吸附Pb的影响 Figure 2 Effects of chemical modification on Pb adsorption by the root cell wall of maize |
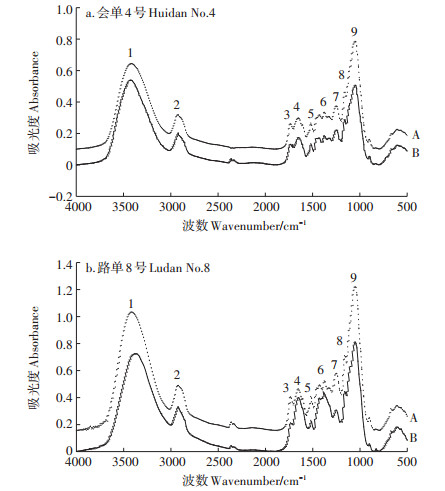
结合已有研究[16, 18]解析“会单4号”和“路单8号”根细胞壁的红外光谱图(图 3),可以得出:3382 cm-1 (No.1)处是羟基(-OH)特征峰,2921 cm-1(No.2)处可能是甲基(C-H)的对称伸缩振动峰,1733 cm-1(No.3)处是酯化果胶中酯基吸收峰,1651 cm-1(No. 4)和1516 cm-1(No.5)处的两个强吸收峰分别是酰胺Ⅰ带C-N、酰胺Ⅱ带N-N,是蛋白质的特征峰,1425 cm-1 (No.6)处的吸收特征峰对应果胶中的羧基(COO-),1251 cm-1(No.7)处对应羧基的C-O、硫酸酯的C-O-S或者磷酸盐的吸收特征峰,1161 cm-1(No.8)处可能对应果胶的多糖环结构的C-C或者C-O,1055 cm-1(No.9)处对应纤维素的多糖链C-C。
|
(A为吸附后,B为吸附前) (A: After the adsorption of Pb, B: Before the adsorption of Pb) 图 3 Pb吸附前后根细胞壁红外光谱图 Figure 3 The FTIR spectra of root cell wall of the cultivars |
根据FTIR的谱图(图 3)进行半定量分析,对比根细胞壁吸附Pb前后的红外光谱发现谱形没有变化,表明吸附Pb后根细胞壁的结构未发生改变,但是细胞壁部分官能团的位置和含量发生了明显的变化。其中“会单4号”和“路单8号”的No.1特征峰均出现了显著的偏移,这说明羟基(-OH)或氨基(-NH2)参与了细胞壁对Pb的吸附过程。“会单4号”的羟基伸缩振动峰位与对照组相比向高频位移动了35 cm-1,“路单8号”向高频位移动了32 cm-1。除No.1特征峰外,“会单4号” No.8特征峰(果胶多糖环结构C-C或C-O)与No.9特征峰(纤维素的多糖链C-C)发生了一定偏移,这表明“会单4号”根细胞壁中的果胶与纤维素一定程度参与了Pb的吸附过程,而“路单8号”的No.6特征峰(羧酸盐COO-不对称伸缩振动)、No.7特征峰(硫酸盐C-O-S或羧基C-O或磷酸盐C-O-P)发生了一定偏移,表明“路单8号”根细胞壁中的羧酸盐、硫酸盐与磷酸盐一定程度上参与了Pb的吸附过程。
以2921 cm-1处甲基(C-H)的特征峰的吸光度(A2921)作为基准,用其他特征峰吸光度与其的比值(A/A2921)来比较玉米根细胞壁中各个官能团的含量差异,比值越高说明该基团的含量越高,用玉米根细胞壁对Pb吸附前后A/A2921比值变化的大小来衡量该基团参与Pb吸附作用的程度。从表 2可以看出,“会单4号”和“路单8号”细胞壁中含量最高的均是纤维素的多糖类C-C,其次为羟基或氨基。比较两个玉米品种经Pb吸附处理前后细胞壁的A/A2921比值变化,“会单4号” A3382/A2921的比值由1.95升高到2.48,升高了0.53,“路单8号” A3385/A2921的比值由2.18升高到2.59,升高了0.41,“会单4号”的变化幅度明显高于“路单8号”,该比值增加说明根细胞壁吸附Pb后增强了细胞壁表面氢键的作用,“会单4号”增强得更加明显;1651 cm-1(No.4)对应的酰胺Ⅰ带C-N是蛋白质的特征红外光谱,其比值出现了明显降低,表明细胞壁上蛋白质含量下降,但两个品种变化差异不明显;而1251 cm-1(No.7)对应的羧基(COO-,C-O)特征峰吸光度比值均升高,但两个品种变化差异不明显。
|
|
表 2 Pb吸附前后“会单4号”、“路单8号”根细胞壁红外光谱分析 Table 2 Analysis of FTIR spectra of root cell wall of"Huidan No.4"and"Ludan No.8"before and after Pb adsorption |
植物细胞壁是吸附重金属离子最主要的亚细胞组分[19-21]。通过吸附解吸动力学结果(图 1)可以发现,“会单4号”的根细胞壁比“路单8号”能吸附更多的Pb,且对Pb的吸附也更加牢固。因为细胞壁对重金属的吸附既可以降低进入植物体内重金属的活性,又可以减少其进入原生质体以及向地上部分转移的量,以减轻重金属的毒害作用[8],“会单4号”的根细胞壁对Pb的吸附能力强于“路单8号”,一定程度上解释了“会单4号”根Pb含量高、籽粒Pb含量低,而“路单8号”根Pb含量低、籽粒Pb含量高的现象。
细胞壁多糖主要由果胶、纤维素、半纤维素三部分组成,研究去果胶、去纤维素、去半纤维素改性细胞壁对Pb的吸附量,可以确定细胞壁果胶、纤维素、半纤维素在Pb吸附过程中的贡献。“会单4号”去果胶、去半纤维素、去纤维素后细胞壁吸附Pb降低了15.79%、20.01%、27.13%,“路单8号”则分别下降了21.75%、23.92%、26.11%,这表明玉米根细胞壁对Pb吸附表现为纤维素>半纤维素>果胶,这与之前的发现“果胶>纤维素>半纤维素” [17]不相符合,这可能与果胶酶处理细胞壁对果胶去除不完全有关。故吸附实验只能证明,半纤维素、纤维素、果胶对Pb吸附都有一定程度的贡献。
利用外源添加的羟基与细胞壁上的羧基发生酯化反应进行酯化改性,减少Pb在细胞壁上游离羧基结合位点,是研究羧基在细胞壁吸附Pb作用的重要手段。研究发现,酯化后的细胞壁对重金属吸附量会显著减少[22]。如“龙井43”茶树根细胞壁酯化后对Pb的吸附量降低了51.10%,“迎霜”茶树根细胞壁下降了39.09%[16]。与本试验结果类似,“会单4号”细胞壁酯化后Pb吸附量降低了44.59%,“路单8号”降低了47.41%,说明羧基在此过程中发挥了至关重要的作用,可能与细胞壁中带羧基的多糖含量有关。但两个品种间差异不显著,这表明羧基在这两个品种玉米根细胞壁吸附Pb过程中发挥的作用相近。
氨基甲基化是利用外源添加的甲基与细胞壁中的氨基反应,以研究氨基在细胞壁吸附Pb过程中的作用。紫花苜蓿细胞壁氨基在吸附Au3+过程中有重要贡献,而在吸附Cr3+过程中作用不明显[22],本研究中玉米根细胞壁氨基甲基化后“会单4号”的Pb吸附量降低了28.60%,“路单8号”下降了24.86%,表明氨基在这两个玉米品种根细胞壁吸附Pb过程发挥了一定作用。
当金属离子与有机分子结合后会导致其化合键对红外光子吸收的特征频率发生变化,在进行FTIR表征时,官能团所对应的特征吸收峰会发生位置和强度的变化,因此,可通过根细胞壁某些官能团与Pb结合前后特征吸收峰的变化来判断其是否参与Pb的结合作用[23]。其中根据特征吸收峰是否出现位移可以判断其是否参与Pb的吸附作用,利用吸收峰吸光度比值的大小变化可以间接半定量判断细胞壁官能团数量变化的大小[16],从而体现该官能团的作用大小。
近年来利用FTIR光谱图来表征氨基、羟基、羧基等离子化基团在重金属吸附过程中作用的研究越来越多,如对海州香薷、茶树、芹菜、垂序商陆等多种植物根细胞壁吸附Cu、Pb、Cd、Mn前后差异的研究[9, 13-14, 23],茶树根细胞壁吸附Pb后,由于Pb取代了羟基中的氢,使羟基特征峰向高波数位移了23个波数[14]。本研究两个玉米品种的根细胞壁羟基、氨基特征峰在吸附Pb前后分别向高波数位移了35个和32个波数,说明这两个玉米品种的根细胞壁中的羟基、氨基在其吸附Pb过程中都发挥了重要的作用,是结合Pb的重要官能团,但其作用大小可能因品种不同而存在差异。对2种茶树根细胞壁吸附Pb前后的红外光谱进行分析,发现A/A2920比值在细胞壁吸附Pb后均降低[16],对芹菜、垂序商陆根细胞壁吸附Cd、Mn前后的FTIR光谱图与茶树的结果相似,而海州香薷根细胞壁吸附Cu后的红外光谱表现为除酰胺Ⅰ带C-N基团A/A2922比值降低外,其他均为升高或变化不明显[9],本研究结果与海州香薷的研究结果相似,表现为“会单4号” A3382/A2921和“路单8号” A3385/A2921的比值显著升高,代表细胞壁羟基、氨基的作用,该比值升高说明根细胞壁吸附Pb后增强了细胞壁表面氢键的作用[16],且升高的程度有明显差异,升高越多,该官能团发挥的作用可能越大,这可能正是造成两个玉米品种根细胞壁吸附Pb能力不同的原因。1651 cm-1 (No.4)对应的酰胺Ⅰ带C-N,是蛋白质的特征红外光谱,其比值(A1651/A2921)均明显下降,也与海州香薷根细胞壁吸附Cu后的表现[16]一致,表明细胞壁上蛋白质含量可能有所下降,但两个品种变化差异不明显。官能团特征吸收峰吸光度比值在细胞壁吸附金属后存在升高和降低两种变化,其具体原因还不清楚,可能与植物种类及金属性质有关,有待进一步研究。
4 结论(1) 根高累积玉米品种“会单4号”根细胞壁对Pb的吸附量高于根低累积玉米品种“路单8号”,且吸附更加牢固。
(2)“会单4号”和“路单8号”根细胞壁果胶、半纤维素、纤维素在吸附Pb的过程中都有不同程度的贡献,表现为纤维素>半纤维素>果胶;多糖中羟基、氨基与羧基在玉米根细胞壁吸附Pb过程中均发挥了重要作用,其中羧基的作用最大。
(3) 傅立叶变换红外光谱表征结果显示,两个玉米品种对Pb表现出的累积能力差异,主要源于根细胞壁上羟基或氨基含量变化的差异。
| [1] |
邹小冷, 祖艳群, 李元, 等. 云南某铅锌矿区周边农田土壤Cd、Pb分布特征及风险评价[J]. 农业环境科学学报, 2014, 33(11): 2143-2148. ZOU Xiao-leng, ZU Yan-qun, LI Yuan, et al. Pollution and health risk assessment of cadmium and lead in cultivated soils and crops surrounding a lead-zinc mine in Yunnan Province[J]. Journal of Agro-Environment Science, 2014, 33(11): 2143-2148. DOI:10.11654/jaes.2014.11.011 |
| [2] |
湛方栋, 陈建军, 秦丽, 等. 镉铅污染的玉米秸秆还田对蚕豆生长、养分和镉铅含量的影响[J]. 农业环境科学学报, 2016, 35(4): 661-668. ZHAN Fang-dong, CHEN Jian-jun, QIN Li, et al. Effects of applying Cd/Pb contaminated maize stalks on growth and nutrient and Cd and Pb content of faba bean[J]. Journal of Agro-Environment Science, 2016, 35(4): 661-668. |
| [3] |
郭晓芳, 卫泽斌, 丘锦荣, 等. 玉米对重金属累积与转运的品种间差异[J]. 生态与农村环境学报, 2010, 26(4): 367-371. GUO Xiao-fang, WEI Ze-bin, QIU Jin-rong, et al. Differences between corn cultivars in accumulation and translocation of heavy metals[J]. Journal of Ecology and Rural Environment, 2010, 26(4): 367-371. DOI:10.3969/j.issn.1673-4831.2010.04.015 |
| [4] |
陈建军, 于蔚, 祖艳群, 等. 玉米(Zea mays)对镉积累与转运的品种差异研究[J]. 生态环境学报, 2014, 23(10): 1671-1676. CHEN Jian-jun, YU Wei, ZU Yan-qun, et al. Variety diference of Cd accumulation and translocation in Zea Mays[J]. Ecology and Environmental Sciences, 2014, 23(10): 1671-1676. DOI:10.3969/j.issn.1674-5906.2014.10.016 |
| [5] |
秦榕璘, 李元, 祖艳群, 等. 不同基因型玉米品种对Pb的富集特征[J]. 农业资源与环境学报, 2016, 33(3): 268-275. QIN Rong-lin, LI Yuan, ZU Yan-qun, et al. Accumulation characteristics of Pb by Zea mays of different genotyoes[J]. Journal of Agricultural Resources and Environment, 2016, 33(3): 268-275. |
| [6] |
沈奕昕, 李元, 祖艳群, 等. 不同玉米(Zea mays L.)品种根细胞壁多糖及Pb累积对Pb胁迫的响应[J]. 生态环境学报, 2018, 27(5): 950-956. SHEN Yi-xin, LI Yuan, ZU Yan-qun, et al. Responses of polysaccharide in root cell wall of maize(Zea mays L.)cultivars to Pb stress[J]. Ecology and Environmental Sciences, 2018, 27(5): 950-956. |
| [7] |
Gibeaut D M, Carpita N C. Glucan synthesis in membranes from Zea mays and Glycine max:Interaction of ER and Golgi membranes[J]. Plant Physiology, 1993, 102(1): 51. |
| [8] |
Jiang X Y, Wang C H. Zinc distribution and zinc-binding forms in Phragmites australis under zinc pollution[J]. Journal of Plant Physiology, 2008, 165(7): 697-704. DOI:10.1016/j.jplph.2007.05.011 |
| [9] |
刘婷婷, 彭程, 王梦, 等. 海州香薷根细胞壁对铜的吸附固定机制研究[J]. 环境科学学报, 2014, 34(2): 514-523. LIU Ting-ting, PENG Cheng, WANG Meng, et al. Mechanism of fixation and adsoption of copper on root cell wall of Elsholtzia splendens[J]. Acta Scientiae Circumstantiae, 2014, 34(2): 514-523. |
| [10] |
Krzeslowska M. The cell wall in plant cell response to trace metals:Polysaccharide remodeling and its role in defense strategy[J]. Acta Physiologiae Plantarum, 2011, 33(1): 35-51. |
| [11] |
王松华, 杨志敏, 徐朗莱. 植物铜素毒害及其抗性机制研究进展[J]. 生态环境, 2003, 12(3): 336-341. WANG Song-hua, YANG Zhi-min, XU Lang-lai. Mechanisms of copper toxicity and resistance of plants[J]. Ecology and Environment, 2003, 12(3): 336-341. DOI:10.3969/j.issn.1674-5906.2003.03.020 |
| [12] |
Kan Q, Wu W W, Yu W Q, et al. Nitrate reductase-mediated NO production enhances Cd accumulation in Panax notoginseng roots by affecting root cell wall properties[J]. Journal of Plant Physiology, 2016, 193(1): 64-70. |
| [13] |
徐向华, 刘翠英, 李平, 等. 垂序商陆叶细胞壁结合锰机制研究[J]. 环境科学, 2015, 36(2): 706-711. XU Xiang-hua, LIU Cui-ying, LI Ping, et al. Mechanism of manganese binding to leaf cell wall of Phytolacca americana L.[J]. Environmental Science, 2015, 36(2): 706-711. |
| [14] |
王梦, 段德超, 徐辰, 等. 茶树根细胞壁不同组分对铅的吸附性能及其功能团的傅里叶红外光谱学研究[J]. 生态学报, 2015, 35(6): 1743-1751. WANG Meng, DUAN De-chao, XU Chen, et al. Adsorption ability of cell wall(CW)components in roots of tea plant(Camellia sinensis L.) to Pb and FTIR spectra of their functional groups[J]. Acta Ecologica Sinica, 2015, 35(6): 1743-1751. |
| [15] |
武贝.海州香薷Cu耐性与积累机制研究[D].杭州: 浙江大学, 2009: 36. WU Bei. Study of mechanism for Cu tolerance and accumulation in Elsholtzia splendens[D]. Hangzhou: Zhejiang University, 2009: 36. http://cdmd.cnki.com.cn/Article/CDMD-10335-2009158229.htm |
| [16] |
徐劼.茶树(Camellia sinensis L.)对铅的吸收累积及耐性机制研究[D].杭州: 浙江大学, 2011: 76-77. XU Jie. Mechanism of lead uptake/accumulation and tolerance tea plant (Camellia sinensis L.)[D]. Hangzhou: Zhejiang University, 2011: 76-77. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012278223.htm |
| [17] |
Zheng S J, Lin X Y, Yang J L, et al. The kinetics of aluminum adsorption and desorption by root cell walls of an aluminum resistant wheat (Triticum aestivum L.)cultivar[J]. Plant and Soil, 2004, 261(1/2): 85-90. DOI:10.1023/B:PLSO.0000035576.71760.2b |
| [18] |
刘婷婷.细胞壁在海州香薷铜耐性中的作用及解毒机理研究[D].杭州: 浙江大学, 2014: 39-51. LIU Ting-ting. The role of cell wall in copper tolerance of Elsholtzia splendens and their detoxification mechanisms[D]. Hangzhou: Zhejiang University, 2014: : 39-51. http://cdmd.cnki.com.cn/Article/CDMD-10335-1014361563.htm |
| [19] |
Malecka A, Piechalak A, Morkunas I, et al. Accumulation of lead in root cells of Pisum sativum[J]. Acta Physiologiae Plantarum, 2008, 30(5): 629-637. DOI:10.1007/s11738-008-0159-1 |
| [20] |
Kopittke P M, Asher C J, Blamey F P C, et al. Localization and chemical speciation of Pb in roots of signal grass(Brachiaria decumbens) and rhodes grass(Chloris gayana)[J]. Environmental Science and Technology, 2008, 42(12): 4595-4599. DOI:10.1021/es702627c |
| [21] |
Konno H, Nakashima S, Katoh K. Metal-tolerant moss Scopelophila cataractae accumulates copper in cell wall pectin of the protonema[J]. Journal of Plant Physiology, 2010, 167(5): 358-364. DOI:10.1016/j.jplph.2009.09.011 |
| [22] |
Gardea-Torresdey J L, Tiemann K J, Parsons J G, et al. XAS investigations into the mechanism(s)of Au(Ⅲ)binding and reduction by alfalfa biomass[J]. Microchemical Journal, 2002, 71(2/3): 193-204. |
| [23] |
徐劼, 保积庆. 芹菜根细胞壁对镉的吸附固定机制及其FTIR表征研究[J]. 环境科学学报, 2015, 35(8): 2605-2612. XU Jie, BAO Ji-qing. Adsorption and fixation mechanism of cadmium on celery(Apium graveolens L.)root cell wall and the analysis of FTIR spectra[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2605-2612. |
 2020, Vol. 37
2020, Vol. 37