邻苯二甲酸酯类化合物(Phthalic acid esters,PAEs)作为塑化剂,被广泛应用于塑料制品、涂料和农药生产中[1],而邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)是一种常见的PAEs,DMP分子小,易被动植物体吸收,且迁移速度最快,毒性强[2],已经成为大气、水体以及土壤中检出率最高的有机污染物之一[3-4],对生态系统造成危害[5]。因此,中国环境监测中心确定DMP为环境优先控制污染物[6],并在2005年开始实施的全国土壤污染现状调查专项中将PAEs列为土壤必测项目[7]。
DMP在土壤环境中不易降解,且降解速度缓慢[8],而生物修复因其高效和无二次污染等优点,在DMP污染修复方面具有广阔的应用前景,被广泛关注[9-11]。Paracoccus sp.QD15-1能够高效降解DMP,且能够以DMP为唯一碳源生长[12-13],但环境中存在多种碳氮源,会影响降解菌的降解能力[14-16],阐明DMP降解菌在多种碳氮源存在时的生长情况及降解效应是十分必要的。因此,本研究以Paracoccus sp.QD15-1为研究对象,研究其生长和降解能力对碳氮源的响应,旨在为DMP污染修复提供理论依据。
1 材料与方法 1.1 供试材料与培养基 1.1.1 菌株DMP降解菌Paracoccus sp.QD15-1,由齐齐哈尔大学微生物实验室提供。
1.1.2 试剂DMP、乙酸乙酯和己烷均为分析纯试剂,购于天津市光复精细化工研究所。
1.1.3 培养基基础无机盐(MSM)培养基:K2HPO4·12H2O 1.0 g,KH2PO4 1.0 g,NH4Cl 0.8 g,NaCl 1.0 g,MgSO4·7H2O 0.5 g,DMP 500 mg,微量元素储备液2 mL,H2O 1000 mL。
碳源:葡萄糖5 g·L-1,蔗糖5 g·L-1,乳糖5 g·L-1,淀粉5 g·L-1。
氮源:硫酸铵5 g·L-1,硝酸钠5 g·L-1,硝酸铵5 g·L-1,尿素5 g·L-1。
微量元素储备液:CaSO4·5H2O 4.0 g,FeSO4·7H2O 7.0 g,FeCl3·6H2O 7.0 g,CoCl3·6H2O 0.2 g,NaMO4 ·2H2O 3.4 g,CaCl2 2.0 g,H2O 1000 mL。
1.2 方法 1.2.1 DMP降解菌菌体浓度的测定以不同的碳源(葡萄糖、蔗糖、乳糖、淀粉)、氮源(硝酸钠、尿素、硫酸铵、硝酸铵)分别配制150 mL的同等质量浓度的碳源、氮源无机盐液体培养基,装于250 mL的三角瓶内进行灭菌。将之前保存的Paracoccus sp.QD15-1吸取50 μL滴入无机盐培养基,培养48 h至菌体生长。取1 mL活化的菌体在4000 r·min-1下离心5 min,取沉淀,加入无菌水反复离心,直至上清液澄清。将活化洗涤后的菌悬液以每个锥形瓶1.1×107 cfu·mL-1的接种量接种于实验组和对照组培养基中,然后添加DMP溶液,使培养基中DMP终浓度为10 mmol·L-1。同时以不添加碳源、氮源的无机盐DMP培养液作对照。在恒温摇床中以30 ℃、200 r·min-1振荡培养60 h。每隔12 h,分别用灭菌吸管各吸取1 mL注入平皿,注入45~50 ℃的无机盐培养基约15 mL,随即转动平皿,使样品与培养基充分混合均匀,待培养基凝固后,翻转平皿,置37 ℃±1 ℃培养箱内培养24 h后,进行菌落计数。用肉眼观察,记下各平皿的菌落数后计算菌体浓度,通过公式μ=ln2/td(td为倍增时间),计算比生长速率。
1.2.2 DMP降解菌降解实验培养基配制与菌株接种量同上,在摇床中200 r·min-1振荡培养60 h,每隔12 h,测量DMP残余量。取10 mL菌液进行离心,将离心后的上清液倒入分液漏斗,加入乙酸乙酯进行萃取,取上层液体倒入旋转蒸发仪的蒸馏瓶,待蒸馏瓶中液体蒸干后取下并加入10 mL甲醇,摇晃均匀后取1.5 mL倒入棕色小瓶,用液相色谱分析仪测量峰面积,液相色谱柱为Waters XTerra@RP18 C18柱(3.9 mm × 150.0 mm,5 µm),以10%的水、90%的甲醇为流动相,流速为1.0 mL ·min-1,检测波长为254 nm,柱温为30 ℃。以液相色谱测得的峰面积为X轴,以不同浓度为Y轴,绘制标准曲线,得出标准曲线方程为y=0.202x-47.954(R2=0.997),并计算DMP降解的半衰期。
2 结果与分析 2.1 碳源对菌株Paracoccus sp.QD15-1的生长和DMP降解的影响 2.1.1 碳源对菌株Paracoccus sp.QD15-1生长的影响由图 1可知,DMP作为唯一碳源时,菌株Paracoccus sp.QD15-1在0~12 h时处于迟缓期,菌体生长量基本没有变化,12 h后菌体进入对数生长期,菌株大量生长,到60 h时达到最大值,最大比生长速率为0.06 lg(cfu)·h-1。在同时含有DMP和葡萄糖两种碳源时,菌株迟缓期明显增长,而在对数生长期后期生物量最大值高于对照,最大比生长速率为0.08 lg(cfu)·h-1,是外加碳源中相对生长较慢的。在同时含有DMP和乳糖两种碳源时,菌株迟缓期相对较长,在对数生长期后期生物量最大值高于对照组,最大比生长速率为0.09 lg(cfu)·h-1。在同时含有DMP和淀粉两种碳源时,菌株进入对数生长期的时间明显提前,且在对数生长期后期生物量最大值明显高于对照组, 最大比生长速率为0.13 lg(cfu)·h-1,是菌株生长速度最快的外加碳源处理组,在36 h即达到最大值。在同时含有DMP和蔗糖两种碳源时,菌株迟缓期相对较短,且在对数生长期后期生物量最大值明显高于对照组,最大比生长速率为0.09 lg(cfu)·h-1。
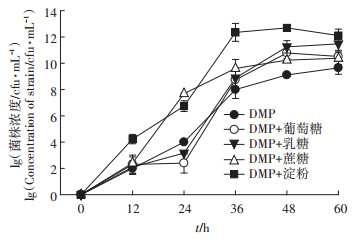
|
图 1 碳源对菌株Paracoccus sp.QD15-1生长的影响 Figure 1 Effect of carbon source on the growth of strain Paracoccus sp.QD15-1 |
由图 2可知,DMP为唯一碳源时,0~12 h时DMP的降解速度最大,12 h后DMP的降解速度逐渐变慢,60 h时DMP降解率为46.6%。在同时含有DMP和葡萄糖两种碳源时,0~36 h时DMP浓度快速下降,这是由于此时菌体处于对数生长期,生物量较大,36 h时DMP降解率为76.0%,DMP半衰期为24.2 h。在同时含有DMP和乳糖两种碳源时,0~24 h时的DMP浓度与对照组基本一致,但24~36 h的DMP降解速度明显变快,且在36 h时DMP降解率为70.6%,DMP半衰期为33.3 h。在同时含有DMP和淀粉两种碳源时,0~12 h时DMP含量明显降低,且低于对照组,36 h时DMP降解率高达78.2%,DMP半衰期最短,为15.6 h。在同时含有DMP和蔗糖两种碳源时,0~12 h时DMP的降解速度较快,12~24 h时速度变慢,36 h时DMP降解率为69.2%,DMP半衰期为28.1 h。添加不同碳源36 h后,DMP的含量均较36 h前略有回升,这可能是由于此时部分菌体死亡,DMP从细胞内释放出来。
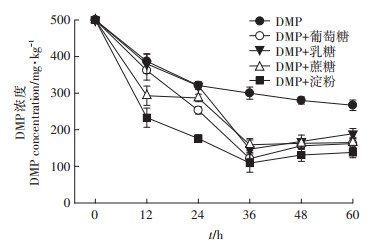
|
图 2 碳源对菌株Paracoccus sp.QD15-1降解能力的影响 Figure 2 Effect of carbon source on degradation ability of strain Paracoccus sp.QD15-1 |
由图 3可知,在无机盐培养基中,菌株Paracoccus sp.QD15-1在0~12 h时处于迟缓期,菌体生长量基本没有变化,12 h后菌体进入对数生长期,菌株大量生长,到60 h时达最大值,其最大比生长率为0.06 lg(cfu)·h-1。在外加尿素时,菌株迟缓期相对较短,且在对数生长期后期生物量高于对照组,最大比生长率为0.08 lg(cfu)·h-1。在外加硝酸钠时,菌株迟缓期无明显变化,在对数生长期后期生物量高于对照组,最大比生长率为0.08 lg(cfu)·h-1。在外加硝酸铵时,菌株迟缓期延长,在对数生长期后期生物量与对照组无明显差异,最大比生长率达到0.09 lg(cfu)·h-1。在外加硫酸铵时,菌株迟缓期延长,在对数生长期后期生物量高于对照组,最大比生长率为0.07 lg(cfu)·h-1。
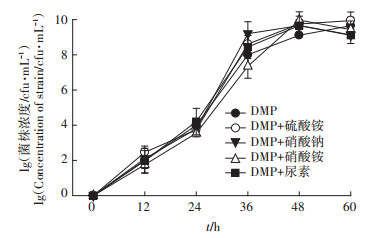
|
图 3 氮源对菌株Paracoccus sp.QD15-1生长的影响 Figure 3 Effect of nitrogen source on the growth of strain Paracoccus sp.QD15-1 |
由图 4可知,在无机盐培养基中,0~12 h时DMP的降解速度最大,12 h后DMP的降解速度逐渐变慢,60 h时DMP降解率为46.6%。在外加尿素时,0~36 h时,DMP含量快速下降,36 h时,DMP降解率为62.8%,是菌株降解DMP最多的,DMP半衰期为27.3 h。在外加硝酸钠时,0~12 h时DMP含量明显下降,且低于对照组,12~36 h时DMP含量下降变慢,DMP半衰期为26.7 h,是外加氮源中半衰期最短的。在外加硝酸铵时,0~36 h时DMP含量一直处于下降状态,且速度很快,DMP半衰期为33.8 h。在外加硫酸铵时,0~12 h时的DMP含量与对照组基本一致,12~24 h时速度变慢,36 h时,DMP降解率为48.8%。
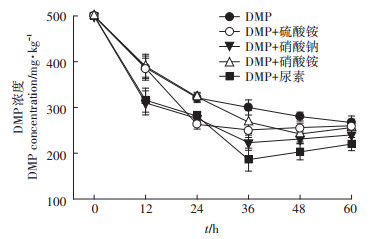
|
图 4 氮源对菌株Paracoccus sp. QD15-1降解能力的影响 Figure 4 The effect of nitrogen source on degradation ability of strain Paracoccus sp. QD15-1 |
随着PAEs化合物的生产量和使用量不断增加,土壤、污泥及沉积物中PAEs的污染问题日益凸显[17]。现阶段,我国土壤中的PAEs主要来源于农用化学品、污水灌溉和大气沉降[18]。而农用薄膜、肥料、农药、污泥堆肥等农业废弃物是我国农田土壤中PAEs的重要来源[19]。PAEs在土壤、污泥及沉积物中的富集过程和迁移转化对生态环境造成了潜在的威胁,危害人类健康[20]。随着近年来研究的深入,人们对DMP降解菌的研究有了很大的进展,但有关碳源和氮源对其降解的影响还鲜有报道。DMP降解菌在不同环境因子存在时对菌株的生长和降解能力也有不同程度的影响,而碳源和氮源是微生物生长所必需的物质。在实验室环境中都是单一的碳氮源,而在自然环境中的碳氮源是复杂的。因此本实验选取四种不同碳氮源用来研究非单一碳氮源存在时,DMP降解菌的降解能力。刘丹丹等[21]发现添加碳源可以促进菌株Paracoccus sp.对阿特拉津的降解。本实验也证明了加入碳源后Paracoccus sp.QD15-1对DMP降解速度增加。Zhang等[22]发现外加氮源可以刺激木质素的降解。因此,碳源和氮源的添加可能会对降解物产生不同的影响,其影响取决于碳源和氮源的类型。本研究结果表明QD15-1在淀粉中生长最好,且降解DMP最多。与其他氮源相比,外加硫酸铵时菌株生长较慢,与加入这四种氮源时DMP的降解趋势一致,表明菌株的生长情况直接影响到其降解能力,此结果与Jin等[23]的研究发现一致。此外,本实验通过添加除DMP以外的四种不同碳氮源发现:在只含有DMP一种碳氮源时,DMP降解菌的生长速率明显低于添加其他碳氮源时,其进入对数生长期的时间也比较缓慢,且进入衰亡期较早;加入其他碳氮源后,DMP降解菌的降解速度明显变快。因此,即使在有多种碳源和氮源存在的外界环境中,菌株Paracoccus sp.QD15-1也可以更好地发挥其降解作用。
4 结论本实验测定了非单一碳氮源存在下,DMP降解菌Paracoccus sp.QD15-1的生长情况和降解能力。
(1)外加碳源后,各处理生物量最大值均高于对照组,且外加四种碳源后,DMP降解菌的降解能力均有所提升。其中外加淀粉的最大比生长率达到0.13 lg(cfu)·h-1,36 h DMP降解率为78.2%,半衰期15.6 h。
(2)加入四种氮源后,降解菌的生物量均有所上升,其中外加尿素后36 h DMP降解率达到62.8%。
(3)外加碳源比外加氮源更有效促进Paracoccus sp.QD15-1的生长及其对DMP的降解。
| [1] |
陈波, 倪静. 土壤中的邻苯二甲酸酯及其生态毒理学效应[J]. 广东农业科学, 2011, 38(2): 155-157. CHEN Bo, NI Jing. Phthalates in soil and toxicological effects of phthalic acid esters[J]. Guangdong Agricultural Sciences, 2011, 38(2): 155-157. DOI:10.3969/j.issn.1004-874X.2011.02.060 |
| [2] |
张惠.邻苯二甲酸二甲酯(DMP)对黄瓜生育期毒性效应研究[D].哈尔滨: 东北农业大学, 2015. ZHANG Hui. Toxic effect of dimethy phthalate(DMP) on cucumber in growth stage[D]. Harbin: Northeast Agricultural University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015396269.htm |
| [3] |
Dickson-Spillmann M, Siegrist M, Keller C, et al. Phthalate exposure through food and consumers′ risk perception of chemicals in food[J]. Risk Anal, 2009, 29(8): 1170-1181. DOI:10.1111/risk.2009.29.issue-8 |
| [4] |
聂湘平, 吴志辉, 李凯彬, 等. 不同暴露方式下酞酸酯在黄斑篮子鱼体中的富集[J]. 中国环境科学, 2007, 27(4): 467-471. NIE Xiang-ping, WU Zhi-hui, LI Kai-bin, et al. Effects of different exposure ways upon the bioaccumulation of phathalate esters in Siganus oramin[J]. Chinese Environmental Science, 2007, 27(4): 467-471. DOI:10.3321/j.issn:1000-6923.2007.04.008 |
| [5] |
Kapanen A, Stephen R, Brüggemann J, et al. Diethyl phthalate in compost: Ecotoxicological effects and response of the microbial community[J]. Chemosphere, 2007, 67: 2201-2209. DOI:10.1016/j.chemosphere.2006.12.023 |
| [6] |
赵晓松, 王志刚, 王春龙, 等. 采用光谱学技术分析邻苯二甲酸酯与DNA互作机制[J]. 生态毒理学报, 2017, 12(4): 385-391. ZHAO Xiao-song, WANG Zhi-gang, WANG Chun-long, et al. Bonding mechanism between phthalic acid esters and DNA by spectroscopy technologies[J]. Asian Journal of Ecotoxicology, 2017, 12(4): 385-391. |
| [7] |
张宝峰.设施菜地土壤中邻苯二甲酸酯累积及吸附特征研究[D].青岛: 青岛农业大学, 2014. ZHANG Bao-feng. Research of phthalates′ accumulation in greenhouse soil and adsorb characteristics[D]. Qingdao: Qingdao Agricultural University, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2663261 |
| [8] |
Han D, Li J, Cao H, et al. Theoretical investigation on the mechanisms and kinetics of OH-initiated photo oxidation of dimethyl phthalate (DMP)in atmosphere[J]. Chemosphere, 2014, 95: 50-57. DOI:10.1016/j.chemosphere.2013.07.087 |
| [9] |
严佳丽, 陈湖星, 杨杨, 等. 一株高效DEHP降解菌的分离、鉴定及其降解特性[J]. 微生物学通报, 2014, 41(8): 1532-1540. YAN Jia-li, CHEN Hu-xing, YANG Yang, et al. Isolation and characterization of a highly efficient DEHP-degrading bacterium[J]. Microbiology, 2014, 41(8): 1532-1540. |
| [10] |
李建龙, 邵向丽, 刘书亮, 等. 邻苯二甲酸二丁酯降解菌株的筛选鉴定及其降解特性研究[J]. 现代食品科技, 2014(10): 108-114. LI Jian-long, SHAO Xiang-li, LIU Shu-liang, et al. Isolation and identification of dibutyl phthalate-degrading strain and its degradation characteristics[J]. Modern Food Science and Technology, 2014(10): 108-114. |
| [11] |
刘帅, 王志刚, 胡云龙, 等. 一株黑土生境中DMP降解菌的分离鉴定和降解条件研究[J]. 浙江农业学报, 2015, 27(10): 1807-1812. LIU Shuai, WANG Zhi-gang, HU Yun-long, et al. Identification of a DMP-degraded strain in black soil and the optimation of degradation conditions[J]. Acta Agriculturae Zhejiangensis, 2015, 27(10): 1807-1812. DOI:10.3969/j.issn.1004-1524.2015.10.22 |
| [12] |
徐伟慧, 刘帅, 王志刚, 等. 一株DMP降解菌的分离鉴定及特性研究[J]. 农业环境科学学报, 2018, 37(8): 1724-1732. XU Wei-hui, LIU Shuai, WANG Zhi-gang, et al. Isolation, identification, and degradation characteristics of a DMP-degrading strain[J]. Journal of Agro-Environment Science, 2018, 37(8): 1724-1732. |
| [13] |
严佳丽.高效DEHP降解菌的分离鉴定及降解基因的研究[D].武汉: 华中师范大学, 2015. YAN Jia-li. Isolation and identification of efficient DEHP degrading bacteria and study on degrading genes[D]. Wuhan: Huazhong Normal University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10511-1015442831.htm |
| [14] |
Chun L. Isolation identification and soil remediation of atrazine-degrading strain T3AB1[J]. Chemosphere, 2010, 50(12): 1642-1650. |
| [15] |
范寰, 梁军锋, 赵润, 等. 碳氮源对复合木质素降解菌木质素降解能力及相关酶活的影响[J]. 农业环境科学学报, 2010, 29(7): 1394-1398. FAN Huan, LIANG Jun-feng, ZHAO Run, et al. Effect of carbon and nitrogen sources on lignin degradation ability and enzyme activity of dual-cultured, lignin-degrading fungi[J]. Journal of Agro-Environment Science, 2010, 29(7): 1394-1398. |
| [16] |
岳黎, 唐赟, 宋嫣, 等. 不同碳、氮源对苯酚降解菌XH-10的生长和苯酚降解的影响[J]. 西华师范大学学报(自然科学版), 2012, 33(2): 146-153. YUE Li, TANG Yun, SONG Yan, et al. Effects of different carbon and nitrogen sources on growth and phenol degradation of phenol degrading bacterium XH-10[J]. Journal of China West Normal University (Natural Science Edition), 2012, 33(2): 146-153. |
| [17] |
冉晓频. 土壤/污泥中邻苯二甲酸酯类化合物的研究进展[J]. 广州化工, 2017, 45(15): 27-29. RAN Xiao-pin. Research progress on phthalic acid esters(PAEs)in soil, sludges and sediments[J]. Guangzhou Chemical Industry, 2017, 45(15): 27-29. DOI:10.3969/j.issn.1001-9677.2017.15.011 |
| [18] |
王凯荣, 崔明明. 农业土壤中邻苯二甲酸酯污染研究进展[J]. 应用生态学报, 2013, 24(9): 2699-2708. WANG Kai-rong, CUI Ming-ming. Phthalic acid esters (PAEs) pollution in farmland soils: A review[J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2699-2708. |
| [19] |
Wang J, Luo Y, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution, 2013, 180(3): 265-273. |
| [20] |
Niu L, Yang X, Chao X, et al. Status of phthalate esters contamination in agricultural soils across China and associated health risks[J]. Environmental Pollution, 2014, 195: 16-23. DOI:10.1016/j.envpol.2014.08.014 |
| [21] |
刘丹丹, 刘畅, 刘长风, 等. 降解菌Pseudomonas sp.对阿特拉津的降解条件优化[J]. 贵州农业科学, 2016, 44(10): 46-49. LIU Dan-dan, LIU Chang, LIU Chang-feng, et al. Optimization for degradation conditions of Pseudomonas sp. strain with degrading atrazine ability[J]. Guizhou Agricultural Sciences, 2016, 44(10): 46-49. DOI:10.3969/j.issn.1001-3601.2016.10.012 |
| [22] |
张欢, 柴立元, 朱咏华, 等. 3株细菌降解木质素的条件调控研究[J]. 中南大学学报(自然科学版), 2011, 42(10): 2922-2928. ZHANG Huan, CHAI Li-yuan, ZHU Yong-hua, et al. Cultural condition regulations for three lignin degrading bacteria[J]. Journal of Central South University(Science and Technology), 2011, 42(10): 2922-2928. |
| [23] |
Jin L, Sun X M, Zhang X J, et al. Co-metabolic biodegradation of DBP by Paenibacillus sp. S-3 and H-2[J]. Current Microbiology, 2014, 68(6): 708-716. |
 2019, Vol. 36
2019, Vol. 36


