2. 江苏省农业气象重点实验室, 南京 210044
2. Jiangsu Key Laboratory of Agricultural Meteorology, Nanjing 210044, China
近年来,由于污水灌溉、化石燃料燃烧、矿石开采和城市垃圾处理等活动而导致的土壤重金属污染日益加剧[1]。相比其他重金属,镉具有较高的生物有效性,更容易在作物中积累。因此,镉污染具有更大的环境风险。土壤中较高浓度的镉会引起作物各种形态和生理的变化,通过作物的吸收和富集后,经食物链进入人体,从而对人体造成不可逆的伤害[2]。因此,由土壤镉污染引起的食品安全及人体健康风险等问题受到了全球极大的关注[3]。
有研究表明,小麦作为主要的谷类作物,对镉具有较强的富集能力,并通过食物链增加人类的健康风险[4]。2017年在河南新乡发现小麦镉含量超出国家食品安全限定值的1.7~12.8倍,使得小麦镉污染再次引起人们的关注[5]。镉污染除了能增加小麦中的镉富集外,还会影响小麦的生长及光合生理指标。研究发现,当小麦暴露于镉胁迫时,叶绿素含量会随着镉浓度的增加而降低,且光合作用受到抑制;在镉浓度为1 mmol时,其茎叶生物量显著下降45%[6]。而Yang等[7]研究发现当镉浓度为3.50 mg·kg-1时,小麦干物质量会达到最大值,超过该浓度,小麦生长将受到抑制。此外,镉胁迫还会通过干扰矿质元素的吸收和运输导致营养元素失衡[8]。然而,小麦对镉胁迫的响应因品种不同而具有差异[9]。
重金属的健康风险评价方法有单因子污染指数法、重金属限量超标评价指数法、插值法及目标危险系数(THQ)法等[10]。重金属作为一种慢性积累的毒性元素,对人体健康具有潜在的危害,且不同的消费人群对于小麦镉污染的接受能力具有差异。因此可运用THQ来评价人类健康风险[11]。
目前研究主要集中于镉对小麦生长、生理特性和镉吸收影响等一个或两个方面,尚缺乏对这几个方面的系统研究。鉴于此,本研究选用耐寒且耐湿性比较好的扬麦13号[12],通过盆栽试验,分析不同镉污染水平下,小麦生长、光合生理特性及各部位磷、镉含量,并利用THQ评价食用小麦籽粒的健康风险,旨在为镉污染区小麦安全生产及健康风险评估提供理论依据。
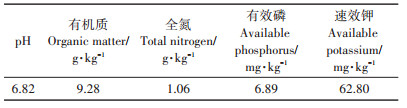
1 材料与方法 1.1 试验材料供试土壤取自南京信息工程大学农业气象试验站表层土(0~20 cm)。土壤自然风干,拣去枯枝落叶和小石子后,过5 mm筛备用。供试土壤的pH、有机质、全氮、有效磷及速效钾等基本理化性质按照常规方法[13]测定,具体见表 1。供试小麦品种为扬麦13号,该品种为优质抗病弱筋小麦。
|
|
表 1 供试土壤理化性质 Table 1 The physical and chemical properties of the tested soil |
称取1 kg过5 mm筛的风干土壤,向其加入含氮(N)、磷(P2O5)、钾(K2O)分别为80、57、60 g·L-1的NH4H2PO4、CO(NH2)2和KCl混合溶液5 mL,充分混匀,使土壤中施入的N、P2O5、K2O分别为400、285 mg·kg-1和300 mg·kg-1。然后向土壤中加入CdCl2溶液混合,并装入聚氯乙烯(PVC)盆中,再向土壤中加入自来水至田间持水量,老化平衡一周。试验共设置5个镉添加水平,即5个镉处理,分别为0、5、10、20 mg·kg-1和50 mg·kg-1,每个处理4个重复,共20盆。
小麦种子用30%的双氧水浸泡消毒15 min,用蒸馏水洗净并浸泡,置于30 ℃的培养箱中过夜。然后转移至吸水纸上,不断补充水分。发芽5 d后,选取长势一致的小麦秧苗进行移栽。每盆移栽10棵小麦秧苗,成活后间苗,使盆中保留长势一致的5棵秧苗。小麦生长期间,不断补充水分,保持土壤湿润。
1.3 样品的采集和处理小麦成熟后,分茎、叶、穗三部分收获。收获后的小麦样品自来水洗净后用蒸馏水冲洗,放入70 ℃烘箱中烘至恒质量。将烘干后的麦穗经人工脱粒,分为壳和籽粒并称其干质量。最后将所有样品用高速粉碎机粉碎,置于密封袋中,并置于干燥器中保存。
1.4 样品测定与分析于小麦分蘖期用叶绿素测定仪(SPAD-502PLUS)测定其叶片的叶绿色度比值(SPAD);用Li-6400便携式光合仪在上午9:00—11:30、下午3:00—5:00测定小麦的净光合速率(Net photosynthetic rate,Pn)、叶片气孔导度(Conductance to H2O,Gs)和蒸腾速率(Transpiration rate,Tr)等光合生理指标,使用红蓝光源,光强为1000 µmol·m-2·s-1;在抽穗前每隔10 d测量小麦株高,用株高差与相对应天数的比值来表示生长速率。
小麦各部位样品用H2SO4-H2O2进行消煮,消煮液中的磷采用钼锑抗比色法测定,镉用原子吸收分光光度计测定(TAS-990,普析)[13]。为了分析质量控制,每批消煮时包括空白和标准物质(GBW07603)。
1.5 目标危险系数法重金属潜在的健康风险是基于目标危险系数评估(THQ)方法来评定的[11],如果THQ值大于1,则该重金属可能会对人体造成明显的不利影响。其中,单一重金属的评估公式为:
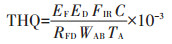
|
式中:EF为暴露频率,365 d·a-1;ED为暴露时间,70 a;FIR为摄食量,成人、儿童小麦消费值分别为192.38、147.96 g·人-1·d-1[14];C为小麦可食部分的镉浓度,mg·kg-1;RFD为口服参考剂量,Cd为0.001 mg·kg-1 ·d-1;WAB为平均体质量,成人、儿童平均体质量分别为55.9、32.7 kg;TA为非致癌物的平均暴露时间,即ED×365 d·a-1。
1.6 数据分析用Microsoft Excel 2007计算小麦的生长速率、生物量和各元素含量的平均值和标准误差,利用IBM SPSS Statistics 19统计软件对数据进行单因素方差分析(One-way AVOVA),并采用最小显著差异法(LSD)比较不同处理间的差异性,用Origin 8.5作图。
2 结果与分析 2.1 不同镉处理对小麦生长的影响图 1是小麦在不同镉处理下的生长速率。由图 1可知,小麦的生长速率因镉添加量的不同而具有一定的差异。与对照相比,5 mg·kg-1镉添加量下小麦生长速率有一定的增加,但未达到显著差异,而随着镉添加量的增加,小麦生长速率降低,当镉添加量为50 mg·kg-1时,具有显著差异(P < 0.05)。
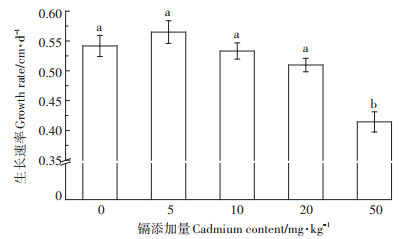
|
不同字母表示不同镉添加量之间存在显著差异(P < 0.05)。下同 Different letters indicate significant differences among different cadmium treatments (P < 0.05). The same below 图 1 镉对小麦生长速率的影响 Figure 1 The effect of cadmium on the growth rate of wheat |
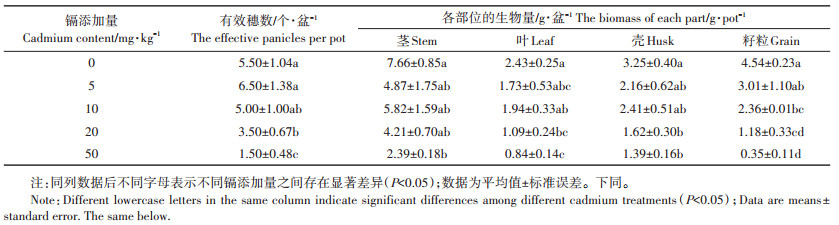
表 2为镉处理对小麦生物量的影响。由表 2可知,除5 mg·kg-1的镉添加量外,小麦有效穗数随着镉添加量的增加呈降低的趋势,且在20 mg·kg-1和50 mg·kg-1下,与对照差异达到显著水平(P < 0.05)。在50 mg·kg-1的镉添加量下,小麦茎、叶、壳、籽粒的生物量最低,分别比对照降低了68.8%、65.4%、57.2%和92.3%。
|
|
表 2 不同镉处理下小麦的生物量 Table 2 The biomass of wheat in the different cadmium treatments |
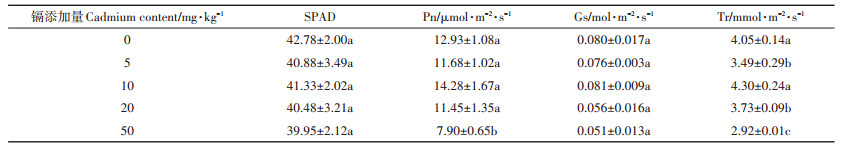
由表 3可知,不同的镉添加量没有显著影响小麦的SPAD和Gs值。在50 mg·kg-1的镉添加量下,小麦的Pn值显著降低,而其他镉添加量与对照相比未见显著差异(P < 0.05)。与对照相比,20 mg·kg-1和50 mg·kg-1镉添加显著降低了小麦蒸腾速率Tr(P < 0.05)。
|
|
表 3 不同镉处理下小麦的光合生理指标 Table 3 The photosynthetic physiology of wheat in the different cadmium treatments |
图 2反映了不同镉添加量下小麦各部位磷含量的差异。由图 2可知,不同镉添加量使得茎、叶和壳的磷含量表现出一致的规律,均随着镉添加量的增加先增加后减少,当镉添加量为50 mg·kg-1时,磷含量最低。而小麦籽粒在不同镉添加量下,磷含量都低于对照,但差异均未达到显著水平。小麦各部位的磷含量在不同土壤镉添加量下顺序一致,表现为籽粒>壳>茎≈叶。
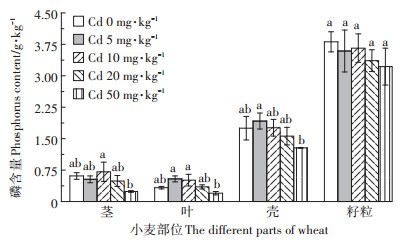
|
图 2 不同镉处理下小麦各部位磷含量 Figure 2 The phosphorus content in different parts of wheat under the different cadmium treatments |
由图 3可知,外源镉显著增加小麦茎、叶、壳和籽粒中的镉含量(P < 0.05),且这四个部位中的镉含量均随着镉添加量的增加而显著增大。当镉添加量最大时,小麦各部位镉含量最大,分别比对照高2 705.7%、2 394.4%、1 063.9%和821.9%。不同镉添加量下,小麦各部位中的镉含量大小顺序一致,表现为叶>茎>壳>籽粒。
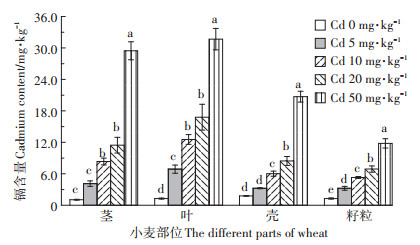
|
图 3 不同镉处理下小麦各部位镉含量 Figure 3 The cadmium concentration in different parts of wheat under the different cadmium treatments |
图 4表示了不同镉添加量下小麦籽粒中镉的THQ值。由图 4可知,随着镉添加量的增加,THQ值的变化趋势与小麦各部位中镉含量的变化趋势一致,都随着镉添加量的增加而增大,且籽粒中镉的THQ值均大于1。另外,比较成人与儿童的THQ值发现,在相同镉添加量下,镉对儿童的THQ值大于成人,表明镉污染对儿童的影响更大。
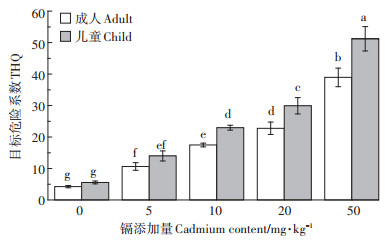
|
图 4 不同镉处理下小麦籽粒镉含量的目标危险系数 Figure 4 The THQ of cadmium in grain under the different cadmium treatments |
通常情况下,如果土壤中的镉含量超过了8 mg·kg-1或者作物组织中镉浓度达到3~30 mg·kg-1时,大多数作物都会表现出可见的镉毒性症状[15]。最直观的表现是植株生长缓慢、发育迟缓、萎蔫枯黄,甚至枯死[16]。在本研究中,低浓度镉增加了小麦的生长速率(图 1),表明低浓度镉会刺激小麦的生长,而当镉浓度过高时(>20 mg·kg-1),则会显著抑制小麦的生长并对小麦造成危害(表 2)。原因可能是,低浓度镉毒性可以依靠小麦的自身调节系统来缓解,而当镉浓度太高超过小麦的耐受能力时,就会抑制小麦的生长。也有研究表明,镉对植物具有刺激性和抑制性,其中刺激效应可以加速植物的生长,低浓度的镉可能通过影响植物激素等而调节小麦的生长[17]。赵一莎等[18]研究得知镉对小麦生长胁迫的临界值在5 mg·kg-1附近,而本研究中发现当土壤中镉浓度大于20 mg·kg-1时,小麦有效穗数及各部位的生物量才显著降低,这可能与小麦品种不同有关。
光合作用对于作物的生长发育起着非常重要的作用,是作物干物质积累的基础,而过量的镉会干扰作物进行光合作用[19]。有研究表明,镉胁迫可以阻碍叶绿素的合成,从而抑制光合作用,所以植物体内的叶绿素含量可以用来衡量光合作用的强弱[20-21]。张利红等[22]研究发现,在0~0.25 mmol·L-1的镉处理中,小麦叶绿素含量会升高,在0.25 mmol·L-1浓度下达到最高值,随后逐渐降低。但本研究发现,在不同镉浓度下,小麦的SPAD值未显著降低,这与李子芳等[21]的研究结果相似。有研究显示镉的添加显著降低了小麦Pn、Tr和Gs值[23]。本研究发现在高浓度的镉处理下,小麦的Pn和Tr值会显著降低,其中Tr值的变化更明显,这说明扬麦13号叶片的蒸腾速率对镉胁迫更敏感。
镉的许多毒性都是与营养元素相互作用产生的,因此在很多作物中镉会对营养元素的吸收和积累产生干扰[24]。据报道,在1、2.5 mg·kg-1和5 mg·kg-1的镉浓度下,洋葱茎叶中的磷元素含量会增加[25]。而张国平等[26]研究表明,小麦对磷元素的积累受到镉的抑制。本研究发现,小麦茎、叶、壳中磷元素的含量与镉的污染水平有关,在较高的镉浓度下会显著降低,表明较高的镉污染会降低小麦中磷元素含量。其原因可能是根系周围过量的镉元素与磷产生的拮抗作用减少了根系对磷的吸收,导致小麦茎、叶、壳中的磷含量降低。但磷作为一种较易移动的元素,使得后期小麦籽粒中的磷含量变化较小。
镉具有较强的潜在危害,可以在不对作物造成严重危害的情况下使作物组织内积累大量的镉元素,且镉在小麦不同组织中的吸收和积累会反映小麦对镉毒害的耐受能力[27-28]。有大量研究表明,小麦组织中的镉含量会随着镉浓度的增加而增大,且镉在小麦各部位的积累量符合以下规律:根>茎>叶>籽粒[29]。本研究得到相似的结果,即小麦各部位的镉含量随着土壤镉浓度的增加而显著增大。图 3表明当镉浓度过大时(>20 mg·kg-1),小麦各部位中的镉含量急剧增大。就食用部分而言,镉含量远远超出了GB 2762—2017中规定的食品中镉限量(0.2 mg·kg-1),这一结果同时表现在图 4中。图 4表明,即使在低浓度外源镉的情况下,THQ值也大于1,表现出了明显的健康风险,且在相同的镉污染水平下,儿童会受到更大的风险。因此,尽管小麦生长在轻、中度镉污染的土壤中会因自身的调节机制抵御一定的镉毒害,但籽粒中的镉含量已经远超过国家规定的限量值,这大大增加了小麦镉污染对人体造成的风险。
4 结论(1)外源镉浓度≤20 mg·kg-1时,未显著影响小麦的生长速率、光合生理指标、有效穗数和小麦各部位的生物量,当镉浓度>20 mg·kg-1时,小麦生长速率、净光合速率、蒸腾速率和小麦各部位的生物量均显著下降。
(2)随着外源镉浓度的增加,小麦茎、叶和壳中的磷含量出现先增大后降低的趋势,不同浓度的外源镉均抑制了小麦籽粒中的磷含量。
(3)随着外源镉浓度的增加,小麦茎、叶、壳和籽粒中的镉含量显著增大。籽粒中镉的THQ值也随外源镉浓度的增加而增大,且儿童的THQ值大于成人,表明镉对儿童造成的健康风险更大。
| [1] |
Yousaf B, Liu G J, Wang R W, et al. Bioavailability evaluation, uptake of heavy metals and potential health risks via dietary exposure in urban-industrial areas[J]. Environmental Science & Pollution Research International, 2016, 23(22): 1-11. |
| [2] |
Huang Y Y, He C T, Shen C, et al. Toxicity of cadmium and its health risks from leafy vegetable consumption[J]. Food & Function, 2017, 8(4): 1373-1401. |
| [3] |
Dziubanek G, Baranowska R, Ćwielag D M, et al. Cadmium in edible plants from Silesia, Poland, and its implications for health risk in populations[J]. Ecotoxicology & Environmental Safety, 2017, 142: 8-13. |
| [4] |
Rehman M Z, Rizwan M, Ghafoor A, et al. Effect of inorganic amendments for in situ stabilization of cadmium in contaminated soils and its phyto-availability to wheat and rice under rotation[J]. Environmental Science & Pollution Research, 2015, 22(21): 16897-16906. |
| [5] |
沈凤斌. 含镉小麦再敲土壤污染警钟[J]. 生态经济, 2017, 33(9): 10-13. SHEN Feng-bin. Warning of soil pollution in cadmium containing wheat[J]. Ecological Economy, 2017, 33(9): 10-13. |
| [6] |
Ouzounidou G, Moustakas M, Eleftheriou E P. Physiological and ultrastructural effects of cadmium on wheat(Triticum aestivum L.)leaves[J]. Archives of Environmental Contamination & Toxicology, 1997, 32(2): 154-160. |
| [7] |
Yang Y M, Nan Z R, Zhao Z J. Bioaccumulation and translocation of cadmium in wheat(Triticum aestivum L)and maize(Zea mays L)from the polluted oasis soil of northwestern China[J]. Chemical Speciation & Bioavailability, 2014, 26(1): 43-51. |
| [8] |
Liu Z P, Ding Y F, Wang F J, et al. Role of salicylic acid in resistance to cadmium stress in plants[J]. Plant Cell Reports, 2016, 35(4): 719-731. DOI:10.1007/s00299-015-1925-3 |
| [9] |
朱志勇, 郝玉芬, 吴金芝, 等. 镉胁迫对不同小麦品种幼苗生长以及Cd2+、Zn2+、Mn2+吸收和积累的影响[J]. 水土保持学报, 2011, 25(2): 209-213. ZHU Zhi-yong, HAO Yu-fen, WU Jin-zhi, et al. Effects of Cd2+ stress on the seedling growth, Cd2+, Zn2+ and Mn2+ uptake of different wheat cultivars[J]. Journal of Soil and Water Conservation, 2011, 25(2): 209-213. |
| [10] |
陈勇.水稻、小麦籽实与土壤Cd含量关系研究及安全利用评价——以X镇为例[D].武汉: 中国地质大学, 2017. CHEN Yong. The study on soil and rice and wheat seeds in Cd the relationship between dose effect and safe use evaluation in southern XX town as an example[D]. Wuhan: China University of Geosciences, 2017. http://cdmd.cnki.com.cn/Article/CDMD-11415-1017126615.htm |
| [11] |
Zhou H, Yang W T, Zhou X, et al. Accumulation of heavy metals in vegetable species planted in contaminated soils and the health risk assessment[J]. International Journal of Environmental Research & Public Health, 2016, 13(3): 289. |
| [12] |
马登玉. 扬麦13号的特征特性及其在水稻茬中高产栽培技术[J]. 现代农业科技, 2007(23): 145. MA Deng-yu. The characteristics of Yangmai 13 and its high yield cultivation techniques in rice stubble[J]. Xiandai Nongye Keji, 2007(23): 145. DOI:10.3969/j.issn.1007-5739.2007.23.100 |
| [13] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000. LU Ru-kun. Method of soil agricultural chemical analysis[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [14] |
肖玉, 成升魁, 谢高地, 等. 我国主要粮食品种供给与消费平衡分析[J]. 自然资源学报, 2017, 32(6): 927-936. XIAO Yu, CHENG Sheng-kui, XIE Gao-di, et al. The balance between supply and consumption of the main types of grain in China[J]. Journal of Natural Resources, 2017, 32(6): 927-936. |
| [15] |
Chen L, Long X H, Zheng Z H, et al. Cadmium accumulation and translocation in two jerusalem artichoke(Helianthus tuberosus L.)cultivars[J]. Pedosphere, 2011, 21(5): 573-580. DOI:10.1016/S1002-0160(11)60159-8 |
| [16] |
He S Y, Yang X E, He Z L, et al. Morphological and physiological responses of plants to cadmium toxicity: A review[J]. Pedosphere, 2017, 27(3): 421-438. DOI:10.1016/S1002-0160(17)60339-4 |
| [17] |
Nyitrai P, Bóka K, Gáspár L, et al. Rejuvenation of ageing bean leaves under the effect of low-dose stressors[J]. Plant Biology, 2004, 6(6): 708-714. DOI:10.1055/s-2004-830385 |
| [18] |
赵一莎, 刘冲, 李虎, 等. Cd胁迫黄土中施用污泥对小麦生长的影响及吸收Cd的效应[J]. 兰州大学学报(自然版), 2016, 52(1): 51-55. ZHAO Yi-sha, LIU Chong, LI Hu, et al. Effect of application of sewage sludge on the growth of wheat and absorption of Cd under Cd stress in loess[J]. Journal of Lanzhou University(Natural Edition), 2016, 52(1): 51-55. |
| [19] |
张其德, 蒋高明, 朱新广, 等. 12个不同基因型冬小麦的光合能力[J]. 植物生态学报, 2001, 25(5): 532-536. ZHANG Qi-de, JIANG Gao-ming, ZHU Xin-guang, et al. Photosynthetic capability of 12 genotypes of Triticum aestivum[J]. Chinese Journal of Plant Ecology, 2001, 25(5): 532-536. DOI:10.3321/j.issn:1005-264X.2001.05.005 |
| [20] |
慈敦伟, 姜东, 戴廷波, 等. 镉毒害对小麦幼苗光合及叶绿素荧光特性的影响[J]. 麦类作物学报, 2005, 25(5): 88-91. CI Dun-wei, JIANG Dong, DAI Ting-bo, et al. Effect of Cd toxicity on photosynthesis and chlorophyll fluorescence of wheat seedling[J]. Journal of Triticeae Crops, 2005, 25(5): 88-91. DOI:10.3969/j.issn.1009-1041.2005.05.019 |
| [21] |
李子芳, 刘惠芬, 熊肖霞, 等. 镉胁迫对小麦种子萌发幼苗生长及生理生化特性的影响[J]. 农业环境科学学报, 2005, 24(增刊): 17-20. LI Zi-fang, LIU Hui-fen, XIONG Xiao-xia, et al. Effect of cadmium on seed germination, seeding development and physiological and biochemical characteristics of wheat[J]. Journal of Agro-Environmental Science, 2005, 24(Suppl): 17-20. |
| [22] |
张利红, 李培军, 李雪梅, 等. 镉胁迫对小麦幼苗生长及生理特性的影响[J]. 生态学杂志, 2005, 24(4): 458-460. ZHANG Li-hong, LI Pei-jun, LI Xue-mei, et al. Effects of cadmium stress on growth and physiological characteristics of wheat seedlings[J]. Chinese Journal of Ecology, 2005, 24(4): 458-460. DOI:10.3321/j.issn:1000-4890.2005.04.023 |
| [23] |
曹莹, 段萌, 刘玉莲, 等. 镉胁迫下铵态氮对春小麦光合生理特性的影响[J]. 生态环境学报, 2011, 20(2): 359-363. CAO Ying, DUAN Meng, LIU Yu-lian, et al. Effects of NH4+-N on photosynthetic characteristics of spring wheat plant under cadmium[J]. Ecology and Environmental Sciences, 2011, 20(2): 359-363. DOI:10.3969/j.issn.1674-5906.2011.02.026 |
| [24] |
陈京都, 何理, 许轲, 等. 镉胁迫对不同基因型水稻生长及矿质营养元素吸收的影响[J]. 生态学杂志, 2013, 32(12): 3219-3225. CHEN Jing-du, HE Li, XU Ke, et al. Growth and nutritional element absorption of different rice genotypes under cadmium stress[J]. Chinese Journal of Ecology, 2013, 32(12): 3219-3225. |
| [25] |
Li X H, Zhou Q X, Sun X Y, et al. Effects of cadmium on uptake and translocation of nutrient elements in different Welsh onion(Allium fistulosum L.)cultivars[J]. Food Chemistry, 2016, 194: 101-110. DOI:10.1016/j.foodchem.2015.07.114 |
| [26] |
张国平, 深见元弘, 关本根. 不同镉水平下小麦对镉及矿质养分吸收和积累的品种间差异[J]. 应用生态学报, 2002, 13(4): 454-458. ZHANG Guo-ping, SHENJIAN Yuan-hong, GUAN Ben-gen. Difference between two wheat cultivars in Cd and mineral nutrient uptake under different Cd levels[J]. Chinese Journal of Applied Ecology, 2002, 13(4): 454-458. DOI:10.3321/j.issn:1001-9332.2002.04.017 |
| [27] |
张兴梅, 杨清伟, 李杨. 土壤镉污染现状及修复研究进展[J]. 河北农业科学, 2010, 14(3): 79-81. ZHANG Xing-mei, YANG Qing-wei, LI Yang. Progress of status and remediation of soil cadmium pollution[J]. Journal of Hebei Agricultural Science, 2010, 14(3): 79-81. DOI:10.3969/j.issn.1088-1631.2010.03.030 |
| [28] |
Rizwan M, Ali S, Abbas T, et al. Cadmium minimization in wheat: A critical review[J]. Ecotoxicology & Environmental Safety, 2016, 130: 43-53. |
| [29] |
姜丽娜, 邵云, 李春喜, 等. 镉在小麦植株体内的吸收、分配和累积规律研究[J]. 河南农业科学, 2004, 33(7): 13-17. JIANG Li-na, SHAO Yun, LI Chun-xi, et al. Studies on uptake, distribution and accumulation of Cd in wheat plant[J]. Henan Agricultural Science, 2004, 33(7): 13-17. DOI:10.3969/j.issn.1004-3268.2004.07.004 |
 2019, Vol. 36
2019, Vol. 36