镉(Cd)是一种高毒的重金属,是我国农田污染最为广泛和农作物中超标最为严重的重金属元素[1]。由于土壤重金属污染具有累积性、隐蔽性、滞后性和不可逆转等特点,可随食物链迁移至人体并累积,进而威胁人类健康[2]。植物修复是一种很有前景的土壤重金属修复方法,具有环保、廉价、易操作等传统方法难以比拟的优势,但是它也有一些局限性,其修复周期长,受地域因素限制,阻碍了大规模实际应用的推进,因而寻找合适的修复植物并探究其对重金属吸收规律及其耐性机制成为当前研究的重点和热点[3-4]。许多学者围绕修复植物体内重金属Cd在亚细胞水平上的分布特征做了大量的研究工作[5-9]。史静等[5]证明水稻根系非蛋白硫基(NPT)含量随着Cd浓度的增加显著增加。张海利等[6]发现Cd超富集植物龙葵根部亚细胞中Cd主要分布在细胞壁中。方继宇等[7]研究发现马缨丹根和叶细胞中Cd主要分布在可溶性组分中,其次是细胞壁。这些研究结果表明,细胞壁沉积和液泡区室化也是重要的耐性机理之一。
曼陀罗(Datura stramonium L.),属茄科曼陀罗属一年生植物,广泛分布于温带至热带地区的喜暖、向阳及排水良好的砂质壤土[10]。曼陀罗生长迅速,生物量大、适应性强,具有一定的经济效益,可作为Cd污染土壤的修复植物[11]。董林林等[12]研究表明,当介质中Cd浓度达100 mg·kg-1时,曼陀罗地上部分富集系数可达1.15。张彪等[13]研究表明在污染企业周边的34种植物中曼陀罗具备植物修复的潜在能力,曼陀罗地上部Cd含量达到26.17 mg·kg-1,地上部生物量达到273.63 g。杨海涛等[14]研究表明曼陀罗对Cd具有很强的耐性,0.5 mg·kg-1浓度处理下曼陀罗生物量甚至略有增加。根系是Cd2+直接接触的部位,有研究表明,高积累型东南景天的根系Cd2+流速显著高于低积累型[15],说明根系吸收Cd2+的流速与植株Cd累积有着必然的联系。利用非损伤微测技术(Non-invasive micro-test technology,NMT)可以在不损伤根系的情况下直接测量进出根系的Cd2+通量,直观地反映根系吸收Cd2+的状况。有研究表明在距小麦根尖不同距离测量的Cd2+流速有显著的差异,Cd/Zn超富集植物伴矿景天也有类似趋势[16-17]。然而相关研究在曼陀罗根系如何吸收、转运Cd等方面探究较少,耐Cd机理尚不明确。鉴于此,本研究通过测定Cd胁迫下曼陀罗根表面不同位置上Cd的流速特征,分析Cd在曼陀罗体内的亚细胞分布,探究曼陀罗对Cd的吸收规律及其耐Cd机制,以期为该植物在土壤重金属污染修复方面的应用提供理论依据。
1 材料与方法 1.1 供试植物与前期育苗供试植物为野生曼陀罗,其种子采自豫西某铅锌冶炼厂周边污染土壤。
首先对曼陀罗种子进行预处理以促进发芽,选择颗粒饱满均一的种子用5% NaClO溶液消毒30 min,用去离子水洗净,之后用10% NaOH处理90 min以打破休眠[18]。处理后的种子播于装满石英砂的塑料盆中,每盆播种30粒,置于黑暗处催芽,幼苗在河南农业大学资源与环境学院土壤修复工程实验室光照培养室内培养至6~7片叶。
1.2 试验设计试验采用水培的方式进行。设置两个处理,Cd浓度分别为0.1 mg·L-1(对照处理,记为CK)和2.5 mg·L-1(胁迫处理,记为TR)。采用CdCl2为Cd源。挑选长势一致的曼陀罗幼苗放置在水培箱中,用改良Hoagland营养液(pH 6.5)进行培养,两周后施加Cd处理,每3 d更换一次营养液,每日光照16 h,光照强度保持在350~400 mmol·m-2·s-1,温度保持在白天25 ℃、夜晚19 ℃,连续通气,Cd处理培养12 d后收取样品。
1.3 测试指标与方法 1.3.1 各部位Cd2+含量的测定取样时,幼苗用清水洗净,将根系浸泡在20 mmol· L-1 Na2-EDTA中10 min,解吸根系表面附着的Cd2+,去离子水冲洗干净。称取0.50 g植株干样,用HNO3: HClO4 = 4:1混酸消解,原子吸收分光光度计(AAS ZEEnit700)测定Cd含量。
本研究中镉迁移系数(Transfer factor,TF)代表其在植物各部位的迁移程度。计算公式为:
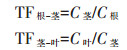
|
式中:C根、C茎、C叶分别代表根、茎和叶中Cd的含量。
1.3.2 Cd2+流速的测定根系表面不同位置的Cd2+流速采用非损伤微测技术进行测定。首先,微电极在5、50 μmol·L-1的校正液中进行校正,微电极符合使用标准[19]。
为减少根部差异引起的误差,挑选长势一致的新生根进行测定。根系放在含测试液的培养皿中平衡10 min,然后置于显微操作台,将微电极探近至根表面不同区域处进行Cd2+流速的测定。使用Ifluxes/Imfluxes软件用于离子流数据的获取,然后用附属于非损伤微测系统的Mage-Flux软件将离子流数据转换为流速(pmol·cm-2·s-1)[20-21]。
1.3.3 亚细胞中Cd浓度的测定采用差速离心法分离不同的细胞组分。分别称取曼陀罗鲜样(根、茎、叶)各0.50 g置于研钵中,加20 mL提取液(0.25 mol·L-1蔗糖、50 mmol·L-1 Tris-HCl缓冲液和1 mmol·L-1二硫赤鲜糖醇),研磨至匀浆。匀浆在冷冻离心机3000 g下离心15 min,沉淀(F1)主要为细胞壁组分。上清液在12 000 g下继续离心30 min,沉淀(F2)主要为细胞器组分,剩余上清液组分(F3)主要包括细胞质及液泡等胞液[5],试验操作过程均在4 ℃下进行。F1和F2组分使用HNO3-HClO4消解后测定Cd浓度;F3组分直接稀释测定。
1.4 数据分析使用SPSS 20.0软件完成统计分析,数据处理采用单因素ANOVA,然后利用Duncan法进行多重比较(α = 0.05),用Origin进行数据分析制图。
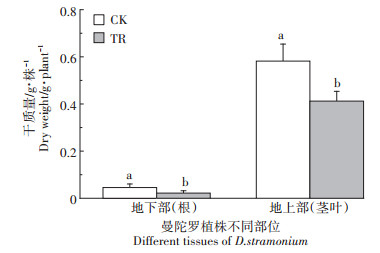
2 结果与分析 2.1 各部位生物量及Cd2+的含量图 1显示的Cd胁迫下曼陀罗的生物量。对照处理的样品其生物量在地上部与地下部均大于胁迫处理,且差异达到显著水平(P < 0.05)。由此说明,Cd胁迫下植株各部位生物量均受到抑制作用。
|
不同小写字母表示同一部位不同处理间存在显著差异(P < 0.05)。下同 Different lowercase letters mean significant differences between treatments in the same part. The same below 图 1 Cd处理下曼陀罗的生物量 Figure 1 Biomass of D. stramonium in Cd treatments |
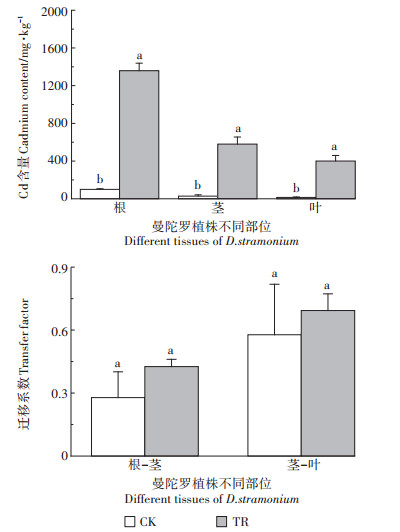
当介质中Cd浓度为2.5 mg·L-1时,曼陀罗各部位Cd含量显著增加,根到茎、茎到叶的迁移系数均增大,但与对照处理相比差异未达到显著水平(图 2)。胁迫后的曼陀罗各部位Cd含量显著大于对照(P < 0.05)。无论是CK还是TR处理,各部位Cd含量大小都表现为根 > 茎 > 叶。
|
图 2 镉在曼陀罗各部位的含量及其迁移 Figure 2 The concentration of Cd and transfer to different parts of D. stramonium |
从图 3可知,根系不同部位的Cd2+流速存在显著差异。根系的Cd2+流速均是负值,代表根系对Cd2+的吸收作用。对照处理下根冠区Cd2+流速仅为2 pmol· cm-2·s-1,但在分生区Cd2+流速达到最大值后,伸长区流速有所降低,至成熟区后流速进一步降低。与对照处理不同,胁迫处理下伸长区流速大于分生区。

|
图 3 曼陀罗根系各部位的Cd2+流速 Figure 3 Flux of Cd2+ at root system of D. stramonium |
对照和胁迫处理下根冠区和成熟区对Cd2+的吸收没有明显差异,且Cd2+流速均较低;相比根系其他部位,对照处理下分生区Cd2+流速较大,而胁迫处理下分生区和伸长区Cd2+流速均较大。由此判断,无论低浓度还是高浓度Cd条件下,曼陀罗根系吸收Cd2+主要集中在分生区和伸长区。
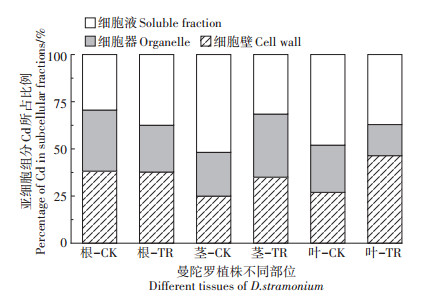
2.3 亚细胞中Cd的分布状况细胞壁和细胞液中Cd占比之和高于细胞器(图 4)。叶片和根的亚细胞各组分Cd含量均大于茎,其中对照处理下,根系亚细胞各组分Cd含量最多,其次是叶、茎;而胁迫处理下,曼陀罗叶片的细胞壁和细胞液中Cd占比最多,其次是根、茎,而叶片细胞壁和细胞液中Cd含量均显著高于细胞器。这说明在高浓度Cd胁迫下根系生长严重受阻,Cd向茎叶中转移,导致茎和叶中Cd含量增多。对照处理下,根细胞壁Cd占比最多,占39%;茎的细胞液含Cd最多,占比52%,细胞器和细胞壁Cd含量无显著差异;叶片细胞液Cd含量显著高于细胞壁和细胞器。胁迫处理下,根部和茎部亚细胞各组分Cd含量无显著差异,而叶中Cd向细胞壁转移,Cd含量显著高于细胞器。据此分析,各部位的Cd含量均在细胞壁和细胞液组分中配比最高,其所占比例在亚细胞组分中占65%以上。
|
图 4 曼陀罗各部位亚细胞组分Cd所占比例 Figure 4 Proportion of Cd in subcellular fractions among different parts of D. stramonium |
生物量可直观显示植株对Cd胁迫的响应(图 1)。地上部和根部生物量在高浓度Cd胁迫下显著减少,这说明曼陀罗生长受到了Cd的抑制作用,且在高浓度Cd胁迫下这种抑制作用尤为明显。这与很多作物的研究结果相一致,如水稻、小麦、玉米等[5,22-23],相关研究都证实了作物在高浓度Cd的胁迫下,体内积累的Cd达到一定程度时会造成植株生长受到显著抑制,影响了某些功能细胞的正常运转,说明Cd在植株和细胞两个层次都产生毒害作用。
曼陀罗各部位Cd含量依次为根 > 茎 > 叶(图 2)。当Cd浓度为2.5 mg·L-1时,这一趋势并未改变,根到茎、茎到叶的迁移系数虽有所增大,但与对照处理的差异未达到显著水平。这表明无论是低浓度还是高浓度Cd条件下,根部对Cd的滞留作用均较大,抑制其向地上部的运输,减少了Cd对地上部的毒害。这与杨海涛等[14]的研究一致,当外界Cd浓度较低时,曼陀罗主要通过根部滞留来限制Cd向地上部分的转运,缓解Cd的毒害。其他修复植物的研究也可佐证这一耐性机制,修复植物马缨丹随着外界Cd浓度的增大,其各部位中Cd含量为根 > 茎 > 叶,且迁移系数小于1,表明根部对Cd的滞留作用较大,抑制了Cd向地上部转运[7]。但是在实际应用中,也有学者证实在Cd污染企业周边的曼陀罗体内Cd的含量表现出叶 > 茎 > 根这一分布规律[24]。这一差异的出现可能是因为曼陀罗在后期生长过程中其转移系数增大,随着Cd胁迫时间的增加,根部向地上部转移增加,此时Cd转移至地上部叶片中储存。
3.2 Cd胁迫对根系各区域Cd2+流速的影响植物为了维持正常的生长发育,需要从土壤中吸收营养元素,但是一些有毒重金属元素(如Cd)也进入了植株体内,对植物造成伤害[25]。根系吸收营养和水分这一过程中,根尖是最活跃的部位[26]。有研究报道利用非损伤微测技术可以实时测量离子流速,例如Ca2+、Na+和K+[27-29],也可在不伤害根尖细胞的情况下测定其吸收Cd2+的流速,直观地反映出根尖各部位细胞主动吸收离子的能力[30]。本研究中,曼陀罗根系分生区和伸长区吸收Cd2+的能力最强,显著高于其他部位(图 3)。分生区、伸长区具有较强的细胞分裂能力,细胞代谢较快,因此在相同时间内吸收Cd2+较多;成熟区细胞分裂已经减缓、代谢减弱,所以对Cd2+的吸收开始下降。对水稻的研究也证实了伸长区的Cd2+流速明显大于根部其他区域[19-20]。对遏蓝菜和小麦的研究结果也显示分生区至伸长区的Cd2+流速最大[21]。Cd/Zn超富集植物伴矿景天的根系Cd2+流速测量结果也表明,不同根区的Cd2+吸收速率有显著的差异[17]。当介质中Cd浓度由0.1 mg·L-1升至2.5 mg·L-1时,根系各部位Cd2+流速都有所增加,其中分生区和伸长区增长显著。这说明无论介质中Cd浓度大小,根部分生区和伸长区都是Cd进入曼陀罗根系的主要位置(图 3)。许多研究证实伸长区是根部Cd吸收速率较大的区域[15,20,30],考虑到本研究曼陀罗体内Cd由根系向茎的转运系数并未显著改变(图 2),说明曼陀罗幼苗通过分生区和伸长区吸收的Cd2+向上进一步转运的比例未明显增长,这可能是曼陀罗幼苗耐Cd的机制之一。
3.3 Cd胁迫对Cd在曼陀罗各部位亚细胞分布的影响细胞壁是Cd2+进入细胞的第一道屏障。有研究表明细胞壁中含有多种纤维素、半纤维素、果胶、多糖分子和蛋白质分子,其含有大量的羧基、羟基和氨基酸残基,可与重金属结合生成活性很弱的络合物固化在细胞壁上,从而减少重金属毒害作用[8,31-32]。本研究发现Cd浓度由0.1 mg·L-1提高到2.5 mg·L-1,曼陀罗亚细胞各组分Cd含量显著升高,且叶中细胞壁组分显著提高(图 4)。
还有研究表明细胞区室化效应也是植物内部缓解Cd毒害的一种重要方式。当Cd2+通过细胞壁进入胞液时,可与胞液中的柠檬酸、植物络合素、金属硫蛋白、硝酸和苹果酸等相结合,形成一种活性很弱的螯合态,储存在胞液中阻止了Cd2+进入细胞器,避免造成细胞器损伤,甚至功能性缺失[9,33]。在其他的一些植物中也有相类似的耐性机理。例如在水稻中根系细胞壁Cd含量最大,其次为胞液[5],在龙葵中根部细胞壁Cd含量最高,其次是细胞液[6]。方继宇等[7]发现Cd在马缨丹根和叶细胞组分的分布中,可溶性组分的分配比例最高,其次为细胞壁。
曼陀罗叶细胞中Cd分布在细胞壁和细胞液中的比例达80%以上,当Cd浓度由0.1 mg·L-1提高到2.5 mg·L-1时,在根和叶中这种分配比例显著增大,而在细胞器的分配比例随之降低(图 4),表明细胞中Cd向细胞壁(固定效应)和细胞液(区室化效应)转移可能是曼陀罗细胞耐Cd机制之一。当外界Cd浓度升高为2.5 mg·L-1、细胞壁吸附Cd达到饱和时,细胞液对Cd的络合作用增强,这种表现在根中尤为明显。因此,Cd在曼陀罗细胞中的耐Cd机制是通过细胞壁和细胞液对Cd的固定、络合、再分配以达到缓解Cd对细胞产生的毒害,从而增强曼陀罗的耐Cd能力。
4 结论(1)曼陀罗对Cd2+吸收的位置主要集中在根系分生区和伸长区。随介质中Cd浓度的增大,Cd由根系向地上部转移,但转运能力并未显著增强。
(2)低Cd条件下的亚细胞分布特征表明根部细胞壁对Cd的固定和茎叶中细胞液对Cd的区室化作用是曼陀罗耐Cd的重要机制。
(3)高Cd条件下根部细胞液组分增大,而叶细胞中细胞壁对Cd的固定作用更加明显,这可能是曼陀罗耐Cd的主要原因。
| [1] |
倪中应, 谢国雄, 章明奎. 镉污染农田土壤修复技术研究进展[J]. 安徽农学通报, 2017, 23(6): 115-120. NI Zhong-ying, XIE Guo-xiong, ZHANG Ming-kui. Research progress on remediation technology of cadmium-contaminated agricultural soils[J]. Anhui Agricultural Science Bulletin, 2017, 23(6): 115-120. |
| [2] |
姜洋, 罗远恒, 顾雪元. 农田土壤镉污染的原位钝化修复及持久性研究[J]. 南京大学学报(自然科学), 2017, 53(2): 265-274. JIANG Yang, LUO Yuan-heng, GU Xue-yuan. In situ immobilization of cadmium in soil and persistence study[J]. Journal of Nanjing University(Natural Science), 2017, 53(2): 265-274. |
| [3] |
樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10): 1727-1736. FAN Ting, YE Wen-ling, CHEN Hai-yan, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environmental Sciences, 2013, 22(10): 1727-1736. DOI:10.3969/j.issn.1674-5906.2013.10.015 |
| [4] |
郑黎明, 袁静. 重金属污染土壤植物修复技术及其强化措施[J]. 环境科技, 2017, 30(1): 75-78. ZHENG Li-ming, YUAN Jing. Phytoremediation of soils contaminated by heavy metals and strengthening measures[J]. Environmental Science and Technology, 2017, 30(1): 75-78. DOI:10.3969/j.issn.1674-4829.2017.01.018 |
| [5] |
史静, 潘根兴. 外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响[J]. 生态环境学报, 2015, 24(5): 853-859. SHI Jing, PAN Gen-xing. Effects of Cd-spiking treatment on Cd accumulation, subcellular distribution and content of nonprotein thiols in rice[J]. Ecology and Environmental Sciences, 2015, 24(5): 853-859. |
| [6] |
张海利, 王涛, 邹路易, 等. 铜绿假单胞菌对龙葵中Cd的亚细胞分布和化学形态的影响[J]. 农业环境科学学报, 2018, 37(8): 1602-1609. ZHANG Hai-li, WANG Tao, ZOU Lu-yi, et al. Effects of Pseudomonas aeruginosa on subcellular distribution and chemical speciation of Cd in Solanum nigrum[J]. Journal of Agro-Environment Science, 2018, 37(8): 1602-1609. |
| [7] |
方继宇, 贾永霞, 张春梅, 等. 马缨丹对镉的生长响应及其富集、转运和亚细胞分布特点研究[J]. 生态环境学报, 2014, 23(10): 1677-1682. FANG Ji-yu, JIA Yong-xia, ZHANG Chun-mei, et al. Effects of cadmium on growth response of Lantana camara L. and its accumulation, translocation and subcellular distribution of Cd[J]. Ecology and Environmental Sciences, 2014, 23(10): 1677-1682. DOI:10.3969/j.issn.1674-5906.2014.10.017 |
| [8] |
Fu X P, Dou C M, Chen Y X, et al. Subcellular distribution and chemical forms of cadmium in Phytolacca americana L[J]. Journal of Hazardous Materials, 2011, 186(1): 103-107. DOI:10.1016/j.jhazmat.2010.10.122 |
| [9] |
Lai H Y. Subcellular distribution and chemical forms of cadmium in Impatiens walleriana in relation to its phytoextraction potential[J]. Chemosphere, 2015, 138: 370-376. DOI:10.1016/j.chemosphere.2015.06.047 |
| [10] |
苏玉彤, 李明英, 张娟, 等. 曼陀罗的栽培管理[J]. 特种经济动植物, 2015(3): 41-42. SU Yu-tong, LI Ming-ying, ZHANG Juan, et al. Cultivation and management of Datura stramonium L[J]. Special Economic Animal and Plant, 2015(3): 41-42. DOI:10.3969/j.issn.1001-4713.2015.03.019 |
| [11] |
杨珍平, 郝教敏, 卜玉山, 等. Cd胁迫对5种植物体内Cd积累及根际土壤特性的影响[J]. 水土保持学报, 2011, 25(6): 186-192. YANG Zhen-ping, HAO Jiao-min, BO Yu-shan, et al. Effects of Cd stress on Cd accumulation in organs and rhizospheric soil characteristics with five plants[J]. Journal of Soil and Water Conservation, 2011, 25(6): 186-192. |
| [12] |
董林林, 赵先贵, 韦良焕. 曼陀罗和苍耳对污染土壤中镉的吸收与富集[J]. 生物技术, 2009, 19(2): 29-32. DONG Lin-lin, ZHAO Xian-gui, WEI Liang-huan. Sorption and accumulation of cadmium in the polluted soil of Datura stramonium and Xanthium sibiricum[J]. Biotechnology, 2009, 19(2): 29-32. |
| [13] |
张彪, 杨海涛, 周志云, 等. 铅锌冶炼厂周边野生植物调查及铅镉携带量研究[J]. 江西农业学报, 2015, 27(5): 111-115. ZHANG Biao, YANG Hai-tao, ZHOU Zhi-yun, et al. Investigation on wild plants and lead cadmium carrying volume around a lead-zinc smelting plant[J]. Acta Agriculturae Jiangxi, 2015, 27(5): 111-115. DOI:10.3969/j.issn.1001-8581.2015.05.026 |
| [14] |
杨海涛, 张彪, 杨素勤, 等. 镉胁迫对苗期曼陀罗生长及镉富集的影响[J]. 江苏农业科学, 2015, 43(10): 309-311. YANG Hai-tao, ZHANG Biao, YANG Su-qin, et al. Effects of cadmium on growth and accumulation of Datura stramonium in seedling stage[J]. Jiangsu Agricultural Sciences, 2015, 43(10): 309-311. |
| [15] |
Sun J, Wang R, Liu Z, et al. Non-invasive microelectrode cadmium flux measurements reveal the spatial characteristics and real-time kinetics of cadmium transport in hyperaccumulator and nonhyperaccumulator ecotypes of Sedum alfredii[J]. Journal of Plant Physiology, 2013, 170(3): 355-359. DOI:10.1016/j.jplph.2012.10.014 |
| [16] |
Li L Z, Tu C, Peijnenburg W J G M, et al. Characteristics of cadmium uptake and membrane transport in roots of intact wheat(Triticum aestivum L.)seedlings[J]. Environmental Pollution, 2017, 221: 351-358. DOI:10.1016/j.envpol.2016.11.085 |
| [17] |
Li L Z, Tu C, Wu L H, et al. Pathways of root uptake and membrane transport of Cd2+ in the zinc/cadmium hyperaccumulating plant Sedum plumbizincicola[J]. Environmental Toxicology and Chemistry, 2017, 36(4): 1038-1046. DOI:10.1002/etc.v36.4 |
| [18] |
慕小倩, 史雷, 赵云青, 等. 曼陀罗种子休眠机理与破眠方法研究[J]. 西北植物学报, 2011, 31(4): 683-689. MU Xiao-qian, SHI Lei, ZHAO Yun-qing, et al. Seed dormancy mechanism and dormancy breaking methods of Datura stramonium L[J]. Acta Botanica Boreali - Occidentalia Sinica, 2011, 31(4): 683-689. |
| [19] |
Li L, Liu X, Peijnenburg W J G M, et al. Pathways of cadmium fluxes in the root of the halophyte Suaeda salsa[J]. Ecotoxicology Environmental Safety, 2012, 75(1): 1-7. |
| [20] |
韩立娜, 居学海, 张长波, 等. 水稻镉离子流速的基因型差异及其与镉积累量的关系研究[J]. 农业环境科学学报, 2014, 33(1): 37-42. HAN Li-na, JU Xue-hai, ZHANG Chang-bo, et al. Genotypic variation of Cd2+ flux and its relationship with Cd accumulation in rice plant[J]. Journal of Agro-Environment Science, 2014, 33(1): 37-42. |
| [21] |
Piñeros M A, Shaff J E, Kochian L V. Development, characterization, and application of a cadmium-selective microelectrode for the measurement of cadmium fluxes in roots of Thlaspi species and wheat[J]. Plant Physiology, 1998, 116(4): 1393-1401. DOI:10.1104/pp.116.4.1393 |
| [22] |
刘凤, 魏雨蒙, 刘霜平, 等. 镉胁迫对小麦生长和生理特性的影响[J]. 山东化工, 2017, 46(3): 24-26. LIU Feng, WEI Yu-meng, LIU Shuang-ping, et al. Effect of cadmium stress on seedlings growth and physiological characteristics of wheat[J]. Shandong Chemical Industry, 2017, 46(3): 24-26. DOI:10.3969/j.issn.1008-021X.2017.03.009 |
| [23] |
惠俊爱, 党志. 土壤不同镉浓度对玉米CT38生长及抗氧化酶活性的影响[J]. 生态环境学报, 2014, 23(5): 884-889. HUI Jun-ai, DANG Zhi. Effects of different cadmium concentrations in soil on growth and antioxidant enzyme activities of maize CT38[J]. Ecology and Environmental Sciences, 2014, 23(5): 884-889. DOI:10.3969/j.issn.1674-5906.2014.05.024 |
| [24] |
杨海涛, 卢炳坤, 苗利娟, 等. 野生曼陀罗生态学特性及镉铅携带量的研究[J]. 西南农业学报, 2016, 29(2): 413-419. YANG Hai-tao, LU Bing-kun, MIAO Li-juan, et al. Study on ecological characteristics and capacity of carrying cadmium and lead in wild Datura stramonium[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(2): 413-419. |
| [25] |
Clemens S. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants[J]. Biochimie, 2006, 88(11): 1707-1719. DOI:10.1016/j.biochi.2006.07.003 |
| [26] |
Jungk A. Root hairs and the acquisition of plant nutrients from soil[J]. Journal of Plant Nutrition and Soil Science, 2015, 164(2): 121-129. |
| [27] |
Wang Y H, Chen T, Zhang C Y, et al. Nitric oxide modulates the influx of extracellular Ca2+ and actin filament organization during cell wall construction in Pinus bungeana pollen tubes[J]. New Phytologist, 2009, 182(4): 851-862. DOI:10.1111/j.1469-8137.2009.02820.x |
| [28] |
Sun J, Dai S X, Wang R G, et al. Calcium mediates root K+/Na+ homeostasis in poplar species differing in salt tolerance[J]. Tree Physiology, 2009, 29(9): 1175-1186. DOI:10.1093/treephys/tpp048 |
| [29] |
Ma W W, Xu W Z, Xu H, et al. Nitric oxide modulates cadmium influx during cadmium-induced programmed cell death in tobacco BY- 2 cells[J]. Planta, 2010, 232(2): 325-335. DOI:10.1007/s00425-010-1177-y |
| [30] |
贾代东, 刘爱琴, 李惠通, 等. 非损伤微测技术在植物生理生态学研究中的应用进展[J]. 应用与环境生物学报, 2017, 23(1): 175-182. JIA Dai-dong, LIU Ai-qin, LI Hui-tong, et al. Applications and advances of non-invasive micro-test technology in plant physiologicalecology research[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(1): 175-182. |
| [31] |
Wójcik M, Vangronsveld J, D'Haen J, et al. Cadmium tolerance in Thlaspi caerulescens:Ⅱ. Localization of cadmium in Thlaspi caerulescens[J]. Environmental and Experimental Botany,, 2005, 53(2): 163-171. |
| [32] |
Allan D L, Jarrell W M. Proton and copper adsorption to maize and soybean root cell walls[J]. Plant Physiology, 1989, 89(3): 823-832. DOI:10.1104/pp.89.3.823 |
| [33] |
杨居荣, 黄翌. 植物对重金属的耐性机理[J]. 生态学杂志, 1994, 13(6): 20-26. YANG Ju-rong, HUANG Yi. Mechanism of heavy metal tolerance of plants[J]. Chinese Journal of Ecology, 1994, 13(6): 20-26. DOI:10.3321/j.issn:1000-4890.1994.06.012 |
 2019, Vol. 36
2019, Vol. 36


