2. 山西省农业科学院农业环境与资源研究所, 太原 030031
2. Institute of Agricultural Environment and Resources, Shanxi Academy of Agricultural Sciences, Taiyuan 030031, China
矿区新复垦土壤具有有机质含量低、微生物活性差的特点,豆科植物可以作为先锋植物来提高土壤的肥力[1-4]。土壤微生物是维持土壤活性的重要组成部分,参与有机质分解、养分转化和循环等多种生化过程,其多样性是评价土壤质量的重要生物学指标[5]。因此,从植物种植的角度出发,比较不同植物种植下土壤微生物多样性的变化特点,对于揭示矿区土壤质量演变的机制和定向培育具有重要意义。
目前已有众多研究者研究了植物种植对土壤微生物的影响。孟庆杰等[6]发现东北黑土区自然恢复土壤微生物平均颜色变化率(AWCD)和Shannon多样性指数高于农田无肥处理;梁素钰等[7]发现开垦荒地种植橡胶树后土壤中的微生物多样性丰富度与种植前后差距不大;于镇华等[8]发现东北黑土区垦殖处理较自然恢复降低了土壤微生物群落对碳源的代谢能力。张轩[9]研究发现矿区种植大豆后,土壤中细菌、真菌、放线菌数量、Shannon多样性指数与碳利用丰富度指数均高于自然恢复区。综上所述,不同研究者在不同区域研究发现种植植物对土壤中微生物多样性的影响不尽相同。对于煤矿复垦区,不同植物种植下矿区复垦微生物多样性特点还不明确。因此,本研究以山西省农业科学院古交屯兰矿复垦试验基地为研究平台,研究种植植物后矿区复垦土壤微生物多样性特征,寻找影响矿区复垦土壤微生物代谢功能的关键碳源,以揭示植物种植对矿区复垦土壤微生物多样性的影响机制,旨在为研究区及类似地区复垦工作提供理论依据和指导。
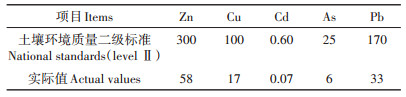
1 材料与方法 1.1 试验设计试验区位于山西省古交屯兰矿区,该区年平均气温为9.5 ℃,平均降水量460 mm,降水量集中在7、8月份,无霜期约105 d,为温带大陆性季风气候。2013年停止排矸后在矸石山填埋区进行了覆土,土壤以周围黄土丘陵区的马兰黄土为主,经一年时间的自然沉降后,测定发现复垦土壤中Cd、Pb、As等重金属含量(表 1)均低于国家土壤环境质量标准(GB 15618— 2018)二级限值(pH值> 7.5),说明该复垦土壤可以种植农作物。2014年5月下旬开始在矸石山覆土区进行植物种植,设置玉米(Maize,M)、大豆(Soybean,S)、毛苕子(Hair-vetch,H)、苜蓿(Alfalfa,A)及自然恢复(Natural-restoration,N)5种种植处理,每亩(667 m2)施肥量均为商品有机肥250 kg、缓控释复合肥20 kg。
|
|
表 1 试验区实际值与土壤环境质量标准比较(mg·kg-1) Table 1 Actual values in the test area and soil environmental quality standards(level Ⅱ)(mg·kg-1) |
在研究区降水量大、气温最高的7月份,即植物生长旺季,按照对角线法采集不同植物种植下的0~ 20 cm的土壤样品,每个处理三次重复,将采集的土样混合均匀,放入灭菌袋,密封后(4 ℃保温箱)带回室内,未能及时做微生物培养实验的土样放在-80 ℃冰箱冷冻保存。
1.2.2 实验方法(1) Biolog-ECO:称取10 g矿区土壤,放入已灭菌的装有90 mL浓度为0.85% NaCl的带玻璃珠的三角瓶中,在旋转式摇床上以250 r·min-1充分振荡30 min,连续两次10倍稀释后,在Biolog-ECO板的96个孔中加入150 μL土壤接种液,利用96个孔中的31种不同碳源,在28 ℃恒温培养箱中进行培养,每隔24 h利用Biolog分析仪读取各孔的AWCD吸光值,连续测一周,观测土壤微生物对不同碳源的动态利用变化。
(2) 16S rDNA高通量测序:由上海派森诺生物公司对矿区复垦土壤进行微生物组DNA提取、目标片段PCR扩增、产物回收纯化、荧光定量等,利用MiSeq测序仪对不同植物种植下矿区复垦土壤微生物V3~V4区OTU序列单元进行测定。
1.2.3 数据处理采用培养96 h的数据计算微生物群落的多样性指数,利用香农-维纳指数、优势度指数、均一度指数描述微生物群落多样性,计算方法参照杨永华等[10]的研究。利用Excel、SPSS和R软件等对所测数据进行整理、方差分析、主成分分析等。
2 结果与分析 2.1 不同植物种植下矿区复垦土壤微生物分类组成从表 2可知,不同植物种植下矿区复垦土壤微生物丰度在门水平上表现为大豆种植最高,苜蓿种植最少;纲、目、科水平上均为大豆最高,毛苕子最少;而在属、种水平上均表现为毛苕子种植最高,自然恢复最少。
|
|
表 2 不同植物种植下矿区复垦土壤微生物分类数量比较 Table 2 Microbial classification comparison in reclaimed soil under different plant cultivation |
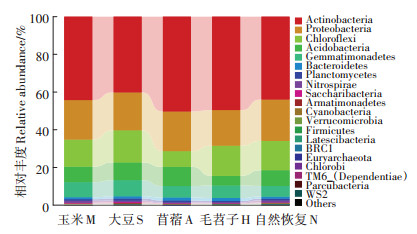
从图 1可以看出,不同植物种植下矿区复垦土壤微生物在门水平上丰度值较高的为放线菌门(Actinobacteria)、球形菌门(Protebacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和伽马菌门(Gemmatimonadetes)。从图 2可以看出,在属水平上丰度值较高的为假节杆菌属(Pseudarthrobacter)、芽球菌属(Blastococcus)、气微菌属(Aeromicrobium)、鞘氨醇单胞菌属(Sphingomonas)、类诺卡式属(Nocardioides)、Lamia 属、分枝杆菌属(Mycobacterium)、链霉菌属(Streptomyces)。
|
图 1 不同植物种植下矿区复垦土壤微生物门分类 Figure 1 Microbial phylum classification in reclaimed soil under different plant cultivation |

|
图 2 不同植物种植下矿区复垦土壤微生物属分类 Figure 2 Microbial genus classification in reclaimed soil under different plant cultivation |
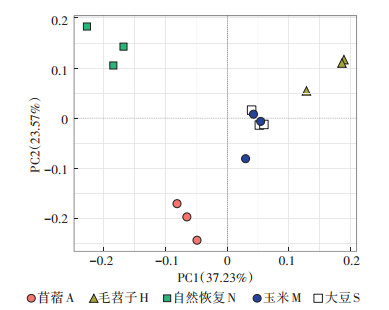
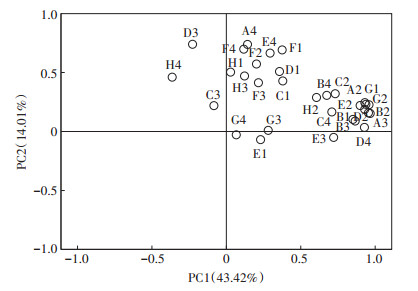
从图 3可以得知,第一、二主成分分别可以解释37.23%、23.57%,共解释60.80%。自然恢复、苜蓿分别位于第二、三象限,第一主成分将其与大豆、玉米、毛苕子分开,且大豆、玉米距离较近,位于第一、二主成分轴附近,说明种植大豆与玉米土壤微生物属水平上丰度差异不大,而种植毛苕子、苜蓿和自然恢复下土壤微生物属水平差异较大(P < 0.05),分别位于第一、三、二象限内。毛苕子位于第一象限,说明其与第一、二主成分均呈正相关。
|
图 3 不同植物种植下矿区复垦土壤微生物主成分分析 Figure 3 Principal components analysis of soil microorganism in reclaimed soil under different plant cultivation |
生物代谢通路分为6类,即代谢、遗传信息处理、环境信息处理、细胞进程、生物体系统和人类疾病,每一类代谢通路又可划分为多个等级。从图 4可以得知,利用基因测序结果,根据PICRUSt预测,获得不同植物种植下矿区复垦土壤的代谢功能,发现不同植物种植下土壤微生物代谢功能主要集中于氨基酸代谢与碳水化合物代谢,均占到10%以上,其他次生代谢产物的生物合成最低,只有1%,说明在矿区复垦土壤中的微生物碳代谢功能较强。
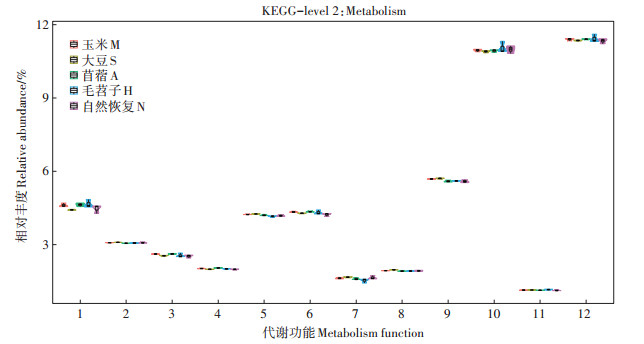
|
1.外来物质的降解和代谢;2.核苷酸代谢;3.萜和甾体类化合物代谢;4.其他氨基酸代谢;5.辅助因子和维生素代谢;6.脂质代谢;7.聚糖生物合成与代谢;8.酶科代谢;9.能量代谢;10.碳水化合物代谢;11.其他次生代谢产物的生物合成;12.氨基酸代谢 1.Xenobiotics biodegradation and metabolism; 2.Nucleotide metabolism; 3.Metabolism of terpenoids and polyketides; 4.Metabolism of other amino acids; 5.Metabolism of cofactors and vitamins; 6.Lipid metabolism; 7.Glycan biosynthesis and metabolism; 8.Enzyme famillies metabolism; 9.Energy metabolism; 10.Carbohydrate metabolism; 11.Biosynthesis of other secondary metabolism; 12.Amino acid metabolism 图 4 不同植物种植下矿区复垦土壤微生物的代谢功能 Figure 4 Metabolism function of microorganism in reclaimed soil under different plant cultivation |
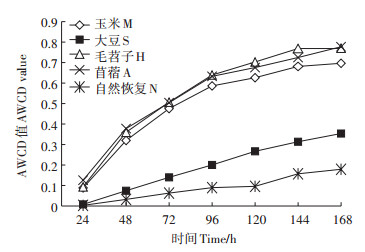
从图 5可以看出,不同植物种植下土壤微生物碳源利用率不同,在0~24 h玉米、毛苕子、苜蓿AWCD值变化大,而大豆和自然恢复基本未变,24 h后,土壤微生物碳源利用率均迅速增长,96 h后均呈缓慢增长趋势。种植玉米、毛苕子、苜蓿的土壤微生物碳源利用率在任意时刻均高于大豆与自然恢复,自然恢复的碳源利用率最差。
|
图 5 不同植物种植下矿区复垦土壤微生物平均碳利用率的动态变化 Figure 5 Dynamic changes of average carbon utilization rate of microorganism in reclaimed soil under different plants cultivation |
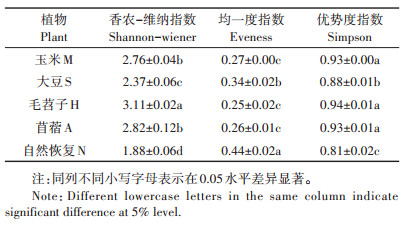
从表 3可以看出,不同植物种植下矿区土壤微生 物多样性的香农-维纳指数差异较大,顺序为毛苕子 > 苜蓿 > 玉米 > 大豆 > 自然恢复;矿区土壤微生物优势度指数在种植玉米、毛苕子、苜蓿后差异不显著,自然恢复优势度指数最低,自然恢复与种植植物间的差异显著;而对于均一度指数,种植玉米、毛苕子、苜蓿间差异不显著,且毛苕子均一度指数最低,自然恢复最高(P < 0.05)。说明种植植物可以明显提高矿区复垦土壤微生物的香农-维纳指数与优势度指数,降低均一度指数。
|
|
表 3 不同植物种植下矿区复垦土壤微生物多样性指数 Table 3 The microbial diversity index in reclaimed soil under different plant cultivation |
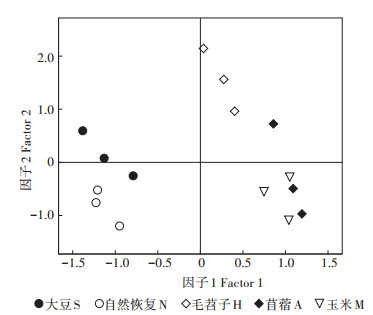
采用96 h时刻不同植物种植下矿区复垦土壤微生物对碳源利用的吸光值,并利用SPSS软件进行主成分分析,计算不同植物种植下的得分值。土壤中的碳源主要分为糖类、氨基酸类、酯类、醇类、胺类与酸类。从图 6可以看出,不同植物种植下对矿区复垦土壤微生物代谢功能在第一、二主成分中贡献率大于80%的碳源:糖类中的B2(D-木糖)、A2(β-甲基D-葡萄糖苷)、G2(葡萄糖-1-磷酸盐)、G1(D-纤维二糖);氨基酸类中的D4(L-丝氨酸)、A4(L-精氨酸);酯类中的B1(丙酮酸甲酯)、A3(D-半乳糖酸γ内酯);醇类中的D2(D-甘露醇);胺类中的E2(N-乙酰基-D-葡萄胺);酸类中的D3(4-羟基苯甲酸)、B3 (D-半乳糖醛酸)。从不同植物的得分值(图 7)可以看出,毛苕子的得分值最大,与第一、二主成分正相关,而自然恢复位于第三象限,与第一、二主成分负相关。说明种植毛苕子有利于矿区复垦土壤微生物的碳代谢功能增强,而自然恢复下土壤碳代谢功能较差。
|
图 6 矿区复垦土壤微生物碳源利用的主成分分析 Figure 6 Principal component analysis of microbial carbon source utilization in reclaimed soil |
|
图 7 矿区复垦土壤微生物碳源利用的主成分得分图 Figure 7 Score about principal component analysis of microbial carbon source utilization in reclaimed soil |
16S rDNA技术通过提取微生物组总DNA进行定量、测序,从而鉴定微生物菌群结构[11],但是对于序列相同的不同细菌难以鉴定。Biolog-ECO通过研究单一碳源底物利用能力不同来鉴定微生物群落结构[12-14],可弥补其他方法无法获得微生物群体活性信息的不足[15],但培养条件改变可能会引起微生物对碳底物实际利用能力的改变,从而造成一定的误差,同时目前标准数据库中菌种资料不完善,一些种类还不能被准确鉴定,只能得到相似类群[16-17]。通过两种方法的结合使用,可以较好地验证实验结果。
种植不同植物对土壤微生物群落的影响不同[18-19]。在本研究中,16S rDNA分析表明种植植物后土壤微生物种属数量高于自然恢复,且种植毛苕子后微生物属、种的分类数量最多,微生物多样性的丰度最高,自然恢复下多样性最低;Biolog-ECO分析表明不同植物种植下土壤微生物利用碳源能力存在差异性,种植毛苕子后土壤微生物活性最高,而自然恢复下土壤中可利用碳源的微生物活性最低,代谢功能最差,可能与复垦初期自然恢复土壤有机质含量低有关,这一结果与于镇华等[8]、孟庆杰等[6]对东北黑土区垦殖处理的研究结果不同,可能与研究区土壤环境因素(气温、降水等)的差异有关。
4 结论(1) 种植豆科植物毛苕子后土壤中微生物的种、属数量高于其他处理,且对土壤中碳源利用的综合能力增强,微生物活性最强,与自然恢复差异较大,说明种植毛苕子利于矿区复垦土壤中微生物多样性指数增加,利于矿区复垦土壤向健康方向发展。
(2) 在实际复垦工作中,可以通过种植毛苕子来增加复垦土壤微生物多样性,促进土壤的培育。
| [1] |
王莉, 张和生. 国内外矿区土地复垦研究进展[J]. 水土保持研究, 2013, 20(1): 294-300. WANG Li, ZHANG He-sheng. The research progress of land reclamation in mining area in domestic and abroad[J]. Research of Soil and Water Conservation, 2013, 20(1): 294-300. |
| [2] |
刘胜洪, 周玲艳, 杨妙贤, 等. 十种耐逆植物在和平县稀土矿区生态修复中的应用[J]. 天津农业科学, 2013, 19(7): 92-96. LIU Sheng-hong, ZHOU Ling-yan, YANG Miao-xian, et al. Application of ten stress tolerance plants in ecological restoration of rare earth mine of Heping County[J]. Tianjin Agricultural Sciences, 2013, 19(7): 92-96. DOI:10.3969/j.issn.1006-6500.2013.07.023 |
| [3] |
谢英荷, 洪坚平, 金志南, 等. 山西矿区退化土地复垦途径的试验研究[J]. 自然资源学报, 1997, 7(20): 18-24. XIE Ying-he, HONG Jian-ping, JIN Zhi-nan, et al. An experimental study of the reclamation ways of the deteriorated land in the mining area of Shanxi[J]. Journal of Natural Resources, 1997, 7(20): 18-24. |
| [4] |
王尚义, 石琪, 牛俊杰, 等. 煤矸石山不同植被恢复模式对土壤养分的影响——以山西省河东矿区1号煤矸石山为例[J]. 地理学报, 2013, 68(3): 379-379. WANG Shang-yi, SHI Qi, NIU Jun-jie, et al. Influence of vegetation restoration models on soil nutrient of coal gangue pile:A case study of No. 1 coal cangue pile in Hedong, Shanxi[J]. Acta Geographica Since, 2013, 68(372): 379-379. |
| [5] |
王飞, 秦方锦, 王先挺, 等. 基于Micro RespTM不同施肥方式对土壤微生物群落的影响[J]. 生态与农村环境学报, 2018, 34(7): 622-629. WANG Fei, QIN Fang-jin, WANG Xian-ting, et al. Study on effects of different fertilization regimes on soil microbial community based on Micro RespTM method[J]. Journal of Ecology and Rural Environment, 2018, 34(7): 622-629. |
| [6] |
孟庆杰, 许艳丽, 李春杰, 等. 不同植被覆盖对黑土微生物功能多样性的影响[J]. 生态学杂志, 2008, 27(7): 1134-1140. MENG Qing-jie, XU Yan-li, LI Chun-jie, et al. Effects of different vegetation coverage on microbial functional diversity in black soil[J]. Chinese Journal of Ecology, 2008, 27(7): 1134-1140. |
| [7] |
梁素钰, 李琳, 杜倩, 等. 橡胶草种植前后土壤微生物细菌多样性研究(Ⅰ)——基础分析[J]. 安徽农业科学, 2014, 42(9): 2563-2564, 2596. LIANG Su-yu, LI Lin, DU Qian, et al. Study on diversity of soil bacteria before and after planting Taraxacum kok-saghyz(Ⅰ):Basic analysis[J]. Journal of Anhui Agriculture Science, 2014, 42(9): 2563-2564, 2596. DOI:10.3969/j.issn.0517-6611.2014.09.014 |
| [8] |
于镇华, 元野, 刘居东, 等. Biolog-Eco解析垦殖与自然恢复黑土微生物群落代谢功能季节变化[J]. 土壤与作物, 2013, 2(3): 2095-2961. YU Zhen-hua, YUAN Ye, LIU Ju-dong, et al. Seasonal variations of microbial community functional diversity in cultivated and natural restored mollisols using Biolog-Eco method[J]. Soil and Crop, 2013, 2(3): 2095-2961. |
| [9] |
张轩.覆土厚度对矸石山复垦区土壤性质的影响研究[D].太原: 山西大学, 2013. ZHANG Xuan. Effect of soil replacement depth on soil properties in reclaimed coal waste piles[D]. Taiyuan: Shanxi University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10108-1017000181.htm |
| [10] |
杨永华, 姚健, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 2000, 20(2): 23-25. YANG Yong-hua, YAO Jian, HUA Xiao-mei. Effect of pesticide pollution against functional microbial diversity in soil[J]. Journal of Microbiology, 2000, 20(2): 23-25. |
| [11] |
刘国华, 叶正芳, 吴为中. 土壤微生物群落多样性解析法:从培养到非培养[J]. 生态学报, 2012, 32(14): 4421-4433. LIU Guo-hua, YE Zheng-fang, WU Wei-zhong. Culture-dependent and culture-independent approaches to studying soil microbial diversity[J]. Acta Ecologica Sinica, 2012, 32(14): 4421-4433. |
| [12] |
郑华, 欧阳志云, 方治国, 等. BIOLOG在土壤微生物群落功能多样性研究中的应用[J]. 土壤学报, 2004, 41(3): 456-461. ZHENG Hua, OUYANG Zhi-yun, FANG Zhi-guo, et al. Application of BIOLOG to study on soil microbial community functional diversity[J]. Acta Pedologca Sinica, 2004, 41(3): 456-461. DOI:10.3321/j.issn:0564-3929.2004.03.020 |
| [13] |
杨磊, 王卫超, 张凤华. 开垦对土壤团聚体含量及微生物群落代谢多样性的影响[J]. 干旱地区农业研究, 2018, 36(5): 215-223. YANG Lei, WANG Wei-chao, ZHANG Feng-hua. Effects of reclamationon content and microorganism community metabolic diversity of soil aggregates[J]. Agricultural Research in the Arid Areas, 2018, 36(5): 215-223. |
| [14] |
周庆伍, 李红歌, 李安军, 等. Biolog ECO解析不同产地大曲微生物群落功能多样性特征[J]. 食品与发酵科技, 2014, 50(3): 53-57. ZHOU Qing-wu, LI Hong-ge, LI An-jun, et al. Analysis of microbial community functional diversity in Daqu from different regions using Biolog-ECO method[J]. Food and Fermentation Technology, 2014, 50(3): 53-57. |
| [15] |
Garland J L, Lehman R M. Dilution extinction of community phenotypic characters to estimate relative structural diversity in mixed communities[J]. FEMS Microbiology Ecology, 1999, 30: 333-343. DOI:10.1111/fem.1999.30.issue-4 |
| [16] |
Medeiros P M, Fernandes S F, Dick R P. Seasonal variations in sugar contents and microbial community in a rye grass soil[J]. Chemosphere, 2006, 65(5): 832-839. DOI:10.1016/j.chemosphere.2006.03.025 |
| [17] |
钟文辉, 蔡祖聪. 土壤微生物多样性研究方法[J]. 应用生态学报, 2004, 15(5): 899-904. ZHONG Wen-hui, CAI Zu-cong. Methods for studying soil microbial diversity[J]. Chinese Journal of Applied Ecology, 2004, 15(5): 899-904. DOI:10.3321/j.issn:1001-9332.2004.05.037 |
| [18] |
Bronwyn D H, Raymond L C. Using the Gini coefficient with Biolog substrate utilization data to provide an alternative quantitative measure for comparing bacterial soil communities[J]. Journal of Microbiological Methods, 1997, 30: 91-101. DOI:10.1016/S0167-7012(97)00048-1 |
| [19] |
张恩平, 田悦悦, 李猛, 等. 长期不同施肥对番茄根际土壤微生物功能多样性的影响[J]. 生态学报, 2018, 38(14): 5027-5036. ZHANG En-ping, TIAN Yue-yue, LI Meng, et al. Effects of various long-term fertilization regimes on soil microbial functional diversity in tomato rhizosphere soil[J]. Acta Ecologica Sinica, 2018, 38(14): 5027-5036. |
 2019, Vol. 36
2019, Vol. 36