铜离子是一种常见的重金属离子,也是环境污染中量大、面广的一种代表性重金属离子,如果水中铜离子含量达0.01 mg·L-1,对水体自净有明显的抑制作用,超过3.0 mg·L-1,会产生异味,超过15 mg·L-1,就无法饮用[1]。近年来,利用天然农业废弃物吸附重金属的方法,受到越来越多的关注。大量研究表明一些天然农业废弃物(木屑、果壳、秸秆、玉米芯等)对重金属离子具有一定吸附能力[2-4]。然而,由于天然农业废弃物本身含有的吸附活性基团较少,对重金属离子吸附能力有限,因此,为提高其吸附能力,农业废弃物重金属离子吸附剂研究的重点是改性农业废弃物。目前物理改性和化学改性农业废弃物作为吸附剂处理废水中重金属离子的研究已经非常广泛,研究结果表明,经高温碳化、氧化、酯化、醚化以及接枝等改性后的农业废弃物作为吸附剂,对重金属Pb、Cr、Cd、Cu、As、Hg等离子都显示出良好的吸附作用[5-8],但改性过程带来严重的二次污染,改性制备条件严苛,生产成本过高,不利于工业化应用。生物改性农业废弃物,因具有改性过程成本较低、无二次污染等优点,受到越来越多研究者的青睐。
生物改性方法是利用生物体生长过程中的代谢作用或是生物酶类等的分解聚合等作用对材料进行改性。天然农业废弃物本身含有大量的氮、磷、钾、糖等营养物质,生物改性过程中,可以作为微生物固态发酵中的培养基质,在培养过程中通过微生物对基质的利用产生改性效果[9]。赵雅兰等[10]利用白腐真菌改性花生壳,制备出一种吸附Cd的价廉易得的材料。周建斌等[11]利用微生物群落改性竹炭,对污水起到良好的净化效果。彭丹等[12]利用纤维素酶对玉米秸秆进行改性,得到了一种高效的石油吸附剂。目前,生物改性农业废弃物的吸附处理领域集中在石油、染料、污水净化等,对水体中重金属处理的报道较少。因此,生物改性农业废弃物在重金属处理中的应用具有很大的研究空间。
本课题组前期开展了黑曲霉菌体作为吸附剂吸附重金属的研究,结果显示黑曲霉对Cr、Cd、Pd、Cu、Ni等重金属都有一定吸附作用[13-15]。然而在实际应用中,利用液相发酵黑曲霉的培养基成本较高,培养步骤繁琐,并且单独使用黑曲霉处理Cu、Ni等重金属效果不理想。另外,黑曲霉在生长过程中会产生大量纤维素酶,可以用于改性玉米秸秆。
本研究利用黑曲霉改性玉米秸秆,通过固态发酵技术将两者有机地结合起来,玉米秸秆作为固态发酵培养基质,培养过程中黑曲霉产生的代谢产物对玉米秸秆产生改性作用,制成吸附效能更高的黑曲霉-玉米秸秆生物吸附剂。一方面,避免了生物菌剂单独制备时培养基的高成本,更易于实现工业化;另一方面,避免了以往化学改性农业废弃物产生二次污染的问题,利于实现农作物秸秆资源化。
1 材料与方法 1.1 试剂与材料硫酸铜(CuSO4·5H2O)、氢氧化钠(NaOH)、硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、硝酸铅[Pb(NO3)2]、硝酸钙[Ca(NO3)2]、硝酸镉[Cd(NO3)2]、葡萄糖、琼脂,以上试剂均为分析纯,购于上海阿拉丁生化科技股份有限公司,试验前未做其他处理。
实验所用黑曲霉(Aspergillus niger)菌株在实验室制备,于4 ℃下低温保存在PDA斜面培养基上。实验用的玉米秸秆取自哈尔滨郊区一个农场,洗净烘干后粉碎过20~40目筛,待用。
1.2 试验方法 1.2.1 PDA培养基的配制称取200 g马铃薯,洗净去皮切碎,加水1000 mL,煮沸30 min,用纱布过滤,再加10~20 g葡萄糖和17~ 20 g琼脂,充分溶解后趁热用纱布过滤,分装于试管中,每试管约5~10 mL(视试管大小而定),置于灭菌锅中,121 ℃灭菌20 min左右后取出试管摆斜面,冷却后贮存备用。
1.2.2 Cu2+溶液的配制称取3.906 2 g CuSO4·5H2O固体,加入适量水,加热使之溶解,转移到1000 mL容量瓶中,定容,得到1000 mg·L-1的Cu2+溶液,待用。
1.2.3 黑曲霉改性玉米秸秆生物吸附剂的制备前期实验确定了黑曲霉固态发酵法改性玉米秸秆的最佳条件及实验步骤:将3.0 g玉米秸秆粉装入直径9 cm平皿(使用前160 ℃灭菌2 h)作为固体培养基,依据玉米秸秆粉质量,在玉米秸秆粉中添加固液比1:5的蒸馏水,利用柠檬酸缓冲溶液调控培养基pH为5.4,搅拌均匀后封口、灭菌,冷却后,无菌接入0.2 mL的黑曲霉孢子悬浮液后封口,在28 ℃下进行固态发酵培养,培养3 d后,将培养好的材料经50 ℃干燥,粉碎,过60目筛待用。制备的黑曲霉改性玉米秸秆生物吸附剂标记为ACS,天然玉米秸秆标记为RCS。
1.2.4 吸附材料的表征利用傅里叶红外光谱(FT-IR,美国Perkin-Elmer公司,Spectrum One B),对比改性前后玉米秸秆表面的官能团变化情况。通过扫描电镜(SEM,日本日立公司,SU8010)观察改性前后玉米秸秆微观表面形貌的变化。
1.2.5 吸附实验将50 ℃干燥后的吸附材料,粉碎过60目筛,准确称取0.15 g,分别放入100 mL初始浓度为20 mg·L -1 Cu(Ⅱ)溶液中,pH为5.3(无酸或碱),并在30 ℃、150 r·min-1下摇动30 min,分别用0.45 μm膜过滤,使用火焰-原子吸收分光光度法(AAS)对滤液进行测定,每组吸附实验平行重复3次。
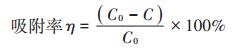
|
(1) |
式中:η为吸附率,%;C0为原溶液中Cu(Ⅱ)的初始浓度,mg·L-1;C为吸附反应后溶液中Cu(Ⅱ)浓度,mg·L-1。
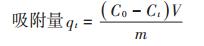
|
(2) |
式中:qt为t时刻Cu(Ⅱ)的吸附量,mg·g-1;Ct为t时刻溶液中Cu(Ⅱ)的浓度,mg·L-1;V为溶液体积,L;m为吸附剂的质量,g。
1.2.6 吸附动力学与吸附等温线为了进一步阐明吸附剂对Cu(Ⅱ)的吸附动力学,利用准一级动力学模型、准二级动力学模型进行拟合分析。
准一级动力学模型:
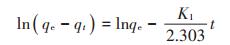
|
(3) |
准二级动力学模型:
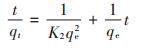
|
(4) |
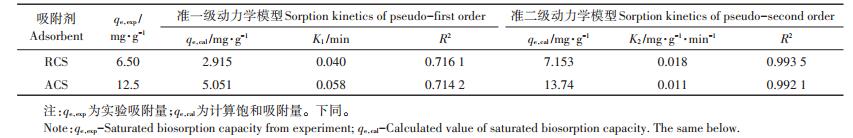
式中:qe为Cu(Ⅱ)吸附达到平衡时的吸附量,mg·g-1;K1为准一级动力学反应速率常数,min-1;K2为准二级动力学反应速率常数,mg·g-1·min-1。
为了进一步阐明吸附剂对Cu(Ⅱ)的吸附过程,利用Langmuir和Freundlich等温方程进行拟合分析。
Langmuir等温方程:
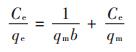
|
(5) |
Freundlich等温方程:
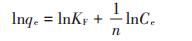
|
(6) |
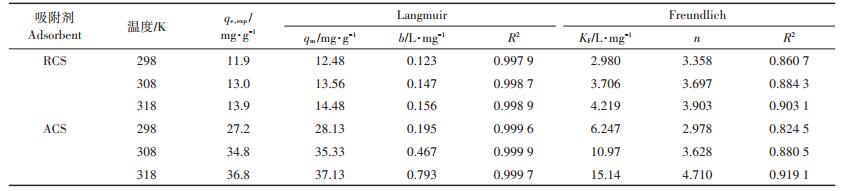
式中:qm为最大饱和吸附量,mg·g-1;Ce为吸附平衡浓度,mg·L-1;b为吸附作用的平衡常数,也称为吸附系数;KF、1/n为Freundlich吸附常数。
1.2.7 共存离子吸附实验在100 mL初始浓度20 mg·L-1的Cu(Ⅱ)溶液中,分别加入20 mg·L-1的含单一Pb(Ⅱ)、Cu(Ⅱ)、Ca(Ⅱ)、Cl-、NO3-、SO42 -溶液,考察常见共存阴阳离子的影响。实验条件:吸附剂投加量为0.15 g,pH为5.3,并在30 ℃、150 r·min-1下摇动30 min,分别用0.45 μm膜过滤,使用火焰-原子吸收分光光度法(AAS)对滤液进行测定。
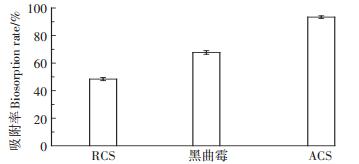
2 结果与讨论 2.1 吸附对比实验相同条件下,利用相同投加量(0.15 g)的ACS、黑曲霉菌体和RCS分别处理100 mL初始浓度20 mg·L-1的Cu(Ⅱ)溶液。由图 1可知,ACS对Cu(Ⅱ)的吸附率为93.5%,黑曲霉对Cu(Ⅱ)的吸附率为67.7%,RCS对Cu(Ⅱ)的吸附率为48.4%,结果表明,通过黑曲霉改性后的玉米秸秆对Cu(Ⅱ)的吸附性能明显提高,ACS对Cu(Ⅱ)的吸附率较RCS提高了45.1个百分点,较黑曲霉提高了25.8个百分点。
|
图 1 吸附率比较 Figure 1 Comparisons of biosorption rate |
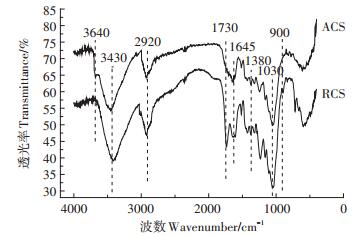
将改性前后的玉米秸秆分别进行红外表征,结果如图 2所示,玉米秸秆改性前后的红外谱图出现了几个共有的特征峰,3430、2920、1380 cm-1和1030 cm-1均是纤维素本身的特征吸收峰[16]。对比ACS和RCS的红外谱图,900、1730、3640 cm-1均发生了变化,ACS在900 cm-1及1730 cm-1处的峰消失了,而在3640 cm-1处则出现了一个峰。900 cm-1处的变化可能是由于改性后玉米秸秆的纤维素结构上的内糖苷结构受到破坏,造成振动消失[17]。1730 cm-1处的变化可能由于酯类的结构遭到破坏[18],不饱和的C=O键被氧化成为-COOH。而3640 cm-1处出现的峰则有可能是改性后纤维素大分子内部氢键遭到破坏,释放出一部分自由-OH,发生伸缩振动。红外谱图表明,在黑曲霉改性玉米秸秆的过程中,黑曲霉释放的代谢产物降解了部分玉米秸秆中的纤维素,氧化了纤维素中的部分基团,将被纤维素束缚的-OH和-COOH释放出来,这部分活性基团具有高效的吸附重金属的能力[19],从而提高了玉米秸秆的吸附性能。
|
图 2 玉米秸秆改性前(RCS)和改性后(ACS)的红外谱图 Figure 2 IR spectra of natural (RCS)and modified corn stalks (ACS) |
图 3是ACS和RCS在相同放大倍数下的扫描电镜照片。对比左右照片中的表面微观结构,改性玉米秸秆表面挂满丝状物体,丝状物体表面挂满小球,这些丝状物体和小球的表观形态与本项目组前期关于黑曲霉的研究结果一致[15],可确定为黑曲霉的菌丝和孢子。改性后的玉米秸秆较天然玉米秸秆的表面更为粗糙,片状表面出现明显的孔隙,使得纤维素内层的-OH和-COOH等活性基团得以暴露,这与红外图谱的结果一致,说明黑曲霉在改性玉米秸秆的过程中降解了一部分纤维素,从而使对重金属吸附有利的活性基团增多,使材料的吸附性能得到提高。

|
图 3 玉米秸秆改性前(RCS)和改性后(ACS)的SEM图(×1000倍) Figure 3 SEM of natural (RCS)and modified corn stalks (ACS) (×1000 times) |
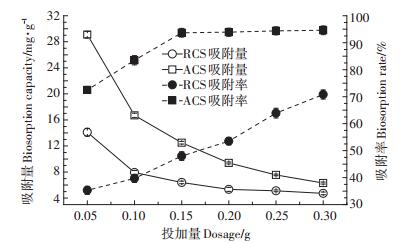
吸附剂的投加量分别设为0.05、0.10、0.15、0.20、0.25、0.30 g,吸附30 min后,各处理吸附量和吸附率结果如图 4所示。随着吸附剂投加量的增加,ACS和RCS对Cu(Ⅱ)的吸附率均呈增长趋势,其中ACS投加量≥0.15 g时,对Cu(Ⅱ)的吸附率均大于93.1%,且增长缓慢,这是由于随着吸附剂投加量的增加,吸附剂表面可供吸附Cu(Ⅱ)活性位点也增加,对Cu(Ⅱ)的吸附率也随之增加,当吸附剂的投加量增加到一定量时,相对于固定浓度的铜离子溶液,其对Cu(Ⅱ)的吸附达平衡,吸附率几乎不再增加。但是,随着吸附剂投加量的增加,ACS和RCS对Cu(Ⅱ)的吸附量却下降,ACS对Cu(Ⅱ)的吸附量从28.8 mg·g-1降至6.27 mg·g-1,RCS对Cu(Ⅱ)的吸附量从14.0 mg· g-1降至4.70 mg·g-1,这是由于当吸附剂投加量增大到一定量后,对固定浓度的铜离子溶液中Cu(Ⅱ)的吸附达平衡,多出的吸附剂的吸附位点空出,然而在计算吸附量时,把吸附剂的总投加量作为基数,因此单位质量的吸附剂对Cu(Ⅱ)的吸附量反而下降。
|
图 4 吸附剂投加量对Cu(Ⅱ)吸附的影响 Figure 4 Effect of adsorbent dosage on Cu(Ⅱ)ion biosorption |
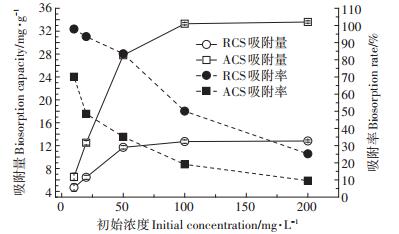
Cu(Ⅱ)溶液的初始浓度分别设为10、20、50、100、200 mg·L-1,吸附30 min后,各处理吸附量和吸附率结果如图 5所示。随着溶液初始浓度的增加,ACS和RCS对Cu(Ⅱ)的吸附量均呈现增长趋势,当溶液的初始浓度≥100 mg·L-1时,ACS和RCS对Cu(Ⅱ)的吸附量增长缓慢,对于固定投加量的吸附剂,其吸附基本达到饱和,ACS对Cu(Ⅱ)的饱和吸附量为33.6 mg·g-1,RCS对Cu(Ⅱ)的饱和吸附量为12.7 mg·g-1,改性玉米秸秆对Cu(Ⅱ)的饱和吸附量是天然玉米秸秆的2.65倍。但是,随着溶液初始浓度的增加,ACS和RCS对Cu(Ⅱ)的吸附率均呈下降趋势,这是由于随着溶液中Cu(Ⅱ)浓度的增加,吸附剂表面的活性位点不断被占据,当吸附剂吸附达到饱和后,尽管溶液中Cu(Ⅱ)浓度增加,但是吸附剂表面没有剩余活性位点用于Cu(Ⅱ)吸附,故吸附率呈现下降趋势。
|
图 5 溶液初始浓度对Cu(Ⅱ)吸附的影响 Figure 5 Effect of different initial concentrations on Cu (Ⅱ)ion biosorption |
溶液的初始pH值分别设为1.0、2.0、3.0、4.0、5.0、6.0,吸附30 min后,各处理吸附量和吸附率结果如图 6所示。随着溶液初始pH值的增大,ACS和RCS对Cu(Ⅱ)的吸附量和吸附率均呈现相同的变化趋势。当pH为1.0时,吸附量很低,这可能是由于溶液中H+较多,对Cu(Ⅱ)形成竞争吸附,造成吸附量较低;当pH在1.0~5.0时,吸附量显著增加,这可能是由于吸附材料表面的正电位降低[20],与Cu(Ⅱ)形成竞争的H+减少,促进了吸附。当pH>5.0,吸附量几乎不再增加,这是由吸附和化学沉淀作用共同造成的,在中性至碱性溶液中既存在吸附剂对Cu(Ⅱ)的吸附,又伴随着Cu(OH)2的生成。未调溶液pH值为5.3,在吸附最适pH范围,以后吸附实验可不调pH。
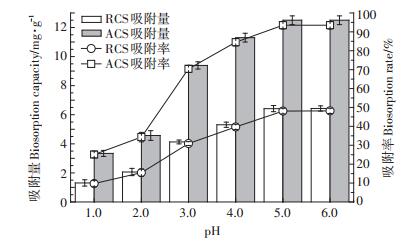
|
图 6 溶液初始pH对Cu(Ⅱ)吸附的影响 Figure 6 Effect of different pH on Cu(Ⅱ)ion biosorption |
图 7为ACS和RCS对Cu(Ⅱ)吸附量随吸附时间的变化曲线,ACS和RCS对Cu(Ⅱ)的吸附量随时间增加呈现相同的变化趋势。在反应初期,吸附剂对Cu(Ⅱ)的吸附量随着反应时间迅速增加,反应时间大于30 min后逐渐趋于平稳。
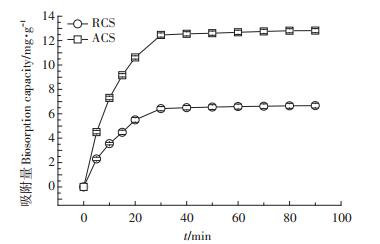
|
图 7 吸附时间对Cu(Ⅱ)吸附的影响 Figure 7 Effect of different sorption time on Cu(Ⅱ) ion biosorption |
图 8和图 9分别为ACS和RCS吸附Cu(Ⅱ)的准一级动力学和准二级动力学拟合图。动力学模型拟合参数如表 1所示,结果表明,准二级动力学模型的决定系数R2大于0.99,计算吸附量与实验吸附量更接近,可以判断准二级动力学模型能更好地解释吸附剂对Cu(Ⅱ)的吸附过程,说明吸附剂对Cu(Ⅱ)的吸附过程主要受化学吸附机理的控制,吸附速率由吸附剂表面未被占有的活性位点控制。
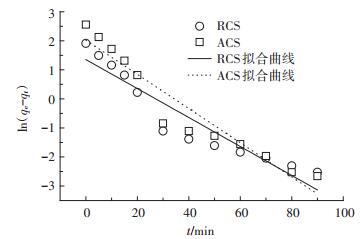
|
图 8 准一级动力学模型 Figure 8 Sorption kinetics of pseudo-first order |

|
图 9 准二级动力学模型 Figure 9 Sorption kinetics of pseudo-second order |
|
|
表 1 吸附剂对Cu(Ⅱ)吸附动力学模型拟合参数 Table 1 Kinetic parameters for biosorption of Cu(Ⅱ)by different adsorbents |
图 10为不同温度下ACS和RCS对Cu(Ⅱ)的吸附等温线,ACS和RCS对Cu(Ⅱ)的吸附量随温度升高而增大,说明温度升高有利于吸附剂对Cu(Ⅱ)的吸附。
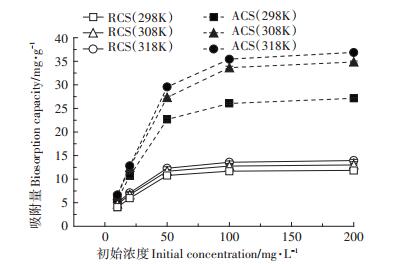
|
图 10 不同温度下吸附剂对Cu(Ⅱ)的吸附等温线 Figure 10 Biosorption isotherm of Cu(Ⅱ)by different adsorbent at different temperatures |
等温线模型拟合参数如表 2所示,Langmuir模型拟合的决定系数R2大于0.99,计算饱和吸附量与实验吸附量更接近,可以判断吸附剂对Cu(Ⅱ)的吸附过程与Langmuir等温模型更吻合,说明吸附剂对Cu(Ⅱ)的吸附过程以单层吸附为主,主要发生在吸附剂的外表面。由Freundlich理论可知,KF代表吸附剂的单位吸附能力,而1/n表示吸附剂的吸附强度,n值越大,吸附性能越好,当1/n在0.1~0.5之间时,吸附容易进行,而当1/n大于2时,吸附很难进行[10]。本实验中1/n均在0.1~0.5之间,因此该改性材料的吸附容易进行。
|
|
表 2 吸附剂对Cu(Ⅱ)的Langmuir和Freundlich吸附等温线参数 Table 2 Parameters of Langmuir and Freundlich models for biosorption of Cu(Ⅱ)by different adsorbents |
工业含铜废水除了含有铜离子外,还有很多其他共存阴、阳离子。共存阳离子和阴离子对改性玉米秸秆吸附Cu(Ⅱ)造成的干扰效果如图 11所示。引入的Pb(Ⅱ)、Cd(Ⅱ)与Cu(Ⅱ)产生竞争吸附,导致吸附量下降,而Ca(Ⅱ)由于其半径较小,几乎不与Cu(Ⅱ)产生竞争吸附,故吸附量变化不大;而改性玉米秸秆吸附剂在阴离子共存溶液体系中的吸附性能变化较小,说明Cl-、NO3-、SO42 -的引入,不会使改性玉米秸秆对Cu(Ⅱ)的吸附能力发生显著变化,不影响其投加使用。
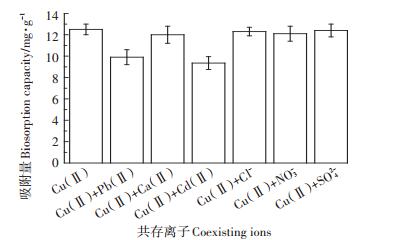
|
图 11 共存离子对Cu(Ⅱ)吸附的影响 Figure 11 The effect of coexisting ions on Cu(Ⅱ)ion biosorption |
(1)经黑曲霉改性后的玉米秸秆对Cu(Ⅱ)的吸附性能明显提高,改性玉米秸秆对Cu(Ⅱ)的吸附率较天然玉米秸秆提高了45.1个百分点,改性玉米秸秆对Cu(Ⅱ)的饱和吸附量为33.6 mg·g-1,是天然玉米秸秆的2.65倍。
(2)改性玉米秸秆投加量≥0.15 g,Cu(Ⅱ)溶液初始浓度20 mg·L-1,pH为5.3,吸附30 min后,即达到吸附饱和,吸附率均在93.1%以上。
(3)改性玉米秸秆对Cu(Ⅱ)的吸附过程,可用准二级动力学模型很好地拟合,吸附材料在第一阶段中吸附速率最快,说明材料的吸附过程中外扩散阶段起着不可或缺的作用,主要依靠颗粒外表面提供的活性位点对Cu(Ⅱ)进行吸附。
(4)改性玉米秸秆对Cu(Ⅱ)的吸附等温线,可用Langmuir模型很好地拟合,这表明该改性材料的吸附过程是单层吸附。而Freundlich方程拟合参数1/n在各温度下均在0.1~0.5之间,因此该改性材料的吸附容易进行。
| [1] |
Akpor O B, Muchie M. Remediation of heavy metals in drinking water and waste water treatment systems:Processes and applications[J]. International Journal of the Physical Sciences, 2010, 5(12): 1807-1817. |
| [2] |
Sud D, Mahajan G, Kaur M P. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions:A review[J]. Bioresource Technology, 2008, 99(14): 6017-6027. DOI:10.1016/j.biortech.2007.11.064 |
| [3] |
Johns M M, Marshall W E, Toles C A. Agricultural by products as granular activated carbons for adsorbing dissolved metals and organics[J]. Journal of Chemical Technology and Biotechnology, 1998, 71(2): 131-140. |
| [4] |
Abdelfattah I, Ismail A A, Sayed F, et al. Biosorption of heavy metals ions in real industrial wastewater using peanut husk as efficient and cost effective adsorbent[J]. Environmental Nanotechnology, Monitoring & Management, 2016, 6: 176-183. |
| [5] |
Wang F T, Pan Y F, Cai P X, et al. Single and binary adsorption of heavy metal ions from aqueous solutions using sugarcane cellulosebased adsorbent[J]. Bioresource Technology, 2017, 241: 482-490. DOI:10.1016/j.biortech.2017.05.162 |
| [6] |
Aguayo-Villarreal I A, Bonilla-Petriciolet A, Muñiz-Valencia R. Preparation of activated carbons from pecan nutshell and their application in the antagonistic adsorption of heavy metal ions[J]. Journal of Molecular Liquids, 2017, 230: 686-695. DOI:10.1016/j.molliq.2017.01.039 |
| [7] |
Thuan T V, Quynh B T P, Nguyen T D, et al. Response surface methodology approach for optimization of Cu2+, Ni2+ and Pb2+ adsorption using KOH-activated carbon from banana peel[J]. Surfaces and Interfaces, 2017, 6: 209-217. DOI:10.1016/j.surfin.2016.10.007 |
| [8] |
Ngabura M, Hussain S A, Ghani W A W A, et al. Utilization of renewable durian peels for biosorption of zinc from wastewater[J]. Journal of Environmental Chemical Engineering, 2018, 6(2): 2528-2539. DOI:10.1016/j.jece.2018.03.052 |
| [9] |
赵雅兰.生物改性花生壳材料的制备及其对Cd2+的吸附性能研究[D].广州: 华南理工大学, 2013. ZHAO Ya-lan. The study on preparation of biological modified peanut shells and its adsorption properties of Cd2+[D]. Guangzhou: South China University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1013318984.htm |
| [10] |
赵雅兰, 易筱筠, 雷娟, 等. 基于镉吸附的花生壳酶改性研究[J]. 矿物岩石地球化学通报, 2014, 33(2): 208-213. ZHAO Ya-lan, YI Xiao-jun, LEI Juan, et al. Research of Cd sorption by enzymatic modified peanut hulls[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2014, 33(2): 208-213. DOI:10.3969/j.issn.1007-2802.2014.02.008 |
| [11] |
周建斌, 叶汉玲, 张合玲. 生物改性竹炭制备工艺及其应用的研究[J]. 水处理技术, 2008, 34(10): 38-41. ZHOU Jian-bin, YE Han-ling, ZHANG He-ling, et al. Study on preparation process and application of bio-modified bamboo charcoal[J]. Technology of Water Treatment, 2008, 34(10): 38-41. |
| [12] |
彭丹, 党志, 郑刘春. 生物改性玉米秸秆处理溢油污染水体的研究[J]. 农业环境科学学报, 2018, 37(2): 309-315. PENG Dan, DANG Zhi, ZHENG Liu-chun. Study on oil-spilled water treated by bio-modification of corn stalks[J]. Journal of Agro-Environment Science, 2018, 37(2): 309-315. |
| [13] |
Ren B Q, Zhang Y T, Zhao L Y, et al. Biosorption of chromium by the spores of Aspernigillus niger[C]. Rome: International Conference on Mechatronics, Electronic, Industrial and Control Engineering, 2015.
|
| [14] |
Ouyang F J, Wang Y, Ren B Q, et al. Biosorption characteristics of Aspergillus Niger spores for removal of Pb(Ⅱ)ions from an aqueous solution[C]. Shenyang: International Conference on Logistics Engineering, Management and Computer Science, 2015.
|
| [15] |
Ren B Q, Wang J Y, Zhang W J, et al. Removal of Cr(Ⅵ)from solution by free and immobilised spores of Aspergillus niger[J]. Micro & Nano Letters, 2017, 12(9): 615-617. |
| [16] |
Liu C F, Xu F, Sun J X, et al. Physicochemical characterization of cellulose from perennial ryegrass leaves(Lolium perenne)[J]. Carbohydrate Research, 2006, 341(16): 2677-2687. DOI:10.1016/j.carres.2006.07.008 |
| [17] |
郑刘春.玉米秸秆及其纤维素的改性和吸附水体镉离子的机理研究[D].广州: 华南理工大学, 2011. ZHENG Liu-chun. Studies on the modification of corn stalk(cellulose)and the mechanism of Cd(Ⅱ)adsorption[D]. Guangzhou: South China University of Technology, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10561-1011188586.htm |
| [18] |
卢松.微生物处理玉米秸秆的腐解特征研究[D].重庆: 西南大学, 2010. LU Song. Study on the decomposition characteristics of corn stalk treated by microorganisms[D]. Chongqing: Southwest University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10635-2010095932.htm |
| [19] |
Wan Ngah W S, Hanafiah M A K M. Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents:A review[J]. Bioresource Technology, 2008, 99(10): 3935-3948. DOI:10.1016/j.biortech.2007.06.011 |
| [20] |
Hu H, Zhang J, Lu K, et al. Characterization of Acidosasa edulis shoot shell and its biosorption of copper ions from aqueous solution[J]. Journal of Environmental Chemical Engineering, 2015, 3(1): 357-364. DOI:10.1016/j.jece.2014.12.021 |
 2019, Vol. 36
2019, Vol. 36