2. 杭州余杭水务有限公司, 杭州 311100;
3. 生态环境部南京环境科学研究所, 南京 210042
2. Hangzhou Yuhang Water Service Co. Ltd, Hangzhou 311100, China;
3. Nanjing Institute of Environmental Science, Ministry of Ecology and Environment of the People's Republic of China, Nanjing 210042, China
无组织的分散式农村生活污水排放是水环境面源污染的一个主要来源[1-2]。农村生活污水主要包括厨房污水、洗浴污水和厕所污水, 其中厕所污水污染负荷贡献率最大, 其对生活污水的化学需氧量(COD)、总氮(TN)、氨氮(NH3-N)、总量贡献率分别达到74.92%、93.93%、94.86%、89.41%[3]。虽然各地对分散式化粪池进行了一定的改造, 但化粪池出水污染物浓度尚达不到排放标准, 且与相关环境标准差距较大[4-8], 不利于水环境质量的提升。
氮素负荷过高是化粪池出水的典型特征[8]。氮素是流域面源污染中主要贡献者, 是水体富营养化的重要控制性指标[2]。高氮负荷化粪池出水直排进入原地土壤, 经土壤渗滤进入地下水最终汇入河流, 成为流域面源污染的一个主要的潜在来源。氮素在土壤中的迁移转化过程是一个复杂的综合过程[9-10]。土壤作为土壤-微生物生态系统组成的基质, 对污水氮素起着物质截留、化学沉淀、吸附、氧化还原、络合及离子交换等作用, 同时为土壤微生物提供了必要的生存环境条件[11-13]。土壤由固、液、气和生物多相构成, 伴随着矿化、硝化、反硝化、吸附-解吸和厌氧氨氧化等生物化学作用及非生物化学作用, 物质的迁移转化极为活跃, 具有较强的净化功能。直排入原地土壤中的化粪池出水, 经过土壤的净化作用能够去除一定含量氮素[11, 14]。
相关研究表明, 含氮污水中90%以上的TN在距土壤介质表面30 cm以内被去除, 75%左右的铵态氮(NH4+-N)在距土壤介质表面10 cm以内被去除[15]。因此, 深入探讨化粪池出水氮素在原地10 cm土壤中的迁移转化过程, 对流域氮素污染控制和面源污染防治具有重要的意义。而目前对于原地土壤对化粪池出水氮素的迁移转化影响还缺乏系统的研究。本研究采集原地表层土壤及化粪池出水, 通过室内模拟实验, 探讨典型温度下农村化粪池出水氮素在原地土壤中的迁移转化过程, 以期为提高流域水体质量提供一定的理论支撑。
1 材料与方法 1.1 采样点概况采样点位于江苏省南通海门市(32°52′28″ N、121°11′7″ E), 属北亚热带季风气候, 夏季气温20~ 28℃, 冬季气温3~11℃, 年平均降水量1040 mm。本区域农户普遍采用三格式化粪池处理厕所污水[7]。用带盖避光塑料桶(PE, 25 L)采集原地化粪池出水若干桶, 出水基本理化性质见表 1。用避光柱状采样器(有机玻璃, φ100 mm×300 mm)采集化粪池排污口原地土壤约10 cm的柱状样若干柱, 在较小区域内集中采集以保证柱状样有较好的同质性。迅速运回实验室。
|
|
表 1 化粪池出水基本理化性质 Table 1 Basic physicochemical properties of septic tank effluent |
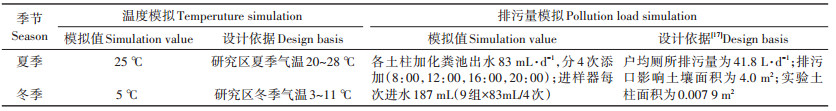
目前, 模拟化粪池污水排放一般通过人工注入污水操作[16], 需要在一日内的不同时间对多个实验重复子系统进行操作。人工注水由于各重复子系统注入液体的时间不一, 且注入量也无法做到完全一致, 从而产生实验偏差, 影响实验结论, 且化粪池污水恶臭、挥发有毒物质, 对实验人员健康存在威胁。本研究研发了模拟化粪池出水的自动实验装置(专利号:ZL 2015 2 0930131.X; ZL 2015 2 0930129.2), 具有均匀布水功能的定量布水装置可以保证各子系统污水注入量的一致性, 提高实验精度。实验装置如图 1所示。实验具体控制温度、排污量模拟值及设计依据如表 2所示。

|
图 1 实验装置示意图 Figure 1 The diagram of experiment device |
|
|
表 2 温度、排污量模拟值及设计依据 Table 2 Simulation value of temperature, pollution load and design basis |
分别取各桶相同体积化粪池污水充分混匀在一起, 作为原水备用待测。系统开始运行后, 分别同步采集布水器直接出水(不经过实验组土壤渗滤)和土壤渗滤液, 每日8:00前完成采样, 持续12 d。采集的水样冷冻保存备用待测。
实验结束后用顶分法每2 cm对土壤分层, 土样经冷冻风干后研磨过100目筛, 备用。
1.4 测定与分析方法备用水样经0.45 μm滤膜抽滤后, 水样中TN、NH4+-N、亚硝态氮(NO2--N)、硝态氮(NO3--N)采用连续流动分析仪(Skalar SAN++, 荷兰)分析测定。原水备用水样pH、氧化还原电位(ORP)用pH/ORP测定仪(HQ11D/HACH)在采样时实时测定, 温度(T)及溶解氧(DO)采用溶解氧仪(YSI-550A)在采样时实时测定, COD采用重铬酸钾法测定。
用2 mol·L-1 KCl浸提土壤, 振荡30 min, 经0.45 μm滤膜抽滤后, 用Skalar测定浸提液中可溶性无机氮(DIN), 即NH4+-N、NO2--N、NO3--N。
在相关研究[18-19]的基础上, 设计土壤NH4+-N的释放动力学试验和吸附热力学试验。用一级动力学方程定量分析表层土壤NH4+-N释放动力学过程, 公式为:
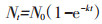
|
式中:Nt为t时刻的NH4+-N释放量, mg·kg-1; N0为释放平衡时NH4+-N的释放量(最大释放量), mg·kg-1; k为NH4+-N释放速率常数; t为释放时间, min。
单位质量土壤的吸附量Q (mg·kg-1)根据下式计算:
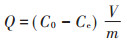
|
式中:V为加入样品中的溶液体积, L; m为土壤干样的质量, kg; C0为NH4+-N初始质量浓度, mg·L-1; Ce为平衡溶液的NH4+-N质量浓度, mg·L-1。
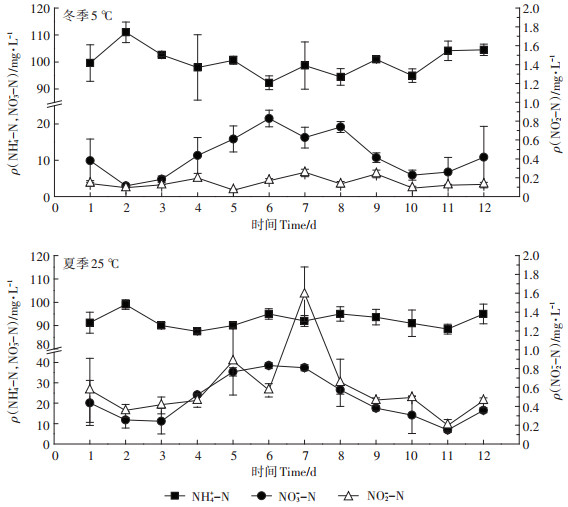
2 结果与分析 2.1 化粪池出水的氮素组成由表 1可知, 农村三格式化粪池出水氮素主要以DIN为主, 而有机氮(ON)的含量极少(< 5%)。主要是因为三格式化粪池具有深度厌氧发酵的二池, 能有效去除CODCr[8, 20], 污水中的高含量ON被矿化为NH4+-N。图 2为系统模拟两种典型温度(夏季25℃, 冬季5℃)实验条件下, 化粪池出水DIN组成情况。如图 2可知, 化粪池出水DIN以NH4+-N为主, 占70%以上, NO2--N浓度最低, 不足2%。两种温度条件下, 化粪池出水DIN浓度之间的差异不明显(P>0.05, n=12), 但NH4+-N、NO2--N、NO3--N浓度均具有极显著性差异(P < 0.01, n=12)。具体来看, 5℃条件下化粪池出水NH4+-N最大浓度为111 mg ·L-1, 是25℃出水最大NH4+-N浓度的1.12倍。25℃条件下化粪池出水NO2--N、NO3--N最大浓度依次1.59、38.43 mg·L-1, 分别是5℃出水NO2--N、NO3--N最大浓度的6.38、1.79倍。两种温度条件下DIN浓度无显著性差异, 表明在化粪池出水水体中均无明显脱氮过程。
|
图 2 化粪池出水的可溶性无机氮(DIN)浓度 Figure 2 The concentration of DIN in the septic tank effluent |
土壤渗滤出水氮素组成情况如图 3所示。两种温度条件下, 土壤渗滤出水DIN、NH4+-N浓度差异均不明显(P>0.05, n=12)。受高NH4+-N负荷进水影响, 土壤渗滤出水NH4+-N浓度仍然维持在较高水平, 5℃和25℃温度条件下渗滤出水NH4+-N浓度分别为53.42~ 75.38 mg·L-1和50.00~69.20 mg·L-1。25℃温度条件下土壤渗滤出水NO3--N最大浓度为48.65 mg·L-1, 是5℃温度条件下的2.59倍。
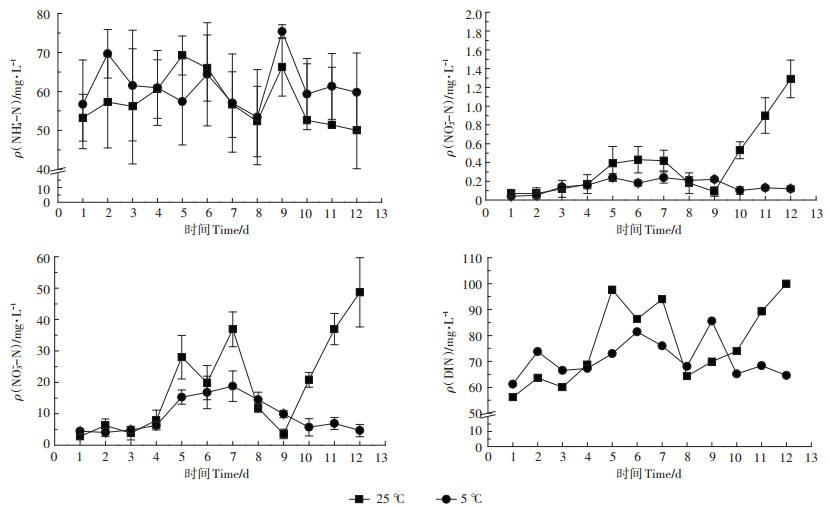
|
图 3 两种温度下土壤渗滤出水的可溶性无机氮(DIN)浓度 Figure 3 The concentration of DIN in the soil infiltration water under two temperature |
两种温度条件下, 土壤渗滤后出水DIN均有明显削减, 其中以NH4+-N削减为主。25℃和5℃条件下土壤渗滤后出水DIN削减率分别为6.53%~ 49.84%和23.62%~44.23%, NH4+-N削减率分别为23.11%~47.37%和25.37%~43.47%。5℃温度条件下土壤渗滤出水中NO2--N、NO3--N浓度与进水水平相比表现为削减, NO2--N、NO3--N平均削减率分别为23.98%、27.11%;25℃温度条件下, 前9 d土壤渗滤出水中NO2--N、NO3--N浓度与进水水平相比均发生削减, NO2--N、NO3--N平均削减率分别为68.06%、52.32%。
2.3 土壤NH4+-N的吸附-解吸实验结束后对表层土壤的NH4+-N吸附-解吸特性进行热力学和动力学分析, 其结果见图 4。一级动力学方程对土壤NH4+-N释放动力行为拟合精度较高(R2=0.96~0.99, P < 0.001, n=7)。25℃温度条件下NH4+-N最大释放量N0低于5℃, 后者为前者的1.66倍。原始土壤NH4+-N最大释放量最低, 分别为25℃和5℃温度条件实验后土壤NH4+-N最大释放量的45.63%和27.49%。
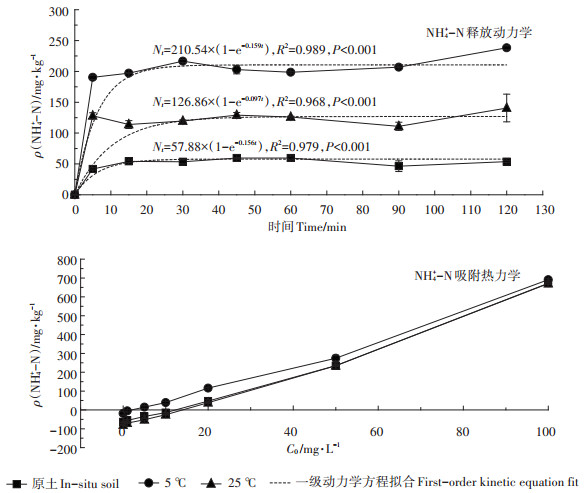
|
图 4 土壤NH4+-N释放动力学曲线及吸附等温线 Figure 4 Release kinetics and adsorption isotherm curves of soil NH4+-N |
由图 4三种试验土壤的NH4+-N吸附等温线可知, 5℃温度条件下土壤对NH4+-N的平衡吸附浓度(ENC0)最低, 为3.15 mg·L-1; 原始土壤与25℃温度条件土壤的ENC0相近, 分别为13.12、15.82 mg·L-1, 5℃土壤ENC0分别为25℃土壤和原始土壤的24.01%和19.91%。
3 讨论 3.1 NH4+-N在原地土壤中的迁移转化化粪池出水中NH4+-N在土壤渗滤过程中可能发生的迁移转化过程主要包括氨挥发、硝化作用、厌氧氨氧化作用以及土壤对NH4+-N离子的吸附-解吸作用。研究表明, 土壤中氨挥发速率与环境温度及总氨氮含量一定范围内呈正相关[21-22]。本研究中化粪池出水NH4+-N浓度高(图 2), 在土壤渗滤过程中, 土壤间隙水中NH4+-N也随之增高(图 3), 两种温度条件下土壤在该NH4+-N浓度氛围中均可能发生氨挥发。Van der Stelt等[22]研究发现, 37℃时氨挥发速率达到最高, 低于该温度氨挥发速率随环境温度的升高而升高, 则25℃对原地土壤中氨挥发的促进作用较5℃更大。由此可知, 在排污负荷相同的情况下, 夏季原地土壤中氨挥发速率较大。不同季节化粪池原地具体氨排放速率, 有待进一步研究。
硝化作用最适宜的温度范围为20~30℃, 因此25℃温度下硝化细菌活性较高, 故夏季原地土壤中NH4+-N可通过硝化作用生成NO3--N。如图 3表述, 实验第10 d开始, 25℃温度条件下土壤渗滤出水中NO2--N、NO3--N浓度和硝化菌群数量迅速增高, 这可能是因为实验前9 d为硝化细菌驯化期, 实验第10 d起硝化细菌驯化完成, 硝化作用活性高, 土壤中NH4+-N迅速转化为NO2--N和NO3--N, 渗滤水NH4+-N浓度表现为降低而NO3--N升高; 此外由于化粪池出水中NO2--N浓度在第7 d明显升高, 而NO2--N不稳定, 易氧化成NO3--N从而导致其浓度升高。NO2--N由于其中间产物特性, 迅速完成转化, 在原地土壤环境中的存在量极低, 占DIN百分比始终低于2%。5℃温度条件下, NO2--N和NO3--N浓度始终无显著增加, 可能是因为低温条件下硝化细菌活性较低[23], 驯化时间更长, 导致无明显硝化作用过程, 为期12 d的研究期内仅有3 d土壤渗滤出水NO3--N浓度超过进水, 最大增加量仅为2.52 mg·L-1。
厌氧氨氧化菌大量存在于自然界许多缺氧、好氧界面中, Jetten[24]在土壤干湿界面发现厌氧氨氧化反应的存在。厌氧氨氧化反应的适宜pH为6.7~8.3[25], 本研究中测得原地土壤pH约为7.49, 符合厌氧氨氧化发生条件。厌氧氨氧化菌对温度的适宜范围较广, 国内大多数学者认为, 在30~35℃下厌氧氨氧化菌的活性较高, 而国外也有学者研究发现了在2~30℃均可反应、最适反应温度为12℃的厌氧氨氧化菌株[26]。故本实验两种温度下均可能发生厌氧氨氧化反应。此外, NO2--N浓度亦对厌氧氨氧化速率产生关键影响。Van Niftrik等[27]认为, NO2--N浓度高于0.92 mg·L-1时将抑制厌氧氨氧化菌活性。本研究表明, 25℃温度条件下化粪池出水及土壤渗滤出水NO2--N浓度分别为(0.59±0.36) mg·L-1和(0.39±0.38) mg·L-1, 5℃温度条件下化粪池出水及土壤渗滤出水NO2--N浓度分别为(0.15±0.06) mg·L-1和(0.15±0.07) mg·L-1, 两种温度下NO2--N浓度均符合厌氧氨氧化反应适宜范围。因此, 化粪池原地土壤中若存在局部缺氧环境发生厌氧氨氧化作用, NH4+-N可作为NO2--N电子受体生成N2O或N2[28], 从而贡献土壤渗滤NH4+-N削减率, 且25℃温度下厌氧氨氧化菌活性可能较5℃更高。
高NH4+-N负荷化粪池出水进入原地土壤后, 土壤胶体对污水中NH4+-N产生吸附, 结合在土壤颗粒中的吸附态NH4+-N在释放动力学试验中被振荡解吸, 高吸附量导致高脱附释放量。因此两种温度条件下实验后的土壤NH4+-N释放量均高于原始土壤(图 4)。翟丽华等[29]认为土壤NH4+-N吸附作用是一个弱放热过程, 孙大志等[30]的研究也表明温度越低, 土壤对NH4+-N的吸附能力越强, 这可能是5℃温度条件下NH4+-N最大释放量大于25℃的原因。由此可知, 冬季土壤对NH4+-N的吸附作用能比夏季产生更大的NH4+-N削减贡献。由三种土壤不同ENC0表现可知, 5℃实验后土壤作为吸附剂吸附能力也更强, 而原始土壤与25℃温度条件实验后土壤吸附剂吸附能力相当。由于吸附等温试验中, 三种实验组分土壤NH4+-N吸附均发生在常温下(21~23℃), 温度对吸附作用产生的影响可以忽略。三种吸附等温曲线的不同主要是由作为吸附剂的土壤的性质差异造成。
3.2 NO2--N和NO3--N在原地土壤中的迁移转化土壤中NO2--N和NO3--N可通过反硝化作用形成N2O或N2进入气相, 或异化还原为铵[31]。反硝化细菌的活性直接影响反硝化作用强度, 25℃反硝化细菌活性比5℃高, 这可能导致25℃温度条件下土壤渗滤出水中NO2--N和NO3--N去除量高于5℃。Yin等[32]研究表明, 土壤中硝酸还原过程除了反硝化作用之外, 还包括硝酸异化还原成铵(DNRA)的过程。DNRA过程以NO2--N或NO3--N为电子受体, 氧化NADH产生NH4+-N。韦宗敏[31]的研究结果表明DNRA过程发生于pH 5~8之间, 反应最佳温度30℃。一般认为DNRA过程多发生于偏碱性的环境中, 而原地土壤pH 7.49, 符合反应发生pH条件; 在达到最佳温度之前, DNRA反应强度随温度的增加而升高[33], 因此25℃温度条件下DNRA强度高于5℃。这也可能是造成25℃温度条件下土壤渗滤出水中NO2--N和NO3--N去除量高于5℃的原因之一。
图 5为三种试验土壤NH4+-N和NO3--N含量, 可见两种温度条件实验后土壤NH4+-N显著提高, 且5℃更高, 25℃和5℃温度条件实验后土壤NH4+-N含量分别为原始土壤的2.19倍和9.27倍; 两种温度条件实验后土壤NO3--N均有提高, 且25℃更高, 25℃和5℃温度条件实验后土壤NO3--N含量分别为原始土壤的2.52倍和1.03倍。实验后土壤NH4+-N升高主要由于土壤NH4+-N吸附, 且温度低吸附能力更强。朱兆良[9]研究表明NO3--N游离性较强, 在土壤中不容易被吸附。游离态的NO3--N基本不会被土壤吸附, 如图 5显示, 5℃温度条件下土壤NO3--N相对原始土壤基本不增加, 而25℃温度条件下土壤NO3--N显著升高, 土壤对NO3--N存在蓄积。这可能是因为25℃温度条件下土壤胶体中吸附态NH4+-N硝化产生吸附态NO3--N, 或硝化产生的高浓度游离NO3--N会以离子交换或配对方式结合在土壤胶体中。这也可能是导致25℃温度条件下土壤渗滤出水中NO2--N和NO3--N去除量高于5℃的原因之一。
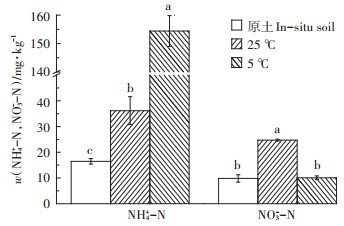
|
不同小写字母表示处理间差异显著(P < 0.05) Different letters indicate significant difference among treatments(P < 0.05) 图 5 土壤铵态氮、硝态氮含量 Figure 5 The content of NH4+-N and NO3--N in the top soil |
(1) 农村化粪池出水氮素主要为DIN, 且NH4+-N占DIN的70%以上。模拟排污条件下出水氮素脱氮过程不明显, 25℃和5℃条件下出水DIN差异不显著(P>0.05, n=12), NH4+-N、NO2--N、NO3--N均表现显著性差异(P < 0.01, n=12), 25℃出水NH4+-N低于5℃, 而NO2--N、NO3--N高于5℃。
(2) 化粪池出水氮素在原地土壤中两种温度下都表现为DIN削减, 其中以NH4+-N削减为主, NH4+-N削减量均占DIN削减量60%以上。25℃ NH4+-N削减主要通过氨挥发、反硝化、厌氧氨氧化等作用, 而5℃ NH4+-N削减主要通过土壤NH4+-N吸附作用。
(3) 两种温度下化粪池出水NO2--N和NO3--N在原地土壤中可发生反硝化或异化还原作用进而得到削减, 其中25℃土壤对NO3--N存在蓄积作用。
| [1] |
陈海洋, 滕彦国, 王金生, 等. 晋江流域非点源氮磷负荷及污染源解析[J]. 农业工程学报, 2012, 28(5): 213-219. CHEN Hai-yang, TENG Yan-guo, WANG Jin-sheng, et al. Pollution load and source apportionment of non-point source nitrogen and phosphorus in Jinjiang River watershed[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(5): 213-219. DOI:10.3969/j.issn.1002-6819.2012.05.036 |
| [2] |
吴雅丽, 许海, 杨桂军, 等. 太湖水体氮素污染状况研究进展[J]. 湖泊科学, 2014, 26(1): 19-28. WU Ya-li, XU Hai, YANG Gui-jun, et al. Progress in nitrogen pollution research in Lake Taihu[J]. Journal of Lake Sciences, 2014, 26(1): 19-28. |
| [3] |
王文林, 胡孟春, 唐晓燕. 太湖流域农村生活污水产排污系数测算[J]. 生态与农村环境学报, 2010, 26(6): 616-621. WANG Wen-lin, HU Meng-chun, TANG Xiao-yan. Estimation of sewage production and discharge coefficients of rural areas in Taihu Lake basin[J]. Journal of Ecology and Rural Environment, 2010, 26(6): 616-621. DOI:10.3969/j.issn.1673-4831.2010.06.020 |
| [4] |
董文杰, 陆广, 严立, 等. 分散式面源生活污水生态处理技术研究进展[J]. 环境污染与防治, 2014, 36(8): 84-88. DONG Wen-jie, LU Guang, YAN Li, et al. Research progress on the ecological treatment technology of distributed non-point sewage[J]. Environmental Pollution and Control, 2014, 36(8): 84-88. DOI:10.3969/j.issn.1001-3865.2014.08.015 |
| [5] |
华永新. 杭州市农村生活污水处理情况调查和分析[J]. 农业工程技术(新能源产业), 2008(6): 30-33. HUA Yong-xin. Investigation and analysis of rural domestic wastewater treatment in Hangzhou City[J]. Agricultural Engineering Technology (New Energy Industry), 2008(6): 30-33. |
| [6] |
李海明. 农村生活污水分散式处理系统与实用技术研究[J]. 环境科学与技术, 2009, 32(9): 177-181. LI Hai-ming. Distributed rural sewage treatment system and practical technology[J]. Environmental Science & Technology, 2009, 32(9): 177-181. DOI:10.3969/j.issn.1003-6504.2009.09.042 |
| [7] |
李健, 金小林, 徐祥珍, 等. 2008年江苏省农村改厕无害化处理效果评价[J]. 中国血吸虫病防治杂志, 2009, 21(4): 293-296. LI Jian, JIN Xiao-lin, XU Xiang-zhen, et al. Effect evaluation of nonhazardous treatment for lavatory improvement in rural areas of Jiangsu Province in 2008[J]. Chinese Journal of Schistosomiasis Control, 2009, 21(4): 293-296. DOI:10.3969/j.issn.1005-6661.2009.04.012 |
| [8] |
王玉华, 方颖, 焦隽. 江苏农村"三格式"化粪池污水处理效果评价[J]. 生态与农村环境学报, 2008, 24(2): 80-83. WANG Yu-hua, FANG Ying, JIAO Jun. Evaluation of night soil treatment efficiency of "Three-Grille-Mode" septic tanks in the rural area of Jiangsu[J]. Journal of Ecology and Rural Environment, 2008, 24(2): 80-83. DOI:10.3969/j.issn.1673-4831.2008.02.018 |
| [9] |
朱兆良. 土壤中氮素转化研究的近况[J]. 干旱区研究, 1986(4): 3-15. ZHU Zhao-liang. Status of nitrogen transformation in soil[J]. Arid Zone Research, 1986(4): 3-15. |
| [10] |
朱兆良. 中国土壤氮素研究[J]. 土壤学报, 2008, 45(5): 778-783. ZHU Zhao-liang. Research on soil nitrogen in China[J]. Acta Pedologica Sinica, 2008, 45(5): 778-783. DOI:10.3321/j.issn:0564-3929.2008.05.003 |
| [11] |
黄映恩, 雷中方, 张振亚, 等. 土壤渗滤系统中土壤酶活性与系统脱氮效果的关系研究[J]. 复旦学报(自然科学版), 2009, 48(1): 94-99. HUANG Ying-en, LEI Zhong-fang, ZHANG Zhen-ya, et al. Relationship between soil enzymatic activities and nitrogen removal in soil infiltration treatment system[J]. Journal of Fudan University(Natural Science), 2009, 48(1): 94-99. |
| [12] |
小菅伸郎.淹水土壤脱氮的研究概况[J].王家玉, 译.土壤学进展, 1981(4): 29-33. XIAOJIAN Shen-lang. A survey of research on nitrogen removal from flooded soil[J]. WANG Jia-yu, Translate. Progress in Soil Science, 1981(4): 29-33. |
| [13] |
杨国治, 邵宗臣. 苏南水稻土脱氮的土壤条件[J]. 土壤通报, 1981(3): 4-7. YANG Guo-zhi, SHAO Zong-chen. Soil conditions for denitrification of paddy soil in south of Jiangsu[J]. Chinese Journal of Soil Science, 1981(3): 4-7. |
| [14] |
刘玉忠, 王丽君, 张列宇, 等. 地下土壤渗滤系统脱氮效果的研究[J]. 环境科学与管理, 2012, 37(10): 28-31. LIU Yu-zhong, WANG Li-jun, ZHANG Lie-yu, et al. Research on denitrification effect of subsurface wastewater infiltration system[J]. Environmental Science and Management, 2012, 37(10): 28-31. DOI:10.3969/j.issn.1673-1212.2012.10.009 |
| [15] |
李建民, 刘培斌, 魏炜, 等. 利用土地处理系统对再生水进行脱氮[J]. 安徽农业科学, 2012, 40(15): 8667-8669. LI Jian-min, LIU Pei-bin, WEI Wei, et al. Nitrogen removal efficiency of the reclaimed water by land treatment system[J]. Journal of Anhui Agricultural Sciences, 2012, 40(15): 8667-8669. DOI:10.3969/j.issn.0517-6611.2012.15.101 |
| [16] |
周锋, 王文林, 王国祥, 等. 化粪池排口处土壤对典型农户生活污水氮素污染物的消减测算研究[J]. 环境科学, 2013, 34(10): 3954-3962. ZHOU Feng, WANG Wen-lin, WANG Guo-xiang, et al. Estimate the abatement rate of septic tank sewage outfall soil on nitrogen pollutants of typical farmer household sewage[J]. Environmental Science, 2013, 34(10): 3954-3962. |
| [17] |
田媛, 杨昕, 花伟军, 等. 城市周边生活污水排放对绿地土壤环境质量的影响[J]. 生态学报, 2008, 28(2): 742-748. TIAN Yuan, YANG Xin, HUA Wei-jun, et al. Fuzzy analysis of the effect of city sewage water on environmental quality of greenspace soil[J]. Acta Ecologica Sinica, 2008, 28(2): 742-748. DOI:10.3321/j.issn:1000-0933.2008.02.036 |
| [18] |
刘波, 盛明, 唐千, 等. 有机质对城市污染河道沉积物铵态氮吸附解吸的影响[J]. 湖泊科学, 2015, 27(1): 50-57. LIU Bo, SHENG Ming, TANG Qian, et al. Effect of organic matter on adsorption/desorption of ammonium in the sediments of heavily polluted urban river[J]. Journal of Lake Sciences, 2015, 27(1): 50-57. |
| [19] |
孙大志. 氨氮在土壤中吸附/解吸的动力学与热力学研究[J]. 北华大学学报(自然科学版), 2007, 8(6): 493-496. SUN Da-zhi. Ammonia absorption/desorption behavior and thermodynamics in soil[J]. Journal of Beihua University(Natural Science), 2007, 8(6): 493-496. DOI:10.3969/j.issn.1009-4822.2007.06.004 |
| [20] |
朱萌, 王强. 农村三格化粪池卫生厕所建造技术与改进研究[J]. 安徽农业科学, 2011, 39(11): 6704-6705. ZHU Meng, WANG Qiang. Study of the construction technologies and improvement of 3-pool septic tank sanitary toilet using by countryside[J]. Journal of Anhui Agricultural Sciences, 2011, 39(11): 6704-6705. DOI:10.3969/j.issn.0517-6611.2011.11.150 |
| [21] |
Huijsmans J F M, Hol J M G, Vermeulen G D. Effect of application method, manure characteristics, weather and field conditions on ammonia volatilization from manure applied to arable land[J]. Atmospheric Environment, 2003, 37(26): 3669-3680. DOI:10.1016/S1352-2310(03)00450-3 |
| [22] |
Van der Stelt B, Temminghoff E J M, Van Vliet P C J, et al. Volatilization of ammonia from manure as affected by manure additives, temperature and mixing[J]. Bioresource Technology, 2007, 98(18): 3449-3455. DOI:10.1016/j.biortech.2006.11.004 |
| [23] |
何乐韵.低温冲击下硝化菌抗氧化酶系统响应机制研究[D].成都: 西南交通大学, 2013. HE Le-yun, Research on the response mechanism of nitrifying bacteria antioxidant enzyme system under low-temperature shock[D]. Chengdu: Southwest Jiaotong University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10613-1013251249.htm |
| [24] |
Jetten M S M. New pathways for ammonia conversion in soil and aquatic systems[J]. Plant and Soil, 2001, 230(1): 9-19. DOI:10.1023/A:1004683807250 |
| [25] |
郑宇慧.温度对厌氧氨氧化的影响研究[D].苏州: 苏州科技学院, 2011. ZHENG Yu-hui. Study of the temperature influence on anammox[D]. Suzhou: Suzhou University of Science and Technology, 2011. http://cdmd.cnki.com.cn/article/cdmd-10332-1011224953.htm |
| [26] |
Rattray J E, Van de Vossenbery J, Jaeschke A, et al. Impact of temperature on ladderane lipid distribution in anammox bacteria[J]. Appl Environ Microbiol, 2010, 76(5): 1596-1603. DOI:10.1128/AEM.01796-09 |
| [27] |
Van Niftrik L A, Fuerst J A, Sinninghe Damsté J S, et al. The anammoxosome:An intracytoplasmic compartment in anammox bacteria[J]. Fems Microbiology Letters, 2010, 233(1): 7-13. |
| [28] |
Kuypers M M, Sliekers A O, Lavik G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J]. Nature, 2003, 422(6932): 608. DOI:10.1038/nature01472 |
| [29] |
翟丽华, 刘鸿亮, 徐红灯, 等. 浙江某农场土壤和沟渠沉积物对氨氮的吸附研究[J]. 环境科学, 2007, 28(8): 1770-1773. ZHAI Li-hua, LIU Hong-liang, XU Hong-deng, et al. Property of ammonium adsorption on sediments in ditches and adjacent soils[J]. Environmental Science, 2007, 28(8): 1770-1773. DOI:10.3321/j.issn:0250-3301.2007.08.021 |
| [30] |
孙大志, 李绪谦, 潘晓峰. 氨氮在土壤中的吸附/解吸动力学行为的研究[J]. 环境科学与技术, 2007, 30(8): 16-18. SUN Da-zhi, LI Xu-qian, PAN Xiao-feng. Ammonia absorption/desorption behavior in soil[J]. Environmental Science & Technology, 2007, 30(8): 16-18. DOI:10.3969/j.issn.1003-6504.2007.08.006 |
| [31] |
韦宗敏.微好氧环境中硝酸盐异化还原成铵的影响研究[D].广州: 华南理工大学, 2012. WEI Zong-min. Preliminary research on dissimilatory nitrate reduction to ammonium in microaerobic condition[D]. Guangzhou: South China University of Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10561-1012450921.htm |
| [32] |
Yin S X, Chen D, Chen L M, et al. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology & Biochemistry, 2002, 34(8): 1131-1137. |
| [33] |
陶怡乐, 温东辉. 细菌硝酸盐异化还原成铵过程及其在河口生态系统中的潜在地位与影响[J]. 微生物学通报, 2016, 43(1): 172-181. TAO Yi-le, WEN Dong-hui. Dissimilatory nitrate reduction to ammonium:The potential and impacts in estuarine regions[J]. Microbiology China, 2016, 43(1): 172-181. |
 2019, Vol. 36
2019, Vol. 36