2. 江苏省固体有机废弃物资源化高技术研究重点实验室, 南京 210095
2. Jiangsu Provincial Key Lab for Organic Solid Waste Utilization, Nanjing Agricultural University, Nanjing 210095, China
磷灰石在农业、环境、生物等领域都发挥重要作用, 作为主要的含磷矿产资源, 是农业磷肥和其他磷产品的工业原料[1]。同时磷灰石也被用于重金属污染治理和环境修复[2]。磷灰石是磷元素在自然界中最主要的存在形式, 地球上大部分磷都储藏在磷灰石矿物中[2-4]。磷灰石矿物的化学式为[Ca10(PO4)6(F, OH, Cl)], 即有三种主要存在形态[5]:羟基磷灰石(Hydroxylapatite)、氟基磷灰石(Fluorapatite)以及氯基磷灰石(Chlorapatite)。其中羟基磷灰石(OHAp)是构成生物体骨骼和牙齿的重要组分; 氟基磷灰石(FAp)是自然环境中分布最广泛的磷灰石矿物[3, 6]。但磷灰石的低溶解度(水溶液中为mg·L-1级别)极大地限制了其在磷肥工业生产、环境修复等方面的作用。因此, 如何提高磷灰石的利用效率是一个备受关注的话题。
解磷微生物(如细菌、真菌、放线菌等)是农业土壤中常见的微生物种类, 能够风化磷灰石矿物, 将难溶性磷转化为可溶性磷, 进而提高磷的利用率[7-8]。解磷微生物的溶磷作用机理复杂[9-10], 其中通过分泌有机酸溶解含磷矿物是学界公认的最主要的机理[11-14]。解磷微生物中解磷真菌单位时间内分泌的有机酸量大, 溶磷能力强于其他解磷微生物(如解磷细菌)。其中黑曲霉泌酸能力强, 是解磷真菌中主要的菌种。黑曲霉主要分泌三种有机酸:甲酸(CH2O2)、柠檬酸(C6H8O7)和草酸(H2C2O4), 其中草酸和甲酸的分泌量最大[15]。三种酸的第一级电离常数(Kα1)分别为草酸6.5×10-2、柠檬酸7.4×10-4、甲酸1.78×10-4[16]。可见, 草酸(H2-Oxalete)的电离常数远高于另外两种有机酸两个数量级以上, 因此其在溶磷过程中占主导作用。
农用土壤铅污染是一个备受关注的领域。据统计, 全世界平均每年排放Pb 500万t[17]。目前, 国家对包括铅污染在内的重金属修复也十分重视[18]。由于铅在土壤中的停留时间长, 会在农产品中富集进而对人体产生较高的毒性, 加之现代社会人类活动频繁(如采矿、电池制造、固体废弃物排放等), 使土壤铅污染的现象日益加重[19-20]。磷灰石能通过溶解后再沉淀的方式与铅离子结合形成溶解度极低的磷氯铅类矿物(Pyromorphite), 从而有效固定铅元素。磷氯铅类矿物主要有三种形态:氯基磷酸铅[Pb5(SO4)3Cl], 磷氯铅类矿物中最常见形态, lgKsp为-84.4;羟基磷酸铅[Pb5(PO4)3OH], lgKsp为-76.8;氟基磷酸铅[Pb5(PO4)3F], lgKsp为-71.6[21-22]。目前, 用于铅污染修复的磷灰石矿物多集中于羟基磷灰石和生物磷灰石[11, 14, 23], 而用氟基磷灰石进行铅污染修复的研究十分有限。氟基磷灰石是自然界存在最广泛的磷灰石矿物类型, 相对于羟基磷灰石和生物磷灰石其获取成本更低(国内价格约500元·t-1), 因此具有更大的应用潜力。但由于磷灰石溶解性极低, 在自然状态下磷酸根(PO43-、HPO42-、H2PO4-)释放量少, 铅元素的固定效率较低[24-25]。解磷微生物可通过溶磷作用提高磷灰石中磷酸根的释放量, 进而提高铅元素的固定效率。因此, 研究解磷微生物复合磷灰石修复土壤铅污染的反应机理对于铅污染修复的研究具有重大意义。但是前人利用黑曲霉复合氟基磷灰石除铅的实验结果[26]表明, 除氟基磷酸铅外, 体系中还有大量草酸铅生成。此外, 很多基于磷灰石的除铅实验还会产生碳酸铅矿物。多种含铅矿物的形成机制, 需要进一步探究, 以便为基于矿物材料的农业土壤铅修复提供理论指导。
GWB (The Geochemist′ s Workbench®12)是一款功能强大的地球化学模拟软件。该软件(GWB专业版)内有13个程序模块, GSS、Rxn、Act2、Tact、TEdit、SpecE8、React、Phase2、X1t、X2t、Gtplot、P2plot、Xtplot, 同时搭配有基于大量地球化学实验或地球化学反应推算的庞大数据库, 可模拟反应路径, 计算稳定区图和水体中的反应平衡状态(如溶解和沉淀反应平衡), 模拟溶质运移过程等, 并能对计算结果进行绘图以及分类储存。由于实际室内或野外实验受限于观测方法和手段, 只能得到反应终产物的浓度, 无法监测体系中物质的浓度(包括产物的生成)随其他条件(如pH值、反应物的添加等)变化的趋势, 难以揭示反应机理。而模拟软件的应用可以准确检测体系中物质浓度变化, 分析反应机理, 恰好解决了这一难题。本论文使用GWB软件的React和Act2程序模块, 结合前人实测实验数据, 模拟微生物结合氟基磷灰石固定铅的反应, 进而探究解磷真菌复合氟基磷灰石修复铅污染的反应机理。
1 材料与方法反应路径指的是一个经历了不可逆反应的系统达到局部热力学平衡的过程, 反应路径模拟是在计算体系中化学种态的基础上发展出来的, 主要依据体系的平衡, 即基于质量守恒方程, 质量作用定律和电荷平衡方程对体系的平衡状态进行计算。
本文的模拟基于南京农业大学生态系统生态学实验室软件平台的GWB专业版软件。GWB软件中的React程序模块用于反应路径模拟。React程序模块主要由两部分组成:初始系统和改变过程。在React程序模块中, 软件从体系的初始平衡状态开始模拟, 通过向体系中添加(去除)某种物质、改变温度或外部缓冲气体的逸度等操作来改变体系的原有平衡, 使之达到新的平衡。本实验采用的反应路径模拟模式为滴定模式(Titration), 即向已知物质组成和反应参数的溶液中逐渐加入一种或多种物质, 然后通过计算得到溶液的组成成分及各项参数随反应进度的进行而变化的过程。这一过程是热力学上的模拟, 模拟上的每一点都代表着体系达到平衡时的状态。
GWB软件中的Act2程序模块用于绘制相图, 反映某元素在某体系中随条件改变产生的形态变化, 以及体系中占主导作用的离子。在Act2程序中需要先确定图像绘制的对象元素, 再设置X轴和Y轴来确定体系中的两个变量(其中离子活度、气体逸度、活度比、逸度比、pH和电势都可作为变量), 最后设置体系在初始状态下溶液中其他物质的含量, 其中其他物质的初始量可设为定值, 也可设置为随变量而改变(如CO2气体在碱性溶液中以CO32-的形式存在)。软件通过计算每一点上体系达到平衡的状态模拟出关于对象元素存在形态的马赛克图, 直观反映对象元素在不同条件下的主要存在形态。
本次模拟主要使用GWB软件中自带的thermo.data数据库, 由于数据库里缺少氟基磷酸铅[Pb5(PO4)3F]的数据, 所以需要根据前人发表的文献添加氟基磷酸铅的摩尔质量和溶解常数lgKsp(-71.6)[27]。
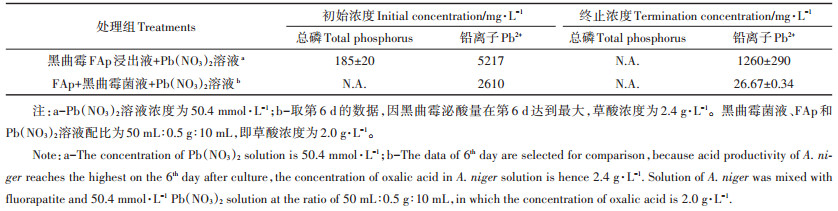
2 结果与分析 2.1 React程序模块模拟结果反应路径模拟的参数设置依据Li等[26]的文章中黑曲霉复合氟基磷灰石除铅实验所用的数据(表 1)。实验中黑曲霉菌液、FAp和Pb (NO3)2溶液(浓度50.4 mmol·L-1)以50 mL:0.5 g:10 mL比例混合, 取黑曲霉菌液第6 d达最大泌酸量时菌液中草酸浓度2.4 g·L-1, 则1 L混合溶液中各组分含量:2 g·L-1草酸、8.3 g FAp和8.4 mmol·L-1 Pb(NO3)2。
|
|
表 1 模拟黑曲霉复合FAp除铅的实验数据[26] Table 1 The experimental data of application of A.niger and fluorapatite in lead remediation[26] |
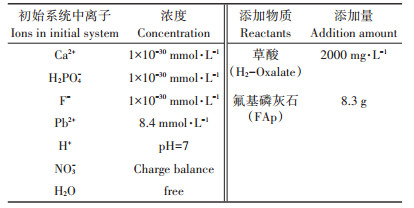
依据上述原始数据, 具体模拟参数设置如表 2所示。其中水为溶剂, 初始系统pH值为7, Pb2+浓度为8.4 mmol·L-1, 钙离子(Ca2+)、磷酸二氢根离子(H2PO4-)、氟离子(F-)和草酸根离子(C2O42-)浓度忽略不计, 硝酸根离子(NO3-)为调节溶液电荷平衡的组分。改变过程中FAp和草酸在滴定模式下分约100步逐次添加到溶液中, 草酸总添加量设为2000 mg·L-1, FAp总添加量为8.3 g。当溶液中某一组分浓度可忽略不计时, 不能将该组分浓度参数直接设为0, 这里用1×10-30 mol·L-1来表示该组分初始浓度忽略不计。
|
|
表 2 React模块反应模拟参数设置 Table 2 The settings in React program module |
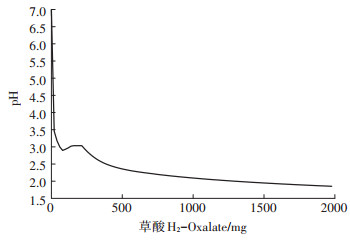
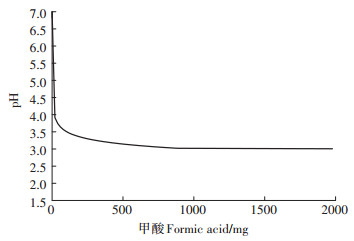
React程序用以模拟溶液pH值随草酸和FAp逐步向溶液中添加至完成的变化曲线。结果如图 1所示, 反应初始pH=7、草酸投加量为80 mg时, pH值降至2.894;投加量为80~200 mg时, pH值回升至3.034;投加量大于200 mg时, 溶液pH值下降变缓并渐趋平稳, 至反应终止时溶液pH=1.99。由于黑曲霉的草酸和甲酸分泌量较大, 为排除甲酸对于模拟结果的影响, 笔者将2000 mg·L-1草酸替换为2000 mg·L-1甲酸, 模拟结果见图 2, 可发现溶液pH值逐渐下降, 在投入量大于20 mg后, 溶液pH值下降变缓并渐趋平稳, 至反应终止时溶液pH=3.00。通过模拟发现, 在加入2000 mg·L-1草酸的情况下, 加入2000 mg·L-1甲酸与否, 对后续的模拟过程没有明显影响。
|
GWB软件在此过程中模拟的是逐步(100步左右)添加草酸的pH值变化 Oxalic acid is added into the mixture step by step for about 100 steps 图 1 溶液pH值在反应中随草酸添加量变化曲线 Figure 1 The curve of pH value varied with addition of oxalic acid in the mixture |
|
GWB软件在此过程中模拟的是逐步(100步左右)添加甲酸的pH值变化 Formic acid is added into the mixture step by step for about 100 steps 图 2 溶液pH值在反应中随甲酸添加量变化曲线 Figure 2 The curve of pH value varied with addition of formic acid in the mixture |
图 3所示为溶液中5种主要离子的浓度随草酸投加量的变化情况。初始系统中Ca2+、H2PO4-、F-和C2O42-浓度均忽略不计, 随着草酸与FAp的添加, Ca2+、H2PO4-、F-和C2O42-浓度在反应早期迅速上升, 之后趋于平稳(图 3a)。Pb2+浓度持续下降(图 3b), Pb2+初始浓度为8.4 mmol·L-1, 反应达终点时溶液中Pb2+浓度为0.048 mmol·L-1, Pb2+与溶液中其他离子结合生成沉淀。

|
图 3 溶液中主要离子浓度随草酸投加量的变化 Figure 3 The concentration curve of the main species varying with the addition of oxalic acid |
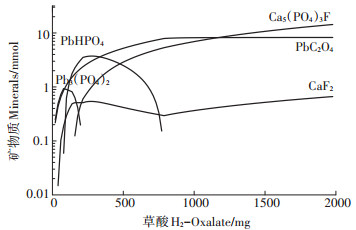
根据图 4显示的模拟结果, 反应过程中先后出现5种矿物:Pb3(PO4)2、PbHPO4、Fluorapatite (氟基磷灰石)、Fluorite (氟化钙)和Pb-Oxalate (草酸铅)。Pb3(PO4)2和PbHPO4随草酸和FAp的投加先生成后部分溶解, 反应达最终状态时, 体系中主要存在氟基磷灰石[Ca5(PO4)3F]、氟化钙(CaF2)和草酸铅(PbC2O4)三种矿物。
|
图 4 5种矿物含量变化曲线 Figure 4 5 minerals formed in the system with the addition of oxalic acid |
FAp作为反应物被逐步投加到体系中, 在反应初期溶解充分, 当草酸投加量达158.2 mg时溶液中开始析出FAp, 其生成量随草酸和FAp的投加不断升高, 说明反应后期FAp受到酸性的限制不再参与反应。草酸铅在草酸投加量达到19.87 mg时开始在溶液中生成, 当草酸投加量达787.3 mg后, 草酸铅含量趋于稳定。此时体系中仅存在草酸铅一种含铅沉淀物。
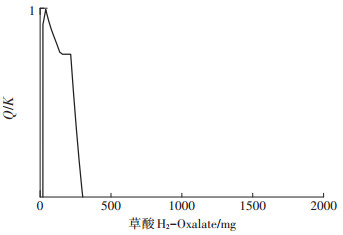
图 5所显示的模拟结果表明, 体系中无氟基磷酸铅生成。饱和指数Q/K值可用来反映某一矿物在溶液中的存在状态, Q为任意时刻溶液中组成该矿物的离子浓度幂次方之积, K为该矿物的溶解度Ksp。Q/K= 1时矿物生成; Q/K < 1时矿物溶解。根据图 3b可知氟基磷酸铅Q/K值先增大后减小, 达到最大时Q/K < 1, 故溶液中无氟基磷酸铅生成。
|
图 5 氟基磷酸铅的饱和指数(Q/K) Figure 5 The saturation value (Q/K) of fluoropyromorphite |
Act2程序的参数设置由三部分构成:对象元素(Diagram species)、坐标轴和溶液中其他元素。设定Pb2+为绘制对象, x轴为F-活度, y轴为草酸活度, 溶液中其他组分为水、Ca2+、H2PO4-、C2O42-和CO2气体。其中水的活度为1, 其他离子的活度近似为这些离子在溶液中的浓度(mol·L-1)。具体参数设置(表 3)依据Li等[26]实验中的处理:黑曲霉FAp浸出液(总磷浓度370 mg·L-1, 草酸2.4 g·L-1)与50.4 mmol·L-1 Pb (NO3)2溶液按1:1混合。黑曲霉FAp浸出液, 即FAp与培养至第6 d的黑曲霉菌液以10 mL:0.5 g混合, 充分反应10 h, 混合液离心后过滤得到滤液。得到的混合液中Pb2+浓度为0.025 2 mol·L-1、Ca2+浓度为0.01 mol·L-1、H2PO4-浓度为0.006 mol·L-1、C2O42-浓度为0.013 mol·L-1。
Act2程序模拟结果(图 6), 即Pb2+在预设溶液(表 3)中随F-活度和草酸活度变化所形成的相图:当溶液中草酸活度lga>-6.475(即草酸浓度>3.35×10-7 mol·L-1), 溶液中仅生成草酸铅一种沉淀, 不受F-浓度影响; 当溶液呈弱酸性、中性或碱性时, 若F-浓度>27 mmol·L-1, 溶液中主要生成氟基磷酸铅; Pb3(PO4)2和PbHPO4在强酸或强碱环境下均不存在; 羟基磷酸铅仅在较窄的草酸铅浓度范围内存在, 此时溶液呈碱性; 在草酸含量极低的碱溶液中仅存在碳酸铅一种沉淀物。

|
黑曲霉FAp浸出液与Pb (NO3)2的混合溶液(总磷含量185 mg·L-1, Pb2+浓度25.2 mmol·L-1) A.niger filtered fluorapatite dissolved solution and Pb (NO3)2 solution (total phosphorous 185 mg·L-1, Pb2+concentration 25.2 mmol·L-1) 图 6 F-和草酸活度改变时铅元素相图 Figure 6 Diagram of lead phase in the mixture when activities of oxalic acid and F-change |
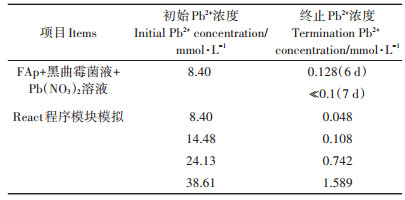
React程序模拟结果验证了解磷真菌复合磷灰石除铅的良好效果。Li等[26]的实验结果与本文软件模拟结果大体一致(表 4), 溶液中Pb2+浓度均由8.4 mmol·L-1降至0.1 mmol·L-1以下。并且, 通过该种物质配比(草酸2.0 g·L-1, FAp 8.3 g)对更高浓度的铅离子模拟发现, 对于浓度高达38.61 mmol·L-1的铅离子依然具有较强的去除能力, 去除率达到95.9%, 证明了该方法对于铅离子的固定效果较强。
|
|
表 4 实验结果[26]与React程序模块模拟结果比较 Table 4 Comparison between actual experimental results[26]and stimulation results |
本文依据Li等[26]实验中的物质配比(草酸2.0 g·L-1, FAp 8.3 g, Pb2+8.4 mmol·L-1)对React程序设置模拟参数, 模拟结果表明最终可能生成的主要含铅矿物有三种, 即Pb3(PO4)2、PbHPO4和PbC2O4, 其中PbC2O4生成量最大。
相对于草酸铅lgKsp (-10)[22], 氟基磷酸铅溶解常数更小, lgKsp为-71.6[28], 因此可以推测, 当溶液中存在游离Ca2+、H2PO4-、F-和C2O42-时, Pb2+可能优先与Ca2+、H2PO4-和F-结合生成氟基磷酸铅沉淀。但是与推测结果相反, 在黑曲霉复合FAp除铅的实际实验中[25], 实验组黑曲霉菌液+FAp+Pb (NO3)2的XRD图谱中未发现氟基磷酸铅的特征峰, 而草酸铅的特征峰和FAp的特征峰明显。通过React程序模拟, 其结果与黑曲霉复合FAp除铅实验的XRD结果具有一致性, 即溶液中生成大量草酸铅, FAp受酸性限制未完全参与反应。推测出现这一矛盾可能原因有两点:(1)溶液中草酸浓度过量, 高浓度的草酸抑制了其他沉淀反应的进行, Pb2+优先与溶液中大量存在的草酸根离子生成草酸铅沉淀; (2)草酸是弱酸, 释放H+的能力有限。而FAp溶解度极低, 因此在该体系内FAp溶解量不高, 释放出的离子浓度低, 未发生溶解再反应。
黑曲霉复合FAp除铅实验[26]的SEM成像结果显示, 黑曲霉菌液+FAp+Pb (NO3)2体系中存在被黑曲霉菌丝包裹的氟基磷酸铅, 与React程序模拟结果不一致, 模拟结果显示草酸+FAp+Pb (NO3)2的混合溶液中无氟基磷酸铅生成。推测是由于黑曲霉溶磷机制复杂, 虽然酸溶过程为溶磷过程中的主要机理, 但也存在其他React模拟中无法体现的生物、物理作用, 使得实际实验结果与模拟结果不一致。根据谌书等[28]的实验, 黑曲霉溶解FAp的过程中, 小的矿物颗粒被菌丝包裹形成矿物和菌体复合物。这可能导致局部FAp溶出, 离子浓度升高(Ca2+、H2PO4-和F-), 进而H2PO4-和F-与溶液中Pb2+结合生成氟基磷酸铅, 并被包裹在菌丝内。根据氟基磷酸铅生成的反应方程式:
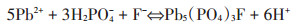
|
影响氟基磷酸铅生成的主要因素为Pb2+、H2PO4-、F-浓度, 以及溶液的酸碱度。其中FAp溶解产生的离子中, F-浓度最低, 因此是影响氟基磷酸铅生成的一个限制因素。在之前的研究中, F-浓度的重要性一直被忽略。
Act2程序模拟草酸浓度和F-浓度变化下, 在Ca2+、H2PO4-、F-和C2O42-存在的Pb2+溶液中, 铅元素的形态变化。F-浓度与草酸浓度共同影响氟基磷酸铅的生成。当lga (F-)>-1.565时(即F-浓度大于27 mmol·L-1), 在弱酸性至碱性溶液中, 有氟基磷灰石生成。当草酸浓度较高时, 溶液中主要生成草酸铅。因此可以解释React程序模拟结果显示大部分情况下未生成氟基磷灰石的原因:溶液中草酸过量, 且F-浓度较低, 未达到形成氟基磷酸铅的条件。草酸浓度大小影响溶液的酸碱度, 酸碱度是影响含铅沉淀物(除氟基磷灰石外)生成的最重要因素。F-浓度变化(总浓度小于27 mmol·L-1时)对其他含铅沉淀物的生成没有影响。当草酸浓度由高到低变化时(即溶液由酸性向碱性变化时), 溶液中生成的主要沉淀物依次为草酸铅、磷酸一氢铅、磷酸铅、羟基磷酸铅、Pb4O (PO4)2和碳酸铅。其中草酸铅在强酸环境下能稳定存在; 羟基磷酸铅在草酸含量较低时生成, 生成范围窄; 碳酸铅在草酸含量极低(溶液呈碱性)时生成。
Shen等[29]在生物磷灰石(BAp, 羟基磷灰石在生物体内的存在形态)复合生物质炭除铅实验的所有处理中都检测到碳酸铅的生成。根据Act2程序模拟结果, 溶于酸性溶液中的二氧化碳不会与Pb2+生成碳酸铅。仅在碱性环境下, 空气中溶于溶液的二氧化碳气体以碳酸根形式存在时与溶液中的铅离子结合生成碳酸铅, 反应方程式:

|
因此处理组酸性生物质炭+BAp+Pb2+反应产物中的碳酸铅很可能并非在原反应体系中形成, 而是烘干过程中随着酸性物质的挥发, 溶液酸度降低, 吸收空气中二氧化碳, 形成碳酸根, 与Pb2+结合生成碳酸铅。这也是很多磷灰石除铅实验出现碳酸铅矿物的原因。
4 结论随着计算机技术发展, 将试验与软件模拟相结合来开展研究已成为农业资源环境领域的一大趋势。GWB软件模拟能够帮助研究者全面系统地揭示解磷微生物复合磷灰石修复土壤铅污染的反应机理和铅的去除机制。
(1) 黑曲霉复合FAp具有较好的除铅效果, 一定条件下, 可使Pb2+浓度由8.4 mmol·L-1降至0.1 mmol·L-1以下。该过程中草酸浓度高, 在反应中起主要作用, 铅离子主要以草酸铅形式沉淀, 草酸铅在强酸条件下不分解, 其中FAp起到缓冲作用, 阻止环境过度酸化。React程序以黑曲霉分泌草酸量达最大时的数据进行模拟, 结果显示体系中无氟基磷酸铅生成。
(2) Act2模拟结果显示, 黑曲霉FAp浸出液与Pb (NO3)2溶液混合体系中, 若草酸根离子浓度为13 mmol·L-1, 在弱酸或碱性环境下, 且溶液中F-浓度大于27 mmol·L-1时, 生成氟基磷酸铅; 当该混合体系中草酸浓度>3.35×10-7 mol·L-1时, 溶液中仅生成草酸铅这一种沉淀; 在酸性条件下, 不会生成羟基磷酸铅及碳酸铅。
用GWB软件模拟反应过程, 能较为直观地展示反应过程中体系中各种物质含量以及化学参数的变化趋势, 但软件模拟是对实际情况的简化, 仅能展示纯化学变化的反应机理。微生物结合磷灰石除铅过程中涉及到的不仅是化学过程, 还有生物作用, 如菌丝体对矿物的包裹是否进一步阻止了反应的进行, 而菌体对溶出离子的吸附作用又可在局部范围内升高某种离子的浓度等这些较为复杂的反应机理还有待进一步的研究。
| [1] |
鲁如坤. 我国的磷矿资源和磷肥生产消费Ⅰ.磷矿资源和磷肥生产[J]. 土壤, 2004, 36(1): 1-4. LU Ru-kun. Phosphorus resource of China and phosphate fertilizer production and consumption Ⅰ. P resources and P fertilizers production of China[J]. Soil, 2004, 36(1): 1-4. |
| [2] |
Howie R A. Apatite:Its crystal chemistry, mineralogy, utilization, and geologic and biologic occurrences[J]. Mineralogical Magazine, 1974, 39: 617-618. DOI:10.1180/minmag.1974.039.305.22 |
| [3] |
Kohn M J, Rakovan J, Hughes J M. Phosphates:Geochemical, geobiological, and materials importance[M]. Washington D C: Mineralogical Society of America, Geochemical Society, 2002.
|
| [4] |
Mkhonto D, Leeuw N H D. A computer modelling study of the effect of water on the surface structure and morphology of fluorapatite:Introducing a Ca10(PO4)6F2 potential model[J]. Journal of Materials Chemistry, 2002, 12: 2633-2642. DOI:10.1039/b204111a |
| [5] |
Pan Y, Fleet M E. Compositions of the apatite-group minerals:Substitution mechanisms and controlling factors[J]. Reviews in Mineralogy & Geochemistry, 2002, 48: 13-49. |
| [6] |
Mathew M, Takagi S. Structures of biological minerals in dental research[J]. Journal of Research of the National Institute of Standards & Technology, 2001, 106(6): 1035-1044. |
| [7] |
Rosling A, Suttle K B, Johansson E, et al. Phosphorous availability influences the dissolution of apatite by soil fungi[J]. Geobiology, 2007, 5(3): 265-280. DOI:10.1111/gbi.2007.5.issue-3 |
| [8] |
Richardson A E, Simpson R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus[J]. Plant Physiology, 2011, 156(3): 989-996. DOI:10.1104/pp.111.175448 |
| [9] |
范丙全, 金继运, 葛诚. 溶磷真菌促进磷素吸收和作物生长的作用研究[J]. 植物营养与肥料学报, 2004, 10(6): 620-624. FAN Bing-quan, JIN Ji-yun, GE Cheng. Effect of phosphate-dissolving fungi on growth and phosphorus uptake of crops[J]. Plant Nutrition and Fertilizer Science, 2004, 10(6): 620-624. DOI:10.3321/j.issn:1008-505X.2004.06.012 |
| [10] |
谌书, 连宾, 刘丛强. 一株胶质芽胞杆菌对磷矿石风化作用的实验研究[J]. 矿物学报, 2008, 28(1): 77-83. CHEN Shu, LIAN Bin, LIU Cong-qiang. The role of a strain of bacillus mucilaginosus on weathering of phosphorite rock under experimental conditions[J]. Acta Mineralogica Sinica, 2008, 28(1): 77-83. DOI:10.3321/j.issn:1000-4734.2008.01.013 |
| [11] |
Wahid O A A, Mehana T A. Impact of phosphate-solubilizing fungi on the yield and phosphorus-uptake by wheat and faba bean plants[J]. Microbiological Research, 2000, 155(3): 221-227. DOI:10.1016/S0944-5013(00)80036-1 |
| [12] |
Kavanagh K. Fungal fermentation systems and products[M]//Fungi: biology and applications. John Wiley & Sons, Ltd, 2005: 89-112.
|
| [13] |
Osorio N W, Habte M. Phosphate desorption from the surface of soil mineral particles by a phosphate solubilizing fungus[J]. Biology & Fertility of Soils, 2013, 49(4): 481-486. |
| [14] |
Mendes G D O, Silva N M R M, Anastácio T C, et al. Optimization of Aspergillus niger rock phosphate solubilization in solid-state fermentation and use of the resulting product as a P fertilizer[J]. Microbial Biotechnology, 2015, 8(6): 930-939. DOI:10.1111/1751-7915.12289 |
| [15] |
Li Z, Bai T S, Dai L T, et al. A study of organic acid production in contrasts between two phosphates solubilizing fungi:Penicillium oxalicum and Aspergillus niger[J]. Scientific Reports, 2016, 6: 25313. DOI:10.1038/srep25313 |
| [16] |
Bolan D N S, Naidu R, Mahimairaja S, et al. Influence of low-molecular-weight organic acids on the solubilization of phosphates[J]. Biology & Fertility of Soils, 1994, 18(4): 311-319. |
| [17] |
李斌, 赵春江. 我国当前农产品产地土壤重金属污染形势及检测技术分析[J]. 农业资源与环境学报, 2013, 30(5): 1-7. LI Bin, ZHAO Chun-jiang. Current situation of heavy metals pollution in soil at farmland and detection technologies analysis in China[J]. Journal of Agricultural Resources and Environment, 2013, 30(5): 1-7. DOI:10.3969/j.issn.1005-4944.2013.05.002 |
| [18] |
聂静茹, 马友华, 徐露露, 等. 我国《土壤环境质量标准》中重金属污染相关问题探讨[J]. 农业资源与环境学报, 2013, 30(6): 44-49. NIE Jing-ru, MA You-hua, XU Lu-lu, et al. Discussion about heavy metal pollution in Soil Environmental Quality Standard in China[J]. Journal of Agricultural Resources and Environment, 2013, 30(6): 44-49. DOI:10.3969/j.issn.1005-4944.2013.06.009 |
| [19] |
Ma L Q, Rao G N. Aqueous Pb reduction in Pb-contaminated soils by florida phosphate rocks[J]. Water, Air, & Soil Pollution, 1999, 110(1/2): 1-16. |
| [20] |
Naik M M, Khanolkar D, Dubey S K. Lead-resistant Providencia alcalifaciens strain 2EA bioprecipitates Pb2+ as lead phosphate[J]. Letters in Applied Microbiology, 2013, 56(2): 99-104. DOI:10.1111/lam.2013.56.issue-2 |
| [21] |
Jin H P, Bolan N. Lead immobilization and bioavailability in microbial and root interface[J]. Journal of Hazardous Materials, 2013, 261(13): 777-783. |
| [22] |
Debela F, Arocena J M, Thring R W, et al. Organic acid-induced release of lead from pyromorphite and its relevance to reclamation of Pb-contaminated soils[J]. Chemosphere, 2010, 80(4): 450-456. DOI:10.1016/j.chemosphere.2010.04.025 |
| [23] |
Oliveira S C D, Mendes G D O, Silva U C D, et al. Decreased mineral availability enhances rock phosphate solubilization efficiency in Aspergillus niger[J]. Annals of Microbiology, 2015, 65(2): 745-751. DOI:10.1007/s13213-014-0914-z |
| [24] |
Giammar D E, Xie L, Pasteris J D. Immobilization of lead with nanocrystalline carbonated apatite present in fish bone[J]. Environmental Engineering Science, 2008, 25(5): 725-736. DOI:10.1089/ees.2007.0168 |
| [25] |
Ma Q Y, Traina S J, Logan T J, et al. In situ lead immobilization by apatite[J]. Environmental Science & Technology, 1993, 27(9): 1803-1810. |
| [26] |
Li Z, Wang F W, Bai T S, et al. Lead immobilization by geological fluorapatite and fungus Aspergillus niger[J]. Journal of Hazardous Materials, 2016, 320: 386-392. DOI:10.1016/j.jhazmat.2016.08.051 |
| [27] |
Traina S J, Laperche V. Contaminant bioavailability in soils, sediments, and aquatic environments[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3365-3371. DOI:10.1073/pnas.96.7.3365 |
| [28] |
谌书, 郑厚义. 磷矿石的微生物风化作用:以一株黑曲霉(Aspergillus niger)为例[J]. 生态环境学报, 2007, 16(3): 1007-1013. CHEN Shu, ZHENG Hou-yi. The role of microorganism in the weathering of phosphorite rock:A case study of Aspergillus niger strain[J]. Ecology and Environment, 2007, 16(3): 1007-1013. DOI:10.3969/j.issn.1674-5906.2007.03.059 |
| [29] |
Shen Z T, Tian D, Zhang X Y, et al. Mechanisms of biochar assisted immobilization of Pb2+ by bioapatite in aqueous solution[J]. Chemosphere, 2017, 190: 260-266. |
 2019, Vol. 36
2019, Vol. 36