2. 养分资源高效开发与综合利用国家重点实验室, 金正大生态工程集团股份有限公司, 山东 临沭 276700;
3. 山东蓬勃生物科技有限公司, 山东 泰安 271018
2. State Key Laboratory of Nutrition Resources Integrated Utilization, Kingenta Ecological Engineering Group Co., Linshu 276700, China;
3. Pengbo Biology Technology Ltd. Co., Tai'an 271018, China
生物刺激素和植物生长调节剂是与植物激素具有相似生理和生物学效应的一类物质,适宜的浓度可改善作物形态指标、提高产量、促进果实淀粉累积[1-2]。碧护为复合型的植物源生长免疫诱导剂,含有植物内源激素、黄酮类催化平衡成分、氨基酸化合物、抗逆诱导剂等多种植物活性物质,主要成分为0.136%芸苔·吲乙·赤霉酸,可有效预防和缓解低温冻害[3-4]、干旱[5]、涝害、药害、土壤板结、盐碱等非生物因子与病虫害等生物因子造成的危害,在粮食[6]、蔬菜、水果、棉油[7]等多种作物上应用效果较好,较大地提升了农产品的产量和品质。Clouse等[8]研究表明碧护主要成分芸苔素内酯主要参与植物生长发育、管道分化及细胞增殖和凋亡等生理活动,可促进细胞伸长、分裂[9],增强光合作用[10]。周小毛等[11]、张兴华等[12]研究表明芸苔素内酯可增强农药药效、促进降解等。腐植酸在自然界中广泛存在,主要成分是植物与土壤微生物分解合成的天然生物大分子,其市售产品主要为腐植酸钠,含有羧基、醌基和酚羟基等活性功能团[13],具有亲水性、吸附性等生物活性,可促进作物对营养元素的吸收[14-15]。裴瑞杰等[16]研究表明,施用腐植酸可促进植株对氮素的积累并提高氮利用率。刘方春等[17]、Fujisawa等[18]研究表明,当肥料中添加具有生物和化学活性的腐植酸后,腐植酸通过螯合、吸附和生物刺激等作用后,可明显提高化肥利用率,使农作物产量提高10%~30%。海藻粗提物富含海藻多糖、碘、甘露醇、藻褐素、海藻多酚等多种活性成分,可增强作物抗逆、抗病能力,提高作物产量和品质,是较为重要的生物刺激素之一[19]。植物内生菌是一类重要的微生物资源,可提高宿主作物激素水平,显著促进植物生长,提高作物抗逆能力[20],其与植物的互作机制日益受到关注。宋艳雨等[21]研究表明,宛氏拟青霉提取物对玉米、大豆、水稻都有一定的促进作用,能够促进作物根系发育,增加产量。
虽然较低浓度生物刺激素和植物生长调节剂可以促进植物生命过程的某些环节,具有增产[22-23]、改善品质、增强作物抗逆性等潜力,但其规范施用要求高、剂量严格导致大面积推广难[24],在粮棉作物和设施蔬菜的应用研究中发现,其促生或抑制浓度存在较大差异[25]。相关物质虽已被发现多年,但并未实现稳定商业化生产,主要原因是其影响因素复杂[26-27],限制了其应用。
樱桃萝卜(Raphanus sativus L. var.radculus pers)是中国主要的四季萝卜之一,耐寒性强,生育期短,单位面积产量高,同时个体小,外形、色泽美观,口感爽脆,解油腻,营养丰富,适于生吃,经济效益高。而适于樱桃萝卜生产的生物刺激素种类及浓度研究鲜有报道。
本试验探讨不同浓度的宛氏拟青霉提取物与碧护(0.136%芸苔·吲乙·赤霉酸)、腐植酸钠、海藻酸浸种及浇灌对樱桃萝卜产量及品质的影响,探究供试生物刺激素和植物生长调节剂对樱桃萝卜增产提质的最适种类及浓度,为其在实际生产中的合理高效应用提供理论和技术支持。
1 材料与方法 1.1 供试材料试验于山东省泰安市山东农业大学土肥资源高效利用国家工程实验室进行。供试生物刺激素和植物生长调节剂:碧护,来源于上海拜诺国际生物科技进出口公司;腐植酸钠液体,来源于山东泉林嘉有肥料有限责任公司;海藻酸粗提液,来源于连云港环宇海藻助剂有限公司;宛氏拟青霉(Paecilomyces variotii)提取物分离自野生沙棘根系[28],来源于山东蓬勃生物科技有限公司。
宛氏拟青霉SJ1(保藏号CGMCC NO.10114)提取物制备:健康的野生沙棘样品采集后立即处理、洗净,然后将根切成小段,用75%的酒精冲洗,用10%巴氏消毒液洗18 min,最后用无菌水冲洗4次;将上述消毒过的根在无菌条件下分别切割成0.5 cm长的小段, 接种于孟加拉红培养基平板上,置于28 ℃培养箱培养5 d后,即可见样品切割过的边缘长出菌丝,经平板(孟加拉红培养基)反复分离、纯化,最后得到宛氏拟青霉菌株SJ1。将沙棘内生真菌分离得到的宛氏拟青霉菌株SJ1接到平板PDA培养基上,25 ℃培养6 d,用打孔器琼脂挖块接种于250 mL三角烧瓶,瓶中装有50 mL种子培养液(PDA培养基不加琼脂做成),于28 ℃、120 r·min-1下在旋转摇床上培养3 d作为种子,以10%量接种入装有150 mL发酵培养基(发酵培养基为马铃薯提取液,酵母膏1.0 g,蛋白胨3.0 g,葡萄糖15.0 g,琼脂17.0 g。马铃薯提取液的制备:去皮马铃薯200 g,切成小块,加海水1000 mL煮沸并持续30 min,滤去马铃薯块,将滤液补足至1000 mL)的500 mL三角瓶中,同条件下培养5 d,终止发酵,放入4 ℃冰箱中保存。将培养得到的菌丝体洗涤后于60 ℃烘干、称重,经高速粉碎机粉碎,用同体积乙醇浸提3次,每次24 h,用磁力搅拌器将其混匀,超声波振荡1 h,真空抽滤,滤液即为宛氏拟青霉提取物[28]。
供试基质为蔬菜育苗基质,来自丹麦品氏托普公司。基本理化性质:有机质含量434.30 g·kg-1,NO3--N含量296.70 mg·kg-1,NH4+-N含量84.09 mg·kg-1,有效磷含量99.25 mg·kg-1,速效钾含量1 169.30 mg·kg-1,pH值5.94(水基质比5:1),电导率2180 μS·cm-1(水基质比5:1)。
供试樱桃萝卜种子来源于荷兰BEJO公司,生长期30~40 d。供试育苗梯形方盒上口边长10 cm、高8 cm、底面边长7 cm。自配营养液是氮、磷、钾比例为20:10:20的育苗专用肥1000倍的水溶液[29]。
1.2 试验设计试验共设13个处理(表 1),置于光照培养箱(宁波江南仪器厂)内,昼夜温度设置为(25±1)℃,相对湿度通过加湿器维持在50%~60%,光照强度约900 μmol·m-2·s-1,每日设定光照16 h[29],各处理重复3次。
|
|
表 1 试验处理 Table 1 Treatments for experiment |
试验于2017年12月23日至2018年1月20日进行。浸种时,选取大小一致籽粒饱满的萝卜种子,分别置于不同浓度的四种供试材料稀释液中(表 1),于25 ℃恒温培养5 h。浸种结束后分别播种2粒于装满供试基质的育苗方盒中,埋深0.3 cm,播种后第5 d(2017年12月28日)间苗,配制营养液与5倍浓度的生物刺激素或植物生长调节剂混合液,播种后于第8 d(2017年12月31日)和16 d(2018年1月8日),分别用混合液50 mL进行灌根,培养28 d后收获。
1.3 样品分析方法生长指标为地上部干质量和鲜质量、地下部果实干质量和鲜质量、根冠比、最大叶长和最大叶宽,测定时每个处理3株分别测定;植株叶片SPAD值采用日本Minolta公司生产的SPAD-502叶绿素仪测定;萝卜可溶性固形物含量采用折光计法,可溶性蛋白总量采用考马斯亮蓝法,过氧化物酶(POD)活性采用愈创木酚法[30]。供试腐植酸钠和宛氏拟青霉提取物红外光谱采用美国尼高力公司Nicolet Nexus 410型红外光谱仪测定,波数范围400~4000 cm-1,光谱分辨率2 cm-1,信噪比50 000:1,扫描32次;供试宛氏拟青霉提取物低分辨质谱采用AB公司QTRAP质谱仪测定,ESI源,离子源温度、离子喷雾电压、帷幕气体、离子源气体1和离子源气体2分别设定为550 ℃、5.5 kV、20 psi(1 psi=6.895 kPa)、20 psi和15 psi。
1.4 数据分析方法ANOVA方差分析及Duncan差异显著性检验通过Excel 2016和SAS 8.2软件完成;采用Excel 2016软件进行作图。
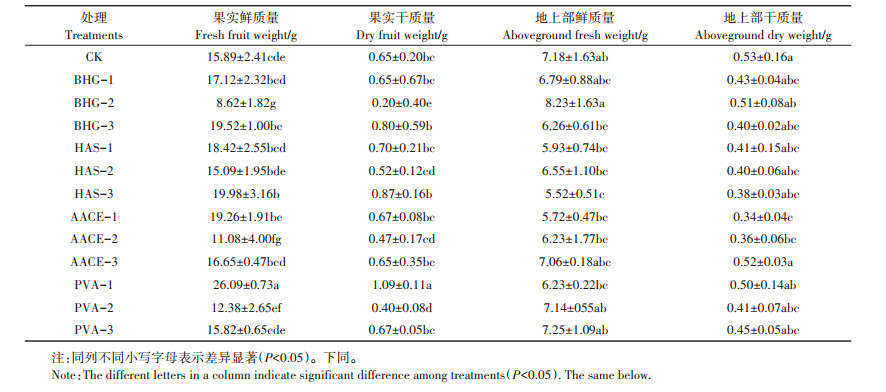
2 结果与讨论 2.1 宛氏拟青霉提取物对樱桃萝卜生物量的影响不同浓度的生物刺激素和植物生长调节剂对樱桃萝卜生物量的影响表现出一定的差异性(表 2)。与清水对照(CK)相比,生物刺激素PVA-1处理果实鲜质量显著增加64.2%,HAS-3处理显著增加25.7%;PVA-1处理果实干质量显著提高67.7%;植物生长调节剂BHG-2处理与生物刺激素AACE-2处理果实鲜质量分别显著减少45.8%和30.3%,其他浓度生物刺激素处理差异不显著,说明添加宛氏拟青霉提取物对樱桃萝卜有较好的促生效果。与对照相比,HAS-3处理的地上部鲜质量显著降低,AACE-1、AACE-2处理的地上部干质量显著降低,其他各处理差异不显著。因此,设定的推荐最适浓度,即处理中各生物刺激素的中间浓度,对樱桃萝卜并不完全适用,这可能与生物刺激素和植物生长调节剂广谱性差、作用浓度范围窄、对不同作物有不同的最佳适用浓度有关,这与靳慧卿等[25]研究结果一致。
|
|
表 2 不同处理的樱桃萝卜生物量 Table 2 Biomass of cherry radish with different treatments |
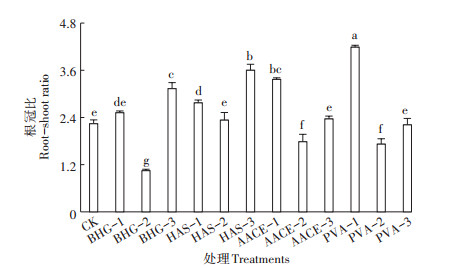
根冠比是指植物地下部分与地上部分生物量的比值,可直观反映根系的生长情况。植物生长调节剂BHG-3处理和生物刺激素PVA-1、HAS-1、HAS-3、AACE-1处理与清水对照相比,根冠比显著提高,其中PVA-1处理和HAS-3处理分别显著提高87.1%和60.9%;BHG-2处理根冠比显著降低53.3%,其他处理无显著差异;不同种类生物刺激素和植物生长调节剂不同浓度之间综合比较,推荐最适浓度处理根冠比均低于最低与最高浓度处理(图 1),证实了该类材料广谱性差,对不同作物有不同的最佳适用浓度,且作用浓度要求严格,这与郑剑超等[24]研究结果一致。
|
不同小写字母表示差异显著(P < 0.05)。下同 The different letters indicate significant difference among treatments (P < 0.05). The same below 图 1 不同处理的樱桃萝卜根冠比 Figure 1 Root-shoot ratio of cherry radish with different treatments |
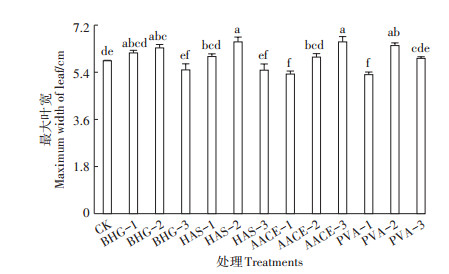
叶片长度、宽度决定植株的叶片面积,进而影响植株光合作用,SPAD值可衡量植株的叶绿素含量。与清水对照相比,供试材料均有促进樱桃萝卜最大叶长的作用,其中HAS-3处理与对照相比差异不显著,而其他各处理均有显著促进作用,各处理中,PVA-2处理促进作用最好,最大叶片长度显著提高28.0%(图 2)。生物刺激素PVA-2、HAS-2、AACE-3处理及植物生长调节剂BHG-2处理樱桃萝卜的最大叶宽显著提高,其中PVA-2处理显著提高了10.0%,其他处理差异不显著或略有降低(图 3)。说明添加适宜浓度的宛氏拟青霉提取物可显著增加樱桃萝卜最大叶长、最大叶宽,促进其生长。植物生长调节剂BHG-2处理和生物刺激素PVA-2处理樱桃萝卜第16、21 d的SPAD值显著降低,分别降低20.0%、21.5%和21.0%、22.7%,其他浓度处理差异不显著(表 3)。

|
图 2 不同处理的樱桃萝卜最大叶长 Figure 2 Maximum length of leaf of cherry radish with different treatments |
|
图 3 不同处理的樱桃萝卜最大叶宽 Figure 3 Maximum width of leaf of cherry radish with different treatments |
|
|
表 3 不同处理的樱桃萝卜叶片SPAD值 Table 3 The SPAD value of cherry radish with different treatments |
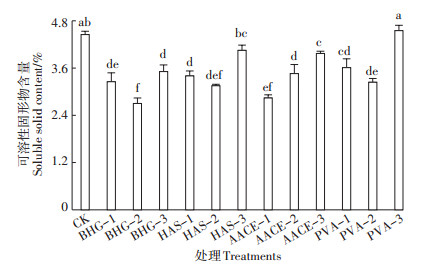
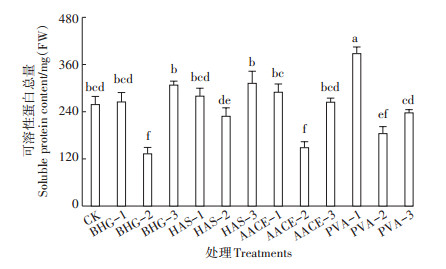
可溶性固形物与可溶性蛋白是表征作物品质的重要指标。与清水对照相比,植物生长调节剂BHG-2处理樱桃萝卜可溶性固形物含量显著降低了39.4%,生物刺激素HAS-3、PVA-3处理与对照相比无显著差异,其他各处理可溶性固形物含量均有所降低(图 4)。与清水对照相比,PVA-1处理的樱桃萝卜可溶性蛋白总量显著提高了50.1%,其他处理差异不显著或有所降低(图 5)。造成植物生长调节剂BHG与生物刺激素HAS、AACE处理樱桃萝卜品质下降的原因可能是这三种外源添加物不适宜樱桃萝卜的生产,而造成PVA-2、PVA-3处理的樱桃萝卜品质下降的原因可能是高浓度对萝卜有抑制作用。上述产量与品质的分析结果趋势一致,也验证了此猜想。
|
图 4 不同处理的樱桃萝卜可溶性固形物含量 Figure 4 Soluble solid contents of cherry radish with different treatments |
|
图 5 不同处理的樱桃萝卜可溶性蛋白总量 Figure 5 Soluble protein contents of cherry radish with different treatments |
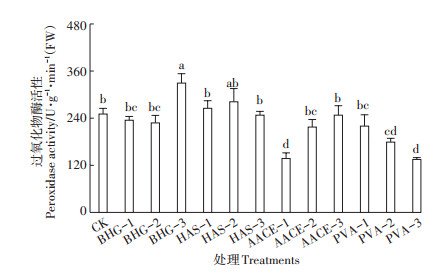
过氧化物酶是植物体内活性氧簇清除系统的主要成分之一,其活性高低可在一定程度上反映逆境对植物的损害程度和植物的衰老进程。与清水对照相比,植物生长调节剂BHG-3处理樱桃萝卜的过氧化物酶活性显著提高了31.3%,生物刺激素PVA-1处理差异不显著,其他处理差异不显著或有所降低(图 6)。
|
图 6 不同处理的樱桃萝卜过氧化物酶活性 Figure 6 Peroxidase activity of cherry radish with different treatments |
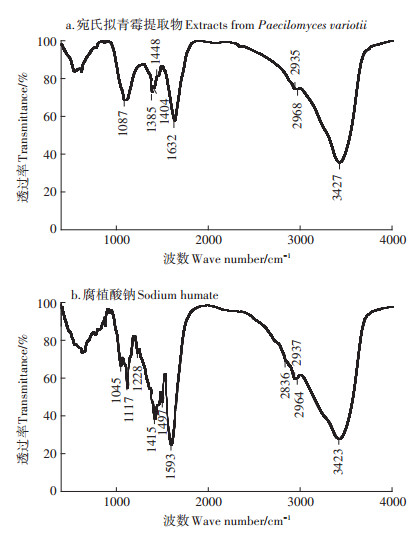
红外光谱具有高度的特征性,可用来研究分子结构、化学键和特征官能团,被广泛用于表征和鉴别各种化学物种[31]。通过谱图检索,供试宛氏拟青霉提取物红外光谱中,3427 cm-1为羟基的伸缩振动峰,2968、2935 cm-1分别为甲基和亚甲基的反对称伸缩振动峰,1448 cm-1为甲基的反对称弯曲振动峰,1385 cm-1为甲基的弯曲振动峰,1087 cm-1为醇中C-O键的伸缩振动峰(图 7a)。其中,酚基和醌基可形成氧化还原体系,提高作物多酚氧化酶、过氧化物酶和抗坏血酸氧化酶等活性,促进呼吸作用,利于作物生长发育[32],其活性基团具有较强的吸附和交换养分离子的能力[33],同时可促进根系和侧根发育,提高根有效吸收面积,提升根系活力从而促进植株长势[34]。供试腐植酸钠红外光谱中3423 cm-1为羟基或氨基的伸缩振动峰,2964、2937、2836 cm-1为甲基和亚甲基的伸缩振动峰,1593 cm-1为苯环的伸缩振动峰,1415 cm-1为醇羟基或酚羟基的O-H伸缩振动峰,1228和1117 cm-1为醚键中C-O的伸缩振动峰,1045 cm-1为醇羟基或酚羟基中C-O的伸缩振动峰(图 7b)。
|
图 7 供试样品红外光谱 Figure 7 Infrared spectrum of the selected samples |
供试宛氏拟青霉提取物分离自野生沙棘根系,沙棘(Hippophae rhamnoides)是防治荒漠化和水土保持的重要经济树种[35],是我国防风固沙的绿色屏障,其根系发达,抗逆性强,枝叶茂密。沙棘根系提取物经低分辨率质谱检测(图 8),可能是由分子量111.1~1 238.8之间的小分子寡糖、氨基酸、嘧啶核苷、糖蛋白、多肽等促生物质组成,能以较低浓度起到较好的增产效果,有效作用浓度仅为腐植酸钠的1/30 000。这可能是由于上述活性成分可诱导植物产生多种内源激素,从而促进作物生长发育[36]。其增产效果仍需通过田间试验进行验证,低浓度促生机制需通过代谢组学等研究手段深入探讨。
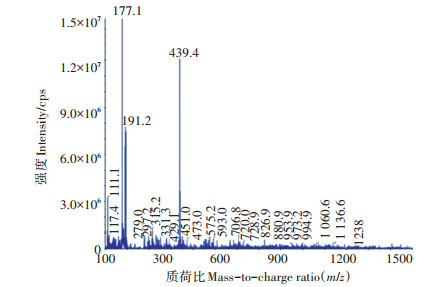
|
图 8 供试宛氏拟青霉提取物质谱图 Figure 8 Mass spectrometry of extracts from Paecilomyces variotii |
本研究条件下,宛氏拟青霉提取物2.50 μg·L-1浸种及灌根处理用量低、增产效果好且提高品质,为樱桃萝卜生产最优处理,而其促生浓度仅为碧护和腐植酸钠浓度的约1/30 000,海藻酸浓度的约1/300 000,具有极高的生物活性和较低的生产成本,可在大幅度稀释的条件下广泛适用于喷灌、滴灌等水肥一体化技术中,应用推广前景极为广阔,然而其对作物产量与品质的影响机制仍需深入探讨。
| [1] |
李辉, 张志强, 田昊. 植物生长调节剂对平菇菌丝生长的影响[J]. 北方园艺, 2013(23): 158-160. LI Hui, ZHANG Zhi-qiang, TIAN Hao. Effect of plant growth regulators on the growth of Pleurorus ostreatus[J]. Northern Horticulture, 2013(23): 158-160. |
| [2] |
袁金蕊, 李霞, 李宝珍, 等. 植物生长调节剂对叶菜产量及氮吸收的影响[J]. 水土保持学报, 2013, 27(2): 131-135. YUAN Jin-rui, LI Xia, LI Bao-zhen, et al. Effects of plant growth regulators on yield and nitrogen uptake in leafy-vegetable crop[J]. Journal of Soil & Water Conservation, 2013, 27(2): 131-135. |
| [3] |
刘强, 董家行, 高金权, 等. 碧护对棉花生长和产量性状的影响[J]. 天津农林科技, 2012(6): 5-6. LIU Qiang, DONG Jia-hang, GAO Jin-quan, et al. Effects of bifurcation on growth and yield of cotton[J]. Science and Technology of Tianjin Agriculture and Forestry, 2012(6): 5-6. DOI:10.3969/j.issn.1002-0659.2012.06.004 |
| [4] |
Shtilman M I, Tzatzarakis M N, Voskanyan P S, et al. Correlation between plant growth regulator release rate and bioactivity for the series of newly synthesized phytoactive polymers[J]. Journal of Plant Growth Regulation, 2006, 25(3): 211-218. DOI:10.1007/s00344-006-0002-0 |
| [5] |
Schiavon M, Leinauer B, Serena M, et al. Plant growth regulator and soil surfactants' effects on saline and deficit irrigated warm-season grasses:Ⅱ. Pigment content and superoxide dismutase activity[J]. Crop Science, 2014, 54(6): 2827-2836. DOI:10.2135/cropsci2013.10.0708 |
| [6] |
Anjum S A, Wang L C, Farooq M, et al. Brassinolide application improves the drought tolerance in maize through modulation of enzymatic antioxidants and leaf gas exchange[J]. Journal of Agronomy & Crop Science, 2011, 197(3): 177-185. |
| [7] |
El-Mashad A A, Mohamed H I. Brassinolide alleviates salt stress and increases antioxidant activity of cowpea plants(Vigna sinensis)[J]. Protoplasma, 2012, 249(3): 625-635. DOI:10.1007/s00709-011-0300-7 |
| [8] |
Clouse S D. Brassinosteroids[M]//Lennarz W J, Lane M D. Encyclopedia of biological chemistry. 2nd ed. San Diego: Elsevier, 2013: 250-254
|
| [9] |
Clouse S D, Zurek D M, McMorris T C, et al. Effect of brassinolide on gene expression in elongating soybean epicotyls[J]. Plant Physiology, 1992, 100(3): 1377-1383. DOI:10.1104/pp.100.3.1377 |
| [10] |
Vardhini B V, Rao S S R. Effect of brassinosteroids on growth, metabolite content and yield of arachis hypogaea[J]. Phytochemistry, 1998, 48(6): 927-930. DOI:10.1016/S0031-9422(97)00710-3 |
| [11] |
周小毛, 柏连阳, 刘雪源, 等. 天然芸苔素内酯缓解胺苯磺隆对后茬水稻药害的作用机理初探[J]. 农药学学报, 2003, 5(1): 61-67. ZHOU Xiao-mao, BAI Lian-yang, LIU Xue-yuan, et al. Studies on the mechanism of activity of brassinolide for reducing the phytotoxicity of ethametsulfuron on rice[J]. Chinese Journal of Pesticide Science, 2003, 5(1): 61-67. DOI:10.3321/j.issn:1008-7303.2003.01.010 |
| [12] |
张兴华, 李捷. 氯吡脲和芸苔素内酯对棉花田草甘膦药害的解毒效果[J]. 农药, 2008, 47(11): 834-835. ZHANG Xing -hua, LI Jie. Detoxification effects of forchlorfen and brassins for glyphosate damage on the cotton[J]. Agrochemicals, 2008, 47(11): 834-835. DOI:10.3969/j.issn.1006-0413.2008.11.020 |
| [13] |
安梦鱼, 张青, 章赞德, 等. 不同用量腐植酸对土壤有效硒含量和硒的形态以及大蒜硒吸收的影响[J]. 农业资源与环境学报, 2017, 34(2): 128-133. AN Meng-Yu, ZHANG Qing, ZHANG Zan-de, et al. Effects of different amounts of humic acid on the content of soil available selenium, the forms of selenium and the selenium absorption in garlic[J]. Journal of Agricultural Resources and Environment, 2017, 34(2): 128-133. |
| [14] |
马建军, 邹德文, 吴贺平, 等. 腐植酸钠对镉胁迫小麦幼苗生物效应的研究[J]. 中国生态农业学报, 2005, 13(2): 91-93. MA Jian-jun, ZOU De-wen, WU He-ping, et al. Biological effect of sodium humate on the Cd-stressed wheat seedlings[J]. Chinese Journal of Eco-Agriculture, 2005, 13(2): 91-93. |
| [15] |
袁天佑, 冀建华, 王俊忠, 等. 腐植酸与氮肥配施对冬小麦氮素吸收利用及产量的影响[J]. 中国生态农业学报, 2017, 25(3): 365-372. YUAN Tian-you, JI Jian-hua, WANG Jun-zhong, et al. Effect of combined application of humic acid and nitrogen fertilizer on nitrogen uptake, utilization and yield of winter wheat[J]. Chinese Journal of EcoAgriculture, 2017, 25(3): 365-372. |
| [16] |
裴瑞杰, 袁天佑, 王俊忠, 等. 施用腐植酸对夏玉米产量和氮效率的影响[J]. 中国农业科学, 2017, 50(11): 2189-2198. PEI Rui-jie, YUAN Tian-you, WANG Jun-zhong, et al. Effects of application of humic acid on yield, nitrogen use efficiency of summer maize[J]. Scientia Agricultura Sinica, 2017, 50(11): 2189-2198. DOI:10.3864/j.issn.0578-1752.2017.11.023 |
| [17] |
刘方春, 邢尚军, 段春华, 等. 腐植酸缓效肥料的NO3--N田间淋溶及土壤残留[J]. 环境科学, 2010, 31(7): 1619-1624. LIU Fang-chun, XING Shang-jun, DUAN Chun-hua, et al. Nitrate nitrogen leaching and residue of humic acid fertilizer in field soil[J]. Environmental Science, 2010, 31(7): 1619-1624. |
| [18] |
Fujisawa N, Fukushima M, Yamamoto M, et al. Structural alterations of humic acid fractions in a steel slag-compost fertilizer during fertilization:Analysis by pyrolysis/methylation-gas chromatography/mass spectrometry[J]. Journal of Analytical & Applied Pyrolysis, 2012, 95(5): 126-133. |
| [19] |
崔维香, 刘正一, 王明鹏, 等. 海藻提取液对黄瓜·番茄种子萌发和幼苗生长的影响[J]. 安徽农业科学, 2017, 45(15): 28-33. CUI Wei-xiang, LIU Zheng-yi, WANG Ming-peng, et al. Effects of seaweed extract on seed germination and seedling growth of cucumber (Cucumis sativus) and tomato(Solanum lycopersicum)[J]. Journal of Anhui Agricultural Sciences, 2017, 45(15): 28-33. DOI:10.3969/j.issn.0517-6611.2017.15.010 |
| [20] |
杨波, 陈晏, 李霞, 等. 植物内生菌促进宿主氮吸收与代谢研究进展[J]. 生态学报, 2013, 33(9): 2656-2664. YANG Bo, CHEN Yan, LI Xia, et al. Research progress on endophyte -promoted plant nitrogen assimilation and metabolism[J]. Acta Ecologica Sinica, 2013, 33(9): 2656-2664. |
| [21] |
宋艳雨, 杨镇, 马晓颖, 等. 一株具有植物促生作用的沙棘内生真菌的分离鉴定[J]. 辽宁农业科学, 2016(2): 19-22. SONG Yan-yu, YANG Zhen, MA Xiao-ying, et al. Isolation and identification of a strain endophytic fungi made plant growth promoting from sea buckthorn[J]. Liaoning Agricultural Sciences, 2016(2): 19-22. DOI:10.3969/j.issn.1002-1728.2016.02.005 |
| [22] |
刘春娟, 冯乃杰, 郑殿峰, 等. 植物生长调节剂S3307和DTA-6对大豆源库碳水化合物代谢及产量的影响[J]. 中国农业科学, 2016, 49(4): 657-666. LIU Chun-juan, FENG Nai-jie, ZHENG Dian-feng, et al. Effects of plant growth regulators(S3307) and DTA-6 on carbohydrate content and yield in soybean[J]. Scientia Agricultura Sinica, 2016, 49(4): 657-666. |
| [23] |
Browne R A, Browne R, White E, et al. Responses of developmental yield formation processes in oats to variety, nitrogen, seed rate and plant growth regulator and their relationship to quality[J]. Journal of Agricultural Science, 2006, 144(6): 533-545. DOI:10.1017/S0021859606006538 |
| [24] |
郑剑超, 智雪萍, 董飞. 植物诱导剂对黄瓜基质穴盘苗生长的影响[J]. 北方园艺, 2017(2): 44-46. ZHENG Jian-chao, ZHI Xue-ping, DONG Fei. Effects of plant inducer on growth of cucumber matrix plug seedling[J]. Northern Horticulture, 2017(2): 44-46. |
| [25] |
靳慧卿, 米福贵, 闫利军, 等. 不同外植体及生物刺激素对几种豆科牧草体细胞胚诱导的影响[J]. 植物生理学报, 2015, 51(12): 2169-2174. JIN Hui-qing, MI Fu-gui, YAN Li-jun, et al. Effects of different explants and plant growth regulator combinations on somatic embryo induction of leguminous forage plants[J]. Plant Physiology Journal, 2015, 51(12): 2169-2174. |
| [26] |
Ramburan S, Greenfield P. Use of ethephon and chlormequat chloride to manage plant height and lodging of irrigated barley(cv. Puma) when high rates of N-fertilizer are applied[J]. South African Journal of Plant & Soil, 2007, 24(4): 181-187. |
| [27] |
刘文彬, 冯乃杰, 张盼盼, 等. 乙烯利和激动素对玉米茎秆抗倒伏和产量的影响[J]. 中国生态农业学报, 2017, 25(9): 1326-1334. LIU Wen-bin, FENG Nai-jie, ZHANG Pan-pan, et al. Effects of ethephon and kinetin on lodging-resistance and yield of maize[J]. Chinese Journal of Eco-Agriculture, 2017, 25(9): 1326-1334. |
| [28] |
山东蓬勃生物科技有限公司.一种宛氏拟青霉菌株SJ1及其应用: 201510059660. 1[P]. 2015-02-05. Shandong Pengbo Biology Technology Ltd. Co.. Application for Paecilomyces Variotii of SJ1: 201510059660. 1[P]. 2015-02-05. |
| [29] |
胡红. 樱桃萝卜日光温室穴盘基质栽培技术探究[J]. 南方农业, 2017, 11(9): 4-5. HU Hong. Research on the cultivation techniques of cherry radish solar greenhouse[J]. South China Agriculture, 2017, 11(9): 4-5. |
| [30] |
Wang F X, Wu X X, Shock C C, et al. Effects of drip irrigation regimes on potato tuber yield and quality under plastic mulch in arid northwestern China[J]. Field Crops Research, 2011, 122(1): 78-84. DOI:10.1016/j.fcr.2011.02.009 |
| [31] |
王多加, 周向阳, 金同铭, 等. 近红外光谱检测技术在农业和食品分析上的应用[J]. 光谱学与光谱分析, 2004, 24(4): 447-450. WANG Duo-jia, ZHOU Xiang-yang, JIN Tong-ming, et al. Application of near-infrared spectroscopy to agriculture and food analysis[J]. Spectroscopy & Spectral Analysis, 2004, 24(4): 447-450. DOI:10.3321/j.issn:1000-0593.2004.04.019 |
| [32] |
刘增兵, 束爱萍, 赵秉强, 等. 风化煤腐植酸增效尿素红外光谱分析[J]. 农业资源与环境学报, 2014, 31(5): 393-400. LIU Zeng-bing, SHU Ai-ping, ZHAO Bing-qiang, et al. The infrared spectrum analysis on compound urea with humic acid extracted from weathered coal[J]. Journal of Agricultural Resources & Environment, 2014, 31(5): 393-400. |
| [33] |
刘继培, 刘唯一, 周婕, 等. 施用腐植酸和生物肥对草莓品质、产量及土壤农化性状的影响[J]. 农业资源与环境学报, 2015, 32(1): 54-59. LIU Ji-pei, LIU Wei-yi, ZHOU Jie, et al. Effects of applying humic acids and bio-fertilizer on the qualities and yields of strawberry and soil agrochemical characters[J]. Journal of Agricultural Resources and Environment, 2015, 32(1): 54-59. |
| [34] |
梁太波, 王振林, 刘兰兰, 等. 腐植酸钾对生姜生长、钾素吸收及钾肥利用率的影响[J]. 水土保持学报, 2008, 22(1): 87-90. LIANG Tai-bo, WANG Zhen-lin, LIU Lan-lan, et al. Effects of potassium humate on growth, potassium uptake and utilization efficiency of ginger[J]. Journal of Soil & Water Conservation, 2008, 22(1): 87-90. DOI:10.3321/j.issn:1009-2242.2008.01.019 |
| [35] |
杜维, 丁健, 阮成江. 沙棘果实发育过程中内源激素水平的动态变化[J]. 植物学报, 2018, 53(2): 219-226. DU Wei, DING Jian, RUAN Cheng-jiang, et al. Dynamic changes of hormones contents in different fruit developmental stages of sea buckthorn[J]. Chinese Bulletin of Botany, 2018, 53(2): 219-226. |
| [36] |
秦娟娟, 闫淑珍, 刘佳. 植物内生细菌固体菌剂对辣椒的促生和防病作用[J]. 植物保护学报, 2010, 37(4): 325-330. QIN Juan-juan, YAN Shu-zhen, LIU Jia. The growth-promotion on pepper and control of Phytophthora capsici by endophytic bacterium agents[J]. Acta Phytophylacica Sinica, 2010, 37(4): 325-330. |
 2019, Vol. 36
2019, Vol. 36