随着我国经济水平的不断提升,畜牧业也得到了迅速发展,这也使养殖场废水污染问题日益严重,给环境造成了巨大的压力,因此养殖场污水的处理问题亟待解决[1]。目前藻类技术作为一种新型的废水处理技术,由于能耗低、适应性广,被认为是一种极有前景的废水处理技术,并得到了广泛的研究[2-3]。将藻类对污水氮磷营养物和有机物的摄取去除功效与细菌强大的污染物降解能力有效地结合起来,可以建立藻菌共培养体系,并应用于沼液净化[4]。藻菌共培养体系处理沼液过程中,藻类通过光合作用向水体供氧,增加水体的溶解氧,供好氧菌不断地降解有机质,藻细胞自身则可利用细菌降解有机质产生的CO2进行光合作用。因此利用藻和菌二者协同作用可以达到很好的污水处理效果。但也有研究表明一些细菌与微藻之间产生抑制或拮抗作用[5-6]。因此筛选获得能够促进微藻生长的细菌并将其应用于藻菌体系处理废水至关重要[7-8]。
目前国内外对于藻菌关系和藻菌共同处理污水已有研究。Cho等[9]对比研究了纯种小球藻在单独培养及藻菌共同培养时的生长情况,筛选出3种促进小球藻生长和2种抑制小球藻生长的细菌。傅海燕等[10]和程海翔[11]分别对小球藻和栅藻处理人工污水做了相关研究,证明了藻菌共同培养处理沼液的效果要优于藻、菌单独处理沼液。Mujtaba等[12]研究了小球藻与Pseudomonas putida构建的藻菌体系,发现其对污水中氮、磷和COD(化学需氧量)的去除效果明显优于小球藻纯培养体系,去除率可达到85%、65%和86%。Ji等[13]研究发现Chlorella vulgaris-Bacillus licheniformis系统中藻菌比例为1:3时藻细胞及叶绿素a含量最高,对TN(总氮)、TP(总磷)和COD的去除率达到最大,分别为88.95%、80.28%和86.55%。这些研究都证明了藻菌共培养体系对于沼液的处理有很好的效果。
本实验从小球藻净化沼液废水体系中筛选并分离、纯化共栖菌,建立藻菌共培养体系,考察共栖菌对小球藻生长的影响及对沼液废水中氮、磷等污染物的去除效果,筛选出沼液处理效果较好的藻菌共培养体系,为人工构建稳定的藻菌共生体系用于废水的资源化处理奠定基础。
1 材料与方法 1.1 试验材料本实验所用小球藻藻种(Chlorella vulgaris)原种由中国科学院水生生物研究所淡水资源藻种库提供,实验用藻种为烟台大学微藻生物技术研究室保存。实验所用沼液为养殖场提供的新鲜沼液,原始沼液中TN、TP和COD含量分别为591.6、2.61 mg·L-1和599.6 mg·L-1。
1.2 试验方法 1.2.1 无菌小球藻的分离和纯化[14]无菌的小球藻经过含有抗生素的BG-11平板筛选获得。先将100 μL微藻培养液涂布至含有10 mg· L-1氨苄青霉素、庆大霉素和硫酸卡那霉素的BG-11固体平板上,再将平板放入光照1000 lx、24 ℃的恒温光照培养箱中培养,将长出的微藻单菌落再划线至新鲜的含有抗生素的BG-11平板上,重复5次,以获得无菌的小球藻。
1.2.2 小球藻生物量测定小球藻细胞浓度的测定采用分光光度法,测定波长680 nm,每隔24 h取样测定1次,根据吸光度值绘制小球藻生长曲线,确定小球藻的对数生长期为培养时间4~9 d。
1.2.3 微藻细胞叶绿素a含量的测定取小球藻液5 mL,10 000 g离心5 min,弃上清液;并将微藻细胞液悬浮于5 mL 90%的甲醇溶液,80 ℃水浴5 min后,10 000 g离心10 min。将上清液取出,以90%甲醇为对照,检测652 nm和665 nm处的吸光度,通过公式计算样品中叶绿素a的浓度(CChla,mg·L-1),微藻细胞叶绿素含量即为叶绿素浓度和所取样品量的比值[15]。
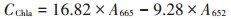
|
取接入小球藻处理15~20 d后的沼液用无菌水以1:10的比例逐级稀释,取100 μL稀释到103~105的稀释液,涂布至以沼液全成分为基础的培养基平板上,将平板放入28 ℃培养箱中1~2 d,挑选不同的单菌落至新的平板培养基中,直到筛选到单菌株。
1.2.5 菌种的鉴定经过多步分离纯化培养后,从沼液与小球藻混合体系中分离出的单菌落采用16S rDNA测序方法进行鉴定,确定细菌的种类。实验过程中先提取5种细菌的DNA[16-17],并测定DNA浓度,进行PCR扩增16S rDNA,再送往生工生物工程(上海)股份有限公司青岛分部对菌种进行鉴定。
1.2.6 细菌计数采用平板菌落计数法。取摇匀的藻菌共培养液1 mL,用无菌水进行系列梯度稀释,然后取0.2 mL在LB固体培养基平板上涂布,37 ℃培养。分别在培养13、24、36 h后计数菌落形成单位,以3次计数的最大值作为最终的菌落数。每个稀释度设置3个平行,取其平均值[18]。
1.2.7 废水污染指标测定COD通过快速分光光度法测定,TN采用GB/T 11894—1989碱性过硫酸钾紫外分光光度法测定,TP采用GB/T 11893—1989钼酸铵分光光度法测定。
1.2.8 藻菌相互作用关系方案设计在小球藻生长到对数期分别接入已经纯培养至对数生长期的5种细菌培养液各20 mL,对照组加入等量的LB培养液,混合培养5 d后,每隔2 d取样,分别测定小球藻的生长量,考察细菌对小球藻生长的作用;同时采用平板计数法进行菌落计数,考察小球藻对菌体生长的影响。此步操作保证严格无菌。
1.2.9 藻菌共培养体系对沼液废水的处理取对数生长期的单菌株假单胞菌培养液和小球藻纯培养液,5000 g离心15 min后,弃上清液,用已高温灭菌的沼液冲洗藻细胞和细菌细胞3次后将其转移到300 mL锥形瓶中,使锥形瓶中沼液体积为200 mL,小球藻和细菌的接种比例为9:1。细菌解淀粉芽孢杆菌和微小杆菌两种单菌株处理方法同假单胞菌。人工构建的三种体系置于光照培养箱中,10 d后取样分别测定小球藻的叶绿素a含量,以及废水的TN、TP和COD,考察藻菌共栖体系以及单独的藻、单独的细菌对废水的处理效果。
1.3 统计学分析数据采用SPSS 13.0软件进行统计分析,数据均表示为平均值±标准差。同时采用单因素方差分析(ANOVA)进行组间差异性比较,并用LSD法进行多重比较。P < 0.05时差异具有统计学意义。
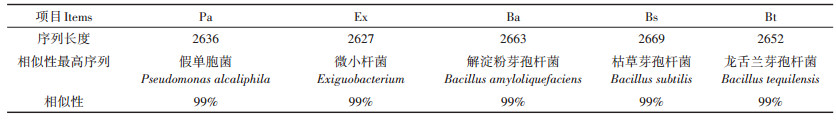
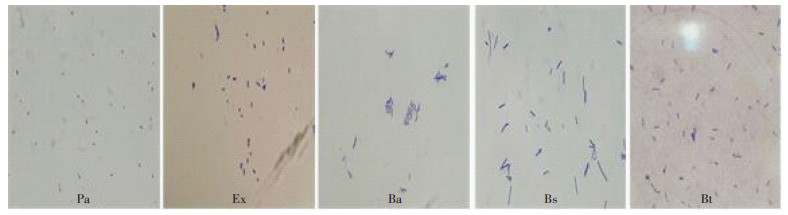
2 结果与讨论 2.1 小球藻共栖菌分离经平板多次划线筛选出5种菌株,16S rDNA测序后结果如表 1所示。所分离的5种菌株分别与假单胞菌(Pseudomonas alcaliphila)、微小杆菌(Exiguobacterium)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)和龙舌兰芽孢杆菌(Bacillus tequilensis)高度相似。经革兰氏染色后油镜(100×10)下观察,均为革兰氏阳性菌,见图 1。
|
图 1 5种细菌革兰氏染色显微镜镜检图片 Figure 1 Five bacteria images by gram stain microscopy |
|
|
表 1 16S rDNA测序结果 Table 1 16S rDNA sequencing results |
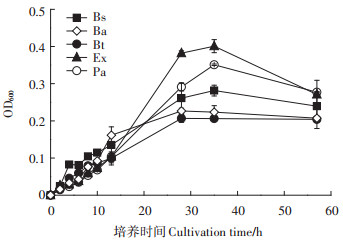
分离纯化获得的5种细菌尚未确定生长周期,故用LB液体培养基,测定不同培养时期细菌的OD值,得到细菌的生长曲线如图 2所示。5种细菌的对数生长期为5~30 h,据此确定后期建立藻菌共栖体系时细菌培养15 h后进行接种。
|
图 2 5种细菌生长曲线 Figure 2 Growth curve of five kinds of bacteria |
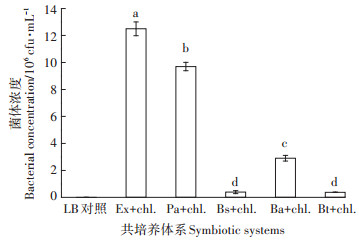
将分离获得的培养至15 h后的5种细菌以初始接种浓度3.5×106 cfu·mL-1的接种比例分别接种到处于对数生长期的小球藻培养液,设置对照组(加入LB培养基),培养12 d后,采用平板菌落计数法计量菌体的浓度,考察小球藻对其共栖菌的影响。结果如图 3所示,对照组中无菌株生长,而实验组各共培养体系中株菌的生长存在较大差异(P < 0.05),微小杆菌和假单胞菌的生长状况较好,12 d后菌体浓度分别达到1.25×107 cfu·mL-1和9.95×106 cfu·mL-1,增加了2.57倍和1.84倍。这2种细菌与小球藻有更好的适应性,与小球藻共培养时细菌能够稳定生长。
|
不同字母表示处理间差异显著(P < 0.05)。下同 Different letters indicate significant differences among treatmens (P < 0.05).The same below 图 3 小球藻对菌体生长的影响 Figure 3 The effect of Chlorella vulgaris on the growth of bacteria |
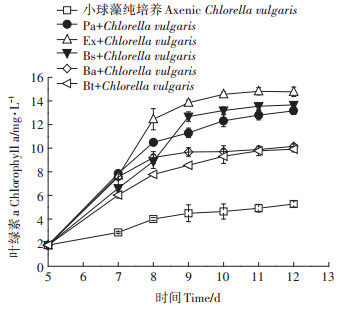
图 4为不同共培养体系中共培养菌对小球藻生长的影响。从图 4可知,5种细菌均可促进小球藻生长,与小球藻纯培养体系有显著性差异(P < 0.05),且不同的细菌对小球藻生长的影响间也存在差异性。其中,微小杆菌、枯草芽孢杆菌和假单胞菌与小球藻构建的藻菌体系与解淀粉芽孢杆菌和龙舌兰芽孢杆菌构建的藻菌体系存在明显差异性(P < 0.05),前3种细菌可明显促进小球藻的生长,分别可使小球藻叶绿素a含量达14.8、13.7 mg·L-1和13.2 mg·L-1,与小球藻纯培养时的5.3 mg·L-1相比,叶绿素a的含量分别提高了1.79、1.58倍和1.49倍。由此可见,微小杆菌、枯草芽孢杆菌和假单胞菌与小球藻具有协同作用。此过程中细菌可为小球藻光合作用提供CO2,同时吸收小球藻释放的O2及多糖等有机物。
|
图 4 细菌对小球藻生长的影响 Figure 4 The effects of bacteria on the growth of Chlorella vulgaris |
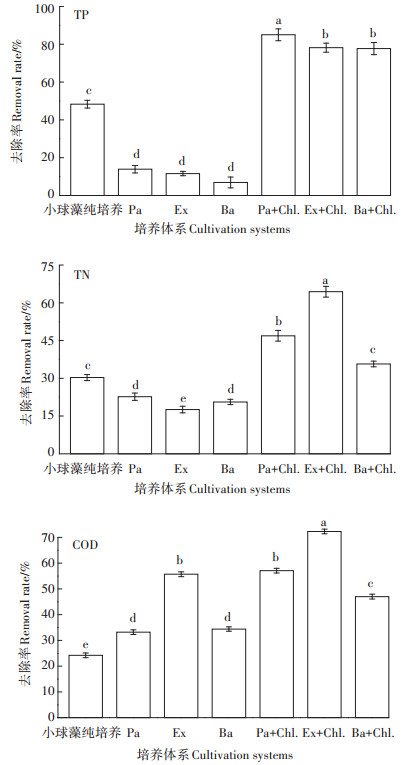
为对比不同的藻菌体系对沼液的处理效果,选取了对小球藻有明显促进作用的微小杆菌、假单胞菌和对小球藻促进效果较差的解淀粉芽孢杆菌构建藻菌混合体系应用于沼液处理中。假单胞菌、微小杆菌和解淀粉芽孢杆菌与小球藻构建的藻菌共培养体系,以及3种细菌分别纯培养和小球藻纯培养对沼液中TN、TP和COD的去除效果结果如图 5所示,藻菌共培养体系对沼液氮磷处理效果与小球藻和细菌纯培养处理效果有显著差异性(P < 0.05),藻菌体系对氮和磷去除率明显高于小球藻和细菌纯培养,对TN、TP的去除机制主要是小球藻生长时吸收沼液中的氮磷从而降低其含量。藻菌混合体系和细菌纯培养体系对沼液中COD的去除效果和小球藻纯培养体系有显著差异性(P < 0.05),而藻菌混合体系与细菌纯培养体系的差异性不是很显著。这是因为沼液中COD的去除作用主要是由细菌分解有机物产生的。藻菌共培养体系处理效果明显优于小球藻纯培养体系。
|
图 5 不同处理体系对沼液废水处理效果 Figure 5 Comparison of different systems for biogas slurry wastewater treatment |
同时由图 5数据分析可知,藻菌的不同共培养体系对沼液的去除效果也有明显差异,其中假单胞菌与小球藻构成的藻菌共栖体系对TP的处理效果优于其他两组藻菌体系(P < 0.05),可使TP降到0.391 mg· L-1,去除率达85%,是小球藻纯培养体系的1.76倍;细菌微小杆菌与小球藻构成的藻菌共栖体系去除COD和TN的效果明显优于假单胞菌和解淀粉芽孢杆菌与小球藻构成的体系(P < 0.05),处理10 d后COD浓度降到166.1 mg·L-1,去除率为72.3%;TN的浓度降到210.6 mg·L-1,去除率为64.4%,是小球藻纯培养体系的2.13倍。说明微小杆菌和假单胞菌与小球藻构建体系处理沼液确实能获得较好的效果。同时对比图 4发现,假单胞菌和微小杆菌能促进小球藻的生长,这可以说明藻菌协同作用促进小球藻吸收沼液中的氮磷用于小球藻自身的生长,但藻菌协同作用处理沼液过程中氮磷的具体转化机制还需进一步研究。
3 结论(1)小球藻处理沼液过程中微生物成分复杂多样,本研究分离纯化获得5株可培养细菌,16S rDNA测序后发现5株细菌分别与假单胞菌(Pseudomonas alcaliphila)、微小杆菌(Exiguobacterium)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、枯草芽孢杆菌(Bacillus subtilis)和龙舌兰芽孢杆菌(Bacillus tequilensis)高度相似。
(2)5种细菌的存在能促进小球藻的生长,其中微小杆菌、枯草芽孢杆菌和假单胞菌与小球藻构建的藻菌共培养体系中小球藻细胞浓度及叶绿素a含量明显高于其他两种藻菌体系,对小球藻的促进效果更好,同时小球藻的存在也使细菌能够稳定存在。小球藻与细菌具有协同作用。
(3)将微小杆菌、假单胞菌和解淀粉芽孢杆菌与小球藻构建的藻菌体系应用于沼液处理中发现,藻菌共培养体系对沼液中的TN、TP和COD的去除效果明显优于各自的纯培养体系。假单胞菌与小球藻构成的藻菌共栖体系对TP的处理效果优于其他两组藻菌体系,去除率可达85%。微小杆菌与小球藻构成的藻菌共栖体系去除COD和TN的效果最好,去除率分别为72.3%和64.4%。这为藻菌共生处理沼液奠定了基础。
| [1] |
Sakar S, Yetilmezsoy K, Kocak E. Anaerobic digestion technology in poultry and livestock waste treatment:A literature review[J]. Waste Management and Research, 2009, 27(1): 3-18. DOI:10.1177/0734242X07079060 |
| [2] |
Szogi A A, Vanotti M B. Removal of phosphorus from livestock effluents[J]. Journal of Environmental Quality, 2009, 38(2): 576-586. DOI:10.2134/jeq2007.0641 |
| [3] |
吴根义, 姜彩红, 易湘琳, 等. 生猪养殖污染防治模式及应用[J]. 中国猪业, 2015(11): 13-15. WU Gen-yi, JIANG Cai-hong, YI Xiang-lin, et al. Pig breeding pollution prevention and control mode and application[J]. China Swine Industry, 2015(11): 13-15. DOI:10.3969/j.issn.1673-4645.2015.11.004 |
| [4] |
李小霞, 谢庆林. 藻菌共生系统处理污水的研究及应用前景[J]. 广西民族学院学报(自然科学版), 2006, 12(3): 112-114, 117. LI Xiao-xia, XIE Qing-lin. The study and application of algae-bacterial symbiotic system for sewage purification[J]. Journal of Guangxi University For Nationalities(Natural Science Edition), 2006, 12(3): 112-114, 117. DOI:10.3969/j.issn.1673-8462.2006.03.025 |
| [5] |
王琼.一株铜绿微囊藻抑藻菌的分离鉴定及其抑藻特性研究[D].南京: 南京农业大学, 2014. WANG Qiong. Isolation and identification and lytic of one algae-inhibiting bacteria on Microcystis Aeruginosa[D]. Nanjing: Nanjing Agricultural University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10307-1016038602.htm |
| [6] |
Kouzuma A, Watanabe K. Exploring the potential of algae/bacteria interactions[J]. Current Opinion in Biotechnology, 2015, 33: 125-129. DOI:10.1016/j.copbio.2015.02.007 |
| [7] |
Wang B, Lan C Q. Biomass production and nitrogen and phosphorus removal by the green alga Neochloris oleoabundans in simulated wastewater and secondary municipal wastewater effluent[J]. Bioresource Technology, 2011, 102(10): 5639-5644. DOI:10.1016/j.biortech.2011.02.054 |
| [8] |
邢丽贞.固定化藻类去除污水中氮磷及其机理的研究[D].西安: 西安建筑科技大学, 2005. XING Li-zhen. Investigations on methods and mechanism for removal of nitrogen & phosphorus in wastewater by immobilized algae[D]. Xi'an: Xi'an University of Architecture & Technology, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10703-2005085037.htm |
| [9] |
Cho D H, Ramanan R, Heo J, et al. Enhancing microalgal biomass productivity by engineering a microalgal-bacterial community[J]. Bioresource Technology, 2015, 175: 578-585. DOI:10.1016/j.biortech.2014.10.159 |
| [10] |
傅海燕, 许鹏成. 三种载体固定化菌藻共生系统脱氮除磷效果的对比[J]. 环境工程学报, 2013, 9(7): 3256-3262. FU Hai-yan, XU Peng-cheng. Comparation of nitrogen and phosphorus removal by coimmobilized bacteria-algae system with three kinds of carriers[J]. Chinese Journal of Environmental Engineering, 2013, 9(7): 3256-3262. |
| [11] |
程海翔.一株栅藻的分离培养及其应用于养猪废水处理的潜力研究[D].杭州: 浙江大学, 2013. CHENG Hai-xiang. Research on isolation and cultivation of a new microalga and the potential of its application for treating piggery wastewater[D]. Hangzhou: Zhejiang University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013340104.htm |
| [12] |
Mujtaba G, Rizwan M, Lee K. Removal of nutrients and COD from wastewater using symbiotic co-culture of bacterium Pseudomonas putida and immobilized microalga Chlorella vulgaris[J]. Journal of Industrial and Engineering Chemistry, 2017, 49(25): 145-151. |
| [13] |
Ji X Y, Jiang M Q, Zhang J B, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater[J]. Bioresource Technology, 2017, 247: 44-50. |
| [14] |
麻晓霞, 马丽萍, 石勋祥, 等. 微藻对常用抗生素敏感性的研究进展[J]. 微生物学免疫学进展, 2012, 40(1): 83-86. MA Xiao-xia, MA Li-ping, SHI Xun-xiang. The research progress of sensitivity of microalgaes to common antibiotics[J]. Prog in Microbiol Immunol, 2012, 40(1): 83-86. DOI:10.3969/j.issn.1005-5673.2012.01.019 |
| [15] |
Halfhide T, Åkerstrøm A, Lekang O I, et al. Production of algal biomass, chlorophyll, starch and lipids using aquaculture wastewater under axenic and non-axenic conditions[J]. Algal Research, 2014, 6(Part B): 152-159. |
| [16] |
黄适.基于培养方法和454测序技术对微拟球藻共栖细菌群落的研究[D].上海: 上海师范大学, 2011. HUANG Shi. Identification of bacterial community associated with nannochloropsis by culture-dependent approach and 454 pyrosequencing technology[D]. Shanghai: Shanghai Normal University, 2011. http://cdmd.cnki.com.cn/article/cdmd-10270-1011160736.htm |
| [17] |
季祥, 王金荣, 王新平, 等. 富油能源微藻斜生栅藻异养培养条件的优化[J]. 渔业现代化, 2011, 35(5): 1-6. JI Xiang, WANG Jin-rong, WANG Xin-ping, et al. Heterotrophic culture of high-oil Scenedesmus obliquus and optimization of growth conditions[J]. Fishery Modernization, 2011, 35(5): 1-6. DOI:10.3969/j.issn.1007-9580.2011.05.001 |
| [18] |
张俊, 杨宇峰, 龚映雪, 等. 中肋骨条藻与锥状斯氏藻藻际细菌溶藻效应研究[J]. 环境科学学报, 2010, 30(6): 1271-1279. ZHANG Jun, YANG Yu-feng, GONG Ying-xue, et al. The lytic effect of bacteria in the phycosphere of Skeletonerna coastaturn and Scrippsiella trochoidea[J]. Acta Scientiae Circumatantiae, 2010, 30(6): 1271-1279. |
 2019, Vol. 36
2019, Vol. 36