2. 四川省兰月科技有限公司, 成都 610207
2. Sichuan Lanyue Science and Technology Co., Ltd., Chengdu 610207, China
我国是农业大国,畜牧养殖业废弃物产生量巨大,若处理不当,其中的抗生素、重金属等有害元素会通过雨水淋溶、地下水扩散等作用,加重周边地区污染。据报道,畜牧养殖业可增加周边地区铜、锌、镉等重金属污染[1-2],且每年用于畜牧养殖业的抗生素超过8000 t[3]。抗生素大部分为水溶性,使用后不能完全被动物吸收利用,约30%~90%的抗生素通过粪便和尿液排出[2],造成了很多负面效应,如:通过动物残留、作物吸收后进入食物链,在人体内蓄积,达到一定浓度后,造成急性或慢性中毒,导致恶心呕吐、过敏反应、激素分泌异常等,甚至对人体肝肾、淋巴细胞等造成伤害,影响人体健康[5-6];危害作物生长,对植物胚轴、根系、叶子的生长均有不同程度的抑制作用[7-8];影响环境微生态,降低微生物多样性和活性,产生耐药基因[9-12],可能导致含多重耐药基因的超级细菌产生,带来更严重的深远影响。
据报道,在畜牧养殖业废水、粪便和周边土壤中检出浓度最高的抗生素为四环素、喹诺酮类、磺胺类兽药抗生素,其浓度达到了μg·L-1或mg·L-1级别[13-16]。这三类抗生素在土壤中都具有易吸附、难降解的共同特点[17-19],而微生物降解又是大部分抗生素在固相环境中降解的重要途径[20-21],但目前针对这些残留抗生素的微生物降解菌株的筛选研究,局限于单一类型抗生素[22-24],且筛选的菌株大多为细菌,在筛选和应用过程中,会导致某些敏感细菌群和抗生素抗性基因的形成和相互传递[25-26],使得某些致病菌变成多种抗生素耐药菌,造成不可估量的隐形环境污染。因此,本研究以目前畜牧养殖常用的3种抗生素——土霉素、诺氟沙星、磺胺二甲嘧啶为靶标物,为减少这3种抗生素抗性因子的传递,筛选鉴定出具有这3种抗生素降解能力的真菌,旨在为防治多种抗生素交叉污染、减少多重耐药基因产生和生产绿色安全农产品提供理论支持。
1 材料与方法 1.1 试验材料 1.1.1 仪器高效液相色谱仪LC-20A,配有紫外检测器(UV)和二极管阵列检测器(DAD),由日本Shimadzu公司制造;高速离心机由德国Eppendorf公司制造;PCR仪、电泳仪、凝胶成像系统由德国Analytikjena公司制造,紫外分光光度计由北京恒通公司制造。
1.1.2 样品采集采集四川省什邡双盛镇矿厂周边7个重金属污染土壤,重金属镉、锌、铜、铅含量均超过土壤环境质量标准三级上限。采集样品用无菌袋封装,-20 ℃保存备用。
1.1.3 培养基无机盐培养基:(NH4)2SO4 2.0 g,K2HPO4 0.5 g,NaH2PO4 0.5 g,双蒸水(ddH2O)1 L,pH 7.0~7.4,1×105 Pa灭菌30 min。
驯化及筛选培养基:在灭菌后的培养基中,分别加入适量过滤除菌抗生素母液。
分离纯化培养基:马铃薯蔗糖培养基。
1.2 菌株富集驯化培养称量10 g用四分法处理后的样品,分别以土霉素、诺氟沙星、磺胺二甲嘧啶浓度100 μg·mL-1为起点,每100 μg·mL-1为一个梯度,接种量为10%,7 d为一个周期,逐级增加抗生素浓度,进行富集驯化培养,培养温度30 ℃,转速150 r·min-1。
1.3 菌株分离与纯化吸取10 mL菌株富集驯化液,加入装有90 mL无菌水和适量玻璃珠的三角瓶中,150 r·min-1充分振荡20 min作为母液菌悬液,进行常规梯度浓度稀释涂布,30 ℃培养3~7 d,将不同形态菌落挑出,进行分离纯化培养。
1.4 菌株降解抗生素能力测定 1.4.1 菌株培养将分离纯化后的菌株斜面培养后,用无菌水将孢子洗脱下来,配制成1×107 cfu·mL-1的菌悬液,按10%接种量,接种到分别含有50、1500 μg·mL-1土霉素、诺氟沙星、磺胺二甲嘧啶的无机盐筛选培养基中,每个重复3次,于30 ℃、150 r·min-1振荡避光培养,为消除理化因素的影响,以含有相同浓度抗生素的培养液作为空白对照。菌株培养7 d后,检测发酵物中各抗生素含量,与空白对照相比计算降解率;取50 μg·mL-1抗生素处理等体积培养物,用真空抽滤分离菌丝体,于60 ℃烘干至恒质量,计算生物量。
1.4.2 抗生素浓度测定运用高效液相色谱法及紫外分光光度法进行3种抗生素含量测定。
样品预处理:为排除菌丝吸附抗生素对检测结果的影响,发酵物经超声破碎后,添加提取物进行纯化、洗脱、流动相溶解,供高效液相色谱法测定,其中,磺胺二甲嘧啶纯化工艺参见文献[27];诺氟沙星纯化工艺参见文献[28];土霉素纯化工艺参见文献[29]。
高效液相色谱进样条件:(1)磺胺二甲嘧啶进样条件为C18色谱柱(250 mm×4.6 mm,粒径5 μm),预柱YMG C18,柱温22 ℃,流动相为25%乙腈:水=1:3,流速1.0 mL·min-1,进样量20 μL,检测波长270 nm;(2)诺氟沙星进样条件为C18色谱柱(150 mm×4.6 mm,粒径5 μm),预柱Kromasil C18,柱温22 ℃,流动相为35%甲醇:水=1:3,流速0.8 mL·min-1,进样量20 μL,检测波长278 nm;(3)诺氟沙星进样条件为C18色谱柱(150 mm×4.6 mm,粒径5 μm),预柱Kromasil C18,柱温22 ℃,流动相为35%甲醇:水=1:3,流速0.8 mL·min-1,进样量20 μL,检测波长350 nm。
土霉素紫外分光光度法检测条件参照文献[30],诺氟沙星紫外分光光度法检测条件参照文献[31],磺胺二甲嘧啶紫外分光光度法检测条件参照文献[32]。
1.5 菌株分类鉴定 1.5.1 菌株形态特征观察对分离得到的菌株用PDA平板30 ℃培养7 d后,采用光学显微镜对菌落、菌丝和孢子等结构进行观察,并参照文献[33]进行鉴定。
1.5.2 ITS核苷酸序列扩增及测定(1) 基因组DNA提取。液氮研磨法破壁后,取大约100 mg研磨物转自1.5 mL离心管中,用真菌基因组提取试剂盒进行菌株基因组DNA提取。(2)PCR扩增。ITS序列使用ITS1(5′ -TCCGTAGGTGAACCT⁃ GCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC- 3′)引物进行扩增[34]。反应体系25 μL:10 × Buffer(Mg2+ free)2.5 μL,2.5 mmol · L-1 dNTPs 2.0 μL,25 mmol·L-1 MgCl2 1.5 μL,10 μmol·L-1 ITS1和ITS4各1.0 μL,5 U·μL-1 Taq酶0.3 μL,模板1.0 μL,ddH2O 15.7 μL。扩增反应条件:95 ℃ 5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 10 min。(3)菌株鉴定。扩增产物送生工生物工程(上海)股份有限公司进行测序,然后在GenBank中进行BLAST比对分析,并用MEGA 6.06软件Neighbor-Joining(NJ)法构建系统发育树。
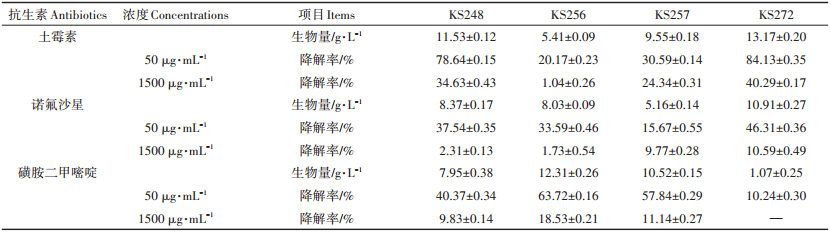
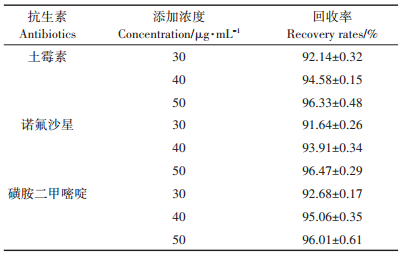
2 结果与分析 2.1 3种抗生素降解真菌的筛选结果从采集的样品土样中,通过富集驯化,初筛得到30个具有土霉素、诺氟沙星、磺胺二甲嘧啶中一种抗生素降解能力的真菌分离物。将初筛获得的真菌分离物进行复筛,结果(表 1)表明,4株真菌分离物具有土霉素、诺氟沙星、磺胺二甲嘧啶中至少2种抗生素降解能力。并且,在各抗生素低浓度(50 μg·mL-1)和高浓度(1500 μg·mL-1)含量下,都具有一定的抗生素降解能力,随着抗生素浓度的增加,菌株对抗生素降解能力有不同程度的削弱。在抗生素浓度1500 μg· mL-1条件下,菌株KS256具3种抗生素降解能力,与其他菌株相比其降解磺胺二甲嘧啶能力最强,降解率达到18.53%(与CK相比)。菌株KS272具两种抗生素降解能力,与其他菌株相比其降解土霉素及诺氟沙星能力最强,土霉素降解率达到40.29%、诺氟沙星降解率达到10.59%。各抗生素回收率通过加标法测定,加标样品为空白培养基及菌株各抗生素发酵液,测得回收率结果为91%~96%(表 2),每个样品3个重复,平行实验结果确定了方法的可靠性。
|
|
表 1 具抗生素降解功能的菌株 Table 1 Strains with antibiotic degradation functions |
|
|
表 2 土霉素、诺氟沙星、磺胺二甲嘧啶高效液相色谱法回收率 Table 2 Oxytetracycline, norfloxacin, sulfadiazine HPLC recovery rates |
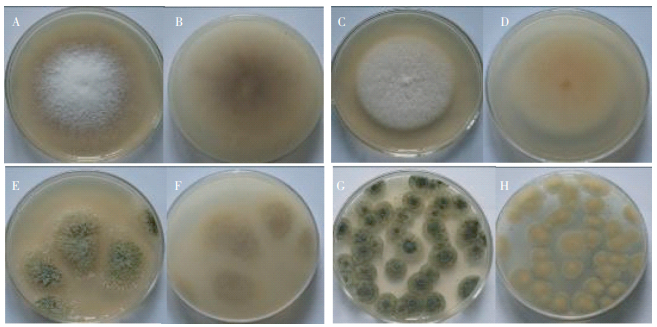
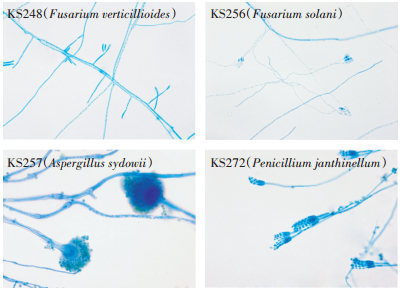
抗生素降解真菌KS248在PDA平板上28 ℃培养6 d形成圆形菌斑,菌落直径3.5~4.5 cm,菌落蛛网状,气生菌丝羊毛状,白色,菌落背面呈牵牛紫;KS256在PDA平板上28 ℃培养6 d形成圆形菌斑,菌落直径2.8~4.9 cm,菌落平铺,气生菌丝羊绒状,白色,基物表面肉色,基物不变色;KS257在PDA平板上28 ℃培养6 d形成圆形菌斑,菌落直径3~4 cm,质地疏松,初白色、黄色,后变为褐色至淡绿色,背面无色;KS272在PDA平板上28 ℃培养6 d形成绒絮状菌斑,菌落表面榄灰色产孢层,菌落背面呈黄色(图 1)。菌株显微特征见图 2。
|
A:KS248菌株正面;B:KS248菌株背面;C:KS256菌株正面;D:KS256菌株背面;E:KS257菌株正面;F:KS257菌株背面;G:KS272菌株正面;H:KS272菌株背面 A:The face of colony of strain KS248;B:The reverse side of colony of strain KS248;C:The face of colony of strain KS256; D:The reverse side of colony of strain KS256;E:The face of colony of strain KS257;F:The reverse side of colony of strain KS257; G:The face of colony of strain KS272;H:The reverse side of colony of strain KS272 图 1 真菌在PDA平板上的菌落形态 Figure 1 Colony characteristics of fungi on PDA |
|
图 2 菌株KS248、KS256、KS257、KS272的显微镜照片(×400,棉兰染色) Figure 2 The morphology of the strain KS248, KS256, KS257 and KS272(×400, cotton blue staing) |
对4个菌株进行DNA提取、PCR扩增,得到的序列提交GenBank中进行BLAST,下载相似度较高的序列,用MEGA 6.06软件邻接法构建系统发育树(图 3)。如图 3所示,KS272与微紫青霉Penicillium janthinellum(KM268714)在同一分支上,相似性为99%;KS257与聚多曲霉Aspergillus sydowii(LT745389)在同一分支上,相似性为99%;KS256与腐皮镰刀菌Fusarium solani(JN222393)在同一分支上,相似性为99%;KS248与轮状镰刀菌Fusarium verticillioides(KC752592)在同一分支上,相似性为99%
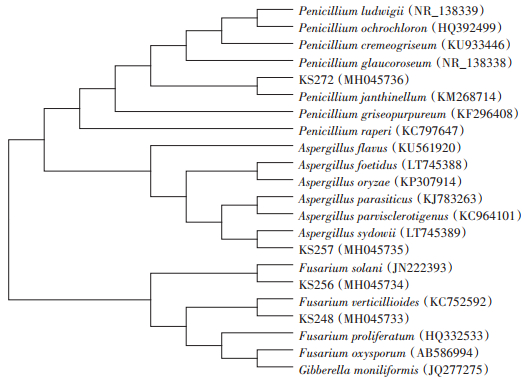
|
图 3 4株菌株rDNA-ITS序列N-J系统发育 Figure 3 Neighbor-Joining phylogenetic tree constructed from rDNA-ITS sequence of four strains |
结合菌株形态学特征,菌株KS272鉴定为微紫青霉Penicillium janthinellum(GeneBank Accession:MH045736);菌株KS257为聚多曲霉Aspergillus sydowii(GeneBank Accession:MH045735);菌株KS256为腐皮镰刀菌Fusarium solani(GeneBank Accession:MH045734);菌株KS248为轮状镰刀菌Fusarium verticillioides(GeneBank Accession:MH045733)。
3 讨论我国畜牧养殖规模小、较分散及多种抗生素使用,造成了畜禽抗生素污染物具有抗生素种类多、分布广、易累积扩散、环境生态风险大的特点。目前,国内外针对畜禽常用的土霉素、诺氟沙星、磺胺二甲嘧啶这3种抗生素物质造成的污染,筛选微生物降解菌进行治理,土霉素降解菌的研究较多,磺胺二甲嘧啶降解菌和诺氟沙星降解菌研究较少,且多数是针对低浓度抗生素的降解筛选,除少量降解土霉素的真菌外[22, 35],其他降解菌多为细菌类降解菌[36-39]。但在现实的土壤环境,抗生素污染均为多种抗生素交叉污染,它们对环境的生态毒性相互叠加并互补,更加重了对土壤植物、土壤动物、土壤微生物的生态毒性,也加快了土壤环境微生物抗药性发展[40-41]。而抗生素和某些重金属污染物,能共同作用形成复合污染物,对生态环境造成影响[42],重金属也可能降低抗生素的降解速率[43],且这3种抗生素都为广谱性细菌和部分放线菌抑制剂[44],如若筛选细菌作为这三类抗生素降解菌,会增加高抗药性基因产生概率,从而增加菌株使用的生态风险。因此,针对土壤多重高浓度抗生素治理,可减少多种抗生素生态毒性叠加,同时减少抗生素-重金属复合污染物的形成,杜绝多种抗性基因及超级细菌的形成和传播。本研究选取了3种使用量较大的畜牧用抗生素为研究对象,综合考虑到抗生素污染的多样性、菌株使用的普适性、菌株对环境的生态友好性及极端环境的适应性,选取重金属污染土壤进行采样,对多种抗生素污染联合修复微生物的筛选进行了探索,在土霉素、诺氟沙星、磺胺二甲嘧啶初始浓度为50 μg·mL-1和1500 μg·mL-1的条件下,筛选到4株具有多种抗生素降解功能的真菌。这对畜禽粪便累积区多种抗生素交叉污染治理,抗生素-重金属复合污染物的防治具有较强的现实意义,今后还应对抗生素降解菌的使用进行环境生态评估,真正实现抗生素无害化处理。
4 结论(1) 在抗生素-重金属复合污染土壤中,对3种农用抗生素微生物修复种质资源进行了筛选,选育到4株抗生素降解真菌,均具有至少2种抗生素降解能力。
(2) 菌株对3种抗生素降解率从高到低依次排序为土霉素>诺氟沙星>磺胺二甲嘧啶,这可能与抗生素自身结构有关。
(3) 为使所筛菌株的应用具有普适性,测定了菌株在低、高浓度抗生素情况下对抗生素的降解率,随着抗生素浓度增加,菌株对不同抗生素降解能力有不同程度的削弱。
| [1] |
贾武霞, 文炯, 许望龙, 等. 我国部分城市畜禽粪便中重金属含量及形态分布[J]. 农业环境科学学报, 2016, 35(4): 764-773. JIA Wu-xia, WEN Jiong, XU Wang-long, et al. Content and fractionation of heavy metals in livestock manures in some urban areas of China[J]. Journal of Agro-Environment Science, 2016, 35(4): 764-773. |
| [2] |
王秋丽. 畜禽养殖导致土壤重金属污染现状及对策[J]. 现代农业科技, 2016(11): 245, 247. WANG Qiu-li. Status and countermeasures on soil heavy metal pollution of livestock[J]. Modern Agricultural Science and Technology, 2016(11): 245, 247. |
| [3] |
陈苏, 陈宁, 晁雷, 等. 土霉素、镉复合污染土壤的植物-微生物联合修复实验研究[J]. 生态环境学报, 2015, 24(9): 1554-1559. CHEN Su, CHEN Ning, CHAO Lei, et al. The experimental study of polluted soils with oxytetracycline and cadmium by plant microbial remediation[J]. Ecology and Environmental Sciences, 2015, 24(9): 1554-1559. |
| [4] |
Halling S B, Nors N S, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical substances in the environment:A review[J]. Chemosphere, 1998, 36(2): 357-393. DOI:10.1016/S0045-6535(97)00354-8 |
| [5] |
曲甍甍, 孙立伟, 陈鋆, 等. 兽药添加剂阿散酸和土霉素的毒理学研究[J]. 农业环境科学学报, 2004, 23(2): 240-242. QU Meng-meng, SUN Li-wei, CHEN Jun, et al. Toxicological characters of arsanilic acid and oxytetracycline[J]. Journal of Agro-Environment Science, 2004, 23(2): 240-242. DOI:10.3321/j.issn:1672-2043.2004.02.009 |
| [6] |
秦国建.磺胺类药物在海南砂质土壤中迁移降解与累积研究[D].长沙: 湖南农业大学, 2012. QIN Guo-jian.Migration and degradation of sulfonamides in sandy soil of Hainan Island[D].Changsha: Hunan Agricultural University, 2012. |
| [7] |
Kudrjashow B A, Strukova S M, Solodenko N M. Growth inhibiting effects of twelve antibacterial agents and their mixtures on the freshwater microalga Pseudokirchneriella subcapitata[J]. Environmental Toxicology and Chemistry, 2008, 27(5): 1201-1208. DOI:10.1897/07-471.1 |
| [8] |
Migliore L, Civitareale C, Brambilla G, et al. Effects of sulphadimethoxine on cosmopolitan weeds(Amaranthus retroflexus L., Plantago major L.and Rumex acetosella L.[J]. Agricultural Ecosystems and Environments, 1997, 65(2): 163-168. DOI:10.1016/S0167-8809(97)00062-5 |
| [9] |
Chopra I. Glycylcyclines:Third-generation tetracycline antibiotics[J]. Current Opinion in Pharmacology, 2001, 1(5): 464-469. DOI:10.1016/S1471-4892(01)00081-9 |
| [10] |
Martinez J L. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 2009, 157(11): 2893-2902. DOI:10.1016/j.envpol.2009.05.051 |
| [11] |
Smith M S, Yang R K, Knapp C W, et al. Quantification of tetracycline resistance genes in feedlot lagoons by real-time PCR[J]. Applied and Environmental Microbiology, 2004, 70(12): 7372-7377. DOI:10.1128/AEM.70.12.7372-7377.2004 |
| [12] |
周启星, 罗义, 王美娥. 抗生素的环境残留、生态毒性及抗性基因污染[J]. 生态毒理学报, 2007, 2(3): 243-251. ZHOU Qi-xing, LUO Yi, WANG Mei-e. Environmental residues and ecotoxicity of antibiotics and their resistance gene pollution:A review[J]. Asian Journal of Ecotoxicology, 2007, 2(3): 243-251. |
| [13] |
Hamscher G, Sczesny S, Höper H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2002, 74(7): 1509-1518. DOI:10.1021/ac015588m |
| [14] |
Martínez-Carballo E, González-Barreiro C, Scharf S, et al. Environmental monitoring study of selected veterinary antibiotics in animal manure and soils in Austria[J]. Environmental Pollution, 2007, 148(2): 570-579. DOI:10.1016/j.envpol.2006.11.035 |
| [15] |
Zhao L, Dong Y H, Wang H, et al. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069-1075. DOI:10.1016/j.scitotenv.2009.11.014 |
| [16] |
邰义萍, 罗晓栋, 莫测辉, 等. 广东省畜牧粪便中喹诺酮类和磺胺类抗生素的含量与分布特征研究[J]. 环境科学, 2011, 32(4): 1188-1193. TAI Yi-ping, LUO Xiao-dong, MO Ce-hui, et al. Occurrence of ouinolone and sulfonamide antibiotics in swine and cattle manures from large-scale feeding operations of Guangdong Province[J]. Environmental Science, 2011, 32(4): 1188-1193. |
| [17] |
章明奎, 徐秋桐. 农田系统中兽用抗生素的污染及其行为研究进展[J]. 浙江农业学报, 2013, 25(2): 416-424. ZHANG Ming-kui, XU Qiu-tong. View on pollution and behavior of veterinary antibiotics in agricultural systems[J]. Acta Agriculturae Zhejiangensis, 2013, 25(2): 416-424. DOI:10.3969/j.issn.1004-1524.2013.02.39 |
| [18] |
Mackay A A, Canterbury B. Oxytetracycline sorption to organic matter by metal-bridging[J]. Journal of Environmental Quality, 2005, 34(6): 1964-1971. DOI:10.2134/jeq2005.0014 |
| [19] |
Figueroa R A, Leonard A, Mackay A A. Modeling tetracycline antibiotic sorption to clays[J]. Environmental Science & Technology, 2004, 38(2): 476-483. |
| [20] |
Schlüsener M P, Bester K. Persistence of antibiotics such as macrolides, tiamulin and salinomycin in soil[J]. Environmental Pollution, 2006, 143(3): 565-571. DOI:10.1016/j.envpol.2005.10.049 |
| [21] |
Holly D, Satish G, Sally N. Antibiotic degradation during manure composting[J]. Journal of Environmental Quality, 2008, 37(3): 1245-1253. DOI:10.2134/jeq2007.0399 |
| [22] |
翟辉.土霉素降解菌的筛选、鉴定及其在污染土壤中的修复模拟[D].杨凌: 西北农林科技大学, 2016. ZHAI Hui.Isolation and identificationg of oxytetracycline-degrading strain and its use in bioremediation simulation of contaminated soil[D].Yangling: Northwest A&F University, 2016. |
| [23] |
赵永斌.3种四环素类抗生素降解菌的筛选及降解特性的研究[D].晋中: 山西农业大学, 2015. ZHAO Yong-bin.The selection of 3 tetracycline to degrading bacteria and the character research of isolation and degrading[D].Jinzhong: Shanxi Agricultural University, 2015. |
| [24] |
高元钢, 向云彬, 余之焕, 等. 耐受氟喹诺酮类药物真菌的筛选[J]. 长江大学学报(自然科学版), 2009, 3(6): 76-80. GAO Yuan-gang, XIANG Yun-bin, YU Zhi-huan, et al. Screening of fungal resistant to fluoroquinolones[J]. Journal of Yangtze University (Nat Sci Edit), 2009, 3(6): 76-80. |
| [25] |
Ji X L, Shen Q H, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai, China[J]. Journal of Hazardous Materials, 2012, 235/236(20): 178-185. |
| [26] |
Cheng W X, Chen H, Su C, et al. Abundance and persistence of antibio-tic resistance genes in livestock farms:A comprehensive investigation in eastern China[J]. Environment Internationnal, 2013, 61: 1-7. |
| [27] |
林红英, 陆桂萍, 沈子龙. 猪肉中磺胺二甲基嘧啶残留量的高效液相色谱法测定[J]. 江苏农业学报, 2006, 22(3): 285-288. LIN Hong-ying, LU Gui-ping, SHEN Zi-long. Determination of sulphodimides residues in pig muscles by high performance liquid chromatography[J]. Jiangsu Journal of Agricultural Sciences, 2006, 22(3): 285-288. DOI:10.3969/j.issn.1000-4440.2006.03.020 |
| [28] |
唐巍, 卢艳芬, 丑亚琴, 等. 高效液相色谱法同时测定鱼肉中四种喹诺酮类药物残留[J]. 中国兽药杂志, 2012, 46(12): 26-29. TANG Wei, LU Yan-fen, CHOU Ya-qin, et al. High performance liquid chromatographic method for simultaneous determination of four quinolones residues in fish muscle tissues[J]. Chinese Journal of Veterinary Drug, 2012, 46(12): 26-29. |
| [29] |
高旭东, 陈士恩, 叶永丽, 等. 高效液相色谱法测定畜禽肉及三文鱼中土霉素、四环素和金霉素残留[J]. 食品安全质量检测学报, 2014, 5(2): 369-376. GAO Xu-dong, CHEN Shi-en, YE Yong-li, et al. Determination of terramycin, minocycline and aureomycin in livestock, poultry meat and salmon by high performance liquid chromatography[J]. Journal of Food Safety and Quality, 2014, 5(2): 369-376. |
| [30] |
冯学忠, 吴光辉, 方炳虎, 等. 紫外分光光度法测定长效土霉素注射液含量方法的建立[J]. 动物医学进展, 2009, 30(9): 65-68. FENG Xue-zhong, WU Guang-hui, FANG Bing-hu, et al. Determination of long-acting oxytertacycline injection by UV spectrophotometry[J]. Progress in Veterinary Medicine, 2009, 30(9): 65-68. DOI:10.3969/j.issn.1007-5038.2009.09.016 |
| [31] |
展惠英, 寇明泽. 紫外分光光度法测定诺氟沙星胶囊中诺氟沙星的含量[J]. 甘肃联合大学学报(自然科学版), 2012, 26(3): 50-51. ZHAN Hui-ying, KOU Ming-ze. Determination norfoxacian in the capsules by ultraviolet spectrophotometry[J]. Journal of Gansu Lianhe University (Natural Sciences), 2012, 26(3): 50-51. DOI:10.3969/j.issn.1672-691X.2012.03.013 |
| [32] |
张从良, 文春波, 王岩, 等. 紫外分光光度法测定土壤中磺胺嘧啶的含量[J]. 分析科学学报, 2007, 23(5): 616-618. ZHANG Cong-liang, WEN Chun-bo, WANG Yan, et al. Determination of sulfadiazine in soil by spectrophotometry[J]. Journal of Analytical Science, 2007, 23(5): 616-618. DOI:10.3969/j.issn.1006-6144.2007.05.031 |
| [33] |
魏景超. 真菌鉴定手册[M]. 上海: 上海科学出版社, 1979: 129-135. WEI Jing-chao. Fungal identification manual[M]. Shanghai: Shanghai Science Press, 1979: 129-135. |
| [34] |
Wäli P R, Ahlholm J U, Helander M, et al. Occurrence and genetic structure of the systemic grass endophyte Epichloë festucae in fine fescue populations[J]. Microbial Ecology, 2007, 53(1): 20-29. DOI:10.1007/s00248-006-9076-2 |
| [35] |
罗湘颖.黄孢原毛平革菌降解土霉素和吸附金属镉的研究[D].长沙: 湖南大学, 2014. LUO Xiang-ying.Studies on degradation of oxytetracycline and adsorption of the metal cadmium by Phanerochaete chrysosporium[D].Changsha: Hunan Universtity, 2014. |
| [36] |
于浩, 李晔, 程全国. 土霉素降解菌的筛选及其降解条件优化[J]. 沈阳大学学报(自然科学版), 2017, 29(1): 21-25. YU Hao, LI Ye, CHENG Quan-guo. Screening and optimization of degradation condition of oxytetracycline degrading bacteria[J]. Journal of Shenyang University (Natural Science), 2017, 29(1): 21-25. |
| [37] |
成洁, 杜慧玲, 张天宝, 等. 四环素类抗生素降解菌的分离与鉴定[J]. 核农学报, 2017, 31(5): 884-888. CHENG Jie, DU Hui-ling, ZHANG Tian-bao, et al. Isolation and identification of tetracyclines degrading bacteria[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(5): 884-888. |
| [38] |
付泊明, 陈立伟, 蔡天明, 等. 诺氟沙星降解菌NOR-36的分离筛选及降解特性研究[J]. 环境科学学报, 2016, 37(2): 576-584. FU Bo-ming, CHEN Li-wei, CAI Tian-ming, et al. Isolation and characterization of norfloxacin-degrading bacterium strain NOR-36[J]. Acta Scientiae Circumstantiae, 2016, 37(2): 576-584. |
| [39] |
赵方.磺胺二甲基嘧啶的微波与微生物降解研究[D].郑州: 郑州大学, 2012. ZHAO Fang.The degradation of sulfamethazine by microwave and microorganism[D].Zhengzhou: Zhengzhou University, 2012. |
| [40] |
王敏, 唐景春. 土壤中的抗生素污染及其生态毒性研究进展[J]. 农业环境科学学报, 2010, 29(增刊1): 261-266. WANG Min, TANG Jing-chun. Research of antibiotics pollution in soil environments and its ecological toxicity[J]. Journal of Agro-Environment Science, 2010, 29(Suppl 1): 261-266. |
| [41] |
唐非凡.金霉素、磺胺嘧啶在土壤中的降解特征及其对土壤微生物的影响[D].杭州: 浙江大学, 2012. TANG Fei-fan.Degradation of chlortetracycline and sulfadiazine in soil and their effects on soil microorganisms[D].Hangzhou: Zhejiang University, 2012. |
| [42] |
张杰.诺氟沙星的土壤环境行为及生态效应研究[D].南京: 南京农业大学, 2008. ZHANG Jie.Behaviors of norfloxacin in soil and its ecotoxicity[D].Nanjing: Nanjing Agricultural University.2008. |
| [43] |
孙春晓, 宋文华, 高敏苓, 等. 土霉素在土壤中降解特性研究[J]. 农业环境学学报, 2012, 31(6): 1141-1146. SUN Chun-xiao, SONG Wen-hua, GAO Min-ling, et al. Degradation properties of oxytetracycline in soil[J]. Journal of Agro-Environment Science, 2012, 31(6): 1141-1146. |
| [44] |
张树平, 高允生. 药理学[M]. 北京: 科学出版社, 2012. ZHANG Shu-ping, GAO Yun-sheng. Pharmacology[M]. Beijing: Science Press, 2012. |
 2018, Vol. 35
2018, Vol. 35