2. 西北师范大学生命科学学院, 兰州 730070;
3. 甘肃省农业科学院农业经济与信息研究所, 兰州 730070
2. College of Life Science, Northwest Normal University, Lanzhou 730070, China;
3. Institute of Agricultural and Economic Information, Gansu Academy of Agricultural Sciences, Lanzhou 730070, China
随着科学技术不断发展进步,利用生物种间关系、种内关系调节有害生物种群密度的生物防治手段越发受到人们的重视[1]。这种生物防治措施具有安全、有效和无污染等特点,与保护生态环境和社会协调发展的要求相吻合[2]。研究发现各类植物和庞大的微生物群体是有效获得生物拮抗菌的巨大宝库[3]。我国有着非常丰富的动植物和微生物资源,对此进行广泛筛选,针对不同的有害生物建立相应的资源数据库,这是十分重要的基础工作[4]。
由致病疫霉菌引起的马铃薯晚疫病在马铃薯生产中是一种毁灭性的病害[5],我国马铃薯生产每年因此而减产10%~15%[6],化学农药的防治措施造成的农药残留、环境污染和病原菌产生抗性等问题日益突出[7],因此,开发对人类和环境友好、同时具有较好防治效果的生物农药就显得十分必要。国内外已有研究[8-13]表明,许多植物成分或微生物对马铃薯晚疫疫霉菌表现出杀菌活性。Filippov等[14]很早就将Pseudomonas putida和Bacillus subtilis应用于马铃薯晚疫病的防治中,结果表明,生物制剂Immunofit M的防效效果与化学药剂相当;王树桐等[10]研究了88种中草药提取物对马铃薯晚疫病的抑菌活性;崔月贞等[7]从高寒草地牧草内生菌中筛选出对马铃薯晚疫疫霉菌具有高拮抗性的芽胞杆菌262AY11、262AY6和264AY2。这些研究为马铃薯晚疫病的生物防治奠定了理论和应用基础,展示了生物防治技术良好的应用前景。但是,病原菌会不断发生变异或者出现新的生理小种,拮抗菌的拮抗性状也可能会随着接种代数的增加而发生变异退化,所以针对这些问题,需要不断补充新的拮抗菌[15]。再者,从不同分离渠道获得的生防菌往往存在不易繁殖、在土壤和植物体内定殖能力弱、田间防效差和抗菌谱窄的缺点[16],而从马铃薯种植地土壤中分离筛选本土拮抗菌更易获得繁殖力强、易定殖的高效拮抗菌株。本研究从甘肃省临洮、会川等马铃薯种植地采集土样分离细菌,测定其对马铃薯晚疫疫霉菌的抑制效果,筛选出高拮抗生防菌,为晚疫病生物防治菌剂的研发提供菌株资源和理论依据。
1 材料与方法 1.1 供试材料土壤样本分别采集于甘肃会川和临洮马铃薯种植地。供试的植物病原真菌为辣椒疫霉菌(Phytophthora capsici)、黄瓜尖孢镰刀菌(Fusarium oxysporum)、马铃薯立枯丝核菌(Rhizoctonia solani)、马铃薯晚疫疫霉菌(Phytophthora infestans)、辣椒炭疽菌(Colletotrichum capsici)、小麦禾谷镰刀菌(FusaHum graminearum),均由西北师范大学生命科学学院微生物实验室提供。
土壤中细菌分离、纯化和培养采用牛肉膏蛋白胨培养基(NA),马铃薯晚疫疫霉菌的培养与拮抗试验采用黑麦-西红柿培养基(HX),其余植物病原菌的培养及拮抗试验采用马铃薯葡萄糖培养基(PDA)。NA培养基:牛肉浸膏3 g,蛋白胨10 g,氯化钠5 g,琼脂18 g,加水至1 L,pH 7.0;HX培养基:黑麦60 g,西红柿汁100 mL,碳酸钙0.4 g,琼脂15 g,加水至1 L;PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,加水至1 L。
1.2 试验方法参照张国庆等[17]的方法对所采土壤样品进行处理培养。取土壤样品1 g置于NA液体培养基内,37 ℃、180 r·min-1培养24 h。取0.1 mL培养液,用无菌水稀释成103、104、105这3个浓度梯度,涂布于NA平板上,37 ℃培养24 h。根据菌落形态和颜色等挑取不同单菌落,按常规方法纯化后保存,供筛选鉴定。
采用平板对峙生长法,测定所有分离菌株对马铃薯晚疫疫霉菌的拮抗作用,从中筛选出具有较强拮抗性的菌株。在直径9 cm的HX平板中央接入直径为5 mm的马铃薯晚疫疫霉菌菌饼,20 ℃左右黑暗生长一周后,在距中央2.5 cm处接入浸有活化培养24 h的分离菌株菌液的滤纸圆片(直径5 mm),20 ℃左右继续黑暗培养,设不接种分离菌株的处理为对照,每个菌株处理重复3次,10 d后测量病原菌的菌落半径。
参照王莉衡等[18]的平板对峙生长方法,在PDA平板上,进一步测定拮抗菌株对其他5种植物病原真菌的抑制能力,每个处理重复3次,10 d后测量病原菌的菌落半径。
观察拮抗菌株的培养形态、革兰氏染色并测定其生理生化特征,以及参照邢芳芳等[19]菌落基因组。采用细菌通用引物27F(5′ -AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′ -GGTTACCTTGTTACGACTT- 3′),由上海英俊生物技术有限公司合成。反应体系(50 μL):EX premix Tag 25 μL、27F引物(10 mmol· L-1)1 μL、1492R引物(10 mmol·L-1)1 μL、上清液模板5 μL、ddH2O 18 μL。PCR反应体系:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃ 10 min。通过生理特征和分子水平分析共同确定拮抗菌株的种属。
采用PCR方法,对菌株HC5进行多种抗生素合成基因的检测,名称和相应引物[20]序列见表 1。
|
|
表 1 菌株HC5中抗生素合成基因的检测 Table 1 Detection of antibiotic synthesis gene in strain HC5 |
拮抗菌株的抑菌率=(对照菌落半径-处理菌落半径)/对照菌落半径×100%
细菌常规的生理生化指标测定参照《常见细菌系统鉴定手册》[21]。
扩增片段测序后,所得序列经校对后与GenBank数据库中的已有序列进行BLAST比对分析,用MEGA 6.0软件聚类分析,构建系统发育树。
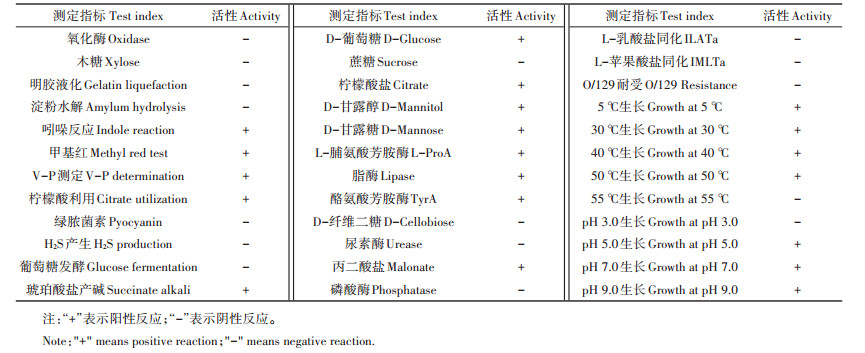
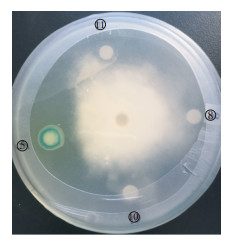
2 结果与分析 2.1 拮抗菌株HC5的筛选获得从土壤富集、稀释之后培养出的细菌中,选取了12株菌株进行与马铃薯晚疫疫霉菌的对峙拮抗筛选,其中从甘肃省会川所采土样中分离获得的菌株HC5对马铃薯晚疫疫霉菌有较好的拮抗效果(图 1和图 2)。
|
图 1 不同菌株与马铃薯晚疫疫霉菌的拮抗效果(5号显著) Figure 1 Antagonistic efficacy of different strain to P. infestans (No.5 is best) |
|
图 2 菌株HC5对马铃薯晚疫疫霉菌的抑制作用 Figure 2 Inhibitive activity of strain HC5 to P. infestans |
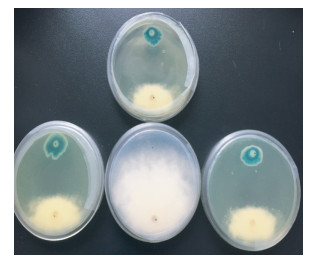
采用平板对峙试验,菌株HC5对测试的6种植物病原真菌中的4种都有不同程度的拮抗作用。其中对马铃薯晚疫疫霉菌拮抗性最显著,抑菌率达89%。对辣椒疫霉菌、黄瓜尖孢镰刀菌、辣椒炭疽菌也有一定的拮抗作用。对马铃薯立枯丝核菌、小麦禾谷镰刀菌不具有拮抗作用,病原菌包围拮抗菌,并长满整个平板(表 2和图 3)。
|
|
表 2 菌株HC5对植物病原真菌的抑制效果 Table 2 Inhibitive efficacy of strain HC5 to pathogenic fungi |
|
图 3 菌株HC5对植物病原真菌的抑制作用 Figure 3 Inhibitive activity of strain HC5 to pathogenic fungi |
HC5菌株在NA培养基上室温培养24 h,菌落呈扁平圆形,表面光滑有光泽,乳白色,不产色素;在PDA培养基上室温生长24 h,表面光滑湿润,产生蓝色色素和一种黄绿色代谢物,使周边培养基呈现淡黄色。革兰氏染色为阴性。生理生化鉴定结果见表 3。
|
|
表 3 菌株HC5生理生化特征 Table 3 Biochemical characteristics of strain HC5 |
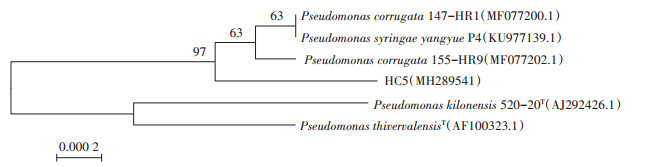
对菌株HC5经过扩增测序后,测序结果提交于GenBank进行同源比对,比对结果显示,HC5菌株的16S rRNA基因序列与公开发表的假单胞菌属同源性较高,相似度达99%。利用MEGA 6.0软件,将菌株HC5与模式菌株和假单胞菌属内的多个不同种的16S rRNA基因序列构建系统发育树,结果见图 4。
|
图 4 菌株HC5基于16S rRNA基因序列的系统发育树 Figure 4 Phylogenetic tree of strain HC5 and its relatives based on 16S rRNA gene sequences |
PCR检测结果见图 5,其中2,4-二乙酰基间苯三酚(2,4-DAPG)、吩嗪-1-羧酸(PCA)、吩嗪-1-甲酰胺(PCN)和藤黄绿脓菌素(PLT)都未扩增出相应条带,硝吡咯菌素(PRN)和氢氰酸(HCN)分别在786 bp和587 bp上出现了亮条带,说明菌株HC5中含有硝吡咯菌素和氢氰酸的合成基因,能够代谢产生这两种抗生素,在其抑制病原菌生长过程中发挥相应作用。

|
图 5 菌株HC5中抗生素合成基因检测 Figure 5 Detection of antibiotic synthesis gene in strain HC5 |
一般地,16S rRNA基因序列同源性大于99%,可以认为是同一种;同源性为95%~98%可以认为是同属不同种;同源性在95%以下可以认为不同属[22-23]。根据同源性比对、系统发育树的构建,结合形态和生理生化特征分析,确定菌株HC5为假单胞菌。假单胞菌在自然界广泛分布,种类繁多,能抑制多种植物病原菌,并在植物根际中具有很强的定殖能力,是植物根际土壤周围起生物防治功能的主要细菌类群[24]。根围微生物群被认为是植物的“第二基因组”[25],为植物提供由微生物衍生的化合物并具有相应的特性[26],因此,根系生防菌可谓是植物抵抗病原菌的天然屏障,故从自然界中分离新的假单胞菌是充分利用该细菌的基础[27]。
本研究分离获得的假单胞菌HC5经对峙实验发现,对辣椒疫霉菌、黄瓜尖孢镰刀菌、马铃薯晚疫疫霉菌、辣椒炭疽菌均有一定的抑制作用,尤其对马铃薯晚疫疫霉菌的抑菌效果显著,抑菌率达89%。通过生理生化检测发现,该菌株对温度和酸碱的耐受力极强,因此,认为假单胞菌HC5是一株具有开发潜力的生防细菌。
假单胞菌HC5对马铃薯晚疫疫霉菌有较强的抑制作用。假单胞菌的生防作用机理涉及有效的根部定殖、抗生作用、根际营养竞争(特别是对Fe的竞争)、诱导植物抗性、分泌降解微生物的酶、分泌一种或几种抗生素[28]。本研究通过PCR方法检测发现,菌株HC5中含有合成硝吡咯菌素和氢氰酸的基因。因此,菌株分泌的代谢产物中会存在这些抗生素,它们通过单一或协同作用产生抑菌效果,具体作用方式还有待进一步地深入研究来验证。
本研究对菌株HC5的拮抗性仅做了初步的鉴定,对马铃薯晚疫疫霉菌的拮抗能力的测定仅局限于实验室,对其在田间的拮抗能力表现仍需开展进一步的试验加以研究,将菌株HC5制备成制剂进行田间试验评价是我们下一步研究的重点。
4 结论以土壤为筛选基质,从中选取12株菌株进行对马铃薯晚疫疫霉菌的拮抗试验,获得一株拮抗率高达89%的菌株,编号为HC5,种属鉴定为假单胞菌,其可产生硝吡咯菌素和氢氰酸两种抗生素的合成基因,生长中对温度、酸碱的耐受力较强,是一株具有开发潜力的生防细菌。
| [1] |
夏丽琴.黑附球菌XF1菌株对马铃薯晚疫病的防治作用研究[D].保定: 河北农业大学, 2012. XIA Li-qin. Study about control efficacy of the Epicoccum purpurascens strain XF1 against potato late blight[D]. Baoding: Agricultural University of Hebei, 2012. |
| [2] |
李杨.黑附球菌XF1菌株对马铃薯晚疫病的生防作用[D].保定: 河北农业大学, 2010. LI Yang. Bio-control efficacy of the Epicoccum nigrum strain XF1 against potato late blight[D]. Baoding: Agricultural University of Hebei, 2010. |
| [3] |
曹克强, Ariena H C van Bruggen. 几种植物提取物和天然产物对马铃薯晚疫病菌的抑制作用[J]. 河北农业大学学报, 2001, 24(2): 90-96. CAO Ke-qiang, Ariena H C van Bruggen. Inhibitory efficacy of several plant extracts and plant products on Phytophthora infestans[J]. Journal of Hebei Agricultural University, 2001, 24(2): 90-96. DOI:10.3969/j.issn.1000-1573.2001.02.021 |
| [4] |
孟艳.马铃薯晚疫病菌的生物防治及寄主抗性机制的研究[D].大庆: 黑龙江八一农垦大学, 2009. MENG Yan. Study on biological control of Phytophthora infestans debary and resistance mechanisms of the host[D]. Daqing: Heilongjiang Bayi Agricultural University, 2009. |
| [5] |
郭梅, 闵凡祥, 王晓丹, 等. 生物源农药防治马铃薯晚疫病研究进展[J]. 中国马铃薯, 2007, 21(4): 227-230. GUO Mei, MIN Fan-xiang, WANG Xiao-dan, et al. Research progresses in biological pesticides control Phytophthora infestans[J]. Chinese Potato Journal, 2007, 21(4): 227-230. DOI:10.3969/j.issn.1672-3635.2007.04.013 |
| [6] |
蓝娟. 固原市原州区马铃薯晚疫病发生特点及防治技术[J]. 现代农业科技, 2014(19): 154-155. LAN Juan. Occurrence characteristics and control techniques of potato late blight of Yuanzhou District in Guyuan City[J]. Modern Agricultural Science and Technology, 2014(19): 154-155. DOI:10.3969/j.issn.1007-5739.2014.19.102 |
| [7] |
崔月贞, 杨小利, 杨成德, 等. 拮抗马铃薯晚疫病菌的高寒草地牧草内生细菌的鉴定及其生物功能测定[J]. 植物保护学报, 2016, 43(5): 789-795. CUI Yue-zhen, YANG Xiao-li, YANG Cheng-de, et al. Identification and determination of biological functions of endophytic bacteria from alpine pasture against Phytophthora infestans[J]. Journal of Plant Protection, 2016, 43(5): 789-795. |
| [8] |
Cǎrǎbet A, Grozea I, Chirita R, et al. Biological control of late blight (Phytophthora infestans(Mont.)de Bary)in tomatoes with my coextracts from Fusarium culmorum and Fusarium graminearum[J]. Communications in Agricultural and Applied Biological Sciences, 2008, 73(2): 257-262. |
| [9] |
杨怀文, 张志铭, 杨秀芬, 等. 嗜线虫致病杆菌代谢物对马铃薯晚疫病的抑制作用[J]. 中国生物防治, 2000, 16(3): 111-113. YANG Huai-wen, ZHANG Zhi-ming, YANG Xiu-fen, et al. Antibiosis of Xenorhabdus nematophilus metabolites against Phytophthora infestans[J]. Chinese Journal of Biological Control, 2000, 16(3): 111-113. |
| [10] |
王树桐, 宋风平, 胡同乐, 等. 知母提取物诱导马铃薯植株抗晚疫病作用机制初探[J]. 植物保护, 2009, 35(4): 34-38. WANG Shu-tong, SONG Feng-ping, HU Tong-le, et al. Resistance mechanism of potato plants to Phytophthora infestans induced by Anemarrhena asphodeloides extract[J]. Plant Protection, 2009, 35(4): 34-38. DOI:10.3969/j.issn.0529-1542.2009.04.007 |
| [11] |
蒋继志, 赵丽坤, 史娟, 等. 几种真菌发酵液对致病疫霉的抑制作用[J]. 微生物学通报, 2001, 28(2): 55-59. JIANG Ji-zhi, ZHAO Li-kun, SHI Juan, et al. Inhibition of fungal fermented filtrates on Phytophthora infestans[J]. Microbiology China, 2001, 28(2): 55-59. DOI:10.3969/j.issn.0253-2654.2001.02.015 |
| [12] |
蓝希钳, 周泽扬, 胡军华, 等. 假单孢菌20#-5菌株YFP对马铃薯晚疫病菌的抑制作用[J]. 植物保护学报, 2003, 30(3): 300-304. LAN Xi-qian, ZHOU Ze-yang, HU Jun-hua, et al. Effect of the metabolites Pseudomonas sp. 20#-5 on Phytophthora infestans[J]. Journal of Plant Protection, 2003, 30(3): 300-304. DOI:10.3321/j.issn:0577-7518.2003.03.014 |
| [13] |
曹静, 客绍英, 王树桐, 等. 20种植物提取物对马铃薯晚疫病菌的抗菌活性研究[J]. 中国农学通报, 2005, 21(12): 343-345. CAO Jing, KE Shao-ying, WANG Shu-tong, et al. Study on fungi toxity of 20 plant extracts against Phytophthora infestans[J]. Chinese Agricultural Science Bulletin, 2005, 21(12): 343-345. DOI:10.3969/j.issn.1000-6850.2005.12.097 |
| [14] |
Filippov A, Kuznetsova M. Different influence of some biofungicides on dynamices of potato plan susceptibility to Phytophthora infestans (Mont.)de Bary[J]. Mikologiya I Fitopatologiya, 1994, 28(4): 64-39. |
| [15] |
起登凤, 邹良平, 周登博, 等. GA1-2菌株的分离鉴定及其对香蕉尖孢镰刀菌的抑菌效果[J]. 植物保护学报, 2017, 44(5): 809-816. QI Deng -feng, ZOU Liang-ping, ZHOU Deng-bo, et al. Isolation, identification of strain GA1-2 and its antifungal activity against Fusarium oxysporum f. sp. cubense[J]. Journal of Plant Protection, 2017, 44(5): 809-816. |
| [16] |
周登博, 井涛, 张锡炎, 等. 香蕉枯萎病拮抗菌筛选及其抑菌活性[J]. 植物保护学报, 2016, 43(6): 913-921. ZHOU Deng-bo, JING Tao, ZHANG Xi-yan, et al. Screening and antibacterial activity of antagonistic bacteria against banana Fusarium wilt disease[J]. Journal of Plant Protection, 2016, 43(6): 913-921. |
| [17] |
张国庆, 董晓芳, 佟建明, 等. 一株芽孢杆菌的分离和鉴定[J]. 微生物学通报, 2010, 37(8): 1159-1163. ZHANG Guo-qing, DONG Xiao-fang, TONG Jian-ming, et al. Isolation and identification of a Bacillus sp. starin[J]. Microbiology China, 2010, 37(8): 1159-1163. |
| [18] |
王莉衡, 柯杨, 强毅, 等. 芦荟内生菌内生哈茨木霉LH-7对植物病原菌的抗性[J]. 应用生态学报, 2014, 25(4): 1130-1136. WANG Li -heng, KE Yang, QIANG Yi, et al. Inhibition effects and mechanisms of the entophytic fungus Trichoderma harzianum LH-7 from Aloe barbadensis[J]. Chinese Journal of Applied Ecology, 2014, 25(4): 1130-1136. |
| [19] |
邢芳芳, 高明夫, 胡兆平, 等. 木霉菌M2的鉴定及其对小白菜促生效果研究[J]. 农业资源与环境学报, 2017, 34(1): 80-85. XING Fang-fang, GAO Ming-fu, HU Zhao-ping, et al. Identification of Trichoderma strain M2 and related growth promoting effects on Brassica chinensis L[J]. Journal of Agricultural Resources and Environment, 2017, 34(1): 80-85. |
| [20] |
周田甜.番茄青枯病拮抗菌J12和J2的分离鉴定及抗生素2, 4-DAPG合成和调控研究[D].南京: 南京农业大学, 2012. ZHOU Tian-tian. Isolation, characterization of antagonistic strains J12 and J2 against tomato bacteria wilt and study of antibiotic synthesis, regulation 2, 4-DAPG[D]. Nanjing: Nanjing Agricultural University, 2012. |
| [21] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 349-398. DONG Xiu-zhu, CAI Miao-ying. Systematic identification manual of common bacteria[M]. Beijing: Science Press, 2001: 349-398. |
| [22] |
Devereux R, He S H, Doyle C L, et al. Diversity and origin of Desulfovibrio species:Phylogenetic definition of a family[J]. Journal of Bacteriology, 1990, 172(7): 3609-3619. DOI:10.1128/jb.172.7.3609-3619.1990 |
| [23] |
Fry N K, Warwick S, Saunders N A, et al. The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family legionellaceae[J]. Journal of General Microbiology, 1991, 137(5): 1215-1222. DOI:10.1099/00221287-137-5-1215 |
| [24] |
Weller D M, Raaijmakers J M, Gardener B B, et al. Microbial populations responsible for specific soil suppressiveness to plant pathogens[J]. Annual Review of Phytopathology, 2002, 40(1): 309-348. DOI:10.1146/annurev.phyto.40.030402.110010 |
| [25] |
吴晓青, 周方园, 张新建. 微生物组学对植物病害微生物防治研究的启示[J]. 微生物学报, 2017, 57(6): 867-875. WU Xiao-qing, ZHOU Fang-yuan, ZHANG Xin-jian. Enlightenment from microbiome research towards biocontrol of plant disease[J]. Acta Microbiologica Sinica, 2017, 57(6): 867-875. |
| [26] |
Lareen A, Burton F, Schäfer P. Plant root-microbe communication in shaping root microbiomes[J]. Plant Molecular Biology, 2016, 90(6): 575-587. DOI:10.1007/s11103-015-0417-8 |
| [27] |
张望月, 高健, 张超, 等. 五种假单胞菌的分离鉴定及其生物活性[J]. 微生物学报, 2013, 53(9): 957-965. ZHANG Wang-yue, GAO Jian, ZHANG Chao, et al. Isolation, identification and characterization of five Pseudomonas strains[J]. Acta Microbiologica Sinica, 2013, 53(9): 957-965. |
| [28] |
何延静, 刘海明, 胡洪波, 等. 一株拮抗辣椒疫霉的假单胞菌的分离与鉴定[J]. 微生物学报, 2006, 46(4): 516-52l. HE Yan-jing, LIU Hai-ming, HU Hong-bo, et al. Isolation and characterization of a new Pseudomonas strain against Phytophthora capsici[J]. Acta Microbiologica Sinica, 2006, 46(4): 516-52l. DOI:10.3321/j.issn:0001-6209.2006.04.003 |
 2018, Vol. 35
2018, Vol. 35