2. 西北农林科技大学机电学院, 陕西 杨凌 712100
2. College of Mechanical and Electronic Engineering, Northwest A & F University, Yangling 712100, China
沼气发酵能产生洁净生物质能源甲烷。截至2017年,中国沼气总产量为158亿m3,相当于1182万t标准煤[1]。我国沼气发酵产业已驶入快车道,工程硬件建设水平不断提升,但沼气发酵管理技术研究相对滞后,其中沼液化学成分常规测定及快速检测技术尚未形成,严重制约了沼气发酵研究及对沼气发酵过程的科学管理,影响了沼气发酵的产气量及效益,尤其是沼液中乙酸含量的常规测定方法亟待优化。McCarty[2]、Müller等[3]研究表明,有机物在厌氧发酵过程中形成的乙酸、CO2、H2及甲醇是形成甲烷的主要原料,其中72%的甲烷是由乙酸形成。因此,沼液中乙酸含量测定对沼气发酵过程研究及管理有重要的理论及实践意义。
目前,乙酸含量测定的常规方法为液相色谱法[4-7],但其测定程序复杂、成本高,需要价格昂贵的液相色谱仪,难以用于沼液中乙酸的常规分析。比色分析是准确快速的常规分析方法,但目前鲜见沼液中乙酸含量比色测定的研究报道。研究表明,利用FeCl3与乙酸的显色反应能够准确测定纯乙酸体系中乙酸含量[8],但该方法能否用于沼液中乙酸的比色测定尚不清楚。本文重点探讨了乙酸与FeCl3比色法用于沼液中乙酸含量测定时的样品预处理方法、可行性及测定条件,旨在为沼液中乙酸含量测定提供一种准确快速的常规分析方法。
1 材料与方法 1.1 试剂与仪器试剂:活性炭;1.0 mol·L-1 NaOH溶液;100.0 g· L-1 FeCl3显色剂;0.175 0、0.350 0、0.525 0 mol·L-1标准乙酸溶液;新采集的沼液。
沼液预处理组合沉淀剂:沉淀剂由Na3PO4和CaCl2两种溶液组成,二者反应形成磷酸钙胶体,具有巨大比表面和凝聚能力,能使浑浊的沼液快速絮凝澄清,加快过滤速度。反应所需CaCl2和Na3PO4的摩尔比为3:2,沉淀剂按此摩尔比配制,具体步骤为称取分析纯Na3PO4·12H2O 150.0 g,加纯水至1 L,称取无水CaCl2 65.1 g,加纯水至1 L,单独保存,使用时按1:1比例(体积比)和需要量加入待处理沼液中混匀即可。
仪器:pH计;721分光光度计。
1.2 方法 1.2.1 沼液预处理从沼气池中采集已搅拌均匀的沼液,摇匀后静置1 h;取200 mL上清液于三角瓶中,分别加入25 mL 150 g·L-1 Na3PO4·12H2O溶液和25 mL 65.1 g·L-1 CaCl2溶液,充分摇匀,溶液总体积为250 mL,静置5 min;向溶液中加入1 g活性炭充分摇匀,5 min后立即过滤。
1.2.2 沉淀剂对乙酸测定的影响沼液中含有大量固体颗粒,影响比色测定结果,需要用沉淀法除去。但自然沉淀耗时长、效果差。本方法中饱和Na3PO4与饱和CaCl2在沼液中反应生成比表面很大的磷酸钙胶体沉淀剂,改善了沉淀效果,能迅速使沼液澄清,但沉淀剂对乙酸有吸附作用,导致乙酸测值偏低,需对乙酸的测定结果进行校正。
磷酸钙沉淀剂对乙酸吸附量的测定:吸取5 mL 0.175 0 mol·L-1乙酸标准溶液于150 mL烧杯中,用1 mol·L-1 NaOH调节pH至7.0,按1:1比例加入1.1节中的组合沉淀剂共0、5(2.5+2.5)、10(5+5)、15(7.5+7.5)mL,充分混匀;静置沉淀0、5、15、30、60 min,摇匀后用中速滤纸过滤至50 mL容量瓶,用少量纯水将烧杯、滤纸及滤纸上沉淀物中残留的游离乙酸全部洗入容量瓶;加入2 mL 100.0 g·L-1 FeCl3显色剂,用1 mol· L-1 NaOH调节pH至3.0,用纯水定容到50 mL,充分摇匀,(25±2)℃显色1.5 h后在550 nm波长测定其吸光值。
不同乙酸浓度下沉淀剂对乙酸吸附量的测定:分别吸取5 mL浓度0.175 0、0.350 0、0.525 0 mol·L-1乙酸标准溶液,用1 mol·L-1 NaOH调节pH至7.0,加入1.1节中的组合沉淀剂共5(2.5+2.5)mL,充分混匀;静置沉淀10 min后用中速滤纸过滤至50 mL容量瓶,后续显色、比色方法与“磷酸钙沉淀剂对乙酸的吸附量的测定”方法相同。空白对照不加组合沉淀剂,其他处理方法及吸光值测定方法与上述加沉淀剂样品完全相同。

|
(1) |

|
(2) |

|
(3) |
式(1)中:B、A分别为组合沉淀剂吸附乙酸前、后的乙酸浓度,mg·mL-1;Va、Vp分别为乙酸沉淀剂作用后的显色体系体积(50 mL)、组合沉淀剂加入量(5 mL)。
1.2.3 活性炭脱色剂对乙酸测定的影响沉淀剂处理后的沼液有颜色,影响比色测定结果,需要脱色。本文以活性炭为脱色剂进行处理。
活性炭对乙酸吸附量的测定:吸取5 mL 0.175 0 mol·L-1乙酸标准溶液,用1 mol·L-1 NaOH调节pH至7.0;分别加入0、0.1、0.2、0.3 g活性炭,充分混匀;在吸附脱色0、5、15、30、60 min后用中速滤纸过滤至50 mL容量瓶,后续显色、比色方法与1.2.2节中“磷酸钙沉淀剂对乙酸吸附量的测定”方法相同。
不同乙酸浓度下活性炭脱色剂对乙酸吸附量的测定:取5 mL浓度0.175 0、0.350 0、0.525 0 mol·L-1乙酸标准溶液,用1 mol·L-1 NaOH调节pH至7.0,加入0.2 g活性炭,充分混匀,吸附脱色10 min后用中速滤纸过滤至50 mL容量瓶,后续显色、比色方法与1.2.2中“磷酸钙沉淀剂对乙酸吸附量的测定”方法相同。空白对照除不加脱色剂外,其他处理方法及吸光值测定方法与上述加脱色剂样品完全相同。
1.2.4 显色时间的选取吸取0、5、10、15、20、25 mL 1.2.1节中沉淀-脱色预处理后的沼液滤液,用1.0 mol·L-1 NaOH调节显色液pH至7.0,加2 mL 100.0 g·L-1 FeCl3显色剂,用1.0 mol·L-1 NaOH调节显色液pH至3.0,用纯水定容到50 mL,(25±2)℃显色1.5、3.0、6.0 h时在波长550 nm处测定其吸光值,绘制不同显色时间时沼液体积与沼液中乙酸铁化合物吸光值比色曲线。
1.2.5 乙酸铁比色标准曲线的绘制吸取0.175 0 mol·L-1乙酸标准液0、2、4、6、8、10 mL于50 mL容量瓶中,加100.0 g·L-1 FeCl3显色剂2 mL,用1.0 mol·L-1 NaOH调节显色液pH为3.0,用纯水定容至50 mL,(25±2)℃显色3.0 h,在550 nm处测定其吸光值,绘制比色曲线,计算乙酸浓度与乙酸铁吸光值间关系的回归方程。
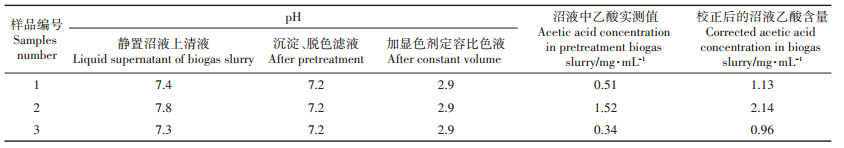
1.2.6 沼液中乙酸的测定吸取10 mL 1.2.1节中沉淀-脱色预处理的沼液滤液于50 mL容量瓶,加2 mL 100.0 g·L-1 FeCl3显色剂,用1.0 mol·L-1 NaOH调节显色液pH至3.0,用去离子水定容至50 mL,(25±2)℃显色3.0 h,在550 nm下测定其吸光值,根据比色标准曲线计算沼液中的乙酸含量,加校正值C即得沼液中乙酸的实际含量。同时测定静置沼液上清液、沉淀-脱色处理滤液及沉淀-脱色处理滤液加显色剂定容后比色液的pH。沼液中乙酸含量计算公式:
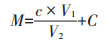
|
(4) |
式(4)中:M为沼液中乙酸含量,mg·mL-1;c为比色液中乙酸浓度,mg·mL-1;C为校正系数,在本方法中,其值为0.62 mg·mL-1;V1、V2分别为比色液体积、显色时加入的沼液待测滤液体积,本方法中V2为10 mL。
1.2.7 沼液中乙酸回收率的测算吸取0、2、4、6、8、10 mL 0.175 0 mol·L-1乙酸标准溶液于50 mL容量瓶;分别加入5 mL沼液滤液及2 mL 100.0 g·L-1 FeCl3显色剂,用1.0 mol·L-1 NaOH调节pH至3.0,用去离子水定容至50 mL,充分混匀后显色3 h,在波长550 nm下测定其吸光值,根据比色标准曲线计算沼液中乙酸含量,并根据乙酸的理论含量与实测含量计算乙酸在沼液体系中的回收率。
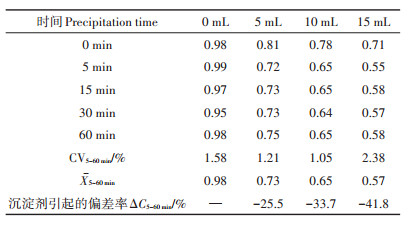
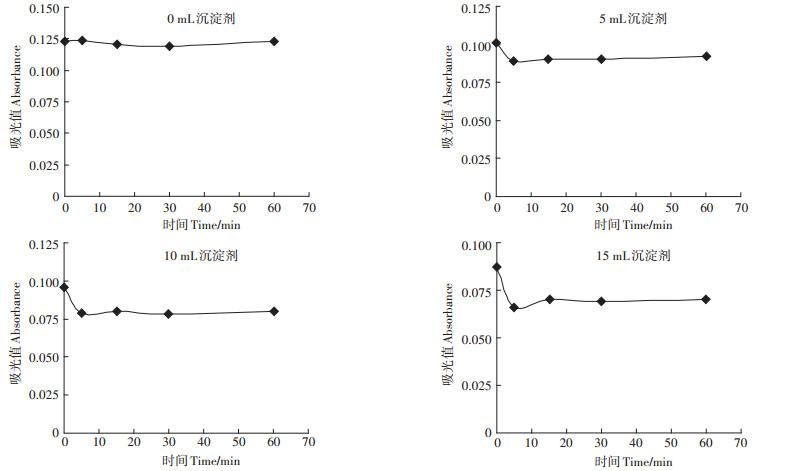
2 结果与分析 2.1 沉淀剂对乙酸测定的影响 2.1.1 沉淀剂用量对乙酸吸附量的影响由表 1、图 1可知,组合沉淀剂对乙酸的吸附过程很快,沉淀剂用量为5、10、15 mL时,沉淀5 min,沉淀剂对乙酸的吸附达到平衡,在5~60 min的吸附平衡时间内,对应乙酸铁化合物浓度变化很小,其变异系数CV分别为1.21%、1.05%、2.38%,表明在同一吸附剂用量时,平衡时间对乙酸铁浓度的影响不大;随组合沉淀剂用量增加,沉淀剂对乙酸的吸附量增加。沉淀剂用量为5、10、15 mL时,乙酸含量测值较不加沉淀剂对照分别下降(测值负偏差)25.5%、33.7%、41.8%,即沉淀剂的加入加快了沼液澄清过程,改善了滤液性质,但会引起乙酸测值产生负偏差,沉淀剂用量愈大,负偏差愈大。在吸附达到平衡时,沉淀剂对乙酸的饱和吸附量恒定,故只需对乙酸的最终测值进行校正就可以消除沼液预处理时沉淀剂对测值的影响。
|
|
表 1 不同沉淀剂用量下滤液中乙酸浓度(mg·mL-1) Table 1 The concentration of acetic acid under different precipitation treatments(mg·mL-1) |
|
图 1 加入不同量组合沉淀剂后乙酸铁的吸光值 Figure 1 The absorbance of ferric acetate treated with different amount of precipitant |
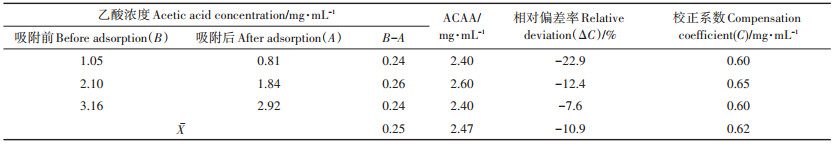
由表 2可知,当沉淀剂加入量一定时,沉淀剂对乙酸的吸附量不受乙酸浓度影响。当乙酸吸附前浓度为1.05、2.10、3.16 mg·mL-1时,加入5 mL组合沉淀剂后乙酸浓度减少量分别为0.24、0.26、0.24 mg · mL-1,均值为0.25 mg·mL-1;组合沉淀剂的乙酸吸附量(ACAA)按式(1)计算,为2.40、2.60、2.40 mg·mL-1,平均值为2.47 mg·mL-1。由此计算出按1.2.1方法进行沼液预处理及比色测定时,消除沉淀剂吸附乙酸产生的负偏差的校正系数C均值为0.62 mg·mL-1,即沼液乙酸浓度的最终测定值加上C值得沼液中乙酸的实际浓度。
|
|
表 2 不同乙酸浓度下组合沉淀剂对乙酸的吸附量(ACAA) Table 2 The ACAA (Adsorption capacity of acetic acid)of precipitant under different acetic acid concentrations |
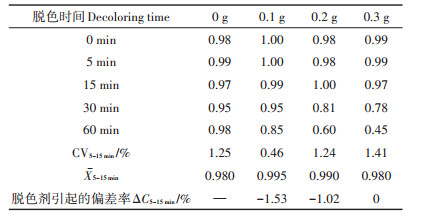
由图 2和表 3可知,在脱色时间15 min以内时,活性炭基本不吸附乙酸,15 min后活性炭对乙酸的吸附量随吸附时间增长大幅度增加;活性炭加入量愈多、时间愈长,活性炭对乙酸吸附量愈大。因此,用活性炭脱色时,脱色时间应控制在15 min内。本方法推荐时间为5 min,在此时间内,脱色过程已完成,且活性炭对乙酸的吸附可以忽略。
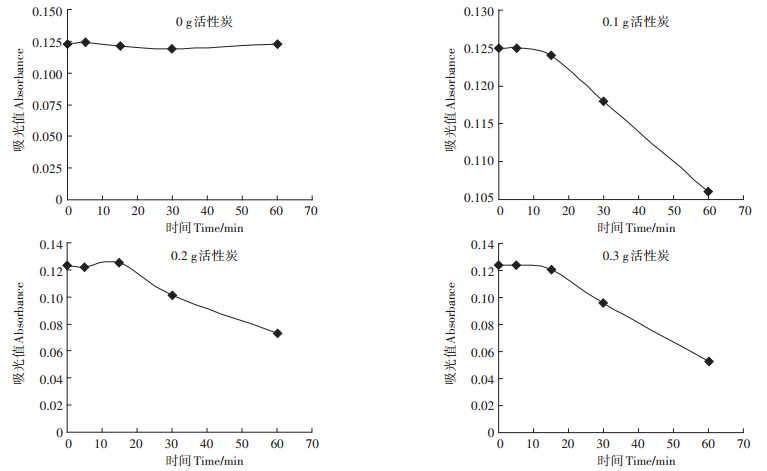
|
图 2 加入不同量活性炭脱色剂后乙酸铁的吸光值 Figure 2 The absorbance of ferric acetate treated with different amount of activated carbon |
|
|
表 3 不同脱色剂用量下滤液中乙酸的浓度(mg·mL-1) Table 3 The concentration of acetic acid under different treatments with decolorizing agent(mg·mL-1) |
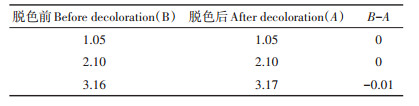
从图 2、表 4可知,在乙酸浓度为1.05~3.16 mg·mL-1范围内,在脱色时间10 min时,活性炭脱色剂不吸附乙酸,且其对乙酸的吸附与乙酸浓度无关。即用活性炭对沼液进行预处理脱色时,脱色时间控制在10 min内,加入活性炭对乙酸比色测定结果无显著影响。
|
|
表 4 活性炭脱色10 min时滤液中乙酸的浓度(mg·mL-1) Table 4 The concentration of acetic acid at 10 min decoloration (mg·mL-1) |
由图 3可知,用比色法测定沼液中乙酸含量时,显色后1.5、3.0、6.0 h,乙酸铁化合物比色曲线的决定系数R2分别为0.957 5、0.997 4、0.996 2。由图 4可知,在3~6 h内,乙酸铁化合物的吸光值基本不变,其相对偏差为±5%。在沼液滤液量为5、10 mL,显色3 h时,乙酸铁化合物的吸光值基本达到最大值,因此,本文推荐沼液滤液量为10 mL,显色时间取3.0 h为宜。
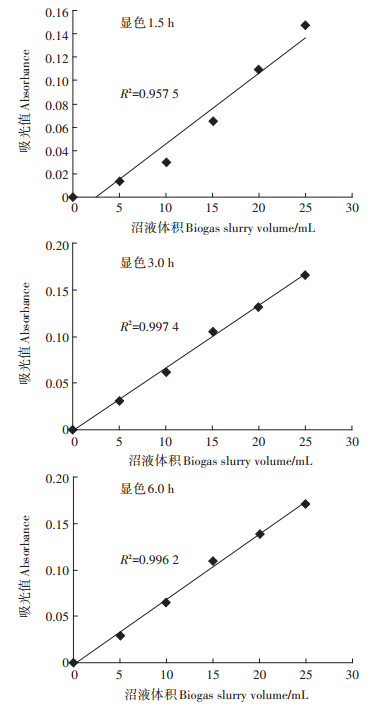
|
图 3 滤液中乙酸铁在不同显色时间的比色曲线 Figure 3 The colorimetric curve of ferric acetate in the pretreatment biogas slurry |
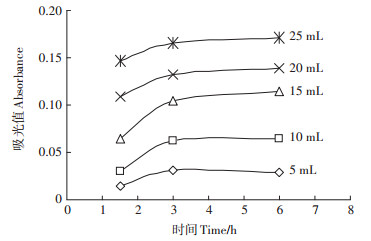
|
图 4 不同体积沼液滤液中乙酸铁吸光值与时间关系 Figure 4 The relationship between the absorbance of ferric acetate and time under different volume of treatment fluids |
由表 5可知,采集pH为7.3~7.8的3份不同沼液样品经沉淀、脱色处理及过滤后,滤液pH均为7.2。取10 mL预处理后的待测液,加入2 mL 100.0 g·L-1 FeCl3显色剂定容后,所测pH均为2.9,即显色液的pH在乙酸铁有色化合物的最佳比色pH范围内[8],不需要用1 mol·L-1 NaOH调节pH,就可以直接比色测定。加上沉淀剂负偏差校正后的沼液乙酸含量分别为1.13、2.14及0.96 mg·mL-1。
|
|
表 5 沼液不同处理pH及乙酸含量 Table 5 The pH and acetic acid concentration of biogas slurry after different treatments |
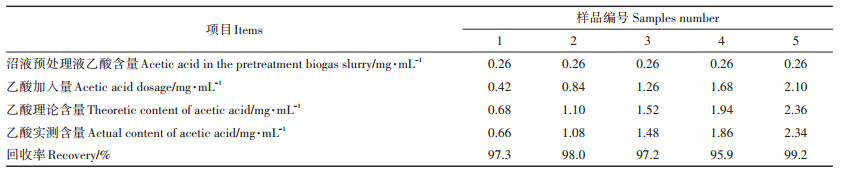
沼液成分较为复杂,乙酸之外的其他成分是否与FeCl3显色剂形成有色物质干扰乙酸测定也不能忽视。从表 6可知,向已知乙酸浓度的5份沼液样品中加入不同量乙酸时,用乙酸铁比色法测得的乙酸回收率为95.9%~99.2%,平均回收率为97.52%,可以满足科学研究及沼气发酵管理对沼液中乙酸含量测值的准确度要求。
|
|
表 6 沼液中乙酸回收率 Table 6 The recovery of acetic acid in biogas slurry |
综合以上结果,可建立沼液中乙酸的乙酸铁比色测定法。
沼液预处理:从沼气池中采集搅拌均匀的沼液500~800 mL,摇匀后静置1 h。取200 mL上清液于三角瓶中,分别加入25 mL 150 g·L-1 Na3PO4·12H2O溶液和25 mL 65.1 g·L-1无水CaCl2溶液,充分摇匀,静置5 min;向溶液中加入1 g活性炭充分摇匀,5 min后立即过滤。
乙酸铁比色测定:吸取10 mL沼液预处理滤液于50 mL容量瓶中,加2 mL浓度为100.0 g·L-1 FeCl3显色剂,用1.0 mol·L-1 NaOH调节pH至3.0(如果显色液pH为2.9~3.0,则直接定容测定),用纯水定容至50 mL,(25±2)℃显色3 h,比色波长550 nm。同步制备乙酸铁标准曲线(详见1.2.5节),根据标准曲线计算沼液中的乙酸含量,加校正值后得到沼液的乙酸含量。
3 讨论研究表明,用FeCl3比色法测定沼液中乙酸含量是可行的。
在测定前,要对沼液进行固相杂质沉淀、有色物质脱色预处理,以获得可用于比色分析的无色透明滤液。沉淀剂磷酸钙胶体对乙酸有吸附作用,加入沉淀剂会降低沼液中乙酸含量测定值,但磷酸钙对乙酸的吸附存在饱和吸附量。当沼液预处理时沉淀剂的加入量确定,则乙酸的饱和吸附量确定。沉淀剂所吸附的乙酸量分摊到单位体积预处理沼液滤液中的乙酸量确定,即吸附剂导致的测定结果负偏差(mg·mL-1)是确定的。按本文方法确定的沉淀剂加入量进行沼液预处理时,该负偏差就是本文测定得到的校正系数C(0.62 mg·mL-1)。当用本文方法测出沼液的乙酸含量时,加上该校正系数,就获得沼液的实际乙酸含量。即可以用沉淀剂校正系数消除沉淀剂吸附乙酸造成的测值负偏差。另外,将活性炭的脱色时间控制在5~10 min时,脱色剂对测定结果的影响可忽略。
各地沼气发酵原料不同,导致沼液黏稠度、颜色存在差异,致使沉淀剂用量发生变化,乙酸测值校正系数也会随之发生改变。在要求较高的研究及精确测定中,要针对沼液澄清的实际需要确定组合沉淀剂的加入量,并测定对应的负偏差校正系数,对乙酸测值进行校正。另外,本文仅探讨了组合沉淀剂对沼液中乙酸测定结果的影响,在后续研究中应继续筛选对乙酸测定影响更小甚至无影响的沉淀剂,以消除沉淀剂引起的乙酸测值负偏差。
4 结论(1)沼液预处理时,沉淀剂吸附乙酸导致待测液中乙酸测值偏低,在沉淀剂用量固定时其负偏差为一常数,可用该常数对乙酸测定结果进行校正。
(2)将脱色时间控制在10 min以内时,加入活性炭脱色剂对乙酸测定结果的影响可忽略。
(3)沼液预处理获得的含乙酸待测液与100.0 g·L-1 FeCl3显色剂反应得到的乙酸铁化合物在550 nm处的吸光值在显色后3.0~6.0 h内基本不变,其相对偏差为±5%。在沼液预处理待测液中,用乙酸铁比色法测定乙酸的平均回收率为97.52%(RSD为1.44%,n=5)。
| [1] |
蒋梦惟, 林子. 5年内我国沼气总产量再增三成[ EB/OL]. (2017- 02-17). http://www.bbtnews.com.cn/2017/0217/181749.shtml. JIANG Meng-wei, LIN Zi. In five years, the total production of methane in China will increase by 30%[EB / OL]. (2017-02-17). http://www.bbtnews.com.cn/2017/0217/181749.shtml. |
| [2] |
McCarty P L. Anaerobic waste treatment fundamentals[J]. Public Works, 1964, 95(9): 107-112. |
| [3] |
Müller V, 马晓航. 巴氏甲烷八叠球菌在产甲烷和生长过程中对H2-甲醇的利用[J]. 国外沼气, 1989(10): 50-55. Müller V, MA Xiao-hang. The utilization of H2-methanol in the production of methane and the growth process of Methanosarcina barkeri[J]. Foreign Biogas, 1989(10): 50-55. |
| [4] |
冯斌, 邵华, 程学美. 高效液相色谱法测定尿中甲酸和乙酸[J]. 中国卫生检验杂志, 2006, 16(2): 207-208. FENG Bin, SHAO Hua, CHENG Xue-mei. Determination of formic acid and acetic acid in urine by high performance liquid chromatography[J]. Chinese Journal of Health Laboratory Technology, 2006, 16(2): 207-208. DOI:10.3969/j.issn.1004-8685.2006.02.035 |
| [5] |
谢明, 吴莹莹, 侯水生. 饲料有机酸化剂中乙酸、柠檬酸的高效液相色谱检测分析[J]. 饲料工业, 2004, 25(10): 48-49. XIE Ming, WU Ying-ying, HOU Shui-sheng. Determination of acetic acid and citric acid in feed organic acidifier by high performance liquid chromatography[J]. Feed Industry, 2004, 25(10): 48-49. DOI:10.3969/j.issn.1001-991X.2004.10.014 |
| [6] |
康春莉, 王洋, 于宏兵, 等. 高效液相色谱法快速测定糠醛废水中的乙酸含量[J]. 吉林大学学报(理学版), 2004, 42(3): 467-470. KANG Chun-li, WANG Yang, YU Hong-bing, et al. Determination of acetic acid in furfural waste water by high performance liquid chromatography[J]. Journal of Jilin University(Science Edition), 2004, 42(3): 467-470. DOI:10.3321/j.issn:1671-5489.2004.03.035 |
| [7] |
冯向东. 高效液相色谱法测定白酒中乳酸和乙酸含量[J]. 酿酒科技, 2009(5): 115-116. FENG Xiang-dong. Determination of the content of lactic acid & acetic acid by HPLC[J]. Liquor-Making Science & Technology, 2009(5): 115-116. |
| [8] |
赵国进. GENMED乙酸比色法定量检测试剂盒:青出于蓝而胜于蓝[J]. 食品安全导刊, 2009(2): 38-39. ZHAO Guo-jin. GENMED kit with colorimetric method can realize quantitive detection more accurately and effectively[J]. China Food Safety Guide, 2009(2): 38-39. |
 2018, Vol. 35
2018, Vol. 35