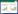文章信息
- 杨欢, 马有宁, 秦美玲, 柴爽爽, 何巧, 张涵彤, 陈铭学
- YANG Huan, MA You-ning, QIN Mei-ling, CHAI Shuang-shuang, HE Qiao, ZHANG Han-tong, CHEN Ming-xue
- 氯虫苯甲酰胺和毒死蜱在水稻中的分布降解研究
- Distribution and degradation of chlorantraniliprole and chlorpyrifos in rice
- 农业资源与环境学报, 2018, 35(4): 342-348
- Journal of Agricultural Resources and Environment, 2018, 35(4): 342-348
- http://dx.doi.org/10.13254/j.jare.2017.0323
-
文章历史
- 收稿日期: 2017-12-14
录用日期: 2018-02-28
稻纵卷叶螟和二化螟等是水稻中常见的害虫,可在营养生长和生殖生长期间为害水稻,造成水稻减产[1]。氯虫苯甲酰胺和毒死蜱是目前防治螟虫的高毒农药替代品[2],其中氯虫苯甲酰胺是一种具有“尼古丁受体激活剂”作用的新型邻酰胺基苯甲酰胺杀虫剂[3]。2010年中国水稻研究所根据两种农药的作用特性开发的复配制剂在害虫防治方面具有较好的协同增效作用[4],可降低农药用量和成本,提高社会经济效益。
迄今为止,国内外有关两种农药杀虫机理[5-6]、残留降解行为[7-16]、检测方法[17-24]等方面的报道较多。为严格监督把控农药的合理使用,国内外也先后制定了两种农药在各样品基体中的限量标准,但目前尚无毒死蜱的毒性代谢产物在各作物中的残留限量。近年来,毒死蜱和氯虫苯甲酰胺新型复配农药在水稻等作物上的应用研究认为,部分农药可能持续到收获期污染籽粒[25-27],但两种农药施用后在水稻各器官的动态残留趋势和籽粒各器官的分布规律的系统研究报道较少。因此有必要开展两种农药在水稻中的残留行为及籽粒中的分布规律研究,为两种农药的合理使用和水稻质量管理提供基本信息。
本研究以水稻为实验对象,采用HPLC-MS/MS技术研究了两种农药在水稻植株中的动力学特征及在籽粒中的残留行为,以期探明水稻中农药及代谢物的积累分布规律,进一步降低籽粒中农药及毒性物质的残留量,为两种农药的复配剂在田间科学使用提供一定参考。
1 材料与方法 1.1 供试药剂与仪器设备40%毒死蜱乳油和200 g·L-1氯虫苯甲酰胺悬浮剂分别由浙江新安化工集团股份有限公司和美国杜邦公司提供,供试水稻品种为籼型杂交稻中浙优10号和甬优12号。毒死蜱(纯度99.0%)标准品购自农业部环境质量监督检验测试中心;氯虫苯甲酰胺和毒死蜱的代谢产物3,5,6-TCP(纯度99.0%)标准品购自德国Dr. Ehrenstorfer公司。乙腈、甲酸(色谱纯,美国Tedia公司);氯化钠(分析纯,上海试四赫维化工有限公司);乙二胺-N-丙基硅烷(PSA)和十八烷基键合硅胶吸附剂(C18)填料(粒径40.0 μm,瓦里安公司);无水硫酸镁(分析纯,Sigma-Aldrich公司)。Surveyor系列液相色谱仪、TSQ Quantum Access Max三重四极杆质谱仪(美国ThermoFisher公司);高速匀浆机、研磨机(德国IKA公司);Primo R离心机(美国ThermoFisher公司);脱壳机(佐竹机械有限公司)。
1.2 实验设计供试品种为中浙优10号和甬优12号,田间试验于2016年7—10月在中国水稻研究所试验区进行,施药时间为水稻抽穗期。消解动态和残留分布试验按NY/T 788—2004农药残留试验准则[28]执行,每小区面积30 m2,每个处理设置3个重复,小区间设保护行,另设空白对照小区。施药方案:水稻中农药及代谢物消解试验分别以40%毒死蜱乳油(7.45 L·hm-2)和200 g·L-1氯虫苯甲酰胺悬浮剂(3.28 kg·hm-2)的两倍推荐剂量为施药量,分布试验设置低剂量(推荐剂量)和高剂量(2倍推荐剂量)两个不同浓度的施药剂量。每次两种农药同时喷施,喷施后24 h内无降雨,空白对照无施药处理。
消解试验样品分别于施药后2 h和1、3、5、7、14、21、28 d在每个小区选取9个点均匀采集水稻植株及籽粒装入塑封袋中,并随时作好标签和取样记录,采集的样品均保存在-20 ℃的冰柜中;残留分布试验在施药后21、28、35 d和42 d(收获期)参照消解试验的取样方法取样,并保存。
1.3 样品前处理与净化称取5.0 g样品于离心管中,依次加入20.0 mL超纯水充分浸泡30.0 min后加入25.0 mL乙腈,振荡混匀后在转速为8000 r·min-1下匀浆2.0 min后,分别加入10.0 g MgSO4、1.0 g NaCl,再次匀浆2.0 min后在3800 r·min-1离心3.0 min。取上层乙腈相5.0 mL于装有1.0 g MgSO4、100.0 mg PSA和100.0 mg C18的离心管中,用旋涡振荡器充分混匀,3800 r·min-1离心3.0 min后取1.0 mL上清液过0.22 μm的有机相滤膜,滤液供仪器分析。
1.4 仪器条件色谱条件:分析物经A相[含0.1%(V/V)甲酸-5 mmol·L-1甲酸铵水溶液]和B相(甲醇)梯度洗脱,在Poroshell 120 EC-C18柱(150 mm×2.1 mm,2.7 μm)上分离;洗脱程序为:0.0~6.0 min,20%~95%B;6.0~10.0 min,95%B;10.0~10.1 min,95%~20%B;10.1~14.0 min,20%B。ESI源正/负双离子模式电离;选择多反应监测(SRM);喷雾电压:3300 V(ESI+),2000 V(ESI-);鞘气(N2)流速:14.0 L·min-1;鞘气压力:253.3 kPa;辅助气(N2)压力:43.0 kPa;毛细管温度:350.0 ℃;离子源温度:300.0 ℃。各化合物的离子采集信息见表l。
2 结果与分析 2.1 仪器与色谱条件优化配制1 mg·L-1的混合标液经蠕动泵注射,优化分析物的响应强度和分离度以达到最佳的检测条件。毒死蜱和氯虫苯甲酰胺在正离子扫描模式下可得到响应高的[M+H]+峰,而毒死蜱的代谢产物3,5,6-TCP在负离子扫描时可达到较高的响应强度。同时,本研究对3,5,6-TCP进行子离子扫描,结果表明3,5,6-TCP产生的碎片离子m/z 35灵敏度低,无法用于定性定量检测,因此碎片离子m/z 196被确定为本实验定性及定量离子,与Gao等[29]研究结果相一致。本研究通过考察不同的流动相对分析物峰形和灵敏度的影响对流动相等色谱条件进行优化,结果表明当流动相组成为甲醇-5 mmol·L-1甲酸铵(含0.1%甲酸)溶液时可使3种化合物的峰形和响应强度达到最佳。
用流动相配制系列浓度的混合标液,以目标化合物各组分浓度为横坐标(x,μg·L-1),定量离子对的峰面积为纵坐标(y)进行线性回归方程和相关系数计算,并通过参考已知农药的最高残留限量(MRL)值在空白样品中添加3个水平的标准溶液,考察方法的准确度和精密度,结果如表 2所示。结果表明,在0.1~1000 μg·L-1范围内,3种化合物的浓度和定量离子的峰面积呈良好的线性关系,线性相关系数范围在0.998 6~0.999 0。方法的检出限范围为0.15~1.5 μg·kg-1;定量限范围为0.5~5.0 μg·kg-1。3种化合物在各水稻基质中的平均回收率范围为74.4 %~104.2%,相对标准偏差(RSD)范围为0.7%~12.3%,回收率和精密度良好。
|
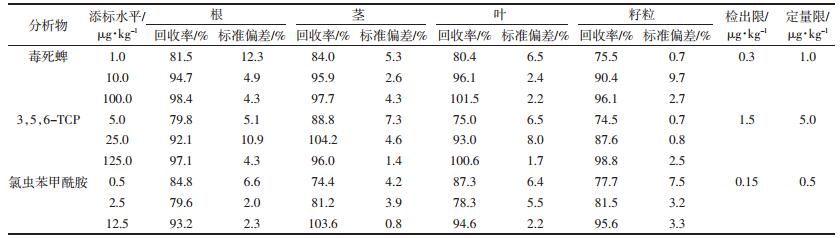
实验结果(图 1、图 2和表 3)表明,施药后两种农药在水稻植株各器官的含量随着时间变化而呈单峰曲线和消解的变化趋势,两种农药在水稻不同器官的初始沉积表现为叶>籽粒>茎>根(P < 0.05)。不同水稻品种根中两种农药均呈先累积后消解的规律,在施药3 d后两种农药在中浙优和甬优根中均达到峰值,但甬优根中氯虫苯甲酰胺和毒死蜱的含量(0.042 mg·kg-1和0.177 mg·kg-1)高于中浙优根中氯虫苯甲酰胺和毒死蜱(0.019 mg·kg-1和0.053 mg·kg-1)。两种农药在不同品种的根、茎和叶片中的初始残留量无显著差异(P>0.05),但甬优籽粒中两种农药的初始残留量显著高于中浙优(P < 0.05),降解速率的不同使得两种农药在不同品种各器官中的最终残留量也存在差异;毒死蜱的代谢物3,5,6-TCP在两品种根茎中的初始残留量和最终残留量均无显著差异(P>0.05),而在籽粒中的最终残留表现为甬优>中浙优。图 1、图 2表明,毒死蜱的降解速率快于氯虫苯甲酰胺。尽管毒死蜱在两个品种籽粒上的初始沉积大于氯虫苯甲酰胺,但毒死蜱在施药后5 d其降解率分别达90.7%(中浙优)和94.8%(甬优),而籽粒中氯虫苯甲酰胺的消解速率相对缓慢,在施药后28 d降解率分别为73.9%(中浙优)和87.4%(甬优)。

|
| 图 1 两种农药及代谢物在中浙优水稻各器官的含量动态变化 Figure 1 The dynamic changes of two pesticides and metabolite in different organs of Zhongzheyou |

|
| 图 2 两种农药及代谢物在甬优水稻各器官的含量动态变化 Figure 2 The dynamic changes of two pesticides and metabolite in different organs of Yongyou |

|
农药降解是作物安全的关键步骤,但毒死蜱在光照和微生物等自然条件作用下降解产生对水体、环境和动物体毒害作用较大的3,5,6-TCP,因此研究水稻中3,5,6-TCP的残留降解可进一步确保稻米质量安全。3,5,6-TCP残留量与时间的动态关系(图 1、图 2和表 3)结果表明,3,5,6-TCP在不同水稻植株中的分布规律为叶>籽粒>茎和根,基本与其母体化合物毒死蜱相一致;各器官3,5,6-TCP的含量随着毒死蜱的降解呈先上升后降低的变化规律,分别在施药后第5 d或第7 d达到最大值,其后随施药时间延长而逐步降解,但两种农药在叶片和籽粒中的最终残留量较大,其含量分别为0.029~0.072 mg·kg-1和0.044~0.059 mg·kg-1。
2.5 农药在籽粒不同部位的动态分布规律稻谷不需经精细加工就可食用,因此对谷物上杀虫剂的动态分布规律分析至关重要。表 4结果表明,两种农药及代谢物在籽粒各器官均存在残留。氯虫苯甲酰胺在两个品种籽粒不同器官具有相似的分配规律,均呈稻壳>糠>精米,且在稻壳和糠中的分配比例达84.1%~100%。毒死蜱在稻壳和精米中随着施药时间延长而逐渐降解,但在糠中的含量呈先上升后下降的变化规律,施药后28 d和35 d毒死蜱在中浙优和甬优糠中含量显著上升至0.694 mg·kg-1和0.721 mg·kg-1,该现象可能是由于毒死蜱从稻壳经糠转运至精米的过程导致其在糠中短暂累积,具体转运机理仍需深入研究。毒死蜱的代谢物3,5,6-TCP主要残留于糠中,其分布规律呈糠>精米>稻壳,在糠中的分配比例在76%以上。
|
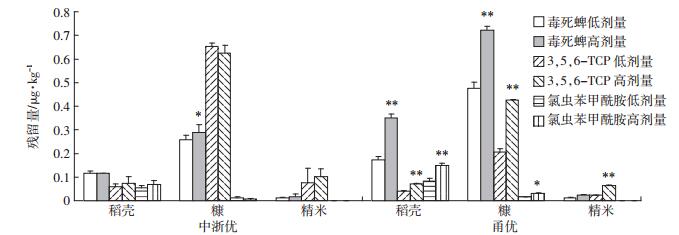
由图 3结果显示,两种农药及代谢物经不同施药剂量处理后两种农药及代谢物在中浙优籽粒各器官的残留量无显著差异(P>0.05),但高剂量施药使甬优稻壳和糠中农药及代谢物的残留量显著高于低剂量处理(P < 0.05),具体表现为高剂量施药处理稻壳、糠和精米中的残留量是低剂量施药的1.52~2.77倍。同时,结果表明不同施药剂量处理下两种农药及代谢物在籽粒各部位中的分布规律无显著差异,氯虫苯甲酰胺分布规律为稻壳>糠>精米,毒死蜱为糠>稻壳>精米,3,5,6-TCP为糠>精米>稻壳。
|
| 图 3 不同剂量处理对两种农药及代谢物在不同水稻品种籽粒中不同部位的分布规律的影响 Figure 3 The effects of different dosage treatments on the distribution of two pesticides and metabolite in different parts of rice varieties |
本研究结果表明农药在水稻品种间的初始残留存在差异,这与水稻品种间株型和茎叶形态等因素密切相关。甬优水稻的群体叶面积指数在孕穗期和抽穗期达到最大,且两品种的分蘖和叶片角度也存在差异,导致在相同施药条件下两个水稻品种植株上农药及代谢物的沉积量存在差异。顾中言等[30]和范鹏等[31]研究表明,相同施药条件下品种间的叶片结构不同也可导致植株中的农药残留量差异。
不同农药在水稻品种间的消解速率也存在差异,农药残留降解除受温度、光照和雨水等自然条件影响外,也与农药的持久力、表面张力和农药剂型等因素相关[32]。本实验采用的两种农药分别是乳油和悬浮剂,氯虫苯甲酰胺悬浮剂因铺展和黏性力较强,在一定条件下可进行二次分布导致降解缓慢。此外,不同水稻品种体内的代谢酶活性影响农药的酶解能力,吴进才等[33]研究表明不同农药对不同品种中的谷胱甘肽转移酶的影响存在差异,也会导致降解速率不同。
3,5,6-TCP在品种间的差异与其母体化合物毒死蜱的残留量和降解速率密切相关。甬优中的毒死蜱残留量高于中浙优,其对应的降解产物3,5,6-TCP也表现为甬优>中浙优,但3,5,6-TCP在两水稻品种中的持久力强于毒死蜱。但目前关于毒死蜱在水稻中转化为3,5,6-TCP的相关转化机理和影响因素还需深入研究。
农药在施药后主要残留于籽粒的稻壳中,但随着时间的延长农药逐渐消解或向籽粒内部转移,毒死蜱在糠中的残留量先增大而后减小。3,5,6-TCP水溶性较强,随营养物质转运由植株和稻壳转运至糠中,使得糠中的3,5,6-TCP的残留量高达0.207~0.654 mg·kg-1,极大增加了稻谷加工过程产生的稻壳和糠等副产品给动物饲料行业带来的安全隐患。为保证稻米食用安全,日本制定糙米中毒死蜱和氯虫苯甲酰胺的最大残留限量分别为0.01、0.05 mg·kg-1,但本实验结果表明收获期不同水稻品种精米中的毒死蜱残留量均接近最大残留量。因此为确保稻米质量安全,在水稻实际生产中需选择农药残留低累积品种,延长收获间隔期,并严格把控稻米加工过程。
4 结论(1)两种农药在水稻中的残留量呈叶>籽粒>茎>根的分布规律,两种农药在施药后28 d的降解率均在90%以上,毒死蜱的逐渐降解使其代谢物3,5,6-TCP在水稻不同器官中的残留量表现为先累积后消解的变化趋势,且在籽粒中的残留量较高,对稻米质量安全构成风险。
(2)甬优水稻对两种农药及代谢物的吸收累积强于中浙优,因此在水稻种植及田间管理期间可将农药防治效果与品种间的吸收能力相结合。
(3)稻壳和糠承载90%以上的农药残留,在籽粒中呈稻壳>糠>精米的分布规律,而3,5,6-TCP在籽粒中的分布表现为糠>精米>稻壳,对人体和动物健康存在潜在威胁。
(4)高剂量施药使籽粒不同器官的残留量高于低剂量,但对农药及代谢物在籽粒中的分配比例无影响,因此在确保达到最佳防治效果的前提下应严格把控农药用量,降低生产成本和环境污染。
| [1] |
唐涛, 符伟, 王培, 等. 不同类型杀虫剂对水稻二化螟及稻纵卷叶螟的田间防治效果评价[J]. 植物保护, 2016, 42(3): 222-228. TANG Tao, FU Wei, WANG Pei, et al. Evaluation of control efficacy of different insecticides on the striped stem borer and rice leaf-roller in the field[J]. Plant Protection, 2016, 42(3): 222-228. (in Chinese) |
| [2] |
Sarao P S, Kaur H. Efficacy of ferterra 0.4% GR(chlorantraniliprole) against stem borers and leaffolder insect-pests of basmati rice[J]. Journal of Environmental Biology, 2014, 35(5): 815-819. |
| [3] |
刘腾飞, 杨代凤, 邓金花, 等. 氯虫苯甲酰胺的残留降解与检测分析研究进展[J]. 中国农学通报, 2015, 31(3): 221-228. LIU Teng-fei, YANG Dai-feng, DENG Jin-hua, et al. Degradation of chlorantraniliprole and development on its residue detection and analysis[J]. Chinese Agricultural Science Bulletin, 2015, 31(3): 221-228. (in Chinese) |
| [4] |
中国水稻研究所. 氯虫苯甲酰胺与毒死蜱复配农药: 101773141[P]. 2010-07-14. China Rice Research Institute. Chlorantraniliprole and chlorpyrifos complex pesticide: 101773141[P]. 2010-07-14. |
| [5] |
王川, 周巧红, 吴振斌, 等. 有机磷农药毒死蜱研究进展[J]. 环境科学与技术, 2011, 34(7): 123-127. WANG Chuan, ZHOU Qiao-hong, WU Zhen-bin, et al. Research advances of a kind of organophosphate pesticide chlorpyrifos[J]. Environmental Science & Technology, 2011, 34(7): 123-127. (in Chinese) |
| [6] |
Cordova D, Benner E A, Sacher M D, et al. Anthranilic diamides:A new class of insecticides with a novel mode of action, ryanodine receptor activation[J]. Pesticide Biochemistry and Physiology, 2006, 84(3): 196-214. DOI:10.1016/j.pestbp.2005.07.005 |
| [7] |
Vijayasree V, Bai H, Beevi N S, et al. Persistence and effects of processing on reduction of chlorantraniliprole residues on cowpea fruits[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 90(4): 494-498. DOI:10.1007/s00128-012-0944-9 |
| [8] |
Dong F S, Xu J, Liu X G, et al. Determination of chlorantraniliprole residues in corn and soil by UPLC-ESI-MS/MS and its application to a pharmacokinetic study[J]. Chromatographia, 2011, 74(5/6): 399-406. |
| [9] |
王思威, 孙海滨, 刘艳萍. 氯虫苯甲酰胺颗粒剂在水稻环境中的残留行为与合理使用评价[J]. 农药, 2013, 52(12): 899-902. WANG Si-wei, SUN Hai-bin, LIU Yan-ping. Study on residue behavior and reasonable use of chlorantraniliprole in rice and environement[J]. Agrochemicals, 2013, 52(12): 899-902. (in Chinese) |
| [10] |
王廷廷, 余向阳, 刘贤进, 等. 氯虫苯甲酰胺在5种土壤中的吸附和解吸特性[J]. 江苏农业学报, 2012, 28(1): 204-209. WANG Ting-ting, YU Xiang-yang, LIU Xian-jin, et al. Sorption and desorption behavior of chlorantraniliprole in five typical soils of China[J]. Jiangsu Journal of Agricultural Sciences, 2012, 28(1): 204-209. (in Chinese) |
| [11] |
段劲生, 王梅, 董旭, 等. 氯虫苯甲酰胺在水稻及稻田环境中的残留动态[J]. 植物保护, 2016, 42(1): 93-98. DUAN Jin-sheng, WANG Mei, DONG Xu, et al. Residue and degradation of chlorantraniliprole in rice and the environment[J]. Plant Protection, 2016, 42(1): 93-98. (in Chinese) |
| [12] |
Li R, Wei W, He L, et al. Chlorpyrifos residual behaviors in field crops and transfers during duck pellet feed processing[J]. Journal of Agricultural and Food Chemistry, 2014, 62(42): 10215-10221. DOI:10.1021/jf502192c |
| [13] |
Sasikala B, Jiwal S, Rout P, et al. Biodegradation of chlorpyrifos by bacterial consortium isolated from agriculture soil[J]. World Journal of Microbiology & Biotechnology, 2012, 28(3): 1301-1308. |
| [14] |
Chen S H, Liu C L, Peng C Y, et al. Biodegradation of chlorpyrifos and its hydrolysis product 3, 5, 6-trichloro-2-pyridinol by a new fungal strain Cladosporium cladosporioides Hu-01[J]. PLoS ONE, 2012, 7(10): 1-12. |
| [15] |
Malhat F, Abdallah H, Hegazy I. Dissipation of chlorantraniliprone in tomato fruits and soil[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(3): 349-351. DOI:10.1007/s00128-011-0465-y |
| [16] |
Jabeen H, Iqbal S, Anwar S. Biodegradation of chlorpyrifos and 3, 5, 6-trichloro-2-pyridinol by a novel rhizobial strain Mesorhizobium sp. HN3[J]. Water and Environment Journal, 2015, 29(1): 151-160. DOI:10.1111/wej.2015.29.issue-1 |
| [17] |
Jamoule M, Roland M, Blane H W. Decontamination of chlorantraniliprole residues on cabbage and cauliflower through household processing methods[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(4): 501-506. DOI:10.1007/s00128-012-0534-x |
| [18] |
Malhat F M. Determination of chlorantraniliprone residues on grape by high-performance liquid chromatography[J]. Food Analytical Methods, 2012, 5(6): 1492-1496. DOI:10.1007/s12161-012-9400-z |
| [19] |
Rodil R, Quintana J B, Reemtsma T. Liquid chromatography-tandem mass spectrometry determination of nonionic organophosphorus flame retardants and plasticizers in wastewater samples[J]. Analytical Chemistry, 2005, 77(10): 3083-3089. DOI:10.1021/ac048247s |
| [20] |
Bicker W, Lammerhofer M, Lindner W. Determination of chlorpyrifos metabolites in human urine by reversed-phase/weak anion exchange liquid chromatography-electrospray ionisation-tandem mass spectrometry[J]. Journal of Chromatography B, 2005, 822(1/2): 160-169. |
| [21] |
章虎, 钱鸣蓉, 李振, 等. 高效液相色谱-串联质谱快速测定稻米中氯虫苯甲酰胺残留[J]. 农药, 2010, 49(12): 906-908. ZHANG Hu, QIAN Ming-rong, LI Zhen, et al. Determination of chlorantraniliprole residue in rices by HPLC-MS/MS[J]. Agrochemicals, 2010, 49(12): 906-908. DOI:10.3969/j.issn.1006-0413.2010.12.017 (in Chinese) |
| [22] |
Grant J, Rodgers C A, Chickering C D, et al. Determination of chlorantraniliprole residues in crops by liquid chromatography coupled with atmospheric pressure chemical ionization mass spectrometry/mass spectrometry[J]. Journal of AOAC International, 2010, 93(4): 1293-1301. |
| [23] |
Xiong J F, Zhou G M, Guan Z, et al. Determination of chlopyrifos and its main degration product TCP in water samples by dispersive liquid-liquid microextraction based on solidification of floating organic droplet combined with high-performance liquid chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2014, 37(11): 1499-1512. |
| [24] |
Mogha N K, Sahua V, Sharma M, et al. Biocompatible ZrO2-reduced graphene oxide immobilized AChE biosensor for chlorpyrifos detection[J]. Materials & Design, 2016, 111: 312-320. |
| [25] |
Dors G C, Primel E G, Fagundes C A, et al. Distribution of pesticide residues in rice grain and in its coproducts[J]. Journal of the Brazilian Chemical Society, 2011, 22(10): 1921-1930. DOI:10.1590/S0103-50532011001000013 |
| [26] |
Jardim A N O, Caldas E D. Brazilian monitoring programs for pesticide residues in food and results from 2001 to 2010[J]. Food Control, 2012, 25(2): 607-616. DOI:10.1016/j.foodcont.2011.11.001 |
| [27] |
Teló G M, Senseman S A, Marchesan E, et al. Residues of thiamethoxam and chlorantraniliprole in rice grain[J]. Journal of Agricultural and Food Chemistry, 2015, 63(8): 2119-2126. DOI:10.1021/jf5042504 |
| [28] |
中华人民共和国农业部. 农药残留试验准则NY/T 788-2004[S]. 北京: 中国农业出版社, 2004. Ministry of Agriculture of PRC. Pesticide residue test guidelines NY/T 788-2004[S]. Beijing: China Agricultural Press, 2004. |
| [29] |
Gao N, Cai K, Guo X C, et al. Analysis of MCPA and TCP in water by liquid chromatography-ion trap-electrospray tandem mass spectrometry[J]. International Journal of Environmental Analytical Chemistry, 2014, 94(6): 594-605. DOI:10.1080/03067319.2013.831411 |
| [30] |
顾中言, 许小龙, 韩丽娟. 不同表面张力的杀虫单微乳剂药滴在水稻叶面的行为特性[J]. 中国水稻科学, 2004, 18(2): 176-180. GU Zhong-yan, XU Xiao-long, HAN Li-juan. Action of drops of monosultap ME with different surface tension on rice leaf[J]. Chinese Journal of Rice Science, 2004, 18(2): 176-180. (in Chinese) |
| [31] |
范鹏, 顾中言, 徐德进, 等. 甲维盐微乳剂药液在水稻叶面的行为分析[J]. 中国水稻科学, 2010, 24(5): 503-508. FAN Peng, GU Zhong-yan, XU De-jin, et al. Action analysis of drops of emamection-benzoate microemulsion on rice leaf[J]. Chinese Journal of Rice Science, 2010, 24(5): 503-508. (in Chinese) |
| [32] |
应兴华, 徐霞, 杨仕华, 等. 水稻籽粒农药残留的品种间差异性[J]. 中国水稻科学, 2011, 25(2): 227-230. YING Xing-hua, XU Xia, YANG Shi-hua, et al. Difference of pesticide residue in grains among rice cultivars[J]. Chinese Journal of Rice Science, 2011, 25(2): 227-230. (in Chinese) |
| [33] |
吴进才, 许俊峰, 冯绪猛, 等. 稻田常用农药对水稻3个品种生理生化的影响[J]. 中国农业科学, 2003, 36(5): 536-541. WU Jin-cai, XU Ju-feng, FENG Xu-meng, et al. Impacts of pesticides on physiology and biochemistry of rice[J]. Scientia Agricultura Sinica, 2003, 36(5): 536-541. (in Chinese) |
 2018, Vol. 35
2018, Vol. 35