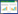文章信息
- 周金波, 金树权, 包薇红, 罗艳, 胡杨
- ZHOU Jin-bo, JIN Shu-quan, BAO Wei-hong, LUO Yan, HU Yang
- 不同浓度氨氮对4种沉水植物的生长影响比较研究
- Comparison of Effects of Ammonia-nitrogen Concentrations on Growth of Four Kinds of Submerged Macrophytes
- 农业资源与环境学报, 2018, 35(1): 74-81
- Journal of Agricultural Resources and Environment, 2018, 35(1): 74-81
- http://dx.doi.org/10.13254/j.jare.2017.0206
-
文章历史
- 收稿日期: 2017-08-11
录用日期: 2017-11-07
2. 宁波市环境保护科学研究设计院, 浙江 宁波 315012;
3. 宁波市农村水利管理处, 浙江 宁波 315000
2. Environmental Protection Research and Design Institute of Ningbo, Ningbo 315012, China;
3. Ningbo Rural Water Conservancy Management Office, Ningbo 315000, China
沉水植物作为水体生态系统的主要初级生产者,通过增加空间生态位、抑制生物性和非生物性悬浮物、改善水下光照和溶解氧条件,为形成复杂的食物链提供食物、场所和其他必要条件,是水体生物多样性赖以维持的基础[1-4]。然而,随着水体富营养化进程的加快,沉水植物的衰退和消失在世界范围内普遍出现[5-8],导致结构复杂、功能健全的以高等水生植物占优势的清水态草型水体逆向退化为结构单一、功能退化的以蓝绿藻等浮游植物为主的浊水态藻型水体[9-10]。氮素是植物生长的必需元素,也是导致水体富营养化的主要元素之一,其中铵态氮(NH4+-N)和硝态氮(NO3-)是植物利用的主要形式,已有研究表明,植物优先利用NH4+-N,但植物吸收过多的NH4+-N就会产生氨害[11],而且NH4+-N的存在还会抑制NO3-的吸收[12]。目前,氨氮是城区内河、集镇河流、景观池等人口居住稠密区水体的最主要污染物[13-14],因此,阐明不同浓度氨氮对不同沉水植物的生长影响,对认识沉水植物在富营养化水体中衰退的机理以及指导沉水植物在富营养水体的恢复重建都具有重要意义。
目前,已有一些关于不同氨氮浓度对单种沉水植物生长影响的研究[15-17],也有关于不同氨氮浓度和光照强度对单种沉水植物协同影响的研究[18],但很少有研究在同一试验条件下开展不同氨氮浓度对多种沉水植物生长影响的对比研究。本研究选择轮叶黑藻、苦草、金鱼藻和小茨藻4种耐污能力和生长竞争优势存在差异的沉水植物为研究对象,在实验室模拟条件下,通过定期测定植物生物量、叶绿素、可溶性糖和过氧化物酶等指标变化,试图阐明不同浓度氨氮对沉水植物的生长影响,以及不同沉水植物之间的耐污差异。
1 材料与方法 1.1 供试材料选择宁波地区野外自然分布的轮叶黑藻(Hydrilla verticillata)、苦草(Vallisneria natans)、金鱼藻(Ceratophyllum demersum)、小茨藻(Najas minor)4种沉水植物为研究对象,试验前野外采集后统一驯化培养7 d。
1.2 试验设计试验选用直径30 cm、高度80 cm的圆柱形玻璃桶进行盆栽试验,底部铺设5 cm石英砂。供试用水经调配后缓缓加入玻璃缸内至70 cm处,选用生长状态良好的沉水植物成熟植株,统一修剪至株高20 cm,清洗干净后种植在玻璃桶内,各处理桶内初始种植100 g。培养液采用1/10 Hoagland’s稀释液,培养液中NH4+-N浓度利用(NH4)2SO4进行调配,设置成0.5、1、2、3、4、6、8、16 mg·L-1 8个浓度处理,分别用CN0.5、CN1、CN2、CN3、CN4、CN6、CN8、CN16表示,同时设置一个不加氨氮的对照组(CK),P浓度统一为0.2 mg·L-1,各处理重复3次。
将各实验组放置于玻璃大棚内进行培养,试验时间为35 d,在第0、7、14、21、28、35 d时,在各处理内取沉水植物2 g鲜重样品进行各指标测定。取样结束后更换培养液保持NH4+-N浓度符合试验要求。试验结束时,将沉水植物全部的根、茎、叶均进行收集,洗净后用滤纸吸干测定鲜重生物量(FW),在恒温烘箱中60 ℃烘24 h,然后测定干重生物量(DW)。
1.3 分析方法氨氮含量测定方法采用纳氏试剂比色法[19];叶绿素含量测定采用丙酮提取法[20];可溶性糖含量采用蒽酮法[20];过氧化物酶(POD)活性测定采用愈创木酚氧化法[21],每次测定重复3次,取平均值。相对生长率计算公式为R=(Wt35-Wt0)/Wt0,公式中Wt35为试验结束后的总生物量,Wt0为试验前的总生物量。
1.4 数据分析不同数据组间的差异(P<0.05)采用SPSS19.0单因素方差(One-Way ANOVA)分析的Duncan新复极差方法,制图软件采用Origin7.5。
2 结果与分析 2.1 不同浓度氨氮对沉水植物相对生长率影响根据图 1可以看出,试验期结束后,4种沉水植物的相对生长率均随着氨氮浓度的升高而呈现先上升后下降的变化规律,当氨氮浓度超过一定浓度时,相对生长率甚至出现负值(负值表明生物量衰退,R=-1表明全部死亡)。可以看出,不同沉水植物的最大相对生长率存在差异,试验中轮叶黑藻、苦草、金鱼藻和小茨藻的相对生长率最大值分别为1.21、0.94、0.52和0.28,相应的水体氨氮浓度分别为2、2、1 mg·L-1和0.5 mg·L-1,均显著(P<0.05)高于其他氨氮浓度处理。轮叶黑藻、苦草、金鱼藻和小茨藻的相对生长率分别在水体氨氮浓度为8、8、6 mg·L-1和4 mg·L-1时出现负值,而在水体氨氮浓度为16、16、8 mg·L-1和6 mg·L-1时植物全部死亡。以上结果表明,不同沉水植物的生长竞争优势和抗逆能力存在差异,4种沉水植物中轮叶黑藻的生长竞争优势和抗逆能力相对较强,而小茨藻相对较弱。不同沉水植物在低浓度氨氮范围内,氨氮升高有利于植物生长,但高浓度水体氨氮将会抑制植物生长甚至导致死亡。
|
| 图中字母表示统计分析的显著性,相同字母表示不显著,不同的字母表示在P=0.05水平上显著 图 1 35 d时不同沉水植物的相对生长率 Figure 1 Growth rate of different submerged macrophytes on the 35th day |
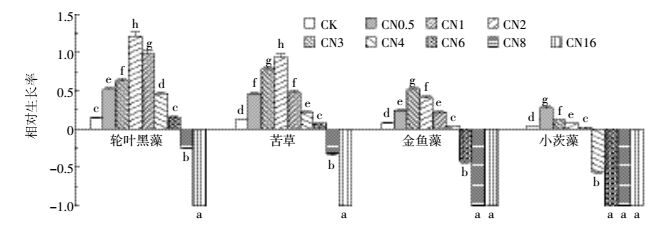
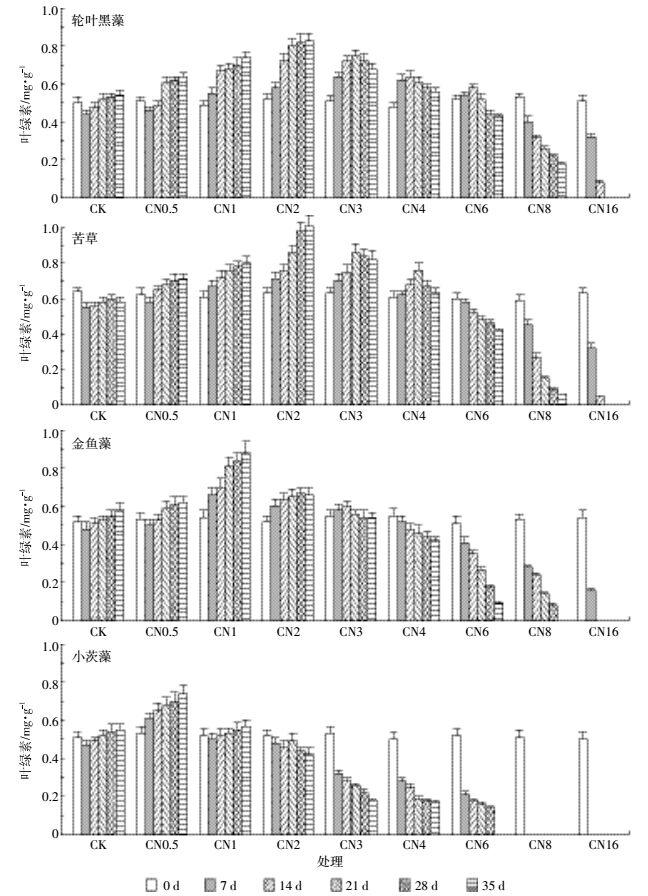
叶绿素和可溶性糖含量代表沉水植物的生长生理状态。从图 2和图 3可以看出,35 d试验结束后,轮叶黑藻、苦草、金鱼藻和小茨藻的叶绿素与可溶性糖含量分别在2、2、1 mg·L-1和0.5 mg·L-1时达到最大值或较高值,在此氨氮浓度范围内,叶绿素和可溶性糖含量在试验期间总体呈明显上升趋势,且试验结束时各处理的叶绿素和可溶性糖含量显著(P<0.05)高于CK处理。当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别超过2、2、1、0.5 mg·L-1,并不超过6、4、3 mg·L-1和2 mg·L-1时,沉水植物的叶绿素和可溶性糖含量变化规律不明显;当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别超过6、4、3 mg·L-1和2 mg·L-1时,沉水植物的叶绿素和可溶性糖含量在试验期间呈明显下降趋势。以上结果表明,不同沉水植物在相应的低浓度氨氮范围内,氨氮浓度的升高会促进沉水植物的叶绿素和可溶性糖生成,但浓度过高会抑制其生成。
|
| 图 2 不同氨氮浓度条件下沉水植物的叶绿素含量 Figure 2 Chlorophyll contents of different submerged macrophytes in different NH4+-N concentrations |
|
| 图 3 不同氨氮浓度条件下沉水植物的可溶性糖含量 Figure 3 Soluble sugar contents of different submerged macrophytes in different NH4+-N concentrations |
从图 4可以看出,轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别在2、2、1 mg·L-1和0.5 mg·L-1范围内,试验期间沉水植物的POD活性变化不大,且与CK处理相对不大。当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别超过2、2、1 mg·L-1和0.5 mg·L-1时,试验期间沉水植物的POD活性显著(P<0.05)高于CK;当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别超过6、4、3 mg·L-1和2 mg·L-1时,试验期间沉水植物POD活性明显升高,并在7~21 d达到最大值,之后开始下降。以上结果表明,不同沉水植物在相应的氨氮适宜浓度范围内,氨氮浓度升高不会影响植物体内的POD活性变化,但水体氨氮浓度超过适宜值时,POD活性会增高,产生抗逆响应。
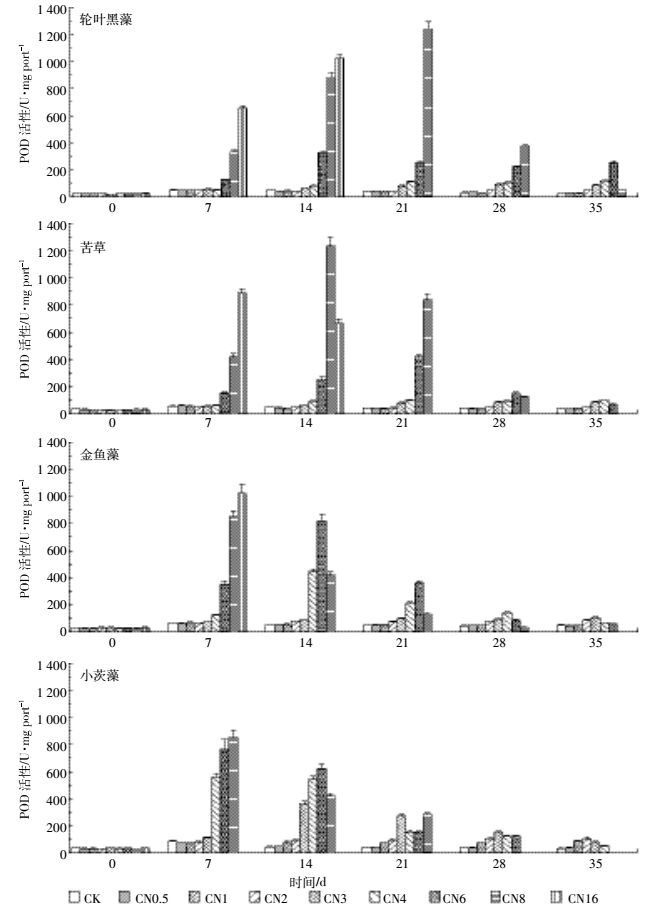
|
| 图 4 不同氨氮浓度条件下沉水植物的POD活性 Figure 4 POD activities of different submerged macrophytes in different NH4+-N concentrations |
沉水植物对富营养化水体的反应机理一直存在分歧,Chamber等[22]认为沉水植物对富营养化水体的敏感性主要受水体透明度下降引起的光衰减(包括与藻类的光竞争)和植物生长型的影响,而不受水体中氮、磷浓度变化所引起的生理反应的影响。而另一种观点认为,水体中较高的营养盐浓度对沉水植物而言,与盐胁迫、环境污染物胁迫一样是一种逆境胁迫,影响其正常生理活动[23-24],是可能导致水体中影响沉水植物退化的限制因子之一。本研究结果表明,当水体氨氮浓度超过一定数值后,会对沉水植物形成逆境胁迫,产生氨害,影响植物的正常生理活动,抑制正常生长,过高氨氮浓度甚至将直接导致植物死亡。
结合沉水植物的相对生长率、叶绿素和可溶性糖含量等指标变化,可以看出水体氨氮浓度是影响沉水植物生长的环境限制因子之一,沉水植物存在最大氨氮适宜浓度和最大氨氮耐污浓度,本研究条件下轮叶黑藻、苦草、金鱼藻和小茨藻的最大适宜氨氮浓度分别为2、2、1 mg·L-1和0.5 mg·L-1,最大耐污浓度分别为6、6、4 mg·L-1和2 mg·L-1。本研究中,轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别为2、2、1 mg·L-1和0.5 mg·L-1时,沉水植物的相对生长率和叶绿素指标均出现最大值,可溶性糖出现较高值,在此浓度范围内水体氨氮浓度升高将有利于植物生长。随着水体氨氮浓度的进一步升高,不同沉水植物的相对生长率、叶绿素和可溶性糖含量等指标开始出现下降,当都仍高于CK,当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别超过6、6、4 mg·L-1和2 mg·L-1时,沉水植物的相对生长率、叶绿素和可溶性糖含量等指标开始低于CK。本试验中,当轮叶黑藻、苦草、金鱼藻和小茨藻所处水体氨氮浓度分别为16、16、8 mg·L-1和6 mg·L-1时,试验期间植物全部死亡。
过氧化物酶(POD)是防御过氧化系统的重要保护酶,在消除自由基、减轻脂质过氧化物作用和膜损伤方面起着重要作用[25-26]。本研究中,不同沉水植物在相应的最大氨氮适宜浓度范围内,植物的POD活性变化不大,但当沉水植物所处水体氨氮浓度超过相应的最大适宜浓度时,沉水植物在试验期间开始产生持续的抗逆响应,试验期间植物体内POD活性均显著高于CK;当沉水植物所处水体超过相应的最大耐污浓度时,植物体内的POD活性在7 d或14 d达到最大值,之后开始下降,这一现象说明在相对高浓度氨氮处理下,沉水植物仍具有抗逆能力,但长期胁迫将使植物生长受到抑制,POD活性逐渐下降或消失,这可能是因为植物体内的碳水化合物已逐渐消耗殆尽,因而无法维持酶的响应活力[25-26]。
颜昌宙等[15]研究发现,当水体氨氮浓度超过4 mg·L-1时,氨氮会对轮叶黑藻的生长产生影响。本研究中,当水体氨氮浓度为2 mg·L-1时,轮叶黑藻生长情况最佳,当水体氨氮浓度为4 mg·L-1和6 mg·L-1时,轮叶黑藻生长情况差于氨氮浓度为2 mg·L-1的处理,但优于CK处理,当水体氨氮大于6 mg·L-1时则明显产生抑制作用。Cao等[17]在低光照条件下,通过10 d试验时间的研究分析沉水植物的FAA/SC(游离氨基酸/可溶性碳水化合物)比值变化,当水体氨氮浓度超过1 mg·L-1时,就会对菹草的生长产生影响。本研究在试验初期(7 d)时,各处理中相对较低的水体氨氮浓度也均会对沉水植物的叶绿素、可溶性糖等指标产生影响,但在后期均有一定程度的回升,表明不同沉水植物均有一定程度的氨氮耐受和适应能力,相应的最大耐污浓度范围内,水体氨氮对沉水植物的生长有促进作用。本研究中沉水植物的氨氮耐污能力相对于其他相似研究[15, 17]存在偏高现象,也可能因为本研究在模拟条件下进行,能保证光照充足和定期更换培养水体,不会产生因光照不足和着生藻类影响而产生的抑制作用。
当然,实验室静态模拟和自然条件存在较大差异,在自然条件下,沉水植物的生长受光照强度、底质条件、水流速度、着生藻类等各种因素影响[29-31]。本研究在实验室模拟条件下的研究结论虽然具有一定的局限性,但仍可为富营养化水体中沉水植物的退化机理和沉水植被的恢复重建提供科学依据。
4 结论(1)本研究条件下,综合分析试验期间沉水植物的相对生长率、叶绿素和可溶性糖含量等指标变化情况,轮叶黑藻、苦草、金鱼藻、小茨藻的氨氮最大适宜浓度和最大耐污浓度分别为2、2、1、0.5 mg·L-1和6、6、4、2 mg·L-1。
(2)不同沉水植物的相对生长率均随着水体氨氮浓度的升高呈现先上升后下降的变化规律,轮叶黑藻、苦草、金鱼藻和小茨藻均在相应的氨氮最大适宜浓度时出现相对生长率最大值,其值分别为1.21、0.94、0.52和0.28。
(3)不同沉水植物在相应的氨氮最大适宜浓度范围内,试验期间植物的叶绿素和可溶性糖含量呈上升趋势,试验结束时其值均显著高于CK处理;当水体氨氮超过相应的最大耐污浓度时,试验期间植物的叶绿素和可溶性糖含量呈下降趋势,试验结束时其值显著低于CK处理。
(4)不同沉水植物在相应的最大氨氮适宜浓度范围内,试验期间沉水植物的POD活性变化不大,当所处水体氨氮介于相应的最大适宜浓度和最大耐污浓度之间时,试验期间植物POD活性均显著高于CK,当所处水体氨氮超过相应的最大耐污浓度时,植物POD活性在7~21 d达到最大值,之后开始下降,甚至由于植物死亡变为0。
| [1] |
张丁予, 章婷曦, 董丹萍, 等. 沉水植物对沉积物微生物群落结构影响:以洪泽湖湿地为例[J]. 环境科学, 2016, 37(5): 1734-1741. ZHANG Ding-yu, ZHANG Ting-xi, DONG Dan-ping, et al. Influence of submerged plants on microbial community structure in sediment of Hongze Lake[J]. Environmental Science, 2016, 37(5): 1734-1741. (in Chinese) |
| [2] |
Gao J Q, Xiong Z T, Zhang J D, et al. Phosphorus removal from water of eutrophic Lake Donghu by five submerged macrophytes[J]. Desalination, 2009, 242(1-3): 193-204. DOI:10.1016/j.desal.2008.04.006 |
| [3] |
Gergely B, Martin S, Péter T, et al. Influence of submerged macrophytes, temperature, and nutrient loading on the development of redox potential around the sediment-water interface in lakes[J]. Hydrobiologia, 2011, 665(1): 117-127. DOI:10.1007/s10750-011-0609-4 |
| [4] |
Gao H L, Qian X, Wu H F, et al. Combined effects of submerged macrophytes and aquatic animals on the restoration of a eutrophic water body:A case study of Gonghu Bay, Lake Taihu[J]. Ecological Engineering, 2017, 102: 15-23. DOI:10.1016/j.ecoleng.2017.01.013 |
| [5] |
陶花, 潘继征, 沈耀良, 等. 滆湖沉水植物概况及退化原因分析[J]. 环境科技, 2010, 23(5): 64-68. TAO Hua, PAN Ji-zheng, SHEN Yao-liang, et al. Overview and degradation reasons of submerged macrophytes of Gehu Lake[J]. Environmental Science and Technology, 2010, 23(5): 64-68. (in Chinese) |
| [6] |
Sergiu C, Angheluta V, Anca S, et al. Long-term changes of submerged macrophytes in the lower Danube Wetland system[J]. Hydrobiologia, 2003, 506(1): 625-634. |
| [7] |
Liu L, Bu X Q, Wan J Y, et al. Impacts of sediment type on the performance and composition of submerged macrophytes communities[J]. Aquatic Ecology, 2017, 51(1): 167-176. DOI:10.1007/s10452-016-9607-y |
| [8] |
Song X X, Wang Z, Xiao B D, et al. Growth of Potamogeton crispus L. from turions in darkness:Implications for restoring submerged plants in eutrophic lakes[J]. Ecological Engineering2017, 2017, 101: 255-260. DOI:10.1016/j.ecoleng.2017.01.035 |
| [9] |
朱丹婷. 光照强度、温度和总氮浓度对三种沉水植物生长的影响[D]. 金华: 浙江师范大学, 2008: 1-3. ZHU Dan-ting. Effects of light, temperature and nitrogen on the growth of three kinds of aquatic plants[D]. Jinhua:Zhejiang Normal University, 2008:1-3.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10345-1012260041.htm |
| [10] |
高云霓, 董静, 何燕, 等. 基于化感物质释放特征的沉水植物抑藻作用模式研究进展[J]. 水生生物学报, 2016, 40(6): 1287-1294. GAO Yun-ni, DONG Jing, HE Yan, et al. Research advances on the modes of action for allelopathic algal inhibition by submerged macrophytes base on the release characteristics of allelochemicals[J]. Acta Hydrobiologica Sinica, 2016, 40(6): 1287-1294. DOI:10.7541/2016.167 (in Chinese) |
| [11] |
Wang C, Zhang S H, Li W, et al. Nitric oxide supplementation alleviates ammonium toxicity in the submerged macrophyte Hydrilla verticillata(L. f.) Royle[J]. Ecotoxicology and Environmental Safety, 2011, 71(1): 67-73. |
| [12] |
Yuan G X, Fu H, Zhong J Y, et al. Nitrogen/carbon metabolism in response to NH4+ pulse for two submersed macrophytes[J]. Aquatic Botany, 2015, 121: 76-82. DOI:10.1016/j.aquabot.2014.12.001 |
| [13] |
金树权, 周金波, 姚红燕, 等. 宁波农村地区典型河流氮磷污染特征分析[J]. 水土保持学报, 2010, 24(1): 105-109. JIN Shu-quan, ZHOU Jin-bo, YAO Hong-yan, et al. Pollution characteristics of nitrogen and phosphorus in typical reaches in rural area of Ningbo[J]. Journal of Soil and Water Conservation, 2010, 24(1): 105-109. (in Chinese) |
| [14] |
王梅, 刘琰, 郑丙辉, 等. 城市内河表层沉积物氮形态及影响因素-以许昌清潩河为例[J]. 中国环境科学, 2014, 34(3): 720-726. WANG Mei, LIU Yan, ZHENG Bing-hui, et al. Nitrogen forms in surface sediments of urban river and their influence factors:A case study of Qingyi River in Xuchang City[J]. China Environmental Science, 2014, 34(3): 720-726. (in Chinese) |
| [15] |
颜昌宙, 曾阿妍, 金相灿, 等. 不同浓度氨氮对轮叶黑藻的生理影响[J]. 生态学报, 2007, 27(3): 1050-1055. YAN Chang-zhou, ZEN A-yan, JIN Xiang-can, et al. Physiological effects of ammonia-nitrogen concentrations on Hydrilla verticillata[J]. Acta Ecologica Sinica, 2007, 27(3): 1050-1055. (in Chinese) |
| [16] |
宋玉芝, 杨美玖, 秦伯强. 苦草对富营养化水体中氮磷营养盐的生理响应[J]. 环境科学, 2011, 32(9): 2569-2575. SONG Yu-zhi, YANG Mei-jiu, QIN Bo-qiang, et al. Physiological response of Vallisneria natans to nitrogen and phosphorus contents in eutrophic waterbody[J]. Environmental Science, 2011, 32(9): 2569-2575. (in Chinese) |
| [17] |
Cao T, Xie P, Ni L Y, et al. Carbon and nitrogen metabolism of an eutrophication tolerative macrophytes, Potamogeton crispus, under NH4+ stress and low light availability[J]. Environmental and Experimental Botany, 2009, 66: 74-78. DOI:10.1016/j.envexpbot.2008.10.004 |
| [18] |
Zhang M, Cao T, Ni L Y, et al. Carbon, nitrogen and antioxidant enzyme responses of Potamogeton crispus to both low light and high nutrient stress[J]. Environmental and Experimental Botany, 2010, 68: 44-50. DOI:10.1016/j.envexpbot.2009.09.003 |
| [19] |
国家环境保护总局. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 2002. State Environment Protection Administration. Water and wastewater monitoring and analysis methods[M]. the 4th edition. Beijing: China Environmental Science Press, 2002. (in Chinese) |
| [20] |
张志良, 翟伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003. ZHANG Zhi-liang, QU Wei-jing. Experimental guidance of plant physiology[M]. Beijing: Higher Education Press, 2003. (in Chinese) |
| [21] |
陈建勋, 王晓峰. 植物生理学实验指导[M]. 广州: 华南理工大学出版社, 2002. CHEN Jian-xun, WANG Xiao-feng. Experimental guidance of plant physiology[M]. Guangzhou: South China University of Technology Press, 2002. (in Chinese) |
| [22] |
Chamber P A, Kalff J. Light and nutrients in the control of aquatic plant community structure[J]. Journal of Ecology, 1987, 75(3): 611-619. DOI:10.2307/2260193 |
| [23] |
Zhu J Y, Liu B Y, Wang J, et al. Study on the mechanism of allelopathic influence on cyanobacteria and chlorophytes by submerged macrophyte(Myriophyllum spicatum) and its secretion[J]. Aquatic Toxicology, 2010, 98(2): 196-203. DOI:10.1016/j.aquatox.2010.02.011 |
| [24] |
Zhang L, Wang S R, Jiao L X, et al. Physiological response of a submerged plant(Myriophyllum spicatum) to different NH4Cl concentrations in sediments[J]. Ecological Engineering, 2013, 58: 91-98. DOI:10.1016/j.ecoleng.2013.06.006 |
| [25] |
王斌, 李伟. 不同N、P浓度条件下竹叶眼子菜的生理反应[J]. 生态学报, 2002, 22(10): 1616-1622. WANG Bin, LI Wei. Physiological reaction of Potatmogeton malaianus to different N and P concentrations in the growth medium[J]. Acta Ecologica Sinica, 2002, 22(10): 1616-1622. DOI:10.3321/j.issn:1000-0933.2002.10.005 (in Chinese) |
| [26] |
Parveen M, Asaeda T, Rashid M H. Hydrogen sulfide induced growth, photosynthesis and biochemical responses in three submerged macrophytes[J]. Flora, 2017, 230: 1-11. DOI:10.1016/j.flora.2017.03.005 |
| [27] |
Wang J, Zhu J Y, Liu S P, et al. Generation of reactive oxygen species in cyanobacteria and green algae induced by allelochemicals of submerged macrophytes[J]. Chemosphere, 2011, 85(6): 977-982. DOI:10.1016/j.chemosphere.2011.06.076 |
| [28] |
Apudo A A, Cao Y, Wakibia J, et al. Physiological plastic responses to acute NH4+-N toxicity in Myriophyllum spicatum L. cultured in high and low nutrient conditions[J]. Environmental and Experimental Botany, 2016, 130: 79-85. DOI:10.1016/j.envexpbot.2016.05.009 |
| [29] |
Correia R S, Miranda M R, Guimarães R D. Mercury methylation and the microbial consortium in periphyton of tropical macrophytes:Effect of different inhibitors[J]. Environmental Research, 2012, 112: 86-91. DOI:10.1016/j.envres.2011.11.002 |
| [30] |
Choudhury M I, Yang X, Hansson L A. Stream flow velocity alters submerged macrophyte morphology and cascading interactions among associated invertebrate and periphyton assemblages[J]. Aquatic Bontany, 2015, 120: 333-337. DOI:10.1016/j.aquabot.2014.09.013 |
| [31] |
Yang H, Jie C, Yun C. Response of bacterial community structure to disappearance of phenanthrene and pyrene from sediment with different submerged macrophytes[J]. Ecological Engineering, 2016, 91: 207-211. DOI:10.1016/j.ecoleng.2016.02.024 |
 2018, Vol. 35
2018, Vol. 35