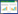文章信息
- 张维国, 邸攀攀, 易能, 严少华, 高岩
- ZHANG Wei-guo, DI Pan-pan, YI Neng, YAN Shao-hua, GAO Yan
- 连续降雨后太湖流域典型农田土地利用方式下土壤至入湖河流水体细菌群落的变化
- Variations of Bacterial Community Along Farmland-river Continuum After Continuous Rainfall in Taihu Lake Basin, China
- 农业资源与环境学报, 2018, 35(1): 48-57
- Journal of Agricultural Resources and Environment, 2018, 35(1): 48-57
- http://dx.doi.org/10.13254/j.jare.2017.0191
-
文章历史
- 收稿日期: 2017-07-24
录用日期: 2017-09-26
2. 农业部长江中下游平原农业环境重点实验室, 江苏 南京 210014;
3. 省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室, 江苏 南京 210014
2. China Ministry of Agriculture Key Laboratory at Yangtze River Plain for Agricultural Environment, Nanjing 210014, China;
3. Key Lab of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Nanjing 210014, China
降雨径流的冲刷和淋溶是农业面源污染的主要来源。农田土壤中的化肥、土壤颗粒、农药及其他有毒有害物质通过降雨径流大量进入河流、湖泊等水体而引发水体富营养化和水环境污染。另外,农业土地利用方式的改变加剧了土壤侵蚀,加速了碳和氮等营养元素从农田向水体生态系统的输移[1]。为了更好地预测或避免这些变化所带来的负面影响,就需要综合考虑农田-水体生态系统碳氮迁移、转化的连续变化过程。碳、氮的转化过程在根本上取决于微生物群落的生命活动[2]。农田系统的微生物随着土壤颗粒的径流迁移从农田-河流连续地输移,逐级传播到相邻的系统中[3-5]。在输移过程中,微生物群落可能发生了适应特定区域环境的表达,从而可能会导致陆地系统与河流系统中的核心微生物群落由不同的类群主导[5-6]。
太湖流域近几年来水蜜桃产业以无锡阳山为中心迅速辐射到无锡、常州、宜兴等其他区域,已成规模,无锡地区水蜜桃栽培面积已超过2 330 hm2,带动周边常州等地发展水蜜桃近6 660 hm2[7]。对于经济效益追求,使得太湖流域大量稻田变更为桃园。不同土地利用方式的农田由于化肥施用频率、化肥施用量及管理方式存在差异,导致了农田土壤中氮磷等营养元素含量、有机碳源含量和质量具有差异,进而可能会引起相同土壤质地条件下土壤微生物的群落结构不同[8-9]。细菌是分解有机质、驱动碳氮循环、碳氮转化及有害物质分解的主要贡献者之一[10]。与真菌相比,细菌具有较短的代谢周期和更高的代谢活性[11-12],担当着转化无机和有机物质的重任[13-14]。研究太湖流域水蜜桃、水稻种植模式下土壤微生物群落的变化和差异,对于太湖流域生态稳定以及合理规划农业发展布局具有现实指导意义。本文借助16S rRNA基因测序和统计分析方法,研究太湖流域森林、果园、水稻田细菌群落结构的特征及差异性,同时分析降水后径流冲淋形成的果园-河流、水稻田-河流细菌群落的变化规律,以期深刻掌握太湖流域果园和水稻田土壤细菌群落结构的差异特征,以及土壤微生物群落从农田系统到河流的变化规律。
1 材料与方法 1.1 采样点常州四十亩岸地区不仅有大片的森林植被覆盖区域,还是桃园典型种植区(稻田很少)并有河流流经;宜兴周铁是典型的果园、稻田交替种植的区域且有河流流经;宜兴蒋家塘为典型的水稻种植区(无桃园)且有河流流经。采样点分布如图 1所示,常州四十亩岸森林土壤(FS)、常州四十亩岸桃园土壤(OS1)、常州四十亩岸河流水样(W1)、宜兴周铁桃园土壤(OS2)、宜兴周铁稻田土壤(RF1)、宜兴周铁河流水样(W2)、宜兴蒋家塘稻田土壤(RF2)、宜兴蒋家塘河流水样(W3),总体上代表了无锡、常州地区典型的土地利用方式。这3种土地利用类型的共同特征均是由小型河流链接了上游不同植被类型覆盖区域到下游的河流输出,本文主要探索雨水经不同植被类型陆地后输出到河流这一陆水连续体内以及不同土地利用方式下微生物群落的变化趋势,以期阐明微生物变化与元素循环及污染修复水平之间的关系,为可持续生态农业发展提供理论支持。
|
| 图 1 采样点分布 Figure 1 The distribution of sampling sites |
为了研究降雨径流冲刷对农田系统土壤细菌群落从农田到河流连续的输移变化,在2016年10月20日—22日连续降雨3 d之后于23日采样。在同一类植被覆盖的区域于3个不同的地块进行采样,作为3个重复;于每个不同地块采用棋盘式采样方法,采集9份土壤,混合均匀,为1个重复。土壤采样前去掉地表堆积的落叶杂物,钻取森林、桃园和稻田0~10、10~20 cm深土壤样品,混合均匀并用无菌包装袋封装好,置于冰盒中(-4 ℃)。每条河流,选取3段1 500 m2(100 m×15 m)河流水面,作为3个重复,每段水面采用棋盘式采水方法,使用手持式采水器于每个点(共9个点)采集水表 0~10、10~20、20~30、30~40、40~50 cm处水样混合均匀,封装于无菌玻璃瓶中,置于冰盒中(-4 ℃)。所采集土样和水样当日运回实验室进行理化指标分析。采样点土样pH 5.3~6.1,总氮为0.08%~0.12%,总磷为0.07%~0.16%;水样pH 7.3~8.1,总氮为1.3~2.2 mg·L-1,总磷为0.26~0.35 mg·L-1。
1.3 土壤以及水样DNA提取每个采样地点的3次重复样品,每个重复都称取0.5 g新鲜土壤放入EP管中,利用Fast DNA® Spin Kit or Soil试剂盒(MP Biomedicals,USA),根据其提供的操作指南提取土壤微生物总DNA。水样经5 μm孔径滤纸去除杂质,滤液再经0.22 μm孔径的微孔滤膜抽滤,将滤膜及过滤物在无菌条件下剪成1~2 mm的碎屑,放入离心管中,-20 ℃条件下保存。
1.4 16S rRNA测序文库的建立和测序提取的样品基因组DNA:用带Barcode的细菌16S V4区特异引物515F-806R扩增,同时设置空白对照PCR组(不加模板以等体积灭菌水代替)。使用Biolabs公司(New England,UK)的PhusionR High-Fidelity PCR Master Mix和GC缓冲液进行扩增:PCR反应体系和程序(30 μL):Phusion Master Mix(2×)15 μL;引物(2 μmol·L-1)3 μL;gDNA(1 ng·μL-1)10 μL(5~10 ng);去离子灭菌H2O 2 μL。反应程序:98 ℃预变性1 min;30个循环包括:98 ℃,10 s;50 ℃,30 s;72 ℃,30 s;72 ℃,5 min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测。然后,根据PCR产物浓度进行等浓度混样,充分混匀后使用1×TAE和2%的琼脂糖胶进行电泳,PCR产物纯化回收使用GeneJET胶回收试剂盒(Thermo Scientific,USA),选择主带大小在400~450 bp之间的序列,割胶回收目标条带。使用NEB Next® UltraTM DNA Library Prep Kit Illumina建库试剂盒进行文库的构建(New England,UK),构建好的文库经过Qubit定量和文库检测,合格后进行上机测序(HiSeq)。
1.5 16S rRNA基因测序数据分析测序得到的原始数据,首先由Flash(V1.2.7)和QIIME(V1.7.0)软件对其进行拼接、过滤,得到1 712 497条有效数据。利用Uparse软件(Uparse V7.0.1001)对所有样品的全部有效数据进行聚类,按照大于97%的序列相似度系数将序列聚类成为95 132条OTUs。对OTUs代表序列用RDP Classifier(Version 2.2)方法与GreenGene数据库进行物种注释分析(设定阈值为0.8~1),得到对应的物种信息和基于物种的相对丰度分布情况;最后对各样品的数据进行均一化处理(以样品中数据量最少的为标准进行均一化处理),后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。基于每个采样点的3次重复地块的测序数据,使用Qiime软件(Version 1.7.0)计算Chao1,Shannon,Simpson,ACE,Goods-coverage指数,使用R软件(Version 2.15.3)绘制相关箱线图;并使用R软件进行Alpha多样性指数组间差异分析,对符合正态分布的数据进行Tukey有参检验,对数据转换后仍不符合正态分布的数据进行Wilcox非参检验。用Qiime软件(Version 1.7.0)计算Unifrac距离,使用R件(Version 2.15.3)绘制主坐标PCoA图。基于T-test检验方法,利用R软件作组间差异显著性物种分析并作物种相对丰度、聚类热图。所有测序原始序列已经上传NCBI数据库,BioProject登录号为PRJNA383100。
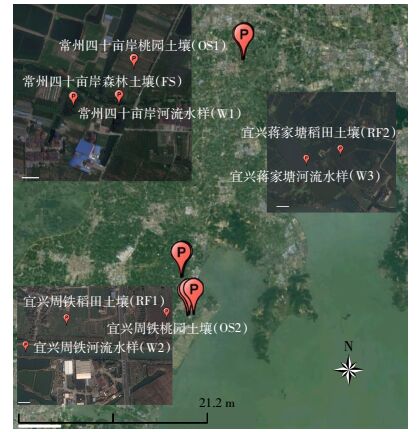
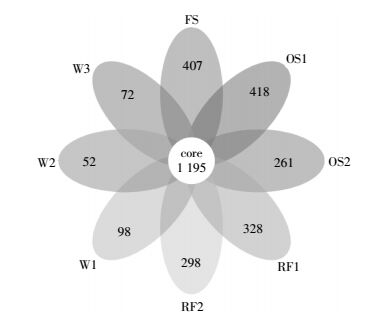
2 结果与分析 2.1 细菌群落多样性变化(门)在本研究中每个样品经拼接、过滤和筛选之后得到1 712 497条有效序列,以97%的一致性将序列聚类成为95 132条OTUs,各样品文库的覆盖率(Goods-coverage)范围为96.1%~99.1%,说明样本中基因序列被检出的概率很高,测序结果能够代表土壤和水体细菌群落的真实情况。从不同分组之间的花瓣图(图 2)可以看出,森林特异性OTUs数目比例为34.1%,共有OTUs数目比例为65.9%;桃园两个地区特异性OTUs数目比例为35.0%和21.8%,共有OTUs数目比例为65%和78.2%;水稻田特异性OTUs数目比例为27.4%和24.9%,共有OTUs数目比例为72.6%和75.1%;三条流经河流特异性OTUs数目比例为8.2%、4.3%和6.0%,共有OTUs数目比例为91.8%、95.7%和94.0%,这表明太湖流域典型土地利用方式下,土壤和河流细菌既有流域大环境的共性也具有典型生境条件下的特性。Alpha多样性指数(ACE、Chao1、Shannon、Simpson)用于分析样品内的微生物群落多样性和复杂度,多样性指数及组间显著性差异分析表明(图 3),森林、桃园、水稻田土壤细菌群落多样性显著高于流经河流,这说明土壤是该区域微生物活动的重要生境,同时表明该区域降雨形成的径流并不会造成大规模微生物由土壤向河流的迁移。常州市四十亩岸森林土壤细菌多样性显著高于桃园,但是与宜兴周铁镇桃园并无显著性差异;显著高于宜兴蒋家塘村稻田,低于宜兴周铁镇稻田。常州四十亩岸桃园土壤细菌多样性低于宜兴周铁桃园、稻田以及蒋家塘稻田;宜兴周铁桃园土壤细菌群落比同区域的稻田要丰富,但与蒋家塘区域的稻田并无显著性差异。基于Weighted Unifrac距离的主坐标(PCoA)分析可以清楚地看出(图 4),森林、桃园、水稻田土壤细菌群落表现出适应自身特异性生境的群落集聚特征,来自于河流样本中的细菌集聚在的第二象限,来自于土壤样本中集聚于第一和第四象限;样本细菌也按照植被覆盖类型集聚于不同坐标轴区域,树木类(森林和桃园)集聚在第一象限,作物类(水稻)集聚于第四象限。这表明,生境和上覆植被类型共同影响环境微生物的分布和群落结构特征。
|
| 森林、桃园、稻田和河流之间共有及特有的OTUs数目,绘图基于每个采样地点3个重复地块的平均OTUs值。中间的core数字代表的是所有样品共有的OTUs数目,花瓣上的数字代表该样品(组)特有的OTUs数目 The common and individual OTUs of forest soil, orchard soil, rice soil and river base on the average value of each sampling site including three repetitive lands. The number in the centre is the common OTUs among all samples, while the numbers in petals are the individual OTUs of each sample 图 2 森林、桃园、稻田和河流之间分组图 Figure 2 Group classification among forest soil, orchard soil, rice soil and river |
|
| Y表示具有显著性差异(P<0.05),N表示不具有显著性差异(P>0.05)。箱线图的绘制及组间差异性分析基于每个采样地点3个重复地块的平均多样性指数值 Y means significant difference(P < 0.05), N means no significant difference(P > 0.05). The data is the average value of each sampling site including three repetitive lands 图 3 森林、果园、稻田、河流Alpha多样性指数ACE、Chao1、Shannon、Simpson以及组间显著性差异分析 Figure 3 Alpha index(ACE, Chao1, Shannon and Simpson) of the bacterial community of forest soil, orchard soil, rice soil and river and the analysis of significance difference |

|
| 图 4 基于weighted unifrac距离的森林、果园、稻田、河流的主坐标分析 Figure 4 The analysis of PCoA based on weighted unifrac distance among forest soil, orchard soil, rice soil and river |
从图 5可以看出,Proteobacteria、Acidobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Gemmatimonadete、Chloroflexi、Nitrospirae、Verrucomicrobia、Planctomycetes是采样区域丰度排名前10的优势物种(门),在各自生境中相对丰度分别为39.1%~80.0%、0.8%~19.7%、1.7%~11.4%、4.7%~16%、2.1%~8.2%、0.3%~6.6%、0.4%~6.6%、0.2%~5.7%、0.9%~4.2%、0.1%~2.0%。组间差异性分析表明,在陆地到河流生境转换下,Acidobacteria在森林景观带、水稻田、桃园中表现出较高的丰度,Proteobacteria在河流中展现出更大的种群优势。Acidobacteria在各种生境中广泛存在,其中在土壤中种群优势明显[15-16],本研究中土壤中的Acidobacteria平均相对种群丰度为13.6%,河流中丰度为1.1%,在土壤中具有更高的丰度(P<0.05)。细菌的硝化能力关系到粮食产量,研究表明硝化细菌丰富和硝化能力强的田块,水稻有更高的产量[17]。Nitrospirae是一类具有硝化作用的细菌[18],研究表明在秸秆还田的土地,Nitrospirae的丰度比不还田的要高[19],在太湖地区农田目前广泛采用的稻麦秸秆还田的耕作方式,但是果园并不存在这一措施,因此在本研究中Nitrospirae在水稻田中较高的优势。

|
| 图 5 门水平排名前10物种的相对丰度 Figure 5 The relative abundance of top 10 phylum |
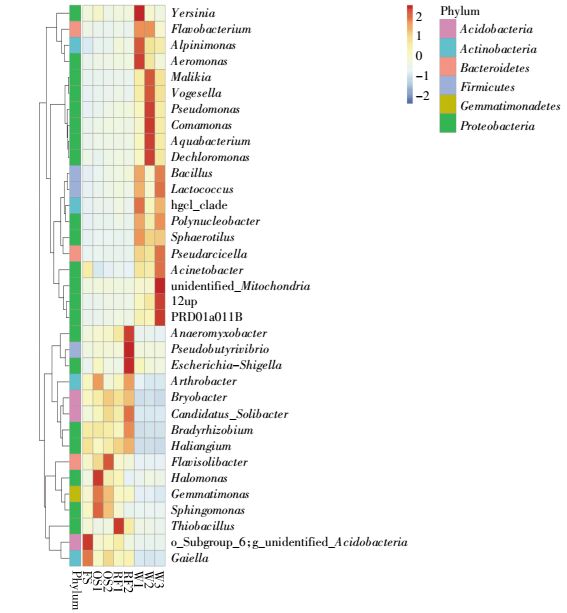
物种丰度聚类热图(属)表明太湖流域土壤和河流优势细菌丰度水平(前35物种)区别明显(图 6),Aeromonas、Pseudomonas、Flavobacterium具有水生动物致病能力,可以引起水生动物出血、溃疡、甲壳变软和烂鳃等不同的症状[20-23],在该区域河流中平均相对丰度为2.1%、2.8%、1.2%,在土壤中为0.2%、0.6%、0.1%,在河流中具有较高的种群丰度(P<0.05);Acinetobacter、Yersinia、Pseudomonas能够直接或条件使人、畜患病,可以引起鼠疫、肺部以及尿路等感染疾病[24-27],在土壤中的平均相对丰度为0.7%、0.1%、0.6%,河流中的平均相对丰度为2.3%、0.6%、2.8%,同样地在河流中具有较高丰度(P<0.05)。Sphingomonas、Arthrobacter、Thiobacillus能降解多种环境污染物,具有降解多环芳烃、杀虫剂、杀菌剂以及除草剂等有机化合物的功能,被认为是有机污染物的有力分解者[28-30],本研究结果表明,其在土壤中相对丰度为7.7%、1.1%、0.4%,在河流中为0.4%、0.1%、0.03%,在土壤中具有显著差异(P<0.05)。Sphaerotilus对污水中的有机物和有毒物质有很强的降解作用,还具有吸附重金属能力,在环保上具有重要作用,普遍存在于被有机物污染的水体中[31],在采样区域稻田中相对丰度为2.0 %,在桃田土壤中为14.9%,在桃园中具有极显著优势(P<0.01)。Anaeromyxobacter是一类厌氧细菌,具有重金属、放射性元素及有机卤化物降解修复功能,广泛存在于灌水稻田中,并与淹水时间成正比[32],其在太湖流域稻田中的平均相对丰度为0.8%,相对于其他生境具有种群优势。
|
| 图 6 属水平排名前35物种的相对丰度聚类热图 Figure 6 The taxa heatmap of relative abundance on genus level |
陆地与河流是两种不同的生境,但是又存在着物质和能量的频繁迁移和转换[3-5],微生物是这种过程的主要承担者,而且能够对土壤微环境变化作出迅速反应。在陆地到河流系列生境转换过程中,微生物群落结构也发生着密切的变化。太湖流域素有“水乡”美称,是重要的水稻产区,由于近几年水蜜桃经济价值的提高,太湖流域近几年水蜜桃种植规模迅速扩大[7],形成了森林景观带、稻田、桃园、河流为主要生境的生态或种植布局。土地利用方式的变化会带来微生物群落的改变[8-9],本研究中森林景观带、稻田、桃园土壤细菌种群多样性明显比河流中要丰富,这表明土壤是该区域微生物活动的重要生境,这很可能会与不同植被交替覆盖下,适合于不同土壤生境微生物的迁移交换有关。土地利用方式会因为地面种植作物(树木)的经济效益而经常发生改变,一块土地会因为板材价格的提升会改种林木,也会因为粮食或水果市场价值的提升改种水稻或果树。本研究表明太湖流域不同陆地植被覆盖下(树木、桃、水稻),细菌多样性有区别但共性明显,这很大程度取决于同一地块种植方式的不断变换,造成不同生境下微生物群落的重叠。
3.2 不同生境下差异性细菌丰度的变化Jangid等[33]分析了不同类型的耕作土壤细菌种群结构,发现Proteobacteria具有统治地位,占30.6%~43.2%;其次是Acidobacteria,占17.1%~26.2%。而Ge等[34]研究了长期施肥的农耕土壤细菌多样性,同样发现Proteobacteria在细菌类群中占统治地位(30.5%),第二大优势类群也是Acidobacteria(15.3%)。Hansel等[35]在不同地带性土壤中也发现了9种主要类型细菌,其中Proteobacteria和Acidobacteria分别占整个克隆文库的39%和20%。在本研究中,Proteobacteria与Acidobacteria同样是采样区域中物种相对丰度最高的前两个门,在各自生境中相对丰度分别为39.1%~80.0%和0.8%~19.7%。而且太湖流域河流中Proteobacteria种群丰度比土壤高,最主要的原因是Proteobacteria在河流中本身也广泛存在;另一方面原因是流经河流纵向流域面积广泛,地表和地下径流很好地将流经区域土壤中的一些Proteobacteria种群带入到河流中。Acidobacteria广泛存在于土壤、水体环境中,总的来说土壤环境更适合Acidobacteria生长,具有降解植物残体、参与铁循环及单碳化合物代谢的环境生态功能[36]。本研究同样发现土壤中Acidobacteria种群丰度较高,这对于森林常年落叶、桃园有机肥以及还田秸秆的降解和元素循环具有重要意义。
在本研究中,出现了一些具有使人牲畜或水生动物染病能力以及具有环境修复能力的细菌,应当引起注意。Aeromonas能导致多种水产动物患病,其中以细菌性出血病最为严重,一旦爆发往往造成巨大的经济损失[20-21]。Flavobacterium是一种世界范围的水生动物致病菌,是我国重要养殖鱼类草鱼、鳜等烂鳃病的病原,也是其他重要经济鱼类如斑点叉尾鮰、鲑鱼和鲤鱼等柱形病的病原[22]。本研究中Aeromonas和Flavobacterium在土壤中的平均相对丰度为0.2%和0.1%,河流中的平均相对丰度为2.1%和1.2%,具有显著差异(P<0.05),在河流中丰度较高。太湖流域是我国重要的水产养殖地区,具有水生动物致病能力的细菌在该区域河流中出现并显现出可观丰度,暗示着对水产养殖业可能带来的潜在风险,应当给予足够重视。Yersinia具有直接或条件使人畜感染鼠疫疾病的革兰氏阴性小杆菌[25]。Pseudomonas对人和水生动物均具有致病能力[26-27],Acinetobacter具有条件致病能力,可以引起人体多个部位的感染[24]。在本研究中,Yersinia、Pseudomonas、Acinetobacter在土壤中的平均相对丰度为0.1%、0.6%、0.7%,河流中的平均相对丰度为0.6%、2.8%、2.3%,具有显著差异(P<0.05),同样在河流中具有较高丰度。太湖流域是人口密集区,这些具有直接或者条件使人畜致病能力的细菌出现在太湖流域河流中同样应该引起注意,比如在考虑使用该区域河水用于饮用或灌溉时,应当谨慎。
值得注意的是一些具有环境修复功能的细菌在太湖流域农田或果园土壤中表现出较高的种群丰富度。Anaeromyxobacter对环境中的重金属、放射性金属和有机卤化物污染具有重要的生物修复功能[32]。研究表明Anaeromyxobacter广泛存在与灌水稻田中,其种群丰度与淹水时间具有正相关关系[32],本研究中该种群在稻田中丰富较高,说明Anaeromyxobacter的修复能力在稻田中具有较高水平。Sphingomonas普遍具有降解杀虫剂、灭草剂、塑料等有机污染物的功能[28]。本研究中,Sphingomonas在土壤中相对丰度为7.7%,在河流中为0.4%,两者具有显著差异,在土壤中具有较高丰度。Arthrobacter被报道可以降解硝化甘油、多种苯衍生物、多环芳香族化合物、卤代醇、卤代烃、N-杂环化合物、杀虫剂和除草剂等多种化合物[29]。本研究中,Arthrobacter在土壤中的平均相对丰度为1.1%,在河流中为0.1%,两者具有显著差异,在河流中具有较高丰度。Thiobacillus通过直接作用或通过其代谢产物产生的氧化、还原、络合、吸附或溶解作用,能够将土壤或沉积物固相中的重金属分离出来,具有环境修复功能[30]。本研究中,Thiobacillus在土壤中的平均相对丰度为0.4%,在河流中为0.03%,两者差异显著,在土壤中具有较高丰度。众所周知无论是水稻还是水蜜桃,都离不开除草剂和农药,近几年采样区域有机肥的施入也逐年增加。与河流相比,在本研究中具有环境修复功能的细菌在采样区域土壤中具有较高的种群优势,这表明该区域土壤具有比河流更强的环境修复能力,同时也说明降雨形成的径流并不能将这些功能细菌很好地带入河流,或者是这些功能细菌并不适合水环境。有意思的是,本研究中Sphingomonas在稻田中相对丰度为2.0 %,在桃田土壤中为14.9%,两者具有极显著性差异(P<0.01),Sphingomonas在桃园土壤中具有较高数量。这说明桃园土壤环境适合Sphingomonas的生长,这将有助于Sphingomonas对桃园除草剂和杀虫剂的降解。此外,本研究中Sphaerotilus在土壤中平均相对丰度值为0.06%,在河流中为2.2%,具有显著差异(P<0.05),在河流中丰度较高。Sphaerotilus普遍存在于被有机物污染的水体中,它对污水中的有机物和有毒物质有很强的降解作用,此外,Sphaerotilus还具有吸附重金属能力,在环保上具有重要作用[31]。这说明与土壤相比,该种群在河流中发挥着更重要的环境修复价值。
4 结论森林、桃园、稻田到河流细菌存在着普遍迁移和交换,不同生境下细菌群落多样性和丰度存在着不同程度的差异。Proteobacteria、Acidobacteria、Firmicutes、Actinobacteria、Bacteroidetes、Gemmatimonadete、Chloroflexi、Nitrospirae、Verrucomicrobia、Planctomycetes是采样区域丰度排名前10的优势物种;Proteobacteria门在河流中展现出更大的种群优势,这说明该区域河流是Proteobacteria更合适的生境。土壤中Acidobacteria种群丰度较高,这对于森林常年落叶、桃园有机肥以及还田秸秆的降解和元素循环具有重要意义。Nitrospirae门是一类具有硝化作用的细菌,在水稻田中具有较高的优势,这对于提高稻田硝态氮水平和粮食产量有积极作用。与陆地土壤相比,具有传播水生动物、人畜流行疾病能力的Yersinia属、Flavobacterium属、Aeromonas属、Pseudomonas属、Acinetobacter属在河流中具有较高丰度,提醒该区域在利用河流水时应该注意潜在的生态健康风险。具有重金属修复和有机卤化物降解功能的Anaeromyxobacter属在该区域稻田中具有种群优势,表明Anaeromyxobacter在该区域具有较高修复水平。具有有机物和有毒物质降解作用的Sphaerotilus属在河流中的丰度明显优于森林、果园和稻田土壤,说明Sphaerotilus在河流中具有较高的环境修复价值。具有降解除草剂、农药等有机污染物的Sphingomonas属、Arthrobacter属、Thiobacillus属在桃园和稻田中表现出较高丰度,表明该区域耕地土壤具有很好的自我修复功能。
本研究揭示了连续降雨后,太湖流域典型土地利用方式下农田与河流,以及森林、农田和果园土壤微生物之间的迁移变化规律,结果表明太湖地区不同土地利用方式下,虽然陆地与河流、土壤与土壤微生物群落结构没有出现根本性变化,但是植被类型和管理方式不同产生的影响是确实存在的,不同生境下具体种属微生物丰度在污染修复、生态健康风险以及土壤微生态恢复方面还是体现出差异性,提示管理者在从事农业生产方面应该综合考虑经济、生态与健康之间的关系。
| [1] |
Seitzinger S P, Mayorga E, Bouwman A F, et al. Global river nutrient export:A scenario analysis of past and future trends[J]. Global Biogeochemical Cycles, 2010, 24(4): 2621-2628. |
| [2] |
段俊英. 土壤微生物在土壤能流和物流中的作用[J]. 生态学杂志, 1984(1): 41-66. DUAN Jun-ying. Roles of soil microorganisms in energy and nutrient flow[J]. Chinese Journal of Ecology, 1984(1): 41-66. (in Chinese) |
| [3] |
Crump R C, Adams H E, Hobbie J E, et al. Biogeography of bacterioplankton in lakes and streams of an arctic tundra catchment[J]. Ecology, 2007, 88(6): 1365-1378. DOI:10.1890/06-0387 |
| [4] |
Nelson C E, Sadro S, Melack J M. Contrasting the influences of stream inputs and landscape position on bacterioplankton community structure and dissolved organic matter composition in high-elevation lake chains[J]. Limnology and Oceanography, 2009, 54(4): 1292-1305. DOI:10.4319/lo.2009.54.4.1292 |
| [5] |
Crump B C, Amaral-Zettler L A, Kling G W. Microbial diversity in Arctic freshwaters is structured by inoculation of microbes from soils[J]. ISME Journal, 2012, 6(9): 1629-1639. DOI:10.1038/ismej.2012.9 |
| [6] |
Domenico S, Lucas S, Ijaz U Z, et al. Bacterial diversity along a 2600 km river continuum[J]. Environmental Microbiology, 2015, 17(12): 4994-5007. DOI:10.1111/1462-2920.12886 |
| [7] |
沈志军. 无锡水蜜桃品种群遗传多样性及与其他群体亲缘关系的SSR分析[J]. 植物遗传资源学报, 2009, 10: 367-372. SHEN Zhi-jun. Genetic diversity of Wuxi juicy peach and genetic relationship with in the population and among other populations[J]. Journal of Plant Genetic Resource, 2009, 10: 367-372. (in Chinese) |
| [8] |
Wang Y, Han B, Shi Z Q, et al. Effects of conservation tillage on soil microbial characters and soil enzyme activities[J]. Journal of Soil & Water Conservation, 2006, 20(4): 120-122. |
| [9] |
毕明丽, 宇万太, 姜子绍, 等. 施肥和土壤管理对土壤微生物生物量碳、氮和群落结构的影响[J]. 生态学报, 2010, 30(1): 32-42. BI Ming-li, YU Wan-tai, JIANG Zi-shao, et al. Effects of fertilization and soil management on microbial biomass and community[J]. Acta Ecologica Sinica, 2010, 30(1): 32-42. (in Chinese) |
| [10] |
Hieber M G, Gessner M O. Contribution of stream detritivores, fungi, and bacteria to leaf breakdown based on biomass estimates[J]. Ecology, 2002, 83(4): 1026-1038. DOI:10.1890/0012-9658(2002)083[1026:COSDFA]2.0.CO;2 |
| [11] |
Frey S D, Elliott E T, Paustian K. Bacterial and fungal abundance and biomass in conventional and no-tillage agroecosystems along two climatic gradients[J]. Soil Biology & Biochemistry, 1999, 31(4): 573-585. |
| [12] |
Attermeyer K, Premke K, Hornick T, et al. Ecosystem-level studies of terrestrial carbon reveal contrasting bacterial metabolism in different aquatic habitats[J]. Ecology, 2013, 94(12): 2754-2766. DOI:10.1890/13-0420.1 |
| [13] |
Gessner M O, Gulis V, Kuehn K, et al. Fungal decomposers of plant litter in aquatic ecosystems[J]. Environmental and Microbial Relationships, 2007, 4: 301-324. DOI:10.1007/978-3-540-71840-6 |
| [14] |
Krauss G J, Solé M, Krauss G, et al. Fungi in freshwaters:Ecology, physiology and biochemical potential[J]. FEMS Microbiology Reviews, 2011, 35(4): 620-651. DOI:10.1111/j.1574-6976.2011.00266.x |
| [15] |
Jones R T, Robeson M S, Lauber C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal, 2009, 3(4): 442-453. DOI:10.1038/ismej.2008.127 |
| [16] |
王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20. WANG Guang-hua, LIU Jun-jie, YU Zhen-hua, et al. Research progress of Acidobacteria ecology in soils[J]. Biotechnology Bulletin, 2016, 32(2): 14-20. (in Chinese) |
| [17] |
段英华, 范晓荣, 李奕林, 等. 水稻增硝营养的生理与分子生物学机制[J]. 中国农业科学, 2008, 41(6): 1708-1716. DUAN Ying-hua, FAN Xiao-rong, LI Yi-lin, et al. Physiological and molecular mechanisms of enhanced nitrate nutrition in rice[J]. Scientia Agricultura Sinica, 2008, 41(6): 1708-1716. (in Chinese) |
| [18] |
郭魏, 齐学斌, 李平, 等. 不同施氮水平下再生水灌溉对土壤细菌群落结构影响研究[J]. 环境科学学报, 2017, 37(1): 280-287. GUO Wei, QI Xue-bin, LI Ping, et al. Impact of reclaimed water irrigation and nitrogen fertilization on soil bacterial community structure[J]. Acta Scientiae Circumstantiae, 2017, 37(1): 280-287. (in Chinese) |
| [19] |
陈金, 庞党伟, 韩明明, 等. 耕作模式对土壤生物活性与养分有效性及冬小麦产量的影响[J]. 作物学报, 2017, 43(8): 1245-1253. CHEN Jin, PANG Dang-wei, HAN Ming-ming, et al. Effects of tillage patterns on soil biological activity, availability of soil nutrients and grain yield of winter wheat[J]. Acta Agronomica Sinica, 2017, 43(8): 1245-1253. (in Chinese) |
| [20] |
Janda J M, Abbott S L. The genus Aeromonas:Taxonomy, pathogenicity, and infection[J]. Clinical Microbiology Reviews, 2010, 23(1): 35-73. DOI:10.1128/CMR.00039-09 |
| [21] |
李莉, 陈颖, 张超, 等. 水产动物气单胞菌鉴定方法研究进展[J]. 水产科学, 2015, 34(2): 128-134. LI Li, CHEN Ying, ZHANG Chao, et al. A review:Identification of Aeromonas in aquaculture[J]. Fisheries Science, 2015, 34(2): 128-134. (in Chinese) |
| [22] |
王良发, 谢海侠, 张金, 等. 我国淡水鱼类柱形病病原菌柱状黄杆菌的遗传多样性[J]. 水生生物学报, 2010, 34(2): 367-377. WANG Liang-fa, XIE Hai-xia, ZHANG Jin, et al. Columnaris diseases and genetic diversity of its bacteria pathogen Flavobacterium columnaris in freshwater fish in China[J]. Acta Hydrobiologica Sinica, 2010, 34(2): 367-377. (in Chinese) |
| [23] |
樊海平. 恶臭假单胞菌引起的欧洲鳗鲡烂鳃病[J]. 水产学报, 2001, 25(2): 147-150. FAN Hai-ping. Study on the gill-rot disease of Anguilla infected by Pseudomonas putida[J]. Journal of Fisherise of China, 2001, 25(2): 147-150. (in Chinese) |
| [24] |
杨淑霞, 范晓华, 钟晓莉, 等. 不动杆菌属的研究进展[J]. 中国医学创新, 2010, 7(28): 192-194. YANG Shu-xia, FAN Xiao-hua, ZHONG Xiao-li, et al. Review of Acinetobacter[J]. Journal of Chinese Medical Innovation, 2010, 7(28): 192-194. DOI:10.3969/j.issn.1674-4985.2010.28.124 (in Chinese) |
| [25] |
邵奎东, 郑威风, 张市. 耶尔森氏菌属主要菌种及引起疾病概述[J]. 中国地方病防治杂志, 2009, 24(6): 417-419. SHAO Kui-dong, ZHENG Wei-feng, ZHANG Shi. Yale's bacterial strains of main overview and cause disease[J]. Chinese Journal of Control of Endemic Diseases, 2009, 24(6): 417-419. (in Chinese) |
| [26] |
褚海青, 李惠萍, 何国钧. 铜绿假单胞菌的耐药机制[J]. 中国感染与化疗杂志, 2003, 3(1): 54-57. CHU Hai-qing, LI Hui-ping, HE Guo-jun. The resistance mechanisms of Pseudomonas aeruginosa[J]. Journal of Infection and Chemotherapy of China, 2003, 3(1): 54-57. (in Chinese) |
| [27] |
张伟琼, 聂明, 肖明. 荧光假单胞菌生防机理的研究进展[J]. 生物学杂志, 2007, 24(3): 9-11. ZHANG Wei-qiong, NIE Ming, XIAO Ming. Advances in biocontrol mechanism of Pseudomonas fluorescens[J]. Journal of Biology, 2007, 24(3): 9-11. (in Chinese) |
| [28] |
Bending G D, Lincoln S D, Sorensen S R, et al. In-field spatial variability in the degradation of the phenylurea herbicide isoproturon is the result of interactions between degradative Sphingomonas spp. and soil pH[J]. Applied & Environmental Microbiology, 2003, 69(2): 827-834. |
| [29] |
Yao Y X, Tang H Z, Su F, et al. Comparative genome analysis reveals the molecular basis of nicotine degradation and survival capacities of Arthrobacter[J]. Scientific Reports, 2015, 5: 8642. DOI:10.1038/srep08642 |
| [30] |
崔岩山. 硫杆菌和元素硫在治理重金属污染中的应用研究进展[J]. 土壤通报, 2007, 38(2): 404-408. CUI Yan-shan. Research progress in the application of Thiobacillus and elemental sulphur for the remediation of heavy metals contaminated soil and sediments[J]. Chinese Journal of Soil Science, 2007, 38(2): 404-408. (in Chinese) |
| [31] |
陈接锋, 许旭萍, 李惠珍. 球衣菌属的研究概况[J]. 环境科学与技术, 2002, 25(6): 43-46. CHEN Jie-feng, XU Xu-ping, LI Hui-zhen. General situation in Sphaerotilus study[J]. Environmental Science and Technology, 2002, 25(6): 43-46. (in Chinese) |
| [32] |
夏淑红, 由焦化, 王保莉, 等. 淹水时间对水稻土中厌氧粘细菌群落结构的影响[J]. 农业生物技术学报, 2011, 19(5): 793-800. XIA Shu-hong, YOU Jiao-hua, WANG Bao-li, et al. Effect of flooding time on Anaeromyxobacter community structure in paddy soil[J]. Journal of Agricultural Biotechnology, 2011, 19(5): 793-800. (in Chinese) |
| [33] |
Jangid K, Williams M A, Franzluebbers A J, et al. Relative impacts of land-use, management intensity and fertilization upon soil microbial community structure in agricultural systems[J]. Soil Biology and Biochemistry, 2008, 40(11): 2843-2853. DOI:10.1016/j.soilbio.2008.07.030 |
| [34] |
Ge Y, Zhang J, Zhang L, et al. Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China[J]. Journal of Soils and Sediments, 2008, 8(1): 43-50. DOI:10.1065/jss2008.01.270 |
| [35] |
Hansel C M, Fendorf S, Jardine P M, et al. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile[J]. Applied and Environmental Microbiology, 2008, 74(5): 1620-1633. DOI:10.1128/AEM.01787-07 |
| [36] |
王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20. WANG Guang-hua, LIU Jun-jie, YU Zhen-hua, et al. Research progress of Acidobacteria ecology in soils[J]. Biotechnology Bulletin, 2016, 32(2): 14-20. (in Chinese) |
 2018, Vol. 35
2018, Vol. 35