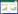文章信息
- 暴秀丽, 张静静, 化党领, 杨秋云, 宋晓燕, 王代长, 刘世亮
- BAO Xiu-li, ZHANG Jing-jing, HUA Dang-ling, YANG Qiu-yun, SONG Xiao-yan, WANG Dai-chang, LIU Shi-liang
- 褐煤基材料对Cd2+的吸附机制
- Thermodynamics and Kinetics of Cadmium Ion Adsorption onto Lignite-derived Amendments
- 农业资源与环境学报, 2017, 34(4): 343-351
- Journal of Agricultural Resources and Environment, 2017, 34(4): 343-351
- http://dx.doi.org/10.13254/j.jare.2017.0136
-
文章历史
- 收稿日期: 2017-05-20
重金属镉作为重要的化工原料,广泛地应用于金属冶炼等各行业,随着经济和工业的快速发展,使得环境中的镉污染日益严重。镉的所有价态对人体均有毒害作用[1]。目前镉的治理技术主要有化学沉淀、离子交换、渗透膜滤法和吸附法等,其中吸附法以成本低、操作简单等优点被广泛采用[2]。中国南方酸性土壤施用粘土矿物、石灰、磷肥和各种秸秆活性炭和生物炭[3]钝化重金属已有很多研究,在北方石灰性土壤上尚无有效的治理土壤重金属污染的方法。研究表明,腐植酸、活性炭亦能够显著移除废水及降低土壤中有毒金属[4-5],在重金属污染治理实践中,发挥了显著作用[6]。褐煤基腐植酸和活性炭等在吸附土壤和废水中镉性能上表现优异[7],但对其吸附机理的研究还较少。褐煤中的腐植酸形态碳由于经历地质历史时期以来稳定化,能够抵抗土壤微生物的分解而保持固有结构。褐煤不仅具有丰富的孔隙结构,而且含有丰富的表面活性基团,包括羧基、羟基、醌基、甲氧基等,能与重金属离子发生离子交换、螯合、络合等化学反应,是一种良好的天然有机离子吸附剂[8]。因此,以褐煤基腐植酸和活性炭为材料,研究不同材料对Cd2+的吸附热力学及动力学机制,探究不同材料修复土壤镉污染机理,为筛选环境性能稳定、降低镉环境毒性高效和成本低廉的修复材料提供科学±据。
1 材料和方法1.1 材料制备本实验所用褐煤样品为云南昭通褐煤。腐植酸与活性炭是从褐煤中提取获得。
腐植酸提取方法:取褐煤和氢氧化钠按质量比5:1混合,加适量蒸馏水,用玻璃棒搅拌混合均匀,静置24 h。取上清液,用10%的盐酸调溶液pH=2,用玻璃棒搅拌,静置24 h。真空泵抽滤,得滤渣,用蒸馏水反复洗涤抽滤至溶液呈中性,抽滤得滤渣,滤渣在烘箱中363.15 K烘干至恒重[9]。
活性炭提取方法:取过80目筛的褐煤100 g,加入含6%硫酸的40%的磷酸溶液搅拌均匀,在温度353.15 K条件下浸渍10 h、过滤,放入恒温电炉中,通入氮气,以10℃·min -1的速度升温使炭化。达到673.15 K后,继续通氮,使温度降至室温,然后用343.15~353.15 K的蒸馏水洗至中性。然后在378.15~383.15 K的恒温干燥箱中烘干即可[10]。
1.2 试验方法吸附热力学试验:配制以0.01 mol·L-1 NaNO3为背景的不同浓度的Cd(NO3)2溶液1 L,参照文献[11-12],用0.01 mol·L-1 HNO3和0.01 mol·L-1 NaOH调节pH值为5.5±0.02,镉离子溶液实测浓度分别为:10.18、32.46、52.49、80.97、100.6、160.05、206.15、296.25 mg·L-1。称取0.100 0 g吸附剂于100 mL离心管中,分别加入不同浓度的Cd(NO3)2溶液50 mL,空气浴振荡机上分别设置3批恒温294.55、303.15、313.15 K,于200 r·min-1条件下振荡24 h,每个吸附剂于每个设定温度均做3次重复。振荡结束以4 000 r·min -1离心10min,过滤上清液,用火焰原子吸收仪测定滤液中重金属的浓度,根据吸附前后溶液Cd2+浓度差和吸附剂质量,计算单位吸附量Qe(即单位质量的吸附剂吸附Cd2+的质量),以3次重复数据平均值拟合吸附等温线方程。
吸附动力学试验:配制1 000 mL的重金属溶液(初始Cd2+浓度10 mg·L -1,pH 5.5,以0.01 mol·L -1NaNO3为背景)于1 000 mL的大烧杯中,在293.15 K温度下,置于恒温磁力搅拌器上搅拌,从加入精确称取的吸附剂0.200 0 g开始计时,间隔一定时间用移液管迅速取样、过滤,取上清液。测定上清液中重金属的浓度,计算吸附量。
红外光谱分析:对褐煤基样进行红外结构分析,测试范围波数为4 000~400 cm-1,扫描次数为32次,扫描时扣除水分和二氧化碳的影响。分别将各样与溴化钾粉末按照1:200的质量比混合并研磨后压片。
1.3 吸附等温和吸附动力学模型及计算公式
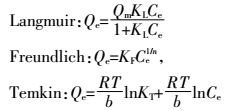
|
准一级动力学: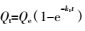
准二级动力学: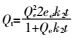
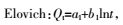
双常数: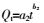
粒子内扩散: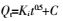
吉布斯自由能: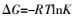
范特霍夫: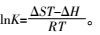
式中:Qm(mg·g-1)为最大吸附量,Ce(mg·L-1)为吸附平衡时Cd2+的浓度,Qe(mg·g-1)为吸附平衡时的吸附量,KL( L·mg-1)是与吸附能有关的常数,Langmuir等温式的重要特性常用分配因子无量纲常数RL表示,KF((mg·g-1)(L·mg-1)1/n)表示结合能力的常数,n代表吸附强度,R是气体常数(8.314 J·mol-1·K-1),T(K)是绝对温度,b(J·mol-1)是与吸附能有关的Temkin常数,Kt(L·mg-1)是与最大结合能有关的平衡常数,t(min)为吸附质与吸附剂接触时间,Qt( mg·g-1)为t时刻的吸附量,K1(min-1)、K2(g·mg-1·min-1)分别为准一级和准二级速率常数,a1(mg·g-1·min-1)和b1(g·mg-1)是与吸附量有关的Elovich方程常数,a2(mg·g-1)和b2(min-1)为双常数方程常数,Ki(mg·g-1·min-1/2)为粒子内扩散速率常数,C(mg·g-1)是与边界层厚度有关的常数。热力学函数包括ΔG(kJ·mol-1),ΔS(J·mol-1·K-1),ΔH(kJ·mol-1)。
1.4 主要仪器及数据分析镉用德国耶拿分析仪器股份有限公司AASZEEnit700原子吸收光谱仪测定;材料的红外光谱用Nicolet IS10(Thermo,Fisher,USA)型傅里叶红外光谱仪和OMNIC 9.2软件采集。数据通过Excel 7.0处理,SPSS 13作统计分析,Origin 9.1拟合曲线与作图。
2 结果与讨论2.1 褐煤基吸附剂的等温吸附特征根据Gibbs分类[13],Cd2+在活性炭和褐煤上的吸附为L型等温线,在腐植酸上的吸附为H型,该等温线在低浓度阶段呈直线上升,表明腐植酸对Cd2+有较强的结合能力,在低浓度有较高的去除率。根据IU原PAC的分类[14],这3种材料对Cd2+的吸附为Ⅰ型吸附等温线,表明吸附存在微孔隙吸附。
用Langmuir,Freundlich及Temkin模型拟合的曲线见图 1,相应的拟合参数见表 1。3种材料对Cd2+的吸附量均随温度的升高而增加,表明吸附反应更容易在高温条件下发生。Langmuir等温模型计算的最大吸附量Qm反映每克吸附剂形成完全的单层吸附所需要的吸附质的量[15],3个温度下活性炭、腐植酸和褐煤最大吸附量变化范围分别在21.04~30.34、36.14~44.09、29.63~38.20 mg·g-1,最大吸附量以腐植酸>褐煤>活性炭。图 1中腐植酸的吸附曲线在低浓度时陡峭上升达到最大吸附量,表明其对较低浓度的镉有较强吸附力。而活性炭和褐煤吸附曲线在低浓度阶段缓慢上升并在较高浓度达到最大吸附量。
|
| 图 1 不同温度活性炭、腐植酸、褐煤对Cd2+的吸附等温线 Figure 1 Adsorption isotherm of Cd2+ onto active carbon, humic acid and lignite at different temperatures |
 |
据表 1中4种等温模型的拟合相关系数判断,拟合适宜度Temkin>Langmuir≈Freundlich。对3个温度下的3种材料的拟合,Langmuir和Freundlich的相关系数不相上下,Langmuir和Freundlich对各温度各材料的R2均在0.959~0.989,可以同时较好地描述各温度各材料对Cd2+的吸附特征。Sivaraju等[16]认为,线性检验中,不同形式的吸附等温公式显著影响相关系数值及判断,运用非线性卡方检验可避免这一缺陷,如果模型得来的值与测定值接近,卡方值较小,据表 1中Χ2值,活性炭与褐煤在较高温313.15 K适合于Freundlich模型,两者在较低温比高温更好地适合Langmuir模型;腐植酸在3个温度都不适合用Lang原muir和Freundlich模型;3种材料均较好地适用于Temkin模型。不同温度的相关系数和卡方值不同,可能表示温度影响固态吸附剂表面性状,因此不同温度的吸附过程可能不同。王泽怿等[17]研究热改性废茶叶的SEM图表明热改性后的茶叶表面出现了许多大小不一、形状各异的小孔,说明温度影响吸附剂表面微观形貌。Temkin的R2在0.990~0.997,最适宜于描述在各温度下3种材料对Cd2+的吸附特征,Bahareh等[18]认为Temkin通过加入吸附过程的温度效应修正了Langmuir模型。3种材料的Qm和KF值随温度增加而增加,表明本质上是吸热过程[19]。
Langmuir模型假定吸附剂表面是均一的且吸附的活性位点是等效的[20]。Langmuir等温线的类型和基本特征可以用常数RL表示[21-22],RL用于预测吸附剂与吸附质间的亲和力[23]。如果利于吸附则0<RL<1。在3个温度下,镉离子浓度在10.18~296.25 mg·L-1范围内,3种吸附剂的RL值均在0~1有利吸附范围,3个温度下RL值范围大小以腐植酸约活性炭约褐煤,较小的RL值表明更利于吸附[24]。由表 1知,各温度下各材料Qm值以腐植酸>褐煤>活性炭,KL值以腐植酸>活性炭>褐煤,KL值越大,则表示吸附能力越强[25]。可见,腐植酸对Cd2+的吸附量和吸附能力最大。
Freundlich适合描述多层和异质表面吸附[26]。n值表示溶液浓度和吸附量间的非线性化程度[27],如果n>1,吸附是物理过程[28-29],并且与Langmuir联合描述此吸附[20]。近藤精一等[13]认为,当n>1时表示吸附剂与吸附质之间存在较强的作用力。由表 1可知,各材料各温度下n>1,表明各材料对镉离子的吸附为物理过程,并且在1<n<10范围是有利的物理吸附[20, 30]。各温度下代表吸附能力[15]的Freundlich吸附平衡常数KF和吸附剂异质性因子n的大小顺序是腐植酸>活性炭>褐煤。对照图 1腐植酸的吸附曲线和表 1中Langmuir拟合得出的Qm平衡最大吸附量,可知Freundlich中较高的 KF和n代表较高的结合能力和吸附强度。
Temkin吸附等温模型用来评价吸附剂对吸附质的吸附势[15, 20],考虑随着覆盖,同层中所有分子吸附热由于吸附质-吸附剂间反应而线性下降。Mahamadi C[30]等认为b与吸附热有关,KT与吸附势有关。3种吸附剂的相关系数R2值在各吸附剂及各温度下大于0.985,高于Langmuir和Freundlich拟合的决定系数,因此Temkin模型最适宜描述各吸附剂对Cd2+的吸附。其b值随温度升高而降低,符合Temkin模型含义,其吸附热作为温度的函数是线性下降而非Freundlich公式意指的对数下降[22]。由表 1可知,在各温度下活性炭、腐植酸和褐煤的b值分别是0.598~0.750、0.498~0.556 KJ·mol-1和0.422~0.485 KJ·mol-1,均小于8 KJ·mol-1,表明Cd2+在褐煤基材料上的吸附为物理吸附[31]。KT值除褐煤外,随温度升高而升高。结合Langmuir和Freundlich拟合参数可知,腐植酸明显较高的KT值可能较好解释其较大的最大吸附量,KT值以腐植酸>活性炭>褐煤,分别是活性炭和褐煤的12.07~12.94倍和29.86~37.58倍,较高的KT值表明吸附剂-吸附质间(腐植酸-Cd2+)比活性炭和褐煤有较强的反应[15]。
2.2 等温吸附热力学特征由表 1可知3种吸附剂的自由能均为负值,表明吸附是自发过程,并且随温度增加而下降,表明升高温度吸附更容易进行[32-33]。腐植酸在3种温度下的自由能值均比活性炭和褐煤更负(即绝对值更大),表明其自发吸附反应更易发生,反应容易发生的顺序是:腐植酸>活性炭>褐煤。3种材料的焓变ΔH正,表明是吸热过程,ΔH值以腐植酸17.42 kJ·mol-1最大。熵变ΔS均为正值,表明是熵增过程,增加了固液界面混乱度,或可能发生了结构改变[16],熵变ΔS 也以腐植酸103.0 J·mol-1·K-1最高。因此,3种材料对Cd2+的吸附为自发的吸热过程,并且温度升高后吸附反应更易进行。腐植酸的3种热力学参数表明其对镉离子的吸附比活性炭和褐煤更易发生。
2.3 褐煤基吸附剂吸附动力学特征图 2为在温度293.15 K下试验所得到的动力学数据,采用常见的动力学模型拟合活性炭、腐植酸、褐煤对Cd2+的吸附量随时间的变化。在0~90 min期间,活性炭、腐植酸、褐煤对Cd2+的吸附量呈直线上升,为快速吸附阶段,分别达到其最大吸附量的90.70%、85.80%、86.36%;此后是慢速吸附阶段。约200 min后,3种材料达到吸附平衡,吸附量无变化。
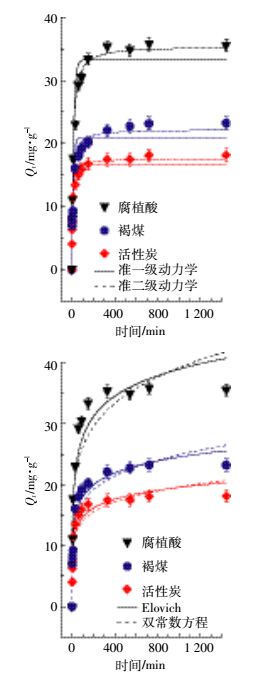
|
| 图 2 活性炭、腐植酸、褐煤对Cd2+吸附动力学曲线 Figure 2 Kinetics of Cd2+ adsorption onto active carbon, humic acid and lignite |
准一级动力学方程表示离子吸附速率±赖于平衡吸附容量。由表 2可知,腐植酸的平衡吸附量最高为33.27 mg·g-1。3种材料拟合的决定系数在0.892~0.955之间,活性炭的速率常数k1最大,说明其最易达到吸附平衡。平衡吸附量Qe ±次为腐植酸>褐煤>活性炭。可以看出,吸附速率大小与平衡吸附量大小不一定一致。
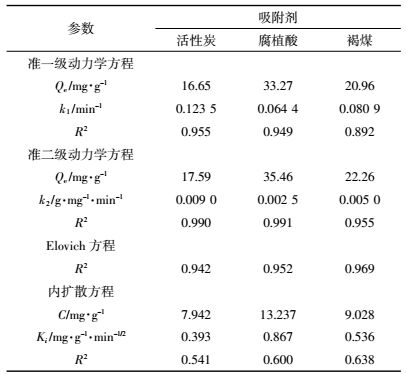 |
通过决定系数和图 2可以判断,准二级动力学模型对活性炭、腐植酸和褐煤的拟合效果最好,决定系数高达0.99,而且二级动力学对活性炭、腐植酸和褐煤拟合的平衡时吸附量的计算值分别为17.59、35.46mg·g -1和22.26 mg·g -1,最接近于其试验值18.15、35.52 mg·g-1和23.21 mg·g-1。准二级吸附动力学模型是建立在速率控制步骤为化学反应或通过吸附剂与吸附质间电子共享、离子交换基础上[34-35],可知,活性炭、腐植酸和褐煤对镉的吸附速率控制步骤属于化学过程。而上述吸附等温研究结果认为是物理吸附,这可能与吸附过程中化学过程参与吸附控制有关,马锋锋等[35]对小麦秸秆生物炭吸附Cd2+的研究也有同样情况。准二级动力学k2反映了材料对Cd2+的吸附速率,活性炭的k2值大于腐植酸和褐煤的k2值,说明活性炭更早达到吸附平衡,与准一级动力学分析结果相同。
Elovich描述高度异质化吸附剂表面的化学吸附过程[36]。Elovich拟合结果,决定系数在0.942~0.969之间,拟合效果较好,说明活性炭、腐植酸、褐煤对Cd2+的吸附存在化学吸附作用。粒子内扩散模型中Ki为粒子内扩散速率常数,C与粒子边界层厚度有关。腐植酸较高的C值表明其表面吸附在速率控制步骤中起较大促进作用,然而,Swain等[37]等认为C值越大,对外部质流的阻力越大而不利于粒子的扩散。其速率常数Ki大小以腐植酸>褐煤>活性炭。但粒子内扩散模型对各个吸附剂在各温度下的拟合决定系数较低,表明粒子内扩散不是决定吸附速率的唯一步骤。
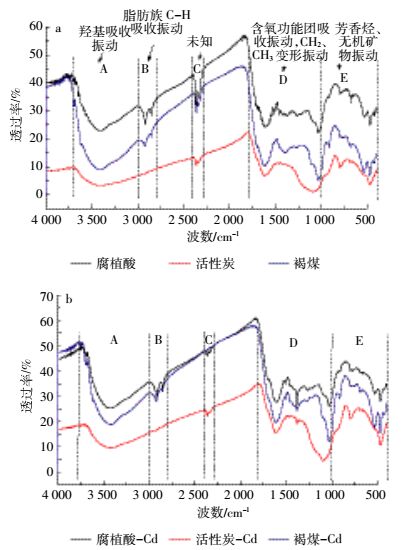
2.4 褐煤基吸附剂的红外光谱分析3种褐煤基材料红外光谱(图 3)可以根据吸收峰分为5个吸收区(表 3)。A区3 800~3 000 cm-1为-OH吸收振动区。羟基是煤分子形成氢键的主要官能团,它与不同的氢键受体可形成不同类型的氢键[38]。此羟基吸收峰强度大、峰面宽。吸收镉后活性炭和褐煤波数从约3 404 cm-1降到约3 421 cm-1,腐植酸前后均为3 421 cm-1左右。
|
| 图 3 吸附Cd2+前(a)、后(b)的红外光谱图 Figure 3 FTIR spectra of absorbents from lignite beforeadsorption(a), after adsorption(b)of Cd2+ |
B区为褐煤基样的红外光谱在波数3 000~2 800cm-1,为脂肪族C-H的吸收振动区。由2 918 cm-1和2 849 cm-1附近两个峰组成,归属于-CH2的不对称伸缩和对称伸缩振动吸收峰[39]。吸收镉前后腐植酸和褐煤的两峰变化不大,活性炭前后均无此两峰。
C区由2 360、2 342 cm-1附近两峰组成。吸收镉前后峰形变化很大,腐植酸和褐煤的两峰尖长,吸收镉后变弱,尤其是褐煤的此两峰几乎消失,活性炭的此两峰较弱,吸收前后无明显变化。此区两峰于国内外文献中均未查到所属功能团或结构,即使在云南昭通褐煤研究文献FTIR图谱中也无发现此峰[38-39],而在呼伦贝尔褐煤[40]光谱中发现有此两峰但未定义。C区两峰在吸附前后显著的改变,暗示对镉吸附显著的贡献,但是何功能团或结构,需要进一步研究。
D区1 800~1 000 cm-1为含氧功能团区,此区是除羟基在3 400 cm-1外,羰基、羧基和醚氧的聚集区,该区域内还有C=C伸缩振动、-CH2和-CH3的弯曲振动和各种C=O的伸缩振动[41]。此区也称为指纹区。由图 3和表 3可知,吸附前腐植酸功能团数目最多,为16种,褐煤和活性炭分别为11种和6种。指纹区吸附前腐植酸、褐煤和活性炭功能团数目分别为6、3种和2种。批吸附试验研究结果中腐植酸对镉平衡吸附量最大,可知含氧功能团聚集区是吸附镉的重要影响区。而且,据其他领域研究[41],此区对煤的热解、燃烧、液化和气化过程起到很大作用。因此,进一步的研究需要识别具体哪些功能团对重金属吸附有重要作用,以便人为改性添加和增强这些关键功能团。
E区为芳香烃区,存在着芳烃C-H面外变形振动,也有资料认为存在煤中无机矿物振动。也以腐植酸功能团数最多。
3 结论(1)活性炭、腐植酸和褐煤在3个温度下对镉的吸附以Temkin等温模型拟合最好,Langmuir和Freundlich吸附模型对于3种材料和3种温度条件下有不同的倾向性,腐植酸在3个温度都不适合用Langmuir和Freundlich模型。Langmuir的KL和Qm值、Freundlich的KF和n值,Temkin的KT值,均能较好解释吸附剂的吸附能力,Temkin的b值不能很好地解释腐植酸较高的吸附量。
(2)活性炭、腐植酸和褐煤对Cd2+最大吸附量大小为腐植酸>褐煤>活性炭;腐植酸对较低浓度的镉有较强吸附力。
(3)Langmuir的分配因子RL、Freundlich吸附强度系数n及Temkin的吸附热均表明活性炭、腐植酸和褐煤在3个温度下为优惠吸附且是物理过程。3种吸附剂对Cd2+吸附是自发的吸热和熵增过程,并且随温度升高吸附更容易进行。
(4)准二级动力学模型对活性炭、腐植酸和褐煤的拟合效果最好,其次为Elovich模型,双常数模型和内扩散模型拟合的相关系数较低。此3种材料对镉的吸附为在物理吸附过程中存在着化学控速过程。
(5)FTIR光谱的含氧功能团区是关键区域,含氧功能团和其他基团种类特征影响其吸收性能;波数2 360、2 342 cm-1附近未知吸收基团也与镉的吸附密切相关。
| [1] | 程亮, 侯翠红, 刘国际, 等. 纳米腐植酸对镉离子的吸附热力学及动力学[J]. 高校化学工程学报, 2015(1): 72–77. CHENG Liang, HOU Cui-hong, LIU Guo-ji, et al. Thermodynamics and kinetics of cadmium ions adsorption by nanoscale humic acid[J]. Journal of Chemical Engineerin g of Chinese Universities, 2015(1): 72–77. (in Chinese) |
| [2] | Anirudhan T S, Suchithra P S, Radhakrishnan P G. Synthesis and characterization of humic acid immobilized-polymer/betonite composites and their ability to absorb basic dyes from aqueous solution[J]. Applied Clay Science, 2009, 43(3): 336–342. |
| [3] | 徐楠楠, 林大松, 徐应明, 等. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报, 2014, 33(5): 958–964. XU Nan-nan, LIN Da-song, XU Ying-ming, et al. Adsorption of aquatic Cd2+ by biochar obtained from corn stover[J]. Journal of Agro-Environment Science, 2014, 33(5): 958–964. DOI:10.11654/jaes.2014.05.019(in Chinese) |
| [4] | 祝武权, 汤达祯, 许浩, 等. 褐煤孔隙结构及比表面积特征[J]. 煤田地质与勘探, 2016, 44(6): 59–63. ZHU Wu-quan, TANG Da-zhen, XU Hao, et al. Characteristics of pore structure and specific surface area of lignite[J]. Coal Geology & Exploration, 2016, 44(6): 59–63. (in Chinese) |
| [5] | 许世鹏. 生物炭吸附剂研制及对废水中重金属的吸附特性研究[D]. 济南: 济南大学, 2015. XU Shi-peng. Development of biochar adsorbents and its adsorbability for heavy metal[D]. Jinan:Jinan University, 2015.(in Chinese) |
| [6] | Doskořil L, Pekař M. Removal of metal ions from multi-component mixture using natural lignite[J]. Fuel Processing Technology, 2012, 101(22): 29–34. |
| [7] | 赵珂, 杨秋云, 化党领, 等. 褐煤基改良剂对石灰性土壤复合体镉赋存形态的影响[J]. 中国水土保持科学, 2016, 14(3): 93–100. ZHAO Ke, YANG Qiu-yun, HUA Dang-ling, et al. Effects of lignite-based amendments on cadmium chemical speciation in calcareous soil complexes[J]. Science of Soil and Water Conservation, 2016, 14(3): 93–100. (in Chinese) |
| [8] | 范福海, 郝艳玲. 天祝褐煤对重金属离子的吸附特征[J]. 材料保护, 2007, 40(12): 72–74. FAN Fu-hai, HAO Yan-ling. Adsorption characteristics of heavy metal onto Tianzhu lignite[J]. Materials Protection, 2007, 40(12): 72–74. DOI:10.3969/j.issn.1001-1560.2007.12.023(in Chinese) |
| [9] | 黄金凤, 赵义龙, 赵金香, 等. 腐植酸的提取及其成分含量测定[J]. 四川畜牧兽医, 2007, 34(5): 27–28. HUANG Jin-feng, ZHAO Yi-long, ZHAO Jin-xiang, et al. The extraction and determination of composition of humic acid[J]. Sichuan Animal & Veterinary Science, 2007, 34(5): 27–28. (in Chinese) |
| [10] | 罗道成, 汪威. 改性褐煤活性焦对含铬(Ⅵ)废水的处理[J]. 材料保护, 2013, 46(1): 50–52. LUO Dao-cheng, WANG Wei. Treatments of chromium(Ⅵ) waste water using modified active coke from lignite[J]. Materials Protection, 2013, 46(1): 50–52. (in Chinese) |
| [11] | Rafatullah M, Sulaiman O, Hashim R, et al. Adsorption of copper(Ⅱ) onto different adsorbents[J]. Journal of Dispersion Science and Technology, 2010, 31(7): 918–930. DOI:10.1080/01932690903224003 |
| [12] | Senthil K P, Sai D A S L, Bharani R, et al. Adsorption of Cu(Ⅱ), Cd(Ⅱ) and Ni(Ⅱ) ions from aqueous solution by unmodified Strychnos potatorum seeds[J]. European Journal of Environmental and Civil Engineering, 2013, 17(4): 293–314. DOI:10.1080/19648189.2013.785983 |
| [13] | 近藤精一, 石川达雄, 安部郁夫. 吸附科学[M]. (第二版). 北京: 化学工业出版社, 2005: 32-34. Seiichi K, Tatsuo I, Ikuo A. Adsorption science(second edition)[M]. Beijing: Chemical Industry Press, 2005: 32-34. (in Chinese) |
| [14] | Sing K S W, Everett D H, Haul R, et al. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity[J]. Pure and Applied Chemistry, 1982, 54(11): 2201–2218. |
| [15] | Amel B, Benaouda B, Abdelaziz B, et al. The influence of surface functionalization of activated carbon on dyes and metal ion removal from aqueous media[J]. Desalination and Water Treatment, 2016, 57(37): 17557–17569. DOI:10.1080/19443994.2015.1086701 |
| [16] | Sivaraju S, Khadhar M M S B. Studies on the performance of ethylamine-modified chitosan carbonized rice husk composite beads for adsorption of metal ion[J]. Bioremediation Journal, 2013, 17(2): 97–106. DOI:10.1080/10889868.2013.786016 |
| [17] | 王泽怿, 赵斌, 沈伯雄, 等. 热改性废茶叶吸附刚果红性能的研究[J]. 工业水处理, 2017, 37(4): 78–82. WANG Ze-yi, ZHAO Bin, SHEN Bo-xiong, et al. Research on the adsorption capacity of thermal-modified waste tea for Congo red[J]. Industrial Water Treatment, 2017, 37(4): 78–82. DOI:10.11894/1005-829x.2017.37(4).019(in Chinese) |
| [18] | Bahareh S, Hossein S, Hamed H, et al. A comparative study on the removal of lead from industrial wastewater by adsorption onto raw and modified Iranian bentonite(from Isfahan area)[J]. Desalination and Water Treatment, 2014, 52(34-36): 6440–6452. DOI:10.1080/19443994.2013.823352 |
| [19] | Abdessalem O, Mourad B, Wassim T, et al. Adsorptive removal of humic acid on activated carbon prepared from almond shell:Approach for the treatment of industrial phosphoric acid solution[J]. Desalination and Water Treatment, 2014, 52(10-12): 2241–2252. DOI:10.1080/19443994.2013.800003 |
| [20] | Dhanashree C P, Vikesh G L, Virendra K R. Adsorptive removal of copper(Ⅱ) from aqueous solution onto the waste sweet lime peels(SLP):Equilibrium, kinetics and thermodynamics studies[J]. Desalination and Water Treatment, 2013, 52(40-42): 7822–7837. |
| [21] | SemraÇ, Feza G. Adsorption of copper(Ⅱ) ions on montmorillonite and sepiolite clays:Equilibrium and kinetic studies[J]. Desalination and Water Treatment, 2012, 45(1-3): 351–360. DOI:10.1080/19443994.2012.692058 |
| [22] | Chethan P D, Vishalakshi B. Adsorption Efficiency of Cr(Ⅵ) by Ethylene-1, 2-Diamine-6-Deoxychitosan[J]. Separation Science and Technology, 2015, 50(8): 1158–1165. DOI:10.1080/01496395.2014.967405 |
| [23] | Weber T W, Chakravorti R K. Pore and solid diffusion models for fixed bed adsorbers[J]. Aiche Journal, 1974, 20(2): 228–238. DOI:10.1002/aic.v20:2 |
| [24] | Bhavna A S, Ajay V S, Chirag B M, et al. Surface modified bagasse fly ash zeolites for removal of reactive black-5[J]. Journal of Dispersion Science and Technology, 2011, 32(9): 1247–1255. DOI:10.1080/01932691.2010.505550 |
| [25] | Samadi N, Hasanzadeh R, Rasad M. Adsorption isotherms, kinetic, and desorption studies on removal of toxic metal ions from aqueous solutions by polymeric adsorbent[J]. Journal of Applied Polymer Science, 2015, 132(11): 41642. |
| [26] | Coles C A, Yong R N. Use of equilibrium and initial metal concentrations in determining Freundlich isotherms for soils and sediments[J]. Engineering Geology, 2006, 85(1-2): 19–25. DOI:10.1016/j.enggeo.2005.09.023 |
| [27] | McKay G, Otterburn M S, Sweetney A G. The removal of colour from effluent using various adsorbents Ⅲ. Silica rate process[J]. Water Research, 1980, 14(1): 15–20. DOI:10.1016/0043-1354(80)90037-8 |
| [28] | Prabu D, Parthiban R, Senthil K P, et al. Adsorption of copper ions onto nano-scale zerovalent iron impregnated cashew nut shell[J]. Desalination and Water Treatment, 2015, 57(14): 6487–6502. |
| [29] | Rifaqat A K R, Amna K. Sorption studies for Cd(Ⅱ) sequestration from aqueous solution on chemically modified Albizia lebbeck[J]. Separation Science and Technology, 2017, 52(3): 435–446. DOI:10.1080/01496395.2016.1213285 |
| [30] | Mahamadi C, Nharingo T. Utilization of water hyacinth weed(Eichhornia crassipes) for the removal of Pb(Ⅱ), Cd(Ⅱ) and Zn(Ⅱ) from aquatic environments:An adsorption isotherm study[J]. Environmental Technology, 2010, 31(11): 1221–1228. DOI:10.1080/09593331003646604 |
| [31] | Agarry S E, Ogunleye O O, Ajani O A. Biosorptive removal of cadmium(Ⅱ) ions from aqueous solution by chemically modified onion skin:Batch equilibrium, kinetic and thermodynamic studies[J]. Chemical Engineering Communications, 2015, 202(5): 655–673. DOI:10.1080/00986445.2013.863187 |
| [32] | Lucas R S, Antonio C A, Gabriel R P A. Study of colloidal properties of natural and Al-pillared smectite and removal of copper ions from an aqueous solution[J]. Environmental Technology, 2015, 36(6): 786–795. DOI:10.1080/09593330.2014.961564 |
| [33] | Pearlin K U, Senthil K P, Sangita G K, et al. Study of adsorption kinetic, mechanism, isotherm, thermodynamic, and design models for Cu(Ⅱ) ions on sulfuric acid-modified eucalyptus seeds:Temperature effect[J]. Desalination and Water Treatment, 2015, 56(11): 2948–2965. |
| [34] | Mathilakhath S, Kadhar M M S B, Sivaraju S. A comparative study of surface modification in carbonized rice husk by acid treatment[J]. Desalination and Water Treatment, 2012, 45(1-3): 170–176. DOI:10.1080/19443994.2012.692039 |
| [35] | 马锋锋, 赵保卫, 刁静茹. 小麦秸秆生物炭对水中Cd2+的吸附特性研究[J]. 中国环境科学, 2017, 37(2): 551–559. MA Feng-feng, ZHAO Bao-wei, DIAO Jing-ru. Adsorptive characteristics of cadmium onto biochar produced from pyrolysis of wheat straw in aqueous solution[J]. China Environmental Science, 2017, 37(2): 551–559. (in Chinese) |
| [36] | Sharma S, Balasubramanian K, Arora R. Adsorption of arsenic(Ⅴ) ions onto cellulosic-ferric oxide system:Kinetics and isotherm studies[J]. Desalination and Water Treatment, 2015, 57(20): 9420–9436. |
| [37] | Swain S K, Tapaswini P, Tanushree P, et al. Kinetics and thermodynamics of fluoride removal using cerium-impregnated chitosan[J]. Desalination and Water Treatment, 2010, 13(1-3): 369–381. DOI:10.5004/dwt.2010.995 |
| [38] | 李力, 陆宇超, 刘娅, 等. 玉米秸秆生物炭对Cd(Ⅱ)的吸附机理研究[J]. 农业环境科学学报, 2012, 31(11): 2277–2283. LI Li, LU Yu-chao, LIU Ya, et al. Adsorption mechanisms of cadmium(Ⅱ) on biochars derived from corn straw[J]. Journal of Agro-Environment Science, 2012, 31(11): 2277–2283. (in Chinese) |
| [39] | 韩峰, 张衍国, 蒙爱红, 等. 云南褐煤结构的FTIR分析[J]. 煤炭学报, 2014, 39(11): 2293–2299. HAN Feng, ZHANG Yan-guo, MENG Ai-hong, et al. FTIR analysis of Yunnan lignite[J]. Journal of China Coal Society, 2014, 39(11): 2293–2299. (in Chinese) |
| [40] | 段江涛, 徐娇. 云南褐煤溶剂萃取研究[J]. 广州化工, 2015, 43(21): 85–98. DUAN Jiang-tao, XU Jiao. Research in solvent extraction of lignite[J]. Guangzhou Chemical Industry, 2015, 43(21): 85–98. DOI:10.3969/j.issn.1001-9677.2015.21.030(in Chinese) |
| [41] | 鄢晓忠, 邱靖, 尹艳山, 等. 褐煤中官能团对其燃烧特性的影响[J]. 煤炭科学技术, 2016, 44(4): 169–174. YAN Xiao-zhong, QIU Jing, YIN Yan-shan, et al. Effects of functional groups in lignite on its combustion characteristics[J]. Coal Science and Technology, 2016, 44(4): 169–174. (in Chinese) |
| [42] | Sait E, Zahir D, Melek M, et al. Formation and characterization of humic acids from low rank Anatolian coals by air oxidation[J]. Energy Sources, 2005, 27(5): 423–430. DOI:10.1080/00908310490441827 |
| [43] | Josanaide S R, Sonay S O, Garrigues S, et al. FTIR tentative characterization of humic acids extracted from organic materials[J]. Spectroscopy Letters, 2001, 34(2): 179–190. DOI:10.1081/SL-100002007 |
| [44] | Lubica P, Markéta K, Ondřej Z, et al. Fate of humic acids isolated from natural humic substances[J]. Acta Agriculturae Scandinavica, Section B (Soil & Plant Science), 2015, 65(6): 517–528. |
| [45] | Alberts J J, Filip Z. Metal binding in estuarine humic and fulvic acids:FTIR analysis of humic acid-metal complexes[J]. Environmental Technology, 1998, 19(9): 923–931. DOI:10.1080/09593331908616750 |
| [46] | Mona Z, Zeeshan A, Javaid A, et al. Extraction and characterization of humic acid from Pakistani lignite coals[J]. Energy Sources, Part A:(Recovery, Utilization, and Environmental Effects), 2017: 1307886. |
 2017, Vol. 34
2017, Vol. 34