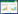文章信息
- 王宇坤, 徐冰, 王小平, 吴林林, 赵念席, 阮维斌, 谷星慧, 张立猛
- WANG Yu-kun, XU Bing, WANG Xiao-ping, WU Lin-lin, ZHAO Nian-xi, RUAN Wei-bin, GU Xing-hui, ZHANG Li-meng
- 昆虫病原线虫对烟草根结线虫及蚜虫病虫害以及蚜茧蜂寄生的影响
- Effects of Entomopathogenic Nematodes on the Development of Root-knot Nematode and Aphid, and on the Parasitism of Aphid Parasitoid in Tobacco
- 农业资源与环境学报, 2017, 34(3): 293-298
- Journal of Agricultural Resources and Environment, 2017, 34(3): 293-298
- http://dx.doi.org/10.13254/j.jare.2016.0241
-
文章历史
- 收稿日期: 2016-10-10
2. 云南省烟草公司玉溪市公司, 云南 玉溪 653100
2. Yuxi Branch, Yunnan Tobacco Company, Yuxi 653100, China
根结线虫(Root-knot nematode)是造成农作物减产甚至绝收的主要有害生物之一,每年造成的经济损失高达500亿美元[1],且由于缺乏高效处理这种虫害的方法,至今仍是困扰农业生长的主要问题。近20年来,科学家研究发现昆虫病原线虫(Entomopathogenic nematode,EPN)能够高效并环保地杀死多种农业害虫(既包括地下部害虫也包括叶面害虫),满足农业可持续发展的需要,满足人们对绿色食品的需求,因此作为一类有潜力的农业生物杀虫剂,昆虫病原线虫对作物病虫害的生物防治及其作用机制受到国内外科学家越来越多的重视[2-5]。其中,对地下部根结线虫的生物防治的研究也逐渐展开。如,Fallon等[6]研究发现,接种EPN Steinernema feltiae的侵染期幼虫,可以显著降低根结线虫Meloidogyne javanica对大豆(Glycine max)根系组织的穿透力;Pérez和Lewis[7]研究发现,花生(Arachis hypogaea)根系中存在有EPN S. feltiae与S. riobrave时,根结线虫M. hapla的侵染效率会显著降低。与此同时,生态学家越来越关注植物地上部与地下部之间的信息传递以及“自下而上”(bottom-up)途径对多营养级有害生物的控制[8],如Bezemer等[9]发现在土壤中加入某些线虫后,叶面蚜虫种群数量受到抑制,再加入某些微生物溶液后,蚜虫种群受抑制程度增加。在关于昆虫病原线虫作用机制的研究中发现,仅EPN-共生菌体系可通过释放化感物质降低根结线虫的活动能力[2, 10-12]。而从多重营养级的角度来研究根际投放昆虫病原线虫对地上部多营养级之间的行为的影响尚未被广泛关注。
烟草(Nicotiana tabacum)作为重要的经济作物,在我国大面积种植,然而地下部根结线虫(Meloidogyne spp.)以及地上部烟蚜(Myzus persicae)对烟草的危害极大,严重时会造成烟草绝收,造成巨大的经济损失,因此烟草是研究昆虫病原线虫对作物地下部根结线虫、地上部蚜虫影响的理想材料。而且,针对烟蚜(M. persicae)的危害,我国学者通过不断地努力,利用蚜茧蜂(Aphidius gifuensis)寄生烟蚜的生物防治体系取得了很好的效果,为当地环境的可持续发展做出了贡献[13]。因此,研究昆虫病原线虫在防治以上害虫的同时,是否会影响已有的生物防治体系(烟蚜-蚜茧蜂)也是需要关注的科学问题,而这方面的问题也属于“bottom-up”途径关注范畴。
因此,本实验选择烟草为研究对象,以EPN添加(本实验选用了在其他作物中对根结线虫有很好抑制效果的Steinernema carpocapsae和Heterorhabditis bacteriophora)为处理组来研究EPN添加对烟草地下部根结线虫繁殖、地上部叶面蚜虫种群生长以及烟蚜-蚜茧蜂关系这些地上部多重营养级的影响。所得结果不仅为我国重要作物烟草根结线虫的生物防治提供实验数据,也会为从“bottom-up”途径理解昆虫病原线虫对多重营养级行为的影响提供科学数据。
1 材料与方法 1.1 实验材料土壤材料于2014年8月自云南省玉溪市红塔区烟田中采集,主要采集严重感染根结线虫病的烟草根系附近20 cm内的土壤,保证土壤内含大量根结线虫虫卵及幼虫。将土壤充分混匀,按2 kg·盆-1(口径17 cm,高15 cm)进行分装后用于烟苗的种植。
烟草材料于2014年5月在温室中播种云烟203,正常培养4个月左右。幼苗移栽前1 d,剪去老叶,仅留2片新叶,每盆1株大小一致的烟草幼苗。
侵染期EPN悬液和虫尸剂(被EPN侵染的宿主尸体,在其死亡至释放新的昆虫病原线虫这一阶段内,有释放大量侵染期EPN的能力,故被称为“虫尸剂”)采用常规方法培养获得。将保存的S. carpocapsae和H. bacteriophora虫尸剂放置于trap装置上,并向装置中加水,7 d后得到具有侵染能力的3龄幼虫悬浮液;吸取trap装置中的昆虫病原线虫悬液,滴加到24孔板内,悬液中EPN数量利用显微镜观察计数,保证每个孔内有50条以上的昆虫病原线虫,并向孔内放入一条健康有活力的大蜡螟(Galleria mellonella)作为宿主受体。将24孔板封好,避光放置在室温条件下进行昆虫病原线虫侵染培养;7 d后,得到侵染期EPN的大蜡螟虫尸剂。实验开始前,将EPN悬液用水调至浓度为2 000条·mL-1。EPN是一种动物寄生性线虫,其生活史可以分为卵、幼虫和成虫3个阶段,本实验所使用的S. carpocapsae和H. bacteriophora2种EPN均只在3龄幼虫期具有在寄主体外存活并寻找、侵染寄主的能力,但并无侵染植物根系的能力。
烟蚜及蚜茧蜂由云南省玉溪市烟草公司马桥基地提供。
1.2 实验方法 1.2.1 EPN施加对根结线虫繁殖的影响:实验一采用双因素实验设计,因素1为EPN种类(无EPN、S. carpocapsae、H. bacteriophora);因素2为投放方式(虫尸剂、悬液),其中,EPN虫尸剂的施用量为每盆1条(缓慢释放EPN),EPN悬液的施用量约为每盆1万条EPN三龄幼虫(即5 mL EPN悬液)。幼苗移栽和施加处理同时进行(2014年7月22日),每种处理10个重复,其中无EPN处理组的2种投放方式共用相同的10个重复,共计50盆。培养期间,按需供水并人工去除叶面烟蚜,每周随机调换盆的位置以减少位置效应。40 d后(2014年9月2日)收集根系上的卵块,采用文献[14]的方法,用次氯酸钠溶液浸泡并用搅拌机打散卵块,分离单株根系虫卵,并在解剖镜下统计卵的粒数。
1.2.2 EPN施加对根结线虫繁殖、烟蚜生长及烟草生物量的影响:实验二采用单因素实验设计,包括2种EPN处理组(S. carpocapsae虫尸剂和H. bacteriophora虫尸剂, 1条·盆-1)和不添加EPN的对照组,幼苗移栽和施加处理同时进行(2014年7月24日),每种处理10个重复,共30盆。培养期间,按需供水但不去除叶面烟蚜。培养28 d后(2014年8月22日),人工去除叶面烟蚜的同时放置3~4龄的烟蚜幼虫10头·盆-1;连续7 d观测烟蚜的数目变化,并构建生长模型。42 d后(2014年9月5日)收获烟草地上部及地下部生物量,并收集和统计地下部根结线虫卵粒数[14],并采用Boiteux等[15]的方法计算卵粒指数(EI),EI=单株卵粒数/单株根鲜重。
1.2.3 EPN施加对根结线虫繁殖以及蚜茧蜂寄生烟蚜的影响:实验三采用单因素实验设计,包括2种EPN处理组(S. carpocapsae虫尸剂和H. bacteriophora虫尸剂, 1条·盆-1)和不添加EPN的对照组,幼苗移栽和施加处理同时进行(2014年9月2日),每种处理5个重复,共15盆。将幼苗放置在体积约30 m3的网棚中(可防止蚜茧蜂飞走)进行培养。培养期间,按需供水并人工去除叶面烟蚜。培养28 d后(2014年9月30日),在烟草叶片背面放置3~4龄的烟蚜幼虫100头·盆-1(超过蚜虫的环境容纳量,以减弱烟蚜选择性取食在不同植株间造成的差异);并同时在棚内投放15头蚜茧蜂雌蜂,蜂蚜比为1:100。并于放置烟蚜0、2、4、6、8、10 d后统计烟草叶上的僵蚜进行计数;2014年10月14日,统计叶片上的蚜虫的数量;并收集和统计地下部根结线虫卵粒数[14]。
1.3 数据分析将所得数据输入EXCEL,并借助SPSS软件进行统计分析来检验不同处理对烟草根结线虫的侵染与繁殖、蚜茧蜂寄生烟草蚜虫、以及对僵蚜数目、烟蚜剩余数目及烟草生物量等观测性状的平均值的影响。利用Conve Expert 3.0软件中的Logistic方程Y=K/(1+Be-rt)进行烟蚜动态拟合,其中,K为环境容纳量;r为生长速率参数。
2 结果与分析 2.1 EPN施加对根结线虫侵染和繁殖的影响表 1双因素方差分析结果显示,EPN种类对烟草根结线虫卵粒数具有显著影响(P < 0.05),而投放方式以及EPN种类与投放方式的交互作用均对烟草根结线虫卵粒数无显著影响(P>0.05)。进一步利用多重比较对相同的投放方式下,EPN种类对根结线虫的卵粒数进行分析,结果表明添加EPN的处理组的根结线虫的卵粒数显著低于无EPN处理,其中,S. carpocapsae悬液处理组根结线虫卵粒数为55.6粒·株-1,显著低于无EPN处理及H. bacteriophora悬液处理(图 1)。

|

|
| 图 1 不同EPN品系对烟草根结线虫卵粒数的影响 Figure 1 Effects of different EPN strains on the number of eggs of root-knot nematode in tobacco |
在此实验中,EPN处理对地下部根结线虫卵数无显著影响,但卵粒指数在S. carpocapsae虫尸剂处理组显著低于对照组(表 2),这与S. carpocapsae虫尸剂处理组地下部生物量高有关。S. carpocapsae虫尸剂处理组,烟草的地上部干重(3.258 g·株-1)和根鲜重(0.819 g·株-1)与对照组地上部干重(0.996 g·株-1)和根鲜重(0.359 g·株-1)相比,分别提高了227%和128%,两者之间差异显著。H. bacteriophora虫尸剂处理组,烟草的地上部干重和根鲜重与对照组相比差异不显著,但从测量结果来看地上部干重增加65%,根鲜重增加38%。
|
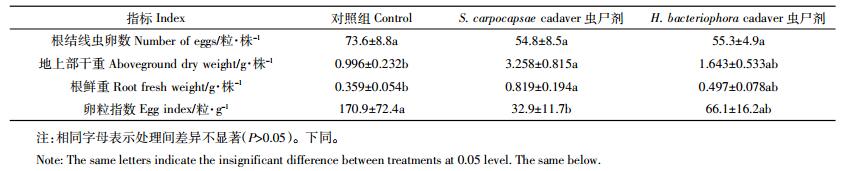
烟蚜种群的生长曲线显示(图 2),在放置蚜虫5~6 d,蚜虫数目达到最大值,且增长曲线能够被Logistic方程很好的模拟(R2>0.99),在长势最好的S. carpocapsae虫尸剂处理组,蚜虫的环境容纳量最大,为99.8头,对照和H. bacteriophora虫尸剂处理组的环境容纳量分别为89.6头和76.6头。而生长速率对照组为1.01,S. carpocapsae虫尸剂处理组和H. bacteriophora虫尸剂处理组分别为1.27和1.44。
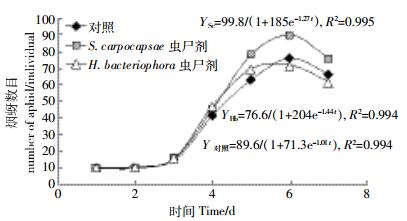
|
| 图 2 不同处理条件下烟蚜种群增长曲线 Figure 2 The growth curves of aphid under different treatments |
单因素方程分析结果显示,仅施加S. carpocapsae虫尸剂对根结线虫卵粒数具有显著的抑制作用(P < 0.05),而不同处理对剩余叶片蚜虫数目的影响无显著差异(表 3)。

|
施加EPN虫尸剂不会对蚜茧蜂寄生烟蚜产生促进作用,在放置烟蚜的早期(前6 d),差异主要表现在施加EPN的两个处理组之间;S. carpocapsae虫尸剂处理显著低于H. bacteriophora虫尸剂处理组;在放置烟蚜第8 d,S. carpocapsae虫尸剂处理组显著低于对照组;放置烟蚜第10 d,所有处理组间均无显著差异(图 3)。
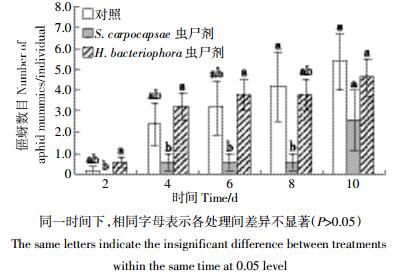
|
| 图 3 不同处理条件对僵蚜数目的影响(5个观测日期) Figure 3 Effects of EPN treatments on the number of aphid mummies (five observation dates) |
本研究发现,使用EPN处理组均能对烟草根结线虫卵粒数或者卵粒指数产生抑制作用(图 1,表 2和表 3),表明利用EPN处理来抑制根结线虫的侵染与繁殖具有可行性,其处理效果与EPN的种类有关。在本研究中,S. carpocapsae处理对烟草根结线虫(或卵粒指数)具有显著抑制作用,并且能促进烟草的生长。同本研究结果类似,Khan等[16]对比研究Steinernema属和Heterorhabditis属EPN对番茄根结线虫的生长与繁殖的影响时,也得出Steinernema属优于Heterorhabditis属的结果。
虽然关注EPN对单一病虫的生物防治方面(如植物地下部、地上部虫害)的研究已经很多,但关注EPN对地上多重营养级之间的影响的研究并不多见。对烟蚜种群增长曲线的研究发现,所有处理均在第5~6 d达到最大值,在H. bacteriophora虫尸剂处理组生长速率最高,而环境容纳量却最低;S. carpocapsae虫尸剂处理环境容纳量最大,为99.8,高于对照组11.1%;结合2种处理组的地上部干重分别比对照组提高了65%和227%,我们可以推测,EPN处理组通过抑制烟草根系的根结线虫,一方面增加了烟草生物量,从而使得烟蚜的环境容纳量增加;另一方面EPN在抑制烟草根结线虫的同时,引发了烟草对昆虫的抗性,使烟草产生的抗防御取食的物质增加,因此,烟蚜的数量并非单纯地随着烟草生物量的增加而增加,而是在叶片单位质量上烟蚜的环境容纳量降低[17]。这也支持Moran等[18]提出的植物诱导抗性具有系统性和通过“bottom-up”途径对地上部有害生物防治的观点。其他研究也有类似的报道[9],Birkhofer等[19]发现在土壤中加入某些线虫处理后,叶面蚜虫种群数量显著受抑制,加入某些微生物溶液后,蚜虫的受抑制程度更显著;长期施用有机肥的有机耕作模式加强了“bottom-up”途径对有害生物的控制。这些结果表明植物根系在土壤中受到外源生物的入侵刺激后,植物体作为有机整体会对来自根系的刺激产生系统性的诱导抗性,增加抗取食性物质的含量,从而加强了对地上部有害生物的抗性。
实验一各处理间剩余烟蚜数目之间无显著差异,与螨虫数目的最高值比较接近,表明不存在烟蚜在不同植株间的大规模转移,也可以排除由于烟蚜的选择取食导致寄生蜂行为改变的可能。在放置蚜茧蜂第8 d,检测到S. carpocapsae虫尸剂处理组的僵蚜数显著低于对照组,但其他观测日均未发现对照组与EPN处理组之间的显著差异,而主要差异为放置蚜茧蜂早期两种EPN处理组间的差异(图 3),这一结果表明EPN处理对蚜茧蜂的行为具有物种特异性,支持其他研究者得出的可通过“bottom-up”途径影响昆虫-天敌行为的结论[20]。
4 结论EPN能够显著降低经济作物烟草根结线虫的卵粒数;EPN提高了烟草的地上和地下部生物量以及降低叶片单位质量上烟蚜环境容纳量,但不会对蚜茧蜂寄生烟蚜产生显著影响。这些结果可为EPN对烟草病虫害的生物防治提供数据支持和实验证据。
| [1] | Caccia M, Lax P, Doucet M E. Effect of entomopathogenic nematodes on the plant-parasitic nematode Nacobbus aberrans[J]. Biology and Fertility of Soils, 2013, 49(1): 105–109. DOI:10.1007/s00374-012-0724-z |
| [2] | Lewis E E, Grewal P S, Sardanelli S. Interactions between the Steinernema feltiae Xenorhabdus bovienii insectpathogen complex and the rootknot nematode Meloidogyne incognita[J]. Biological Control, 2001, 21(1): 55–62. DOI:10.1006/bcon.2001.0918 |
| [3] | Molina G C, Davide R G. Evaluation of microbial extracts for nematicidal activity against plant parasitic nematode Meloidogyne Incognita[J]. Bmc Health Services Research, 2007, 7(1): 1–16. DOI:10.1186/1472-6963-7-1 |
| [4] | Hiltpold I, Baroni M, Toepfer S, et al. Selection of entomopathogenic nematodes for enhanced responsiveness to a volatile root signal helps control a major root pest[J]. Journal of Experimental Biology, 2010, 213(14): 2417–2423. DOI:10.1242/jeb.041301 |
| [5] | Shapiro-Ilan D I, Cottrell T E, Iii R F M, et al. Field suppression of the peachtree borer, Synanthedon exitiosa, using Steinernema carpocapsae:Effects of irrigation, a sprayable gel and application method[J]. Biological Control, 2015, 82: 7–12. DOI:10.1016/j.biocontrol.2014.12.003 |
| [6] | Fallon D J, Kaya H K, Gaugler R, et al. Effects of etomopathiogenic nematodes on Meloidogyne javanica on tomatoes and soybeans[J]. Journal of Nematology, 2002, 34(3): 239–245. |
| [7] | Pérez E E, Lewis E E. Suppression of Meloidogyne incognita and Meloidogyne hapla with entomopathogenic nematodes on greenhouse peanuts and tomatoes[J]. Biological Control, 2004, 30(2): 336–341. DOI:10.1016/j.biocontrol.2004.01.001 |
| [8] | Matthew W, Hefin J T. Relative roles of top down and bottom up forces in terrestrial tritrophic plant-insect herbivore-natural enemy systems[J]. Oikos, 2001, 93: 177–187. DOI:10.1034/j.1600-0706.2001.930201.x |
| [9] | Bezemer T, De Deyn G, Bossinga T, et al. Soil community composition drives aboveground plant herbivore parasitoid interactions[J]. Ecology Letter, 2005, 8(6): 652–661. DOI:10.1111/ele.2008.8.issue-6 |
| [10] | Grewal P S, Lewis E E, Venkatachari S. Allelopathy:A possible mechanism of suppression of plant-parasitic nematodes by entomopathogenic nematodes[J]. Nematology, 1999, 1(7): 735–743. DOI:10.1163/156854199508766 |
| [11] | Hu K, Li J, Webster J M. Nematicidal metabolites produced by Photorhabdus luminescens (Enterobacteriaceae), bacterial symbiont of entomopathogenic nematodes[J]. Nematology, 1999, 1(5): 457–469. DOI:10.1163/156854199508469 |
| [12] | Samaliev H Y, Andreoglou F I, Elawad S A, et al. The nematicidal effects of the bacteria Pseudomonas oryzihabitans and Xenorhabdus nematophilus on the root-knot nematode Meloidogyne javanica[J]. Nematology, 2000, 2(5): 507–514. DOI:10.1163/156854100509420 |
| [13] | 谷星慧, 杨硕媛, 余砚碧, 等. 云南省烟蚜茧蜂防治桃蚜技术应用[J]. 中国生物防治学报, 2015, 31(1): 1–7. GU Xing-hui, YANG Shuo-yuan, YU Yan-bi, et al. Application of biological control technology of Myzus persicae with Aphidius gifuensis in Yunnan Province[J]. Chinese Journal of Biological Control, 2015, 31(1): 1–7. (in Chinese) |
| [14] | 刘维志. 植物病线虫学[M]. 北京: 中国农业出版社, 2000. LIU Wei-zhi. Plant pathogenic nematodes[M]. Beijing: China Agriculture Press, 2000. (in Chinese) |
| [15] | Boiteux L S, Charchar J M. Genetic resistance to root-knot nematode (Meloidogyne javanica) in eggplant (Solanum melongena)[J]. Plant Breeding, 1996, 3: 198–200. |
| [16] | Khan S A, Javed N, Khan M A, et al. Effect of entomopathogenic nematodes on the invasion and development of Meloidogyne incognita in tomato[J]. Pakistan Journal of Phytopathology, 2009, 21(1): 71–76. |
| [17] | 王琪, 张宝杰. 植物诱导防御对昆虫种群结构的影响研究[J]. 环境科学与管理, 2014, 39(8): 145–147. WANG Qi, ZHANG Bao-jie. Impacts of insects community structure from plant induced defense system[J]. Environmental Science and Mangement, 2014, 39(8): 145–147. (in Chinese) |
| [18] | Moran N A, Whitham T G. Interspecific competition between root-feeding and leaf-galling aphids mediated by host-plant resistance[J]. Ecology, 1990: 1050–1058. |
| [19] | Birkhofer K, Bezemer T M, Bloem J, et al. Long-term organic farming fosters below and aboveground biota:Implications for soil quality, biological control and productivity[J]. Soil Biology & Biochemistry, 2008, 40(9): 2297–2308. |
| [20] | Denno R F, Gratton C, Peterson M A, et al. Bottom up forces mediate natural enemy impact in a phytophagous insect community[J]. Ecology, 2002, 83(5): 1443–1458. DOI:10.1890/0012-9658(2002)083[1443:BUFMNE]2.0.CO;2 |
 2017, Vol. 34
2017, Vol. 34