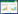文章信息
- 周美利, 沈广爽, 赵瑞瑞, 高张莹, 陈国平, 石福臣
- ZHOU Mei-li, SHEN Guang-shuang, ZHAO Rui-rui, GAO Zhang-ying, CHEN Guo-ping, SHI Fu-chen
- 铅胁迫对紫穗槐光合作用及生理生化特征的影响
- Effects of Lead Stress on Photosynthesis and Physiological and Biochemical Characteristics of Amorpha fruticosa
- 农业资源与环境学报, 2017, 34(3): 286-292
- Journal of Agricultural Resources and Environment, 2017, 34(3): 286-292
- http://dx.doi.org/10.13254/j.jare.2016.0301
-
文章历史
- 收稿日期: 2016-12-12
随着经济快速发展人类对自然环境的开发和利用程度急剧加大,采矿、冶炼等工业“三废”的不合理排放以及污灌农田等行为,使得含Pb的污染物进入土壤环境中,造成严重的土壤污染[1-2]。Pb作为一种不可降解的有毒污染物,不仅影响土壤理化性质,还会降低农作物产量和质量[3],过量的Pb通过食物链进入人体,危害人类健康,尤其是对人类神经、造血系统的毒性危害严重,调查发现人类血铅含量主要来源于土壤[4]。因此如何修复污染土壤成为土壤学和环境科学领域的重要研究内容。
植物修复技术作为一种新兴、高效的土壤修复技术得到广泛认同和应用。有关超富集植物的提出以及耐重金属植物的研究逐渐增多[5-6]。目前发现Pb超富集植物具有植株矮小、生长速度慢、生物量小及生态适应性窄等缺点[7]。对于植物吸收重金属后的生理生态响应及植物的抗性机制研究,多集中在农作物、经济作物等草本植物或水生植物[8],对于具有高生物量,吸收并积累重金属能力强、生长周期长的木本植物的研究较少。
紫穗槐(Amorpha fruticosa)作为豆科紫穗槐属植物,具有较强的耐寒、耐旱和抗贫瘠特性。由于其具有根系发达、生长快、易繁殖等特点,是北方常见的绿化及造林灌木。常见于农田排水沟渠边,铁路路堤边坡以及河岸等地,是防风固沙、水土保持、土壤改良的重要植物[9-11]。关于紫穗槐对于重金属富集方面的研究已经有一些报道[12-13],然而对于紫穗槐在重金属胁迫下的生理生化特征响应方面的研究较少。本研究主要侧重阐明在Pb污染环境胁迫下,紫穗槐叶片丙二醛(MDA)含量、抗氧化酶(SOD、POD、CAT)活性、光合作用参数以及叶绿素荧光参数等生理指标的响应规律,为阐明紫穗槐对重金属的耐受能力,利用紫穗槐进行土壤重金属污染的生态修复提供理论参考。
1 材料与方法 1.1 实验材料选用1年生紫穗槐幼苗进行盆栽试验。选取长势一致的紫穗槐幼苗在2015年4月10日移植于装有2.5 kg河沙的塑料盆(盆底无孔,直径18 cm,高16 cm)中,每盆1株。建筑用河沙在使用前用自来水冲洗,直至清洗后的水清澈,以去除河沙中杂质干扰。由于盆中含有部分水分,每隔10 d浇1次2倍的Hoagland营养液400 mL,以保证盆中Hoagland营养液约为1倍,每日补充适量水分,自然光照条件下生长。于2015年5月20日进行Pb胁迫处理。浓度设定根据预实验以及实际土壤Pb污染情况设定[14],试剂选用Pb(NO3)2,胁迫浓度分别为0、100、300、600 mg·kg-1。各实验组设3个重复,处理30 d后测定各项指标。
1.2 测定方法 1.2.1 光合作用参数的测定在晴朗天气上午的9:30—11:30,采用Li-6400XT便携式光合作用测量系统(Li-Cor Inc.,USA)测定净光合速率(Pn,net photosynthetic rate,μmol CO2·m-2·s-1),气孔导度(Gs,stomatal conductance,mmol H2O·m-2·s-1),胞间CO2浓度(Ci,intercellular CO2 concentration,μmol CO2·mol-1),测定时选择红蓝光源,光照强度为1 000 μmol·m-2·s-1,CO2气体由小钢瓶提供,控制浓度为400 μmol·mol-1。每株选取顶端向阳第5~8片叶,每处理重复5次,取平均值。
1.2.2 叶绿素荧光参数的测定选在晴天上午9:30—11:30,利用超便携式调制叶绿素荧光仪MINI-PAM-II(WALZ,Effeltrich,Germany),在上述测定CO2气体交换参数叶片相近位置进行测定,叶片暗适应30 min后,测定光系统Ⅱ(PSII)最大量子产额Fv/Fm =(Fm-Fo)/Fm。利用内置自动光源测定荧光诱导曲线,计算PSII实际量子产量ФPSII =(Fm′-Ft)/Fm′,光系统Ⅱ开放反应中心转化效率Fv′/Fm′=(Fm′-Fo′)/Fm′,光化学淬灭qP =(Fm′-Ft)/(Fm′-Fo′),非光化学淬灭NPQ =(Fm-Fm′)/Fm′。式中Fm′和Ft分别为光适应过程中的饱和荧光值和实时荧光值,Fo′为光适应过程中最小荧光值,Fm和Fo分别为暗适应后最大荧光值和最小荧光值[15]。
1.2.3 电解质外渗率、丙二醛(MDA)及抗氧化酶(SOD、POD、CAT)活性的测定取紫穗槐新鲜叶片,在去离子水中冲洗干净,用滤纸拭干,测定电解质外渗率和丙二醛(MDA)含量。电解质外渗率采用电导仪法[16],MDA含量的测定采用硫代巴比妥酸(TBA)氧化法[16]。
超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,过氧化氢酶(CAT)活性采用240 nm光密度比色法测定,具体测定方法参照文献[17]。
1.2.4 相对叶绿素含量测定采用SPAD-502叶绿素测定仪(日本Konica公司产品),在测定光合作用的相同位置测定叶绿素相对含量。相同处理10次重复取平均值。
1.3 数据分析用Microsoft Excel 2010和SPASS 13.0进行数据处理和统计分析。采用单因素方差分析,Duncan检验比较样本间参数差异显著性,差异显著性水平为P<0.05。
2 结果与分析 2.1 Pb胁迫对紫穗槐光合作用参数的影响光合作用是植物生长发育的基础,为植物的生命活动提供能量和物质,净光合速率(Pn)是表示光合作用的重要指标。结果显示100 mg·kg-1 Pb处理下幼苗Pn(图 1-A)显著高于其他处理组,300 mg·kg-1和600 mg·kg-1 Pb处理下幼苗Pn显著低于对照组。气孔导度(Gs)(图 1-B)和胞间CO2浓度(Ci)(图 1-C)在100 mg·kg-1 Pb处理下均显著高于其他处理组。气孔限制值(Ls)(图 1-D)在300 mg·kg-1 Pb处理下显著高于100 mg·kg-1和600 mg·kg-1处理组,与对照组无显著差异。
|
| 图 1 Pb胁迫对紫穗槐光合作用参数的影响 Figure 1 Effect of lead stress on photosynthetic parameters of A. fruticosa |
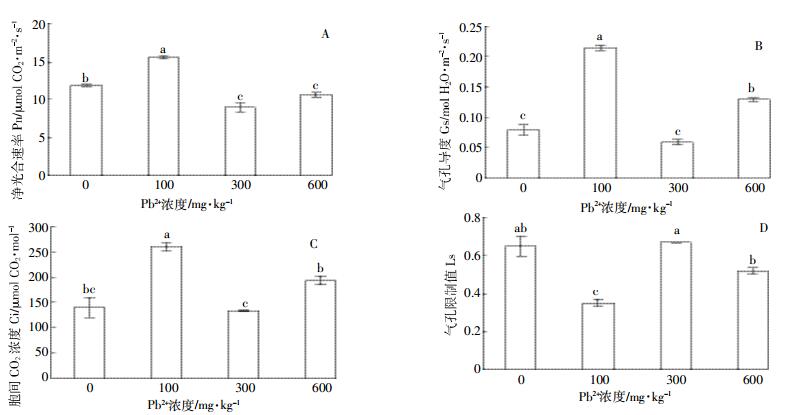
由图 2可以看出,对照和100 mg·kg-1 Pb处理下紫穗槐的Fo、Fm和Fv /Fm没有差异性,说明此处理浓度并没有改变反应中心的原初光化学活性。300 mg·kg-1和600 mg·kg-1处理条件下紫穗槐的Fo(图 2-A)和Fv /Fm(图 2-B)与对照和100 mg·kg-1浓度处理组有显著差异。Fm在100 mg·kg-1处理组中虽较其他处理组低,但并没有显著差异性(图 2-C)。
|
| 图 2 Pb胁迫对紫穗槐叶绿素荧光参数Fo(A)、Fv/Fm(B)和Fm(C)的影响 Figure 2 Effect of lead Stress on chlorophyⅡfluorescence parameter Fo(A), Fv/Fm(B) and Fm(C) of A. fruticosa |
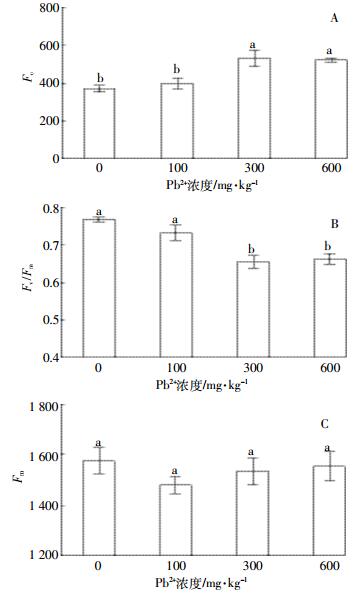
如图 3所示,当Pb胁迫浓度≥300 mg·kg-1时,紫穗槐叶片实际光化学效率(ФPSII(图 3-A)、光化学猝灭系数(qP)(图 3-B)、光系统Ⅱ开放反应中心转化效率(Fv′/Fm′)(图 3-C)显著低于对照,非光化学猝灭系数(NPQ)(图 3-D)升高,说明Pb胁迫改变了紫穗槐叶片激发能的分配。
|
| 图 3 Pb胁迫对紫穗槐叶绿素荧光参数ФPSⅡ(A)、qP(B)、Fv′/Fm′(C)和NPQ(D)的影响 Figure 3 Effect of lead stress on chlorophyⅡ fluorescence parameter ФPSⅡ(A), qP(B), Fv′/Fm′(C) and NPQ (D) of A. fruticosa |
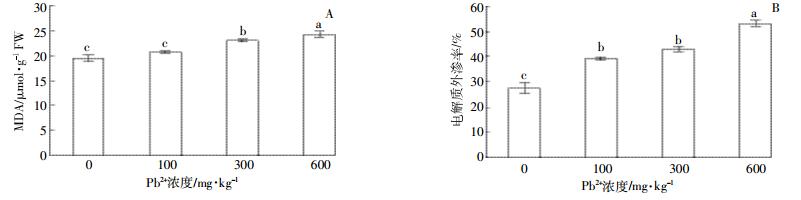
随着Pb浓度的升高,MDA含量呈上升趋势(图 4-A),在300 mg·kg-1与600 mg·kg-1处理条件下,MDA含量显著高于对照组。电解质外渗率随着Pb胁迫强度增加,均显著高于对照组,600 mg·kg-1处理条件下达到最大,显著高于对照及其他处理组,较低浓度Pb(100 mg·kg-1和300 mg·kg-1)处理下其电解质外渗率之间无显著差异(图 4-B)。
|
| 图 4 Pb胁迫对紫穗槐叶片MDA含量(A)和电解质外渗率(B)的影响 Figure 4 Effect of lead stress on MDA (A) and electrolyte leakage (B) in leaves of A. fruticosa |
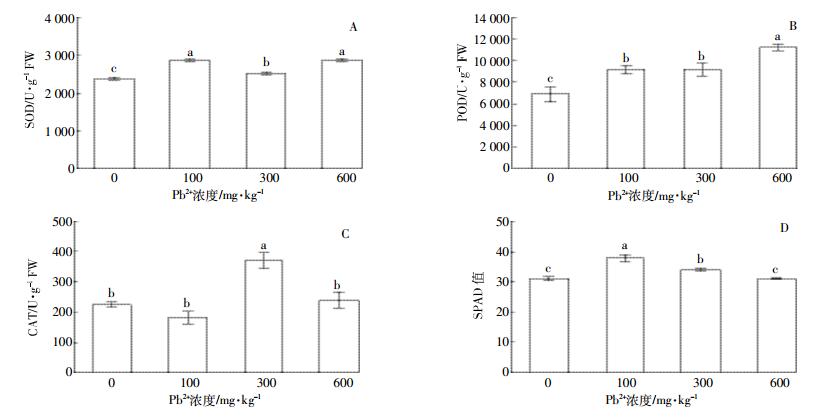
SOD活性随Pb处理浓度的增加,均显著高于对照,在100 mg·kg-1浓度处理下活性最大,但随后下降,到达600 mg·kg-1时又有所升高(图 5-A),表明紫穗槐对Pb有一定的耐受性。POD活性随Pb胁迫增加呈上升趋势,活性均显著高于对照,600 mg·kg-1处理下POD活性显著高于低浓度处理组(图 5-B)。CAT活性随Pb处理浓度增加先升后降,在300 mg·kg-1处理下达到最大,显著高于其他处理组(图 5-C)。紫穗槐叶片在100 mg·kg-1处理下SPAD值显著高于对照及其他处理组,600 mg·kg-1处理组SPAD值与对照组无显著差异(图 5-D)。
|
| 图 5 Pb胁迫对紫穗槐叶片SOD(A)、POD(B)、CAT(C)活性和SPAD值(D)的影响 Figure 5 Effect of lead stress on SOD (A), POD (B), CAT (C) activities and SPAD (D) in leaves of A. fruticosa |
光合作用是植物生长的生理基础,重金属胁迫能够抑制植物的光合作用,从而影响植物的正常发育[18]。SPAD值与叶片叶绿素含量呈正相关关系,可以反映植物叶片叶绿素含量变化[19]。重金属Pb污染对于本研究中紫穗槐在600 mg·kg-1浓度处理下,SPAD值与对照无显著差异,表明Pb浓度即使在600 mg·kg-1浓度时,仍不足以破坏紫穗槐叶绿素的生物合成,这与李永杰[20]的研究结果不同,原因可能是因为试验中栽培介质以及处理试剂等条件不同导致有效态Pb的含量不同,从而对紫穗槐叶绿素的损害程度不同[21]。
导致植物叶片Pn的降低有两种因素:气孔限制和非气孔限制。只有当Ci和Gs以相同的方向变化时,才能确定光合的下降是气孔限制造成的;当Ci升高而Gs下降时,主要因素是非气孔限制[22]。本研究结果显示在300 mg·kg-1处理浓度下,Ls升高且显著高于100 mg·kg-1处理组,Gs下降,Ci降低,说明此浓度处理下,Pn的降低主要受气孔限制因素导致。Ls在600 mg·kg-1浓度处理下显著低于300 mg·kg-1处理组,但Ci增高,表明此时引起Pn降低的因素主要是非气孔限制,即随着Pb浓度的增加,抑制了紫穗槐叶肉细胞的光合活性导致细胞间CO2积累。这一结果与李亚藏等[23]研究Pb对山荆子(Malus baccata)光合作用的影响结果类似。
3.2 紫穗槐叶绿素荧光参数对Pb胁迫的响应叶绿素荧光特性常用于检测光合机构对环境胁迫的响应[24]。本研究结果显示紫穗槐在≥300 mg·kg-1 Pb处理条件下,Fv /Fm显著降低,同时Fo显著升高,而Fm在各处理组中没有显著性差异变化。诸多研究表明Fv /Fm的值会随着胁迫程度的加重而降低,原因是PSⅡ反应中心发生不可逆转的破坏或失活[25],但也有研究发现Fv /Fm降低是植物保护反应的结果[26]。Guo等[27]认为在胁迫条件下PSⅡ反应中心受到损伤会导致Fo升高,但反之不成立。Fm降低可能预示着PSⅡ叶绿素结构受到破坏或者电子传递受到抑制[28]。综上表明紫穗槐在≥ 300 mg·kg-1 Pb胁迫下,光系统Ⅱ反应中心活性可能受到一定程度的损伤,原初光能转化效率降低,但并未造成不可逆转的破坏。
ФPSⅡ和qP都反映植物在光适应状态下进行光化学反应的能力[18],植物通过启动NPQ途径耗散过剩的激发能以保护光合机构免受伤害,所以在受到重金属胁迫时NPQ的值会增加[29]。本研究结果显示当Pb浓度≥300 mg·kg-1时,ФPSⅡ、qP和Fv′/Fm′值较对照显著下降,而NPQ值增加,说明Pb可以抑制PSⅡ光合电子传递能力,降低电子传递速率,紫穗槐通过非辐射能量途径耗散过剩光能,保护自身光合机构。
3.3 紫穗槐叶片生理生化特性对Pb胁迫的响应 3.3.1 紫穗槐叶片MDA和膜透性对Pb胁迫的响应MDA是膜脂过氧化产物之一,其含量变化常作为检测逆境条件下膜系统受损程度的指标[30]。紫穗槐在100 mg·kg-1 Pb胁迫处理下,MDA含量与对照组无显著差异,可能与SOD活性增加使得氧自由基含量减少,从而弱化脂质过氧化作用有关[31]。当300 mg·kg-1 Pb胁迫时,MDA含量和电解质外渗率均呈现上升趋势且显著高于对照组,说明随着Pb胁迫程度的增加,紫穗槐叶肉细胞活性氧水平和膜脂过氧化程度加深,膜的功能和结构遭到破坏。
3.3.2 紫穗槐叶片抗氧化酶活性对Pb胁迫的响应植物体通过SOD、POD和CAT等抗氧化酶相互协调,清除过多活性氧以维持机体活性氧代谢动态平衡,保护或缓解细胞结构的破坏[32]。紫穗槐叶片中SOD、POD活性在不同Pb胁迫处理下,酶活性显著高于对照,因为在重金属胁迫下,植物体内具有的活性氧清除系统和具有抗性特征的生理活动被诱导,从而导致植物体内SOD和POD的合成增强[33-34]。CAT活性变化趋势则随着Pb胁迫浓度的增加表现为先升高后降低,表明一定浓度的Pb处理能够诱导紫穗槐叶片CAT活性升高,当Pb胁迫达到600 mg·kg-1时,紫穗槐叶肉细胞内的酶系统受到损害,代谢趋于紊乱,抑制抗氧化酶基因的表达,导致CAT活性下降,这与郭艳杰等[35]的研究结果类似。
4 结论低浓度Pb胁迫处理(100 mg·kg-1)显著提高了紫穗槐的光合作用;中低浓度Pb胁迫处理(≤300 mg·kg-1)可以增强紫穗槐抗氧化酶活性,提高叶绿素含量;随着Pb胁迫浓度的增加叶片中抗氧化酶SOD、POD活性显著高于对照组;当Pb胁迫浓度达到600 mg·kg-1时,CAT活性开始有所下降,降低光合作用的主要因素是非气孔限制,碳同化能力下降,但并未对紫穗槐叶绿素荧光特性造成严重损伤,说明紫穗槐对Pb有较好的耐受性。
为了更好地探讨紫穗槐对Pb污染土壤的植物修复能力,今后还需要在组织器官水平上研究紫穗槐对Pb的吸收转运积累情况。
| [1] | Hassan W, David J. Effect of lead pollution on soil microbiological index under spinach (Spinacia oleracea, L.) cultivation[J]. Journal of Soils and Sediments, 2014, 14(1): 44–59. DOI:10.1007/s11368-013-0802-3 |
| [2] | Khan K S, XIE Zheng-miao, HUANG Chang-yong. Effect of cadmium, lead, and zinc on size of microbial biomass in red soil[J]. Pedosphere, 1998, 8(1): 27–32. |
| [3] | 邹天森, 潘立波, 王慢想, 等. 某废弃铅冶炼企业周边土壤和蔬菜的铅含量及分布特征[J]. 农业资源与环境学报, 2016, 33(4): 376–383. ZOU Tian-sen, PAN Li-bo, WANG Man-xiang, et al. Lead contents and distribution characteristics of soils and vegetables around an abandoned lead smeltery[J]. Journal of Agricultural Resources and Environment, 2016, 33(4): 376–383. (in Chinese) |
| [4] | 李小平, 刘洁, 夏舒楠, 等. 我国城市土壤铅与儿童血铅空间分布格局[J]. 土壤通报, 2015(1): 226–232. LI Xiao-ping, LIU Jie, XIA Shu-nan, et al. Spatial distribution pattern of lead in urban soil and in children's blood, China[J]. Chinese Journal of Soil Science, 2015(1): 226–232. (in Chinese) |
| [5] | Reeves R D. Tropical hyperaccumulators of metals and their potential for phytoextraction[J]. Plant and Soil, 2003, 249(1): 57–65. DOI:10.1023/A:1022572517197 |
| [6] | 伍钧, 孟晓霞, 李昆. 铅污染土壤的植物修复研究进展[J]. 土壤, 2005, 37(3): 258–264. WU Jun, MENG Xiao-xia, LI Kun. Phytoremediation of soils contaminated by lead[J]. Soils, 2005, 37(3): 258–264. (in Chinese) |
| [7] | 王英辉, 陈学军, 祁士华. 铅污染土壤的植物修复治理技术[J]. 土壤通报, 2007, 38(4): 790–794. WANG Ying-hui, CHEN Xue-jun, QI Shi-hua. Phytoremediation techniques for lead contaminated soil[J]. Chinese Journal of Soil Science, 2007, 38(4): 790–794. (in Chinese) |
| [8] | 王庆仁, 崔岩山, 董艺婷. 植物修复冥重金属污染土壤整治有效途径[J]. 生态学报, 2001, 21(2): 326–331. WANG Qing-ren, CUI Yan-shan, DONG Yi-ting. Phytoremediation:An effective approach of heavy metal cleanup from contaminated soil[J]. Acta Ecologica Sinica, 2001, 21(2): 326–331. (in Chinese) |
| [9] | 文月荣, 党廷辉, 唐骏, 等. 不同林地恢复模式下露天煤矿排土场土壤有机碳分布特征[J]. 应用生态学报, 2016, 27(1): 83–90. WEN Yue-rong, DANG Ting-hui, TANG Jun, et al. Distribution characteristics of soil organic carbon under different forest restoration modes on opencast coal mine dump[J]. Chinese Journal of Applied Ecology, 2016, 27(1): 83–90. (in Chinese) |
| [10] | 吴志远. 地埂柠条和紫穗槐的水保作用与生态及经济效益分析[J]. 水土保持研究, 1999(增刊): 36–37, 57. WU Zhi-yuan. Water conservation role of Salix lutea and Amorpha fruticosa planted in field bund and their ecological and economic benefits[J]. Research of Soil and Water Conservation, 1999(S1): 36–37, 57. (in Chinese) |
| [11] | 王华玲, 赵建伟, 程东升, 等. 不同植被缓冲带对坡耕地地表径流中氮磷的拦截效果[J]. 农业环境科学学报, 2010, 29(9): 1730–1736. WANG Hua-ling, ZHAO Jian-wei, CHENG Dong-sheng, et al. Nitrogen and phosphorus removal efficiency of different vegetative buffer strips on surface runoff from sloping land[J]. Journal of Agro-Environment Science, 2010, 29(9): 1730–1736. (in Chinese) |
| [12] | 施翔, 陈益泰, 王树凤, 等. 废弃尾矿库15种植物对重金属Pb、Zn的积累和养分吸收[J]. 环境科学, 2012, 33(6): 2021–2027. SHI Xiang, CHEN Yi-tai, WANG Shu-feng, et al. Pb, Zn accumulation and nutrient uptake of 15 plant species grown in abandoned mine tailings[J]. Environmental Science, 2012, 33(6): 2021–2027. (in Chinese) |
| [13] | 聂俊华, 刘秀梅, 王庆仁. Pb (铅) 富集植物品种的筛选[J]. 农业工程学报, 2004, 20(4): 255–258. NIE Jun-hua, LIU Xiu-mei, WANG Qing-ren. Screening out of Pb hypertolerant plant species[J]. Transactions of the Chinese Society of Agricultural Engineering, 2004, 20(4): 255–258. (in Chinese) |
| [14] | 宋伟, 陈百明, 刘琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究, 2013, 20(2): 293–298. SONG Wei, CHEN Bai-ming, LIU Lin. Soil heavy metal pollution of cultivated land in China[J]. Research of Soil and Water Conservation, 2013, 20(2): 293–298. (in Chinese) |
| [15] | Maxwell K, Johnson G N. Chlorophyll fluorescence:A practical guide[J]. Journal of Experimental Botany, 2000, 51(345): 659–668. |
| [16] | 李合生. 植物生理生化实验理和技术[M]. 北京: 高等教育出版社, 2000: 261-263. LI He-sheng. Plant physiology and experimental principles and techniques[M]. Beijing: Higher Education Press, 2000: 261-263. (in Chinese) |
| [17] | 高俊风. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 210-228. GAO Jun-feng. Experimental guide of physiology of plant[M]. Beijing: Higher Education Press, 2006: 210-228. (in Chinese) |
| [18] | 万雪琴, 张帆, 夏新莉, 等. 镉处理对杨树光合作用及叶绿素荧光参数的影响[J]. 林业科学, 2008, 44(6): 73–78. WAN Xue-qin, ZHANG Fan, XIA Xin-li, et al. Effects of cadium on photosynthesis and chlorophyll flurescence parameters of solution cultured poplar plants[J]. Scientla Silvae Sinicae, 2008, 44(6): 73–78. DOI:10.11707/j.1001-7488.20080612 (in Chinese) |
| [19] | 姜丽芬, 石福臣, 王化田, 等. 叶绿素计SPAD-502在林业上应用[J]. 生态学杂志, 2005, 12: 1543–1548. JIANG Li-fen, SHI Fu-chen, WANG Hua-tian, et al. Application tryout of chlorophyll meter SPAD-502 in forestry[J]. Chinese Journal of Ecology, 2005, 12: 1543–1548. DOI:10.3321/j.issn:1000-4890.2005.12.034 (in Chinese) |
| [20] | 李永杰. 土壤铅胁迫对紫穗槐幼苗叶片叶绿素的影响[J]. 中国园艺文摘, 2013(8): 27. LI Yong-jie. Effects of lead stress on the chlorophyll contents of Amorpha fruticosa L. seedlings[J]. Chinese Horticulture Abstracts, 2013(8): 27. (in Chinese) |
| [21] | Miller J E, Hassett J J, Koeppe D E. The effect of soil properties and extractable lead levels on lead uptake by soybeans[J]. Communications in Soil Science and Plant Analysis, 1975, 6(4): 339–347. DOI:10.1080/00103627509366573 |
| [22] | Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Plant Biology, 1982, 33(33): 317–345. |
| [23] | 李亚藏, 梁彦兰, 王庆成. 铅对山梨和山荆子光合作用和叶绿素荧光特性的影响[J]. 西北林学院学报, 2012, 27(5): 21–25. LI Ya-cang, LIANG Yan-lan, WANG Qing-cheng. Influence of Pb on photosynthesis and chlorophyll fluorescence characteristics in Pyrus ussuriensis and Malus baccata[J]. Journal of Northwest Forestry University, 2012, 27(5): 21–25. (in Chinese) |
| [24] | Wang P, Duan W, Takabayashi A, et al. Chloroplastic NAD (P) H dehydrogenase in tobacco leaves functions in alleviation of oxidative damage caused by temperature stress[J]. Plant Physiology, 2006, 141(2): 465–474. DOI:10.1104/pp.105.070490 |
| [25] | Peng C L, Gilmore A M. Contrasting changes of photosystem 2 efficiency in Arabidopsis xanthophyll mutants at room or low temperature under high irradiance stress[J]. Photosynthetica, 2003, 41(2): 233–239. DOI:10.1023/B:PHOT.0000011956.29950.97 |
| [26] | Murata N, Takahashi S, Nishiyama Y, et al. Photoinhibition of photosystem Ⅱ under environmental stress[J]. Biochimica et Biophysica Acta, 2007, 1767(6): 414–421. DOI:10.1016/j.bbabio.2006.11.019 |
| [27] | Guo D P, Guo Y P, Zhao J P, et al. Photosynthetic rate and chlorophyll fluorescence in leaves of stem mustard (Brassica juncea var. tsatsai) after turnip mosaic virus infection[J]. Plant Science, 2005, 168(1): 57–63. DOI:10.1016/j.plantsci.2004.07.019 |
| [28] | 邓培雁, 刘威, 韩博平. 宝山堇菜 (Viola baoshanensis) 镉胁迫下的光合作用[J]. 生态学报, 2007, 27(5): 1858–1862. DENG Pei-yan, LIU Wei, HAN Bo-ping. Photosynthesis of Viola baoshanensis under Cd stress[J]. Acta Ecologica Sinica, 2007, 27(5): 1858–1862. (in Chinese) |
| [29] | 刘爱荣, 陈双臣, 王淼博, 等. 高温胁迫对番茄幼苗光合作用和叶绿素荧光参数的影响[J]. 西北农业学报, 2010, 19(5): 145–148. LIU Ai-rong, CHEN Shuang-chen, WANG Miao-bo, et al. Effects of heat stress on photosynthesis and chlorophyll fluorescence parameters in tomato seedlings[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2010, 19(5): 145–148. (in Chinese) |
| [30] | 刘建新, 赵国林, 王毅民. Cd Zn复合胁迫对玉米幼苗膜脂过氧化和抗氧化酶系统的影响[J]. 农业环境科学学报, 2006, 25(1): 54–58. LIU Jian-xin, ZHAO Guo-lin, WAGN Yi-min. Effects of Cd and Zn combined stress on membrane lipid peroxiadation and antioxidant enzyme system of maize seedlings[J]. Journal of Agro-Environment Science, 2006, 25(1): 54–58. (in Chinese) |
| [31] | 田向荣, 吴昊, 李菁, 等. Cd、Pb复合胁迫下湿地匍灯藓 (Plagiomnium acutum) 重金属累积效应及抗氧化系统响应[J]. 农业环境科学学报, 2015, 34(5): 844–851. TIAN Xiang-rong, WU Hao, LI Jing, et al. Heavy metal accumulation and antioxidative system responses of Plagiomnium acutum under combined cadmium and lead stresses[J]. Journal of Agro-Environment Science, 2015, 34(5): 844–851. DOI:10.11654/jaes.2015.05.005 (in Chinese) |
| [32] | Banerjee B D, Seth V, Bhattacharya A, et al. Biochemical effects of some pesticides on lipid peroxidation and free-radical scavengers[J]. Toxicology Letters, 1999, 107: 33–47. DOI:10.1016/S0378-4274(99)00029-6 |
| [33] | 张清智, 陈振德, 王文娇, 等. 毒死蜱胁迫对小白菜抗氧化酶活性和相关生理指标的影响[J]. 生态学报, 2008, 28(9): 4524–4530. ZHANG Qing-zhi, CHEN Zhen-de, WAGN Wen-jiao, et al. Effects of chlorpyrifos stress on antioxidant enzyme activities and some related compound contents in pakchoi[J]. Acta Ecologica Sinica, 2008, 28(9): 4524–4530. (in Chinese) |
| [34] | Qureshi M I, Abdin M Z, Qadir S, et al. Lead-induced oxidative stress and metabolic alterations in Cassia angustifolia Vahl[J]. Biologia Plantarum, 2007, 51(1): 121–128. DOI:10.1007/s10535-007-0024-x |
| [35] | 郭艳杰, 李博文, 杨华, 等. Cd, Pb复合污染对印度芥菜抗氧化酶活性的影响[J]. 水土保持学报, 2011, 25(1): 214–218. GUO Yan-jie, LI Bo-wen, YANG Hua, et al. Stress responses of brassica juncea to Cd and Pb compound contamination in soil[J]. Journal of Soil and Water Conservation, 2011, 25(1): 214–218. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34