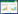文章信息
- 彭鸥, 铁柏清, 叶长城, 张淼, 刘孝利, 魏祥东, 孙健
- PENG Ou, TIE Bo-qing, YE Chang-cheng, ZHANG Miao, LIU Xiao-li, WEI Xiang-dong, SUN Jian
- 稻米镉关键积累时期研究
- The Key Period of Cadmium Accumulation in Rice
- 农业资源与环境学报, 2017, 34(3): 272-279
- Journal of Agricultural Resources and Environment, 2017, 34(3): 272-279
- http://dx.doi.org/10.13254/j.jare.2017.0035
-
文章历史
- 收稿日期: 2017-02-12
2. 广东工业大学环境科学与工程学院, 广东 广州 510006
2. College of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006, China
进入到21世纪,随着工业飞速发展,大量的矿区被开采,农田镉污染日趋严重。根据2014年全国土壤污染调查公报,我国农田镉污染点位超标率达到7.0%,远高于其他重金属污染物[1]。可见重金属镉污染问题已经严重危害我国土壤安全,对粮食安全存在极大的隐患。湖南是我国主要稻米产区和著名的有色金属之乡,常年采冶有色金属矿产导致重金属污染问题日益凸显,其中尤以镉污染最为突出[2]。近年来湖南农田土壤及稻米中重金属污染形势也颇为严峻[3-4]。
水稻生长需要经过不同的生育期,每个生育期对有害物质吸收和积累的规律有明显差异[5]。镉通过水稻自身的富集和转运作用,积累于水稻植株体内,尤其是食用的稻米部位,从而威胁食品安全[6]。稻米中富集的镉主要来源于灌溉水和土壤中[7],但水稻在每个生育期吸收的水分、矿物质与营养物质都有所不同,主要的发育器官、物质转运与合成也不尽相同,要解析镉在水稻体内的吸收、转运及积累过程,就必须分析不同生育期对稻米中镉积累的影响。目前通过水培法在水稻生育期分阶段添加低浓度外源镉研究不多,本研究旨在分析水稻不同生育期镉富集能力变化,找出稻米积累镉的关键生育期,以期为阻控稻米镉积累和水稻安全生产提供理论依据。
1 材料与方法 1.1 试验材料与处理供试早稻品种为中嘉早17号(常规籼稻,全生育期109 d);晚稻品种为湘晚籼13号(常规籼稻,全生育期124 d)。水稻幼苗是由湖南省株洲县洲坪乡农技站提供的幼苗,幼苗五叶一心后开始移栽。幼苗培育是根据当地农业习惯,进行田间育苗。中嘉早17号在营养液中整个培养时间为2015年4—7月,4月30日移栽,5月6日开始添加外源镉;湘晚籼13号在营养液中培养时间为2015年7—10月。7月28日移栽,8月3日开始添加外源镉。营养液中含有微量元素贮备液10 mL。水稻幼苗移栽前早稻幼苗根系镉含量为2.6 mg·kg-1,茎鞘为0.35 mg·kg-1,叶为0.06 mg·kg-1;晚稻幼苗根系镉含量为1.8 mg·kg-1,茎鞘为0.95 mg·kg-1,叶为0.08 mg·kg-1。水稻采用泡沫育苗盘和定植篮固定,每桶5穴,每穴3株;试验培养水稻所需营养液配制方法采用木村B营养液及Arnon A-Z微量元素营养液[8-9]配制。
本试验采用盆栽水培法试验,光源为自然光源,水稻幼苗移栽7 d后开始添加外源镉,每桶添加0.5 mL 1 000 mg·L-1 CdCl2(以Cd2+浓度计算),保持营养液内镉浓度为50 μg·L-1,培养液每5 d换1次,每2 d用10 mol·L-1 NaOH和10 mol·L-1 HCl调pH值至5.5。设置7个处理水平,每个处理重复3次,施用农药情况每个处理保持一致,详见表 1。
水稻样品采集后,先用自来水小心洗净根系,然后用去离子水清洗整个植株,将植株根系、茎鞘、叶、穗手工分离,在103 ℃杀青1 h,置于烘箱65 ℃烘至恒重,称取各部位干重。稻谷风干晒干后用砻谷机分离出糙米和稻壳。所有样品粉碎过100目筛,全部装入封口袋内密封保存备用。称取水稻各部位样品0.500 0±0.000 5 g置于消解管中采用混合酸(HNO3:HClO4=4:1)湿法消解、定容[10]。采用ICP-OES(美国PE8300)测定镉含量在0.1 mg·kg-1以上的水稻样品;用原子吸收分光光度计-石墨炉法(GTA120,美国Varian)测定镉含量在0.1 mg·kg-1以下的水稻样品。
1.2.2 数据处理运用IBM SPSS(Statistical Product and Service Solutions,22.0)对数据进行统计分析处理;运用Microsoft Excel 2010软件对数据进行图表处理。
水稻不同生育期的镉积累速率=[(成熟期样品的镉浓度×干重)-(不同时期样品的镉浓度×干重)] ÷积累天数。
糙米镉积累量贡献率=(各生育期胁迫处理糙米镉浓度×糙米重量-空白)÷(全生育期镉处理胁迫糙米镉浓度×糙米重量-空白)×100%。
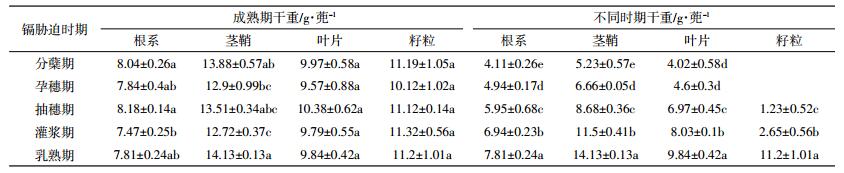
2 结果与分析 2.1 各镉胁迫阶段中水稻各部位镉积累情况 2.1.1 中嘉早17号各部位镉含量情况表 2为不同生育时期添加外源镉中嘉早17号成熟后各部位中镉含量。从表 2可知,中嘉早17号不同部位间镉含量差异大,水稻根系镉含量异常突出。不同处理间,水稻各部位镉含量呈现出的总体规律为:根系>茎鞘>穗轴>稻壳>叶片>糙米,并且全生育期镉胁迫处理(T6)明显高于其他处理。根系镉含量变化范围为3.6~230.35 mg·kg-1;镉胁迫时期处理间表现出T6>T5≈T3≈T2≈T1>T4>CK的规律(“>”表示处理间镉含量从大到小排列差异显著,“≈”表示处理间镉含量从大到小排列但差异不显著,下同);全生育期处理(T6)添加低浓度外源镉胁迫时间最长,根含量最高,除此之外,成熟期(T5)根含量也高。茎鞘中镉含量变化没有根系大,全生育期镉胁迫处理(T6)镉含量最高,其次为抽穗期(T3)与孕穗期(T2)胁迫处理。叶片也是全生育期镉胁迫处理镉含量最高,同根系、茎鞘表现的规律一致,乳熟期(T5)镉胁迫处理叶片镉含量次之。水稻稻壳中镉含量变化范围为0.72~14.96 mg·kg-1,水稻糙米中镉含量变化范围为0.13~6.34 mg·kg-1,稻壳是糙米紧密相连的部位,在镉胁迫生育期中分蘖期(T1)、孕穗期(T2)和抽穗期(T3)稻壳镉含量大。全生育期镉胁迫的处理稻米镉含量远高于其他处理,抽穗期(T3)、孕穗期(T2)这两个时期在镉胁迫条件下稻米中镉含量明显高于除全生育期胁迫处理外的其他处理,是中嘉早17号米镉形成的关键时期。
|
表 3为不同生育时期内添加外源镉湘晚籼13号成熟后各部位中镉含量。由表 3可知,晚稻中各部位镉含量在不同处理间表现出总体规律为:根系>茎鞘>穗轴>叶片>稻壳>糙米,与中嘉早17号试验结果基本一致。水稻植株不同部位镉含量差异明显,根系变化范围为2.26~241.17 mg·kg-1,表现出T6>T1≈T2≈T3≈T5≈T4>CK的规律,根系中除全生育期镉胁迫处理镉含量较高外,分蘖期(T1)、孕穗期(T2)镉胁迫处理含量也高。在水稻茎鞘中除全生育期镉胁迫处理镉含量较高外,分蘖期(T1)镉胁迫处理含量较高,这与镉胁迫时间有关。叶片中的全生育期镉胁迫处理和分蘖期(T1)镉胁迫处理镉含量较高,大量的镉富集在叶片中的暂时贮存。水稻稻壳中镉含量变化范围为0.18~18.69 mg·kg-1,稻壳不同处理间表现出T6>T3≈T2>T5≈T1≈T4>CK的变化规律,湘晚籼13号在不同生育期添加外源镉处理成熟后稻壳中孕穗期(T2)和抽穗期(T3)这两个时期含量较高。在分蘖期(T1)和孕穗期(T2)水稻根系吸收了大量的镉从而向各部位转移。稻壳和糙米中在孕穗期(T2)和抽穗期(T3)这两个时期内添加外源镉胁迫镉含量高于其他处理,但低于全生育镉胁迫处理。中嘉早17号和湘晚籼13号镉积累时期基本一致,均为孕穗期(T2)和抽穗期(T3)。
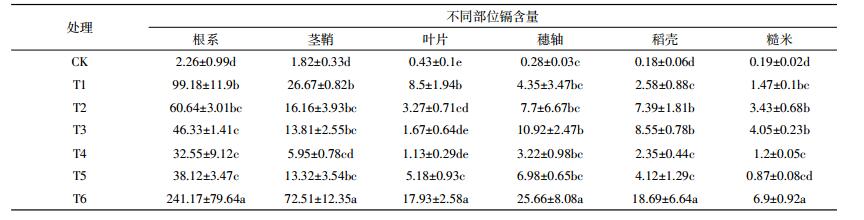
|
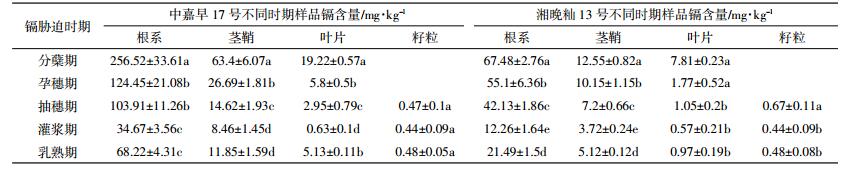
中嘉早17号在生长过程中生长正常,营养良好,并能正常结实。试验分别于2015年6月5日采取分蘖期镉胁迫样品,T1处理停止添加外源镉;6月25日采取孕穗期镉胁迫样品,T2处理停止加镉;稻穗开始进行灌浆;7月9日采取抽穗期镉胁迫样品,T3处理停止加镉;7月18日采取灌浆期镉胁迫样品,T4处理停止加镉,7月26日采取乳熟期镉胁迫样品,所有水稻收获采样。采取的每个样品称量干重及检测镉含量,不同时期样品与成熟期样品每蔸干重详见表 4,不同时期样品镉含量见表 5。
|
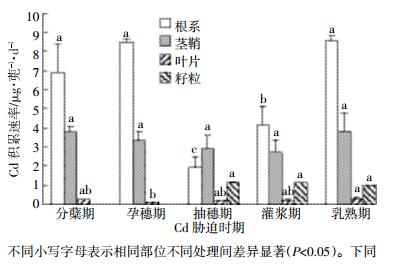
中嘉早17号水稻主要部位镉积累速率见图 1。从图 1可以看出,收获后中嘉早17号不同部位镉积累速率和不同生育期镉积累速率有明显的差异。除抽穗期外,生育期镉胁迫处理水稻根系镉积累速率均远大于茎鞘、叶片、籽粒的镉的积累速率,最高达到8.66 μg·蔸-1·d-1,茎鞘中镉的积累速率最高达到3.88 μg·蔸-1·d-1,叶片中镉积累量最高达到0.29 μg·蔸-1·d-1。籽粒中镉积累量最高达到1.14 μg·蔸-1·d-1。中嘉早17号不同部位镉积累速率基本上表现为根系>茎鞘>籽粒>叶片的规律。
|
| 图 1 中嘉早17号水稻主要部位镉积累速率 Figure 1 Cd accumulation rate in main parts of rice in Zhong Jiazao 17 |
就不同生育期而言,乳熟期水稻镉积累速率大于其他生育期,乳熟期水稻主要进行生殖生长,水稻生物量变化不大。在分蘖期水稻进行营养生长,水稻生长迅速,需要大量的外部营养,镉随着营养物质进入到水稻体内,水稻积累镉的速率也较高。孕穗期水稻处于营养生长和生殖生长同时进行的阶段,水稻开始形成稻壳,有效态镉随着根系吸收不断在水稻体内累积,因此在孕穗期处理比分蘖期处理镉积累速率要高。抽穗期水稻以生殖生长为主,营养物质需求量明显小于分蘖期,在这个阶段根系和茎鞘开始积累镉量下降,积累速率也下降。灌浆期开始形成稻米,镉随着营养物质进入籽粒中,此阶段籽粒镉积累速率最高。中嘉早17号不同生育期镉积累速率规律表现为乳熟期≈分蘖期>孕穗期>灌浆期>抽穗期,籽粒中镉积累速率3个阶段处理没有显著差异,为抽穗期≈灌浆期≈乳熟期。
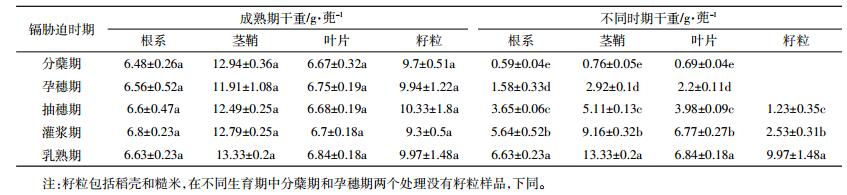
2.2.2 湘晚籼13号镉胁迫后主要部位镉积累速率湘晚籼13号水稻长势基本正常,正常结实。试验分别于2015年8月27日采取分蘖期镉胁迫样品,T1处理停止添加外源镉;9月16日采取孕穗期镉胁迫样品,T2处理停止加镉;9月29日日采取抽穗期镉胁迫样品,T3处理停止加镉;10月7日采取灌浆期镉胁迫样品,T4处理停止加镉;10月18日采取乳熟期镉胁迫样品,所有水稻收获采样。采取的每个样品称量干重及检测镉含量,不同时期样品与成熟期样品每蔸干重详见表 6,不同时期样品镉含量见表 5。
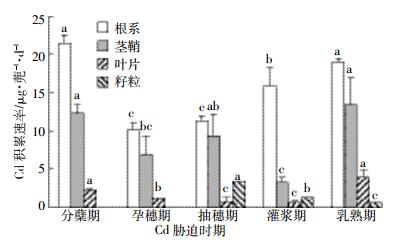
湘晚籼13号水稻主要部位镉积累速率见图 2。从图 2可看出,湘晚籼13号不同部位镉积累速率规律与中嘉早17号基本一致,通过早晚稻根、茎、叶、籽粒积累速率可以看出,无论是中嘉早17号还是湘晚籼13号水稻根系积累速率最高,是水稻主要吸收积累镉的部位。湘晚籼13号不同部位镉积累速率为根系>茎鞘>籽粒>叶片,这与中嘉早17号镉积累量一致。但是值得指出的是湘晚籼13号根、茎、叶、籽粒镉积累量比中嘉早17号均要高,积累速率也比中嘉早17号高。
|
| 图 2 湘晚籼13号水稻主要部位镉积累速率 Figure 2 Cd accumulation rate in main parts of Xiang Wanxian 13 |
对于湘晚籼13号不同生育期来看,不同生育期镉积累速率表现出:分蘖期≈乳熟期>抽穗期>孕穗期>灌浆期。就籽粒镉积累速率来看为抽穗期>灌浆期>乳熟期。分蘖期水稻进行营养生长,有效态镉随着营养物质进入到水稻体内,水稻吸收镉速率较快。孕穗期水稻营养生长和生殖生长并存,孕穗期处理镉积累总量比分蘖期少,积累速率也下降。抽穗期处理水稻开始抽穗形成稻壳,籽粒镉积累速率较高。灌浆期和乳熟期稻米开始形成,这个两个阶段也是镉米形成的重要时期,在这两阶段水稻以生殖生长为主,同时伴随营养生长为水稻生长提供能量,籽粒镉吸收速率均低于抽穗期。
根据中嘉早17号和湘晚籼13号的镉积累速率情况来看,分蘖期处理吸收速率较高,抽穗期处理对籽粒镉积累速率影响最大。因此分蘖期水稻遭受镉胁迫后不断地累积镉,向水稻不同部位转移。抽穗期水稻镉胁迫后,镉不断向穗部转移,形成有毒害的镉米,抽穗期是稻米镉积累的关键时期。
2.3 不同时期镉胁迫稻米镉含量及产量镉胁迫时期稻米镉含量及产量情况见图 3。由图 3可知,水稻在不同生育期添加低浓度(50 μg·L-1)外源镉胁迫后对水稻的产量没有明显的影响,基本上在50 g·盆-1上下波动,早晚稻规律基本一致。镉胁迫时期对水稻成熟后稻米镉含量的大小基本规律为:全生育期处理(T6)>抽穗期处理(T3)>孕穗期处理(T2)>分蘖期处理(T1)>灌浆期处理(T4)>乳熟期处理(T5)>对照处理(CK)。通过水培实验发现,不同生育期在50 μg·L-1外源镉胁迫下稻米镉含量均远远高出国家标准0.2 mg·kg-1。全生育期在50 μg·L-1外源镉胁迫下水稻稻米镉含量达到6 mg·kg-1。另外抽穗期(T3)、孕穗期(T2)处理水稻成熟后稻米镉含量也较高,远远高出分蘖期(T1)、灌浆期(T4)、乳熟期(T5)、对照(CK)处理。换而言之,抽穗期和孕穗期水稻在镉胁迫下稻米中镉积累量较高,水稻在抽穗期和孕穗期这两个生育期是稻米镉积累的关键时期。中嘉早17号和湘晚籼13号在不同生育期稻米镉浓度规律基本一致,但是湘晚籼13号稻米镉含量在不同生育期均略高于中嘉早17号。
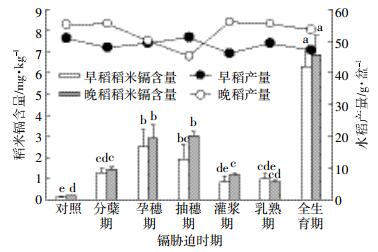
|
| 图 3 镉胁迫时期稻米镉含量及产量情况 Figure 3 Cd contents and yield of rice in different Cd stress stages |
不同时期镉胁迫对稻米镉积累贡献率见图 4。由图 4可以看出,在不同时期镉胁迫对中嘉早17号稻米镉积累量贡献率为:孕穗期>抽穗期>分蘖期>乳熟期>灌浆期;湘晚籼13号稻米镉积累量贡献率大小规律为:孕穗期>抽穗期>分蘖期>灌浆期>乳熟期。由于中嘉早17号和湘晚籼13号两个品种不同以及种植季节不同,造成两种贡献率规律在灌浆期处理和乳熟期处理有一定差异。中嘉早17号和湘晚籼13号的稻米镉积累量贡献率最大的生育期均是是孕穗期,中嘉早17号孕穗期稻米镉积累量贡献率为40.51%,湘晚籼13号孕穗期稻米镉积累量贡献率为37.97%。在水稻抽穗期、孕穗期内添加外源镉胁迫对水稻米镉积累量贡献率最大,这两个时期贡献率超过70%。也就是说在农田实际生产过程中水稻在抽穗期、孕穗期期间应该严格控制灌溉水镉含量,或者在抽穗期、灌浆期以前使用叶面阻控剂阻止水稻穗部对镉的吸收。
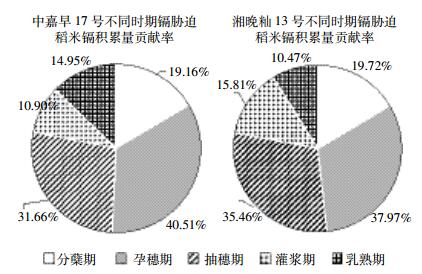
|
| 图 4 不同镉胁迫时期稻米镉积累量贡献率 Figure 4 Contribution rate of rice in different Cd stress stages |
镉不是植物生长发育所必需的营养元素,易通过根系、叶片两种途径进入植物体内,然后在各组织部位累积,进而通过食物链给人类健康带来巨大危害[11]。水稻在生长过程中不同生育期对镉的积累量不同,本研究发现孕穗期和抽穗期是籽粒镉积累主要时期,丁园等[12]研究表明水稻生长过程中,有害元素镉随着营养元素一起,主要在营养生长阶段主动吸收。研究发现水稻在分蘖期水稻进行营养生长,生物量增长迅速,需要大量的外部营养,营养液中有效态镉随着营养物质进入到水稻体内,因此分蘖期水稻镉含量相对较高。镉对水稻植株的毒害作用随生育进程而减弱,即镉对地上部干物质产生的毒害作用在生育后期相对较轻[13]。有研究表明,水稻分蘖期以后对重金属的耐性和解毒能力会得到增强[14]。史静等[15]的研究表明,水稻对镉的吸收因不同生育期而异,分蘖期和成熟期是镉吸收的主要时期,但是稻米中镉积累主要在孕穗期和抽穗期。Rodda等[16]研究3种不同生育期阶段镉胁迫对水稻镉积累的影响,表明在扬花期水稻对镉的耐受能力较强且植株体内镉含量相对较高。王凯荣等[17]利用两种不同遗传品种水稻的水培试验表明,供试水稻对镉的吸收速率表现为中期>后期>前期。水稻营养生长阶段和生殖生长阶段的代谢中心有很大区别,许多离子通道基因在表达时间和表达部位上也有明显的差异[18]。本研究表明水稻在孕穗期、抽穗期对稻米镉积累影响较大,与唐皓等[19]研究一致,因此在孕穗期、抽穗期以前施用叶面阻控剂和减少灌溉水中镉含量也能一定程度减少稻米中镉含量。
本研究发现水稻不同部位对镉吸收积累速率有明显差异,水稻根系镉积累速率最快,根系作为重要的吸收器官和代谢器官,其生长状况不仅直接控制着植物吸收水分和养分的能力,而且决定了植株地上部生长速度[20]。阻控水稻根系对镉吸收和转运是降低稻米中镉含量的关键所在。Nocito等[21]的研究结果表明,在0.1 μmol·L-1 Cd2++的环境中,根系转运到木质部中的Cd2+量似乎就达到了饱和。Cd2++的螯合作用、区域化、吸收利用和转运共同决定了根茎之间Cd2++的含量以及与环境中Cd2++浓度的动态平衡。镉胁迫时间越长,根系向地上部分转运的Cd2++越多,茎叶中的积累量与根系中积累的差距越小[22]。茎鞘是水稻营养物质运输的一个重要的通道,是水稻上部受外界毒害的重要的途径。Uraguchi等[23]、Arao等[24]研究指出,木质部向地上部转运才是决定水稻茎鞘及籽粒中镉含量的最主要和常见的生理过程。叶片能够暂时存储茎鞘运输的部分Cd2+,而后向穗部转运。分蘖期和孕穗期叶片镉积累速率较快,在这两时期阻止叶片镉转运,也能一定地降低稻米中镉含量,这也为在分蘖期、孕穗期施用叶面阻控剂阻控水稻镉的积累提供理论依据。籽粒镉积累要经过3个过程:根系吸收、茎鞘运输以及叶片转运,最终在籽粒中积累[25]。籽粒中镉积累主要出现在抽穗期以后,合理控制水稻后期农业灌溉用水中镉含量,有助于减少籽粒中镉积累。
水培营养液中添加Cd2+被根吸收后通过茎鞘的转运、叶片暂时储存、穗轴向穗部运输、最后在稻米中累积,形成对人类有危害的镉米[26]。本研究在同一镉浓度条件下(外源镉50 μg·L-1)外源镉胁迫水稻生长过程对镉米形成的影响发现,根系镉含量明显高于其他部位,有效阻控水稻根系对土壤和灌溉水中镉的吸收,定能减少稻米中镉含量。叶片作为水稻镉的一个储存库,在分蘖期、孕穗期施用叶面阻控剂阻止叶片中的镉向穗部运输能够有效地降低稻米镉含量。在孕穗期、抽穗期两个时期添加外源镉胁迫,籽粒中镉含量较高,主要是由于分蘖期水稻吸收积累镉以及孕穗期、抽穗期镉随着营养物质的运输积累。对于水稻不同种植季度而言(中嘉早17号与湘晚籼13号),早、晚稻镉含量在生育期内呈现规律基本一致,但是湘晚籼13号的镉含量基本上都比中嘉早17号要高。这虽与气候和品种有关,但也在一定程度上可以说明晚稻应该比早稻更应该注重灌溉水以及土壤镉的阻控。
目前对于控制稻米中镉含量主要措施有施用土壤改良剂、施用叶面阻控剂以及通过工艺措施降低灌溉水中镉含量。因此,在分蘖盛期、孕穗期施用叶面阻控剂,或者在这两个时期严格控制灌溉水中镉含量能够降低稻米镉含量。
4 结论(1)在不同阶段镉胁迫处理下(50 μg·L-1),水稻成熟后不同时期镉胁迫稻米镉含量表现出规律为:全生育期处理>抽穗期处理>孕穗期处理>分蘖期处理>灌浆期处理>成熟期处理>对照处理;成熟后水稻各部位的镉含量差异明显,表现为根系>茎鞘>叶片>穗轴>稻壳>糙米的规律。
(2)水稻不同部位镉积累速率基本规律为:根系>茎鞘>糙米>叶片;就不同时期镉胁迫而言,在分蘖期和乳熟期水稻镉积累速率较快。
(3)孕穗期阶段镉胁迫对水稻成熟后稻米中镉积累量贡献率较高,最高达到40.51%,抽穗期阶段镉胁迫对水稻籽粒镉积累速率影响最为明显,最高为3.41 μg·蔸-1·d-1。孕穗期、抽穗期是控制镉米形成的关键时期。
(4)水稻体内以及稻米中镉含量与受镉胁迫时间呈正相关,试验中全生育期接受外源镉胁迫处理各部位镉含量明显高于每个阶段镉胁迫的镉含量。
| [1] | 环境保护部, 国土资源部. 全国土壤污染状况调查公报[J]. 中国环保产业, 2014(5): 10–11. Ministry of Environmental Protection, Ministry of Land and Resources. Bulletin of the national soil pollution survey[J]. China Environmental Protection Industry, 2014(5): 10–11. (in Chinese) |
| [2] | 刘泉子. 湖南土壤治毒试验[J]. 国土资源导刊, 2014(7): 53–54. LIU Quan-zi. Experiment on soil toxicity in Hunan Province[J]. Land & Resources Herald, 2014(7): 53–54. (in Chinese) |
| [3] | 雷鸣, 曾敏, 郑袁明, 等. 湖南采矿区和冶炼区水稻土重金属污染及其潜在风险评价[J]. 环境科学学报, 2008, 28(6): 1212–1220. LEI Ming, ZENG Min, ZHENG Yuan-ming, et al. Heavy metal pollution and potential risk assessment of paddy soil in Hunan mining area and smelting area[J]. Journal of Environmental Science, 2008, 28(6): 1212–1220. (in Chinese) |
| [4] | 雷鸣, 曾敏, 王利红, 等. 湖南市场和污染区稻米中As、Pb、Cd污染及其健康风险评价[J]. 环境科学学报, 2010, 30(11): 2310–2314. LEI Ming, ZENG Min, WANG Li-hong, et al. Arsenic, lead and cadmium pollution in rice from Hunan markets and contaminated areas and their health risk assessment[J]. Journal of Environmental Science, 2010, 30(11): 2310–2314. (in Chinese) |
| [5] | 余飞宇. 水稻幼苗对镉胁迫的反应及其与全生育期镉积累特性的关系[D]. 扬州: 扬州大学, 2008. YU Fei-yu. Reaction of rice seedling to Cd stress and the relation with Cd accumulation characteristic in whole growth period under Cd stress[D]. Yangzhou:Yangzhou University, 2008.(in Chinese) |
| [6] | 林华, 张学洪, 梁延鹏, 等. 复合污染下Cu、Cr、Ni和Cd在水稻植株中的富集特征[J]. 生态环境学报, 2014(12): 1991–1995. LIN Hua, ZHANG Xue-hong, LIANG Yan-peng, et al. Enrichment of heavy metals in rice under combined pollution of Cu, Cr, Ni and Cd[J]. Ecology and Environmental Sciences, 2014(12): 1991–1995. DOI:10.3969/j.issn.1674-5906.2014.12.016 (in Chinese) |
| [7] | 文志琦, 赵艳玲, 崔冠男, 等. 水稻营养器官Cd积累特性对稻米Cd含量的影响[J]. 植物生理学报, 2015(8): 1280–1286. WEN Zhi-qi, ZHAO Yan-ling, CUI Guan-nan, et al. Effects of cadmium accumulation characteristics in vegetative organs on cadmium content in grains of rice[J]. Plant Physiology Journal, 2015(8): 1280–1286. (in Chinese) |
| [8] | Arnon D I, Stout P R. Molybdenum as an essential element for higher plants[J]. Plant Physiology, 1939, 14(3): 599–602. DOI:10.1104/pp.14.3.599 |
| [9] | 薛应龙. 植物生理学实验手册[M]. 上海: 上海科学技术出版社, 1985. XUE Ying-long. Laboratory manual of plant physiology[M]. Shanghai: Shanghai Science and Technology Press, 1985. (in Chinese) |
| [10] | 刘凤枝. 农业环境监测实用手册[M]. 北京: 中国标准出版社, 2001. LIU Feng-zhi. Agricultural environment monitoring of practical manual[M]. Beijing: Standards Press of China, 2001. (in Chinese) |
| [11] | 柳检, 罗立强. As、Cd和Pb植物根系吸收途径和影响因素研究现状与进展[J]. 岩矿测试, 2015(3): 269–277. LIU Jian, LUO Li-qiang. Research progress on the root uptake pathway of As and Pb and its influence factors[J]. Rock and Mineral Analysis, 2015(3): 269–277. (in Chinese) |
| [12] | 丁园, 宗良纲, 徐晓炎, 等. Cd污染对水稻不同生育期生长和品质的影响[J]. 生态环境学报, 2009, 18(1): 183–186. |
| [13] | 陈京都, 何理, 许轲, 等. Cd胁迫对不同类型水稻生长及营养元素吸收的影响[J]. 生态学杂志, 2013, 32(12): 3219–3225. CHEN Jing-du, HE Li, XU Ke, et al. Growth and nutritional element absorption of different rice genotypes under cadmium[J]. Chinese Journal of Ecology, 2013, 32(12): 3219–3225. (in Chinese) |
| [14] | 仲晓春, 陈京都, 郝心宁. 水稻作物对重金属Cd的积累、耐性机理以及栽培调控措施进展[J]. 中国农学通报, 2015(36): 1–5. ZHONG Xiao-chun, CHEN Jing-du, HAO Xin-ning. Research process of accumulation, tolerance mechanism and cultivation control measures of heavy metal cadmium in rice crops[J]. Chinese Agricultural Science Bulletin, 2015(36): 1–5. DOI:10.11924/j.issn.1000-6850.casb15080109 (in Chinese) |
| [15] | 史静, 李正文, 龚伟群, 等. 2种常规水稻Cd、Zn吸收与器官分配的生育期变化:品种、土壤和Cd处理的影响[J]. 生态毒理学报, 2007, 2(1): 32–40. SHI Jing, LI Zheng-wen, GONG Wei-qun, et al. Uptake and partitioning of Cd and Zn by two non-hybrid rice cultivars in different growth stages:Effect of cultivars, soil type and Cd spike[J]. Asian Journal of Ecotoxicology, 2007, 2(1): 32–40. (in Chinese) |
| [16] | Rodda M S, Li G, Reid R J. The timing of grain Cd accumulation in rice plants:The relative importance of remobilisation within the plant and root Cd uptake post-flowering[J]. Plant and Soil, 2011, 347(1): 105–114. |
| [17] | 王凯荣, 龚惠群. 不同生育期Cd胁迫对两种水稻的生长、Cd吸收及糙米Cd含量的影响[J]. 生态环境, 2006, 15(6): 1197–1203. WANG Kai-rong, GONG Hui-qun. Effects of cadmium exposures in different stages on plant growth, Cd uptake and Cd concentrations in brown rice of a hybrid and conventional rice variety[J]. Ecological and Environment, 2006, 15(6): 1197–1203. (in Chinese) |
| [18] | Paul A Counce, Terry C Keisling, Andrew J Mitchell. A uniform, objective, and adaptive system for expressing rice development.[J]. Crop Science, 2000, 40(2):436-443. |
| [19] | 唐皓, 李廷轩, 张锡洲, 等. 水稻Cd高积累材料不同生育期Cd积累变化特征研究[J]. 农业环境科学学报, 2015(3): 471–477. TANG Hao, LI Ting-xuan, ZHANG Xi-zhou, et al. Cadmium accumulation in high cadmium-accumulating rice cultivars at different growth stages[J]. Journal of Agro-Environment Science, 2015(3): 471–477. DOI:10.11654/jaes.2015.03.008 (in Chinese) |
| [20] | Wu F B, Dong J, Qian Q Q, et al. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J]. Chemosphere, 2005, 60(10): 1437–1446. DOI:10.1016/j.chemosphere.2005.01.071 |
| [21] | Nocito F F, Lancilli C, Dendena B, et al. Cadmium retention in rice roots is influenced by cadmium availability, chelation and translocation[J]. Plant Cell & Environment, 2011, 34(6): 994–1008. |
| [22] | Huang J, Zhang Y, Peng J S, et al. Fission yeast HMT1 lowers seed cadmium through phytochelatin-dependent vacuolar sequestration in Arabidopsis[J]. Plant Physiology, 2012, 158(4): 1779–1788. DOI:10.1104/pp.111.192872 |
| [23] | Uraguchi S, Mori S, Kuramata M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60(9): 2677–2688. DOI:10.1093/jxb/erp119 |
| [24] | Arao T, Ae N, Sμgiyama M, et al. Genotypic differences in cadmium uptake and distribution in soybeans[J]. Plant & Soil, 2003, 251(2): 247–253. |
| [25] | Clemens S, Palmgren M G, Kramer U. A long way ahead:Understanding and engineering plant metal accumulation[J]. Trends in Plant Science, 2002, 7(7): 309–315. DOI:10.1016/S1360-1385(02)02295-1 |
| [26] | 龙小林, 向珣朝, 徐艳芳, 等. Cd胁迫下籼稻和粳稻对Cd的吸收、转移和分配研究[J]. 中国水稻科学, 2014, 28(2): 177–184. LONG Xiao-lin, XIANG Xun-chao, XU Yan-fang, et al. Absorption, transfer and distribution of Cd in indica and japonica rice under Cd stress[J]. Chin J Rice Sci, 2014, 28(2): 177–184. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34