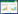文章信息
- 彭怀丽, 李红娜, 张丽, 马金奉, 阿旺次仁, 唐哲仁, 朱昌雄
- PENG Huai-li, LI Hong-na, ZHANG Li, MA Jin-feng, Awangciren ciren, TANG Zhe-ren, ZHU Chang-xiong
- 石油污染土壤中正十六烷降解菌的效果研究
- Degradation Capability of n-hexadecane Degrading Bacteria from Petroleum Contaminated Soils
- 农业资源与环境学报, 2017, 34(3): 257-265
- Journal of Agricultural Resources and Environment, 2017, 34(3): 257-265
- http://dx.doi.org/10.13254/j.jare.2017.0014
-
文章历史
- 收稿日期: 2017-01-11
土壤是人类赖以生存的自然环境,也是生态环境的重要组成部分,土壤的质量状况直接影响动物、植物和微生物的生长。工业革命的爆发使得石油产业得到迅猛发展,据报道,目前世界上每年石油总产量约为3×109 t,约有8×106 t的石油污染物进入环境,其中的大部分进入到了土壤中[1-2]。一个多世纪以来石油在生产、加工、运输和使用过程中由于各种原因进入土壤后,破环了土壤性质,降低了土壤的透水性[3]。石油中富含的反应基能与无机氮、磷结合并限制硝化作用和脱磷酸作用,从而使土壤有效磷、氮的含量减少。石油中的多环芳烃具有致癌、致畸、致突变等活性,并且能通过食物链进行生物富集作用[4-6],对动植物产生较大危害。土壤石油污染问题已经严重制约了我国的生态文明建设和农业的可持续发展[7],研究和探索快速、经济、有效、环境友好的土壤修复措施是丞待解决的关键问题。
传统的处理石油泄漏的方法主要局限于物理和化学控制[8]。与物理化学方法相比,微生物能够对含油成分进行生物降解使得其具有明显优势[9-10]。同时,用微生物去除石油衍生物污染替代物理化学方法净化污染环境更有效、经济和实用[11]。生物降解的速率取决于油浓度、烷烃长度、生物表面活性剂和微生物的类型[12]。烷烃作为石油的重要成分,占石油中含量的50%~95%[13],已有的研究报道表明,原油中的饱和烃,特别是中间长度的烷烃(C10~C20)更容易被生物降解[14]。正十六烷是原油中长链烷烃的重要成分,其在柴油中的含量常作为柴油的自燃性指标[15]。其蒸气对人体上呼吸道、眼睛及皮肤有刺激性,液体直接吸入肺部可引起化学性肺炎。正十六烷具有低水溶性,在环境中很难被消除,因此会对环境造成持久性污染。已报道能降解石油污染物的微生物超过200种,包括细菌、真菌、放线菌及藻类等[16-17],主要有假单胞菌属(Pseudomonas)[18-19]、不动杆菌属(Acinetobacter)[18, 20]、红球菌属(Rhodococcus)[21]、放线菌属(Actinomycetes)[22]、寡养单胞菌属(Stenotrophomonas)、无色杆菌属(Achromobacter)、棒状杆菌属(Corynebacterium)[23]。Deng等[24]从石油污染的海水中筛选出一株无色杆菌属(Achromobacter sp.HZ01)在pH7、28 ℃、石油烃浓度为5 mL· L-1时,能降解90%以上的烷烃,Hassanshahian等[25]用原油浓度为10 mL·L-1的无机盐培养基从波斯湾海岸土壤和海水中筛选出一株棒状杆菌属(Corynebacterium variabile PG-Z)对烷烃具有较好的降解作用,Liu等[20]从石油污染水体中筛选出的不动杆菌属(Acinetobacter sp. LS-1)在pH呈中性条件下能够很好地利用烷烃从而降解石油,Hassanshahian等[23]用正十六烷浓度为10 mL·L-1的无机盐培养基从油库废水和土壤中筛选出的红球菌属(Rhodococcus)、寡养单胞菌(Stenotrophomonas)和假单胞菌属(Pseudomonas)等在中性条件下降解烃类物质能力最强。刘猛等[26]从石油废水中筛选出一株赤红球菌JC-106(Rhodococcus)在pH6~8时对1 mL·L-1的正构烷烃具有较好的降解作用。陆健等[27]从原油中筛选出一株烷烃降解菌的最优降解条件是烷烃浓度为2 mL·L-1,最适pH为7。任丽君等[28]从渤海油田含油污泥中分离出的3株石油烃降解菌,最适降解pH为6~8。
已公开报道的多数烷烃降解菌株对可降解的烷烃浓度均较低,且最适降解pH多在6~8之间,在实际应用中容易受到限制,因此能耐受较高烷烃浓度污染、并能在较宽pH范围下发挥降解作用的微生物修复技术亟待开展。本研究从山东东营的石油污染土壤中筛选分离出能够有效降解高浓度正十六烷的菌株,并研究其在不同条件下的降解效果,为石油污染修复工作提供科学依据和参考。
1 材料与方法 1.1 样品的采集与菌种的筛选分离在山东东营用无菌刀采集被石油污染的土壤1~ 12 cm土层土样,放置于冰上运输到实验室进行筛选分离。无机盐培养基中添加10 mL·L-1的正十六烷作为唯一的碳源和能源[29]。将5 g土壤样品加入含有正十六烷的100 mL无机盐培养基的250 mL锥形瓶中,然后放在180 r·min-1、30 ℃的恒温振荡培养器(Innova4340,美国New Brunswick Scientific)上培养10 d。然后取5 mL混合液装进新鲜的含有正十六烷的100 mL无机盐培养基中。经过4次连续培养后,取出混合液涂布于含有正十六烷的无机盐琼脂培养基上并分离出表面形态不同的菌落;之后将其转移到不含有正十六烷的无机盐琼脂培养基上,去除可以在不含有正十六烷的无机盐琼脂培养基上生长的菌株,以去除自养生物和利用琼脂的细菌。经反复重复和分离,最后筛选出能在正十六烷无机盐培养基上明显生长的菌落进行储存并鉴定。
1.2 试剂与培养基所有试剂除特殊说明外均为市售分析纯或色谱纯。
无机盐培养基:K2HPO4· 3H2O 1.0 g·L-1,KH2PO41.0 g· L-1,MgSO4· 7H2O 0.5 g· L-1,NH4NO3 1.0 g· L-1,CaCl2 0.02 g·L -1,Fe2(SO4)3 0.02 g·L -1,蒸馏水,pH 7.0~ 7.2,121 ℃灭菌20 min。
含有正十六烷的无机盐培养基:正十六烷浓度为10 mL· L-1的无机盐培养基。
含有正十六烷的无机盐琼脂培养基:每100 mL含有正十六烷的无机盐培养基添加1.2~2.0 g的琼脂。
不含正十六烷的无机盐琼脂培养基:每100 mL无机盐培养基添加1.2~2.0 g的琼脂。
活化培养基:牛肉膏5.0 g· L-1,蛋白胨10.0 g· L-1,NaCl 5.0 g· L-1,蒸馏水,pH 7.2~7.4,121 ℃灭菌20 min。
1.3 菌株的鉴定经反复重复和分离,将最后筛选得到的能在正十六烷无机盐培养基上明显生长的菌落进行菌体形态观察、生理生化试验、16S rDNA序列同源性比对分析等[30],确定其分类地位。参照细菌系统鉴定手册[31]进行菌株的生理生化分析及形态特性测定,菌株的16S rDNA克隆正向引物为27F:5’-AGAGTTTGATCCTGGCTCAG-3’,反向引物为1492R:5’-GGTTACCTTGTTACGACTT-3’。PCR反应体系(50 μL)为:PCR Mix 25 μL,引物各2 μL,DNA模板4 μL,ddH2O 17 μL。PCR反应程序:95 ℃预变性5 min,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸2 min,以上程序共进行30个循环,72 ℃延伸10 min,最后4 ℃保存。PCR扩增产物用1%的琼脂糖凝胶电泳进行检测后,交由生工生物工程(上海)股份有限公司(Sangon Biotech)进行测序。将测序的结果在NCBI中与相关的16S rDNA序列进行同源性比对分析,将比对结果用MEGA6软件[32]进行分析,采用邻近法(Neighbor-joining)构建菌株的系统发育树。
1.4 正十六烷的萃取及气相色谱分析正十六烷的萃取使用液-液萃取技术,用正己烷作萃取剂[27]。用气相色谱火焰电离检测器(GC-FID)分析正十六烷的含量[23]。具体操作方法如下:首先,在培养液中加入10 mL色谱纯正己烷,剧烈搅拌2 min,将此混合液倒入分液漏斗中反复震荡,静置分层,吸取上层有机相至25 mL容量瓶中,按以上步骤重复萃取2次。合并萃取液在5 000 r·min-1下离心10 min,收集上层清液,用正己烷定容至25 mL,之后液体通过0.22 μm聚四氟乙烯(PFTE)过滤器。GC-FID的测定条件为:AHP-5MS柱(Agilent,USA)(5%苯基柱,95%甲基硅;长30 m×直径0.025 mm×膜厚度0.25 μm)在120 ℃下保持1 min,以20 ℃·min -1增加到180 ℃,在180 ℃下保持5 min。氮气作为载流气体,控制流速恒定为1.5 mL·min-1。注射器和检测器的温度分别为250 ℃和270 ℃。注射体积为2 μL。
1.5 菌株的生长、降解特性在斜面培养基中挑取少量菌体放入100 mL活化培养基中,盖上封口膜,以上操作均为无菌操作,将装有上述培养基的三角瓶放入摇床中,30 ℃ 180 r· min-1振荡培养。将菌液分装于50 mL的已灭菌的离心管中,6 000 r· min-1下离心90 s,弃去上层培养液,用已灭菌的蒸馏水离心冲洗3次,用已灭菌的无机盐培养液调OD600为0.6,吸取6 mL菌液至加有1 mL过0.22 μm滤膜正十六烷的100 mL无机盐培养基中,盖上封口膜,共3个重复。将装有上述培养基的三角瓶放入摇床中,30 ℃ 180 r·min-1振荡。每隔6 h用分光光度计测各培养液在600 nm处吸光值。其中不添加菌液的无机盐培养基作为对照。
以正十六烷作为唯一碳源,分别测定不同初始温度、NaCl浓度、接种量、正十六烷浓度及pH值对分离出的菌株降解正十六烷的效果影响。温度设置为:5、15、28、36、45 ℃;NaCl浓度设置为:2、5、10、15、20 g· L-1;接种量(V/V)设置为:2%、4%、6%、8%、10%;正十六烷浓度设置为:2、5、10、15、20 mL·L-1;初始pH值设置为:4、5、6、7、8、9。每个处理设3个重复。将筛选后的菌株接种于50 mL含有正十六烷的无机盐培养基中,放入恒温振荡培养箱中180 r·min-1,30 ℃振荡培养,每日测各菌液的OD600值,一周后测定正十六烷的降解率。
1.6 乳化性能测定及菌株表面疏水性测定将带盖的10 mL试管灭菌后,加入5 mL菌悬液,再加入5 mL正十六烷,充分震荡,使正十六烷与菌悬液混合均匀,用试管帽密封后放入30 ℃恒温培养箱中培养,24 h后观察正十六烷与水的分界面和乳化效果[33],每组设置3个重复。乳化率(E24%)=乳化层高(mm)/液体总高度(mm)。
菌株表面疏水性测定用Bacterial Adhesion To Hydrocarbons(BATH)法[34]:将菌株在以正十六烷为唯一碳源的培养基中培养5 d,6 000 r·min-1离心90 s,收集菌体并用已灭菌的无机盐培养基重悬,调OD600值为1.0。取6 mL菌悬液,加入0.5 mL正十六烷,盖上试管塞,在25 ℃下培养10 min,震荡混合物2 min,在室温下静置60 min,使有机层分离,测定前后的液体的吸光值OD600,每组设置3个重复。菌株表面疏水性用BATH%表示,BATH%=(OD600前-OD600后)/OD600前 ×100%。BATH%的范围是0~100%,值越大表示菌体表面疏水性越好[35]。
2 结果与讨论 2.1 菌株的分离、鉴定与生长曲线经过4次连续培养后,分离出共9株能在正十六烷无机盐培养基(10 mL·L-1)上生长的菌株。经综合比较生长速率及降解效果等,从中挑选1株生长速率较快的菌株TZSX2进行重点研究。通过PCR扩增,得到长度为1 368 bp的16S rDNA基因序列片段。将测得的16S rDNA序列在NCBI上进行比对进行同源性分析,将比对结果用MEGA6软件进行分析,采用邻近法(Neighbor-joining)构建菌株TZSX2的系统发育树如图 1。

|
| 图 1 利用邻近法构建的基于16S rDNA的菌株系统发育树 Figure 1 Neighbor-joining phylogenetic tree based on the 16S rDNA gene sequences of strain |
通过对菌株TZSX2的16S rDNA基因序列的对比结果,表明菌株TZSX2属于红球菌属(Rhodococcus)。
TZSX2细菌在接种进正十六烷无机盐培养液中后,会先有大约18 h的延滞期后再进入对数期的生长,经过约30 h对数期的生长后,进入稳定期,经过约80 h的生长后,逐渐进入衰亡期(图 2)。延滞期期间内可能会诱导一些与烷烃降解相关的酶类,这些酶类的积累能够加速菌株对烷烃的利用,从而促进菌株的生长。陆键等[27]从原油中分离出的一株假单胞菌xcz(Pseudomonas)的延滞期长达26 h,随后才进入对数期。张洁等[15]筛选出的两株高效石油烃氧化菌红球菌属PDA2(Rhodococcus)和假单胞菌属PDB3(Pseudomonas)的延滞期则是24 h。而TZSX2的延滞期较短,在20 h以内,有利于在石油污染环境中菌株的定植。
|
| 图 2 菌株TZSX2的生长曲线 Figure 2 The growth curve of strain TZSX2 |
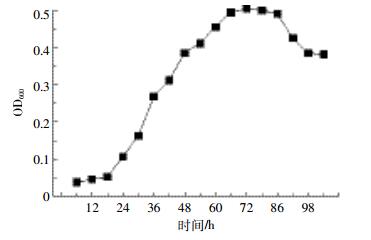
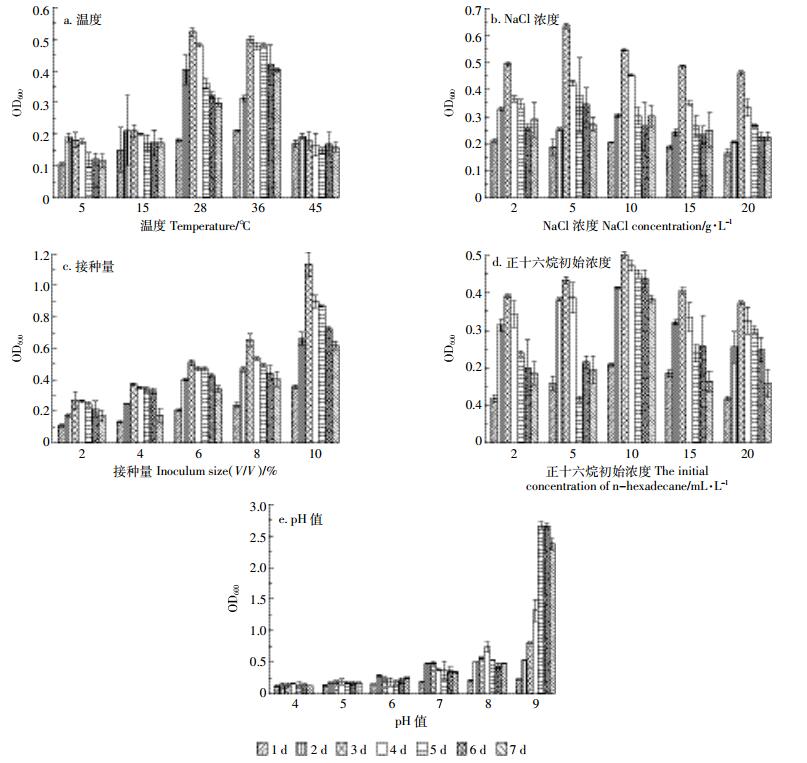
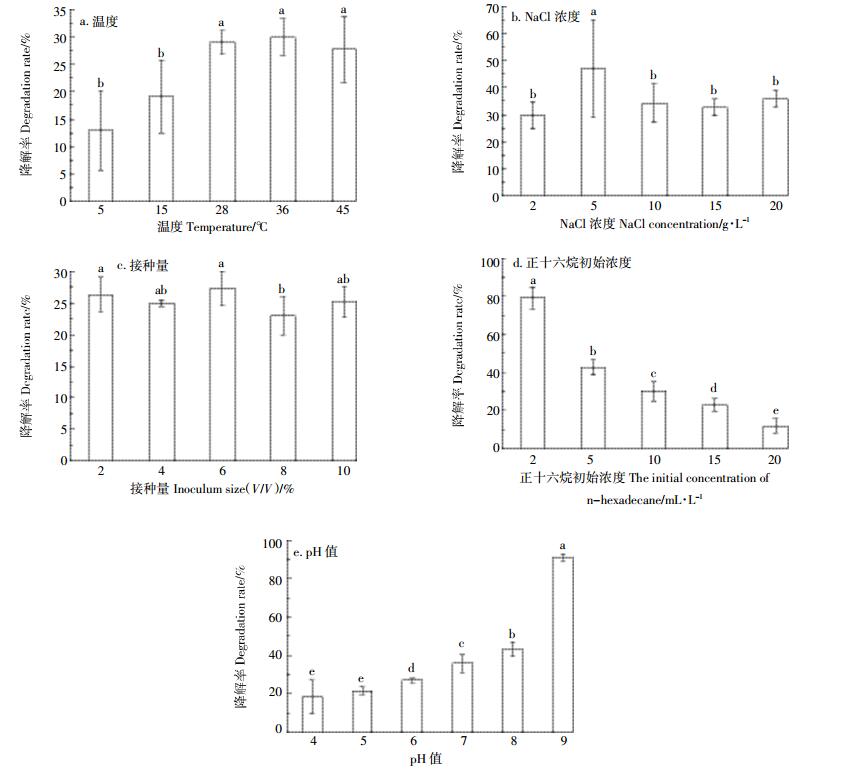
温度能够直接影响油的物理状态、酶的活性和菌株的生长[28],微生物在不同温度下的生长和代谢差异较大。从图 3和图 4中可以看出,实验设置的5组温度中,菌株TZSX2对正十六烷的降解率均超过了10%,其最适温度范围在28~36 ℃之间,最大OD600值均超过0.5,降解率达到30%,低于最适温度时随着温度的降低,降解率逐渐减小。目前,多数研究温度对石油烷烃降解菌的生长和降解率的影响中,石油烷烃降解菌的有效降解温度在20~40 ℃之间[23, 29, 36],低于20 ℃或者高于40 ℃降解率一般都低于10%[28],这是因为菌株的最适生长浓度在20~40 ℃之间,温度过高或者过低都会影响菌株的生长和代谢,从而影响菌株对石油的利用效率。本研究驯化分离出的菌株TZSX2对低温和高温都有一定的耐受能力,对温度的适应能力强。
|
| 图 3 不同影响因子对菌株TZSX2的生长特性的影响 Figure 3 The effect of different environmental factors on strain TZSX2 |
|
| 图 4 不同影响因子对正十六烷降解率的影响 Figure 4 The influence of different environmental factors on the degradation rate of n-hexadecane by strain TZSX2 |
在NaCl浓度为5 g·L-1时,菌株TZSX2在7 d的生长过程中最大OD600值能达到0.636,对正十六烷的降解率达到47%,与不含NaCl的组别相比,实验组添加的NaCl浓度均能够促进菌株的生长,提高降解率。适量的NaCl浓度能够促进菌株TZSX2的生长,但是过高的NaCl浓度会影响TZSX2菌株的生长,这与刘猛等[26]的研究结果一致。据报道,在石油烃类降解菌的影响实验中,适宜菌株生长的NaCl浓度一般为0~ 20 g· L-1之间。盐度过高菌株对石油的降解率会受到相应影响。可能是盐度过高时,微生物会因为细胞外的渗透压过高导致细胞原生质膜中的离子发生种类和数量上的变化,从而抑制微生物的生长繁殖,同时,Na+的增多会抑制微生物脱氢酶和氧化酶等酶物质的产生,影响微生物对石油的利用[37-38]。
随着TZSX2接种量的增加,菌株的OD600值增长的越来越快,但是对正十六烷的降解率影响不大,均在20%~30%之间,可能是菌株TZSX2对正十六烷的降解能力是固定的,达到一定程度后就不能继续降解正十六烷,综合考虑,最优接种量可以设置为2%。
从图 3、图 4可以看出,最适合TZSX2生长的正十六烷浓度是10 mL· L-1,OD600为0.502,降解率为30%,随着正十六烷浓度的升高,降解率逐渐降低,正十六烷浓度为2 mL·L-1时,降解率为79%。在一定浓度范围内,适量的增加正十六烷浓度,能够促进TZSX2菌株的生长,并且TZSX2菌株的耐正十六烷浓度较高,目前多数研究的正十六烷浓度设置在5mL· L-1以内[39-41],超过5 mL· L-1的研究中正十六烷的降解率都低于10%,甚至有些菌株则在高浓度的正十六烷浓度下不能生长,本研究的正十六烷浓度则最高达到了20 mL·L-1,并且TZSX2仍能够生长,降解率能达到12%,对于高浓度石油污染环境,菌株TZSX2具有优良的生长和降解优势。
初始pH值对TZSX2菌株的影响比较大,酸性条件下不利于TZSX2菌株的生长,从图 3可以看出,TZSX2菌株表现出较强的嗜碱性,在碱性条件下菌株生长较快,尤其是在pH为9的条件下,更是表现出了极强的生长速率,OD600高达2.663,并且降解率能达到91%。在石油降解菌的pH值影响研究中,多数降解菌的最适pH在6~8之间。张楠等[42]以正十六烷为唯一碳源从石油污染土壤中筛选出的一株铜绿假单胞菌(Pseudomonas aeruginosa)在pH=7时对2 g· L-1的正十六烷降解率最高,达到80%以上。曹微寰等[43]从腈纶废水中分离筛选出两株高效降解正十六烷的诺卡氏菌(Nocardias pp.)的最适生长pH为6,当正十六烷初始浓度为150 mg·L-1时,降解率可以达到85%。任丽君等[28]从渤海油田含油污泥中分离出的3株石油烃降解菌的最适降解pH分别为6和8。也就是说,与常规的已报道的降解菌相比,本实验所筛选出的正十六烷降解菌表现出极优的耐碱性,在石油污染土壤的修复中将发挥更强的耐受性和更优异的效果。
在正十六烷浓度为10 mL· kg -1经灭菌的500 g土壤中添加OD600为0.6的TZSX2菌悬液20 mL,并加入灭菌纯水,使土壤含水量达30%,未添加TZSX2菌悬液的处理作为空白对照。每日根据蒸发量补充灭菌纯水,每日翻动1次。10 d后测土壤中正十六烷含量。结果显示加有TZSX2降解菌的处理组比空白对照组的正十六烷残余量少12%。说明TZSX2菌在土壤中能够有效降解正十六烷,但具体降解效果还需要长期的降解数据支持。
2.3 乳化性能测定及菌株表面疏水性测定TZSX2的乳化率E24%为52%,细胞表面疏水性BATH%为28%。多数研究筛选的石油降解菌的乳化率在5%~55%之间,细胞表面疏水性范围一般为5%~ 40%[15, 23]。菌株TZSX2的乳化率较高,细菌表面疏水性则属于中等强度。乳化剂能够将不与水互溶的油层乳化成分散的油滴,将油带入水相中,增大油与水中的微生物接触面积,增大油水接触面积,从而使菌株能够很好地利用污染物而进行生长代谢,从而去除油类污染。细菌表面疏水性是影响细菌吸收和降解疏水性物质的主要因素之一,细菌细胞通过疏水性与正十六烷接触降解正十六烷。
3 结论(1)本研究从石油污染的土壤中以10 mL·L-1正十六烷作为唯一碳源经过5个循环共计50 d的驯化培养,筛选出一株能够很好地降解正十六烷的菌株TZSX2,经鉴定为红球菌属Rhodococcus sp.TZSX2,丰富了石油降解菌群,为高浓度石油污染的修复提供了理论基础,对石油污染的环境修复具有十分重要的意义。
(2)菌株TZSX2的最适生长和降解温度在28~36 ℃之间,对10 mL· L-1正十六烷的降解率能达到30%,并且在低温15 ℃以下和高温45 ℃时对正十六烷的降解率仍在10%以上。适量的NaCl浓度能够促进菌株TZSX2的生长和对正十六烷的降解。
(3)能够有效降解10 mL·L-1正十六烷的最适接种量是2%,在正十六烷浓度为2 mL·L-1时,菌株TZSX2能降解79%的正十六烷,并且菌株TZSX2对正十六烷浓度的耐受性高,可以用于高浓度正十六烷的降解。
(4)菌株TZSX2表现出优秀的嗜碱性,在pH=9时培养4 d的OD600值达到1.324,第5 d的OD600值为2.663,培养7 d后能够降解91%的正十六烷,可以用于极端环境中石油污染的修复。
(5)菌株TZSX2的乳化率E24%为52%,细胞表面疏水性BATH%为28%,TZSX2能有效地把在水面上的正十六烷乳化成分散的油滴,使正十六烷进入水相中,增大正十六烷与水中的TZSX2菌的接触面积,从而更好地降解正十六烷。
(6)在正十六烷浓度为10 mL· kg-1的土壤中,添加20 mL OD600为0.6的TZSX2菌悬液,与空白对照组相比,经过10 d处理可以降解土壤中12%的正十六烷,说明TZSX2菌株能够有效降解土壤中的正十六烷,但最终降解效果还需要长期的降解率测定数据。
| [1] | Delille D, Pelletier E, Coulon F. The influence of temperature on bacterial assemblages during bioremediation of a diesel fuel contaminated sub Antarctic soil[J]. Cold Regions Science & Technology, 2007, 48(2): 74–83. |
| [2] | 蔺昕, 李培军, 台培东, 等. 石油污染土壤植物-微生物修复研究进展[J]. 生态学杂志, 2006, 25(1): 93–100. LIN Xin, LI Pei-jun, TAI Pei-dong, et al. Research progress in phytomicrobial remediation of petroleum-contaminated soil[J]. Chinese Journal of Ecology, 2006, 25(1): 93–100. (in Chinese) |
| [3] | 丁克强, 孙铁珩, 李培军. 石油污染土壤的生物修复技术[J]. 生态学杂志, 2000, 19(2): 50–55. DING Ke-qiang, SUN Tei-heng, LI Pei-jun. Bioremediation of the soil contaminated by petroleum hydrocarbons[J]. Chinese Journal of Ecology, 2000, 19(2): 50–55. (in Chinese) |
| [4] | Bossert I, Bartha R. Plant growth in soils with a history of oily sludge disposal[J]. Soil Science, 1985, 140(1): 75–77. DOI:10.1097/00010694-198507000-00010 |
| [5] | Liu D. Fate of petroleum hydrocarbons in sewage sludge after land disposal[J]. Bulletin of Environmental Contamination & Toxicology, 1980, 25(1): 612–622. |
| [6] | 杨茜, 吴蔓莉, 聂麦茜, 等. 石油污染土壤的生物修复技术及微生物生态效应[J]. 环境科学, 2015(5): 1856–1863. YANG Qian, WU Man-li, NIE Mai-qian, et al. Effects and biological response on bioremediation of petroleum contaminated soil[J]. Environmental Science, 2015(5): 1856–1863. (in Chinese) |
| [7] | 王文富, 席承藩. 中国土壤[M]. 北京: 中国农业出版社, 1998. Wang W F, Xi C F. Chinese soil[M]. Beijing: China Agriculture Press, 1998. (in Chinese) |
| [8] | 苏增建, 谷慧宇, 李敏. 海洋石油污染修复研究进展[J]. 安全与环境学报, 2009, 9(2): 56–65. SU Zeng-jian, GU Hui-yu, LI Min. Research advancements on the ways to restore marine oil contamination[J]. Journal of Safety and Environment, 2009, 9(2): 56–65. (in Chinese) |
| [9] | Chaillan F, Flèche Le A, Bury E, et al. Identification and biodegradation potential of tropical aerobic hydrocarbon-degrading microorganisms[J]. Research in Microbiology, 2004, 155(7): 587–595. DOI:10.1016/j.resmic.2004.04.006 |
| [10] | Hanson K G, Nigam A, Kapadia M, et al. Bioremediation of crude oil contamination with Acinetobacter sp. A3[J]. Current Microbiology, 1997, 35(3): 191–193. DOI:10.1007/s002849900237 |
| [11] | Emtiazi G, Saleh T, Hassanshahian M. The effect of bacterial glutathione S-transferase on morpholine degradation[J]. Biotechnology Journal, 2009, 4(2): 202–205. DOI:10.1002/biot.200800238 |
| [12] | Cappello S, Crisari A, Hassanshahian M, et al. Effect of a bioemulsificant exopolysaccharide (EPS2003) on abundance and vitality of marine bacteria[J]. Water Air & Soil Pollution, 2012, 223(7): 3903–3909. |
| [13] | Xia W, Du Z, Cui Q, et al. Biosurfactant produced by novel Pseudomonas sp. WJ6 with biodegradation of n-alkanes and polycyclic aromatic hydrocarbons[J]. Journal of Hazardous Materials, 2014, 276C(5): 489–498. |
| [14] | Roy S, Hens D, Biswas D, et al. Survey of petroleum-degrading bacteria in coastal waters of Sunderban Biosphere Reserve[J]. World Journal of Microbiology & Biotechnology, 2002, 18(6): 575–581. |
| [15] | 张洁, 王卫卫, 郭欣, 等. 两株高效石油烃氧化菌的正十六烷降解特性[J]. 西北大学学报 (自然科学版), 2013, 43(3): 403–410. ZHANG Jie, WANG Wei-wei, GUO Xin, et al. Identification of two high-efficiency hexadecane-degrading bacteria and their degradation characteristics[J]. Journal of Northwest University (Natural Science Edition), 2013, 43(3): 403–410. (in Chinese) |
| [16] | Chandra S, Sharma R, Singh K, et al. Application of bioremediation technology in the environment contaminated with petroleum hydrocarbon[J]. Annals of Microbiology, 2013, 63(2): 417–431. DOI:10.1007/s13213-012-0543-3 |
| [17] | Tang X, He L Y, Tao X Q, et al. Construction of an artificial microalgal-bacterial consortium that efficiently degrades crude oil[J]. Journal of Hazardous Materials, 2010, 181(1-3): 1158–1162. DOI:10.1016/j.jhazmat.2010.05.033 |
| [18] | Mahjoubi M, Jaouani A, Guesmi A, et al. Hydrocarbonoclastic bacteria isolated from petroleum contaminated sites in Tunisia:Isolation, identification and characterization of the biotechnological potential[J]. New Biotechnology, 2013, 30(6): 723–733. DOI:10.1016/j.nbt.2013.03.004 |
| [19] | He Y, Duan X, Liu Y. Enhanced bioremediation of oily sludge using co-culture of specific bacterial and yeast strains[J]. Journal of Chemical Technology & Biotechnology, 2014, 89(11): 1785–1792. |
| [20] | Liu H, Yao J, Yuan Z, et al. Isolation and characterization of crudeoil-degrading bacteria from oil-water mixture in Dagang oilfield, China[J]. International Biodeterioration & Biodegradation, 2014, 87(1): 52–59. |
| [21] | Wang W, Zhang R, Shan D, et al. Erratum to:Indigenous oil-degrading bacteria in crude oil-contaminated seawater of the Yellow Sea, China[J]. Applied Microbiology and Biotechnology, 2014, 98(16): 7253–7269. DOI:10.1007/s00253-014-5817-1 |
| [22] | Wang Y N. Amycolicicoccus subflavus gen. nov. sp. nov. anactinomycete isolated from a saline soil contaminated by crude oil[J]. International Journal of Systematic & Evolutionary Microbiology, 2010, 60(3): 638–643. |
| [23] | Hassanshahian M, Ahmadinejad M, Tebyanian H, et al. Isolation and characterization of alkane degrading bacteria from petroleum reservoir waste water in Iran (Kerman and Tehran provenances)[J]. Marine Pollution Bulletin, 2013, 73(1): 300–305. DOI:10.1016/j.marpolbul.2013.05.002 |
| [24] | Deng M C, Li J, Hong Y H, et al. Characterization of a novel biosurfactant produced by marine hydrocarbon-degrading bacterium Achromobacter sp. HZ01[J]. Journal of Applied Microbiology, 2016, 120(4): 889–899. DOI:10.1111/jam.13065 |
| [25] | Hassanshahian M, Zeynalipour M S, Musa F H. Isolation and characterization of crude oil degrading bacteria from the Persian Gulf (Khorramshahr provenance)[J]. Marine Pollution Bulletin, 2014, 82(1-2): 39–44. DOI:10.1016/j.marpolbul.2014.03.027 |
| [26] | 刘猛, 陈吉祥, 周永涛, 等. 一株石油降解赤红球菌 (Rhodococcus rubber) 特性及处理含油废水研究[J]. 环境科学学报, 2016, 36(10): 3651–3657. LIU Meng, CHEN Ji-xiang, ZHOU Yong-tao, et al. Characterization and application of an oil-degrading Rhodococcus rubber for oily wastewater treatment[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3651–3657. (in Chinese) |
| [27] | 陆健, 黄潇, 武贤明, 等. 高效烷烃降解菌xcz的分离鉴定及降解特性[J]. 土壤, 2008, 40(3): 460–464. LU Jian, HUANG Xiao, WU Xian-ming, et al. Isolation, identification and characterization of a high-efficiency alkane-degrading bacterium xcz[J]. Soils, 2008, 40(3): 460–464. (in Chinese) |
| [28] | 任丽君, 刘宪斌, 田胜艳. 含油污泥中石油降解菌的分离及其降解特性[J]. 环境工程学报, 2015, 9(7): 3538–3544. REN Li-jun, LIU Xian-bin, TIAN Sheng-yan. Isolation of petroleum hydrocarbon degrading bacteria from oily sludge and its degrading characteristics[J]. Chinese Journal of Environmental Engineering, 2015, 9(7): 3538–3544. DOI:10.12030/j.cjee.20150774 (in Chinese) |
| [29] | Hassanshahian M, Emtiazi G, Cappello S. Isolation and characterization of crude-oil-degrading bacteria from the Persian Gulf and the Caspian Sea[J]. Marine Pollution Bulletin, 2012, 64(1): 7–12. DOI:10.1016/j.marpolbul.2011.11.006 |
| [30] | 陈小蓉, 阮志勇, 王彦伟, 等. Gordoniasp. LAM0048的分离鉴定及其降解正十六烷的研究[J]. 生物技术进展, 2015, 5(2): 137–141. CHEN Xiao-rong, RUAN Zhi-rong, WANG Yan-wei, et al. Research on the isolation, identification and n-hexadecane biodegrading characteristics of Gordoniasp. LAM0048[J]. Current Biotechnology, 2015, 5(2): 137–141. (in Chinese) |
| [31] | Bergy D. Bergey's manual of determinative bacteriology[M]. New York: Williams and Wilkins, 1998. |
| [32] | Tamura K, Stecher G, Peterson D, et al. MEGA6:Molecular evolutionary genetics analysis Version 6. 0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725–2729. DOI:10.1093/molbev/mst197 |
| [33] | Hassanshahian M, Tebyanian H, Cappello S. Isolation and characterization of two crude oil-degrading yeast strains, Yarrowialipolytica PG-20 and PG-32, from the Persian Gulf[J]. Marine Pollution Bulletin, 2012, 64(7): 1386–1391. DOI:10.1016/j.marpolbul.2012.04.020 |
| [34] | Pruthi V, Cameotra S S. Rapid identification of biosurfactant-producing bacterial strains using a cell surface hydrophobicity technique[J]. Biotechnology Techniques, 1997, 11(9): 671–674. DOI:10.1023/A:1018411427192 |
| [35] | 陈延君, 王红旗, 王然, 等. 鼠李糖脂对微生物降解正十六烷以及细胞表面性质的影响[J]. 环境科学, 2007, 28(9): 2117–2122. CHEN Yan-jun, WANG Hong-qi, WANG Ran, et al. Effects of rhamnolipid on the biodegradation of n-hexadecane by microorganism and the cell surface hydrophobicity[J]. Environmental Science, 2007, 28(9): 2117–2122. (in Chinese) |
| [36] | 鲁雅梅, 邹东雷, 赵勇胜, 等. 烷烃降解菌SY16的筛选、鉴定及降解能力测定[J]. 生态环境学报, 2007, 16(5): 1394–1398. LU Ya-mei, ZOU Dong-lei, ZHAO Yong-sheng, et al. Isolation, characterization, and alkane degradation potential of hydrocarbon-degrading bacteria SY16[J]. Ecology and Environment, 2007, 16(5): 1394–1398. (in Chinese) |
| [37] | 李习武, 刘志培. 石油烃类的微生物降解[J]. 微生物学报, 2002, 42(6): 764–767. LI Xi-wu, LIU Zhi-pei. Microbial biodegradation of petroleum hydrocarbons[J]. Acta Microbiologica Sinica, 2002, 42(6): 764–767. (in Chinese) |
| [38] | Pospíšil M, Voldǐich M, Marek M, et al. Bioremediation of soil contaminated with polycyclic aromatic hydrocarbons (PAHs)[J]. International Biodeterioration & Biodegradation, 1996, 37(3): 259–259. |
| [39] | 吴仁人, 党志, 易筱筠, 等. 氨基酸对烷烃降解菌GS3C降解性能的影响[J]. 环境科学研究, 2009, 22(6): 702–706. WU Ren-ren, DANG Zhi, YI Xiao-yun, et al. Effect of amino acids on degrading capability of a n-alkanes degrading strain GS3C[J]. Research of Environmental Sciences, 2009, 22(6): 702–706. (in Chinese) |
| [40] | 陈延君, 王红旗. 芽孢杆菌DQ02吸附摄取、运输和降解正十六烷的机理研究[J]. 环境工程学报, 2011, 5(3): 714–720. CHEN Yan-jun, WANG Hong-qi. Study on mechanism of uptake, transport and biodegradation of n-hexadecane by Bacillus sp. DQ02[J]. Chinese Journal of Environmental Engineering, 2011, 5(3): 714–720. (in Chinese) |
| [41] | 李玫, 廖宝文. 红树林湿地烷烃降解菌的分离筛选[J]. 生态科学, 2013, 32(1): 40–43. LI Mei, LIAO Bao-wen. Isolation and screening of hydrocarbon-degrading bacterial strains from mangrove wetland soils[J]. Ecological Science, 2013, 32(1): 40–43. (in Chinese) |
| [42] | 张楠, 陈波水, 方建华, 等. 正十六烷降解菌的分离、鉴定及降解特性[J]. 化学与生物工程, 2012, 29(8): 26–28. ZHANG Nan, CHEN Bo-shui, FANG Jian-hua, et al. Isolation, identification and characteristics of a bacterial strain for biodegradation of nhexadecane[J]. Chemistry & Bioengineering, 2012, 29(8): 26–28. (in Chinese) |
| [43] | 曹微寰, 徐德强, 张亚雷, 等. 烷烃降解菌的筛选及其降解能力[J]. 中国环境科学, 2003, 23(1): 25–29. CAO Wei-huan, XU De-qiang, ZHANG Ya-lei, et al. Screening of alkane degrading bacterium strains and their degradation capability[J]. China Environmental Science, 2003, 23(1): 25–29. (in Chinese) |
 2017, Vol. 34
2017, Vol. 34